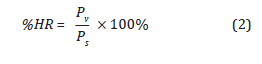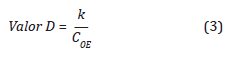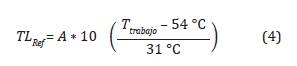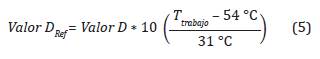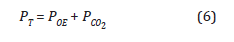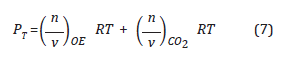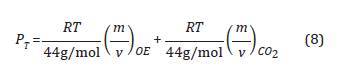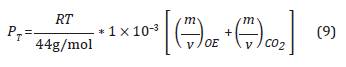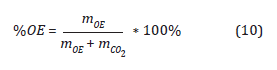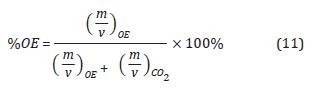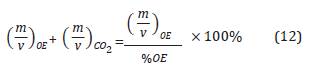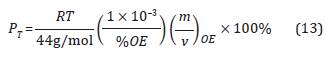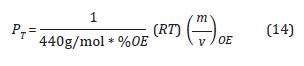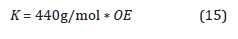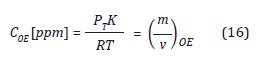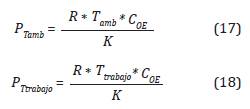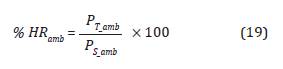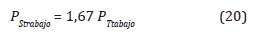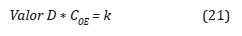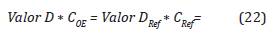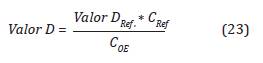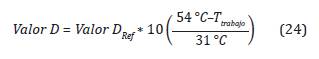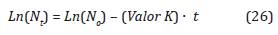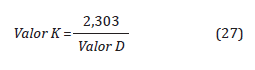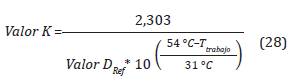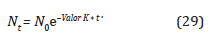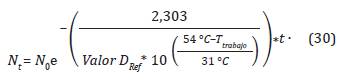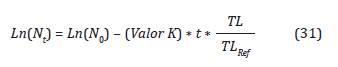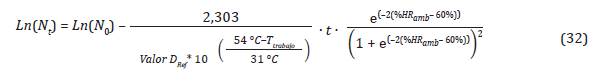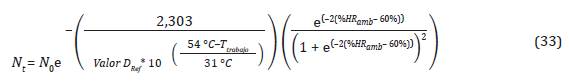1. INTRODUCCIÓN
La esterilización en dispositivos médicos tiene como objetivo eliminar toda forma de vida que pueda tener contacto con los tejidos corporales. Estos dispositivos deben ser estériles cuando se usan, ya que cualquier contaminación microbiana podría dar lugar a la transmisión de enfermedades (Forero et al., 1997), por lo anterior los dispositivos son sometidos a esterilización utilizando vapor de agua, ya que, al no ser toxico, cuenta con el mayor margen de seguridad, economía, esporicida y se calienta rápidamente y penetra en los tejidos del dispositivo. Sin embargo, otros elementos requieren el uso de sustancias químicas para la esterilización (Rutala y Weber, 1999). Se requiere la esterilización de baja temperatura para dispositivos sensibles a la humedad y altas temperaturas. El uso de óxido de etileno (OE) es un proceso de esterilización a baja temperatura utilizado para el reuso de dispositivos médicos que no pueden ser esterilizados con vapor, el OE es un gas incoloro, inflamable y explosivo que inactiva desde virus grandes con envoltura lipídica hasta esporas bacterianas, debido al remplazo de los átomos de hidrogeno con un grupo alquilo en las proteínas, ADN, ARN y en microorganismos mediante la unión a los sulfhidrilo e hidroxilo, amino y grupos carboxilo que dentro de las células impiden el metabolismo celular normal y la capacidad de reproducción, aunque la exposición al OE no causa cambios estructurales al dispositivo. La eficacia de la esterilización por OE, junto con la flexibilidad del proceso, representa algunas de las ventajas de este método en la esterilización de dispositivos médicos, ya que los parámetros del ciclo de OE se pueden ajustar para preservar su integridad (Mendes, Brandão y Silva, 2007).
Las principales desventajas asociadas con OE son el tiempo de uso en ciclos largos, su alto costo y sus riesgos potenciales para los pacientes y el personal, ya que es tóxico, carcinógeno e inflamable (Rutala, Gergen y Weber, 1998). Para la esterilización con OE se necesitan equipos que garanticen parámetros de temperatura, humedad, tiempo de exposición, presión y concentración del agente, estos equipos de esterilización están compuestos de cinco ciclos; preacondicionamiento y humidificación, introducción del gas, exposición del OE, evaluación y aireación (Acosta-Gnass y Stempliuk, 2008).
La eficiencia de estos equipos depende de la programación de estos parámetros, ya que la programación inadecuada del ciclo podría llevar a una baja letalidad de microorganismos, al aumento de los costos y del tiempo por ciclos extremadamente largos y con uso excesivo de gas, además de la generación de trazas de OE que podrían causar daños en pacientes y operadores de los equipos de esterilización. Tanto Mendes et al. (2007) como Agalloco y Carleton (2007) describen diferentes modelos matemáticos que permiten validar y mejorar el proceso de esterilización con OE. Mendes et al. (2007) desarrollaron un modelo en función de los parámetros principales con funciones no específicas de concentración C (t) y temperatura T (t), por otra parte solo es tenido en cuenta el Valor-D de referencia y la humedad no es considerada como variable.
En cuanto a Agalloco y Carleton (2007) no sintetizan la letalidad en una formula, sino que describe cada parámetro independientemente (presión, concentración, humedad, temperatura) y no logran relacionar la humedad con la letalidad de los microorganismos. Se considera entonces que es necesario un modelo que integre todas las variables que influyen en la muerte microbiana, con el principal objetivo de arrojar resultados aproximados que permitan validar procesos y describir ciclos eficaces. El presente estudio propone un modelo matemático para medir y predecir la tasa de letalidad en procesos de esterilización de dispositivos médicos con OE en función de la concentración de OE, humedad relativa, presión, temperatura de trabajo y el tiempo de exposición del dispositivo con OE.
2. DESCRIPCIÓN DEL PROCESO
Deducción de la concentración de OE
La cámara se simuló con OE , y CO>,. como gas (gH 2(g) O diluyente, proponiendo un comportamiento ideal de OE y la mezcla [OE^; CO ], para esto se utilizó la siguiente ecuación de estado para un gas ideal:
Donde P es la presión del gas en Bar; V es el volumen que ocupa el gas en Litros; n las moles del gas; R la constante universal de los gases ideales cuyo valor para este trabajo es 0.08314 Bar.L/mol.K y T es la temperatura en Kelvin.
Deducción de la presión en función de la concentración de OE
La presión es un método indirecto que permite controlar la concentración, es decir cuando la cámara es presurizada se asume que el interior contiene el porcentaje dado de OE relativo al cambio en la presión (Agalloco y Carleton, 2007). Dada la dificultad de modelar la concentración dentro de la cámara, se acude a la proporcionalidad de P y C de los gases ideales y de esta forma es posible la manipulación de la presión para ajustar le concentración de OE deseada.
Deducción de la presión en función de humedad relativa
Para la esterilización con OE se pre-acondicio-na la cámara de esterilización garantizando temperatura y humedad en el sistema por inyección de vapor de agua para proporcionar un ambiente apto para la muerte microbiana, por ende, es necesario determinar la presión real contenida en el ambiente y en la cámara de esterilización en términos de la humedad relativa (%HR) (Kaiser et al., 2002), como se indica a continuación:
Donde P v es la presión contenida en el aire a una temperatura específica y P s es la presión de vapor de agua o también llamada presión de saturación.
Deducción del Tiempo letal 90 (Valor D) en función de la concentración de OE
El Valor D representa el tiempo en minutos requerido para reducir una población microbiana al 90%, este valor disminuye a medida que la temperatura y las concentraciones de OE(g) se incrementan (ISO 11135-1).
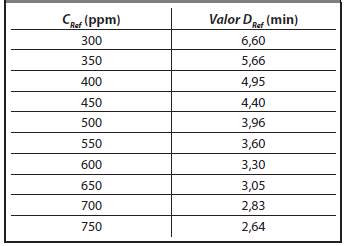
Para encontrar el Valor-D en función de la concentración, se debe tener en cuenta el Tiempo letal de referencia (Valor-DRef), el cual está dado por la ficha técnica de los indicadores biológicos usados como Bacillus atropheus, a una concentración, un %HR y una temperatura de referencia (Tref) (Agalloco y Carleton, 2007).
El Valor-D es inversamente proporcional a la concentración de OE, como se expresa a continuación:
Cambio de la tasa de letalidad microbiana (Z)
El cambio de la tasa de letalidad microbiana se denomina Z y depende de la temperatura. Se interpreta como el número de grados que la temperatura debe incrementar para que el Valor-D cambie por un factor de 10 (Mendes, Brandão y Silva, 2007). Entre los rangos de temperatura (40-60 °C) y de concentración (300-750 ppm) el cambio de la tasa de letalidad tiene un valor de 31°C (Agalloco y Carleton, 2007).
Deducción de la tasa de letalidad
La tasa letal (TL) se define como el tiempo equivalente de un proceso a una temperatura de referencia de 54 2C con respecto a temperatura de trabajo (Agalloco y Carleton, 2007; Mendes, Brandão y Silva, 2007; Mendes y Brandao, 2012). La Ecuación 4, representa la tasa de letalidad para Bacillus atro-pheus a TRef = 54 °C y Z= 31 °C.
Donde A es una constante de valor = 1 minuto.
3. RESULTADOS
Concentración de óxido de etileno (C OE )
Teniendo en cuenta que la mezcla de gases dentro de la cámara se comporta como un gas ideal, y que los gases conservan la identidad debido a la absorción, adsorción y/o condensación, se estableció que la presión total de una mezcla de gases es la suma de las presiones parciales de los componentes de la mezcla (La ley de las presiones parciales de Dalton):
Expresando la presión de cada gas en términos de la concentración utilizando la Ecuación 1:
Donde P OE es la presión de OE(g) y P CO2 es la presión del gas diluyente CO2(g), R es la constante de los gases ideales R = 0.08314 Bar.L/mol.Ky T es la temperatura en Kelvin
Teniendo en cuenta que la masa molecular de OE(g) es aproximadamente igual a la masa molecular del CO2(g) la Ecuación 7 se puede expresar como:
Como 1mg son 1x10-3g y reemplazando en la Ecuación 8, tenemos:
(Agalloco y Carleton, 2007) (Agalloco y Carleton, 2007)(Agalloco y Carleton, 2007).
Si describimos el contenido porcentual en masa de OE en la mezcla como:
(Agalloco y Carleton, 2007)(Agalloco y Carleton, 2007)(Agalloco y Carleton, 2007).
Teniendo en cuenta que el volumen de la mezcla es el volumen que ocupa cada gas tenemos:
Modificando 11:
Sustituyendo 12 en 9:
Simplificando 13
De donde se obtiene el valor K llamado la constante de la mezcla gaseosa:
De esta forma se expresa la concentración de OE como:
Dado que existen valores de %OE entre 10% y 90% en los diferentes ciclos de esterilización (Agalloco y Carleton, 2007), para este modelo se desea trabajar con una mezcla de gases 90% OE(g) y 10% CO2(g), por lo tanto la constante K adquiere un valor de 39600g/mol.
Presión de trabajo en función de la concentración de OE
De la Ecuación 16 se obtiene de la deducción del sistema de presiones que controlan la concentración y se describe de la siguiente forma:
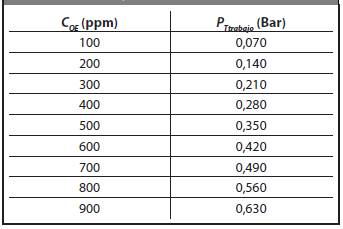
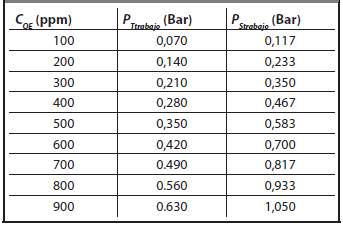
Donde P tamb es la presión en Bar a la que se encuentra la cámara a temperatura ambiente (Tamb) y P Ttraaa.o es la presión en Bar a la que se encuentra la cámara a la temperatura de la cámara (T traaa.o ). En la Tabla 1 se presentan las presiones de la cámara variando la concentración OE(g) a T traaa.o = 60 °C en
Presión en función de la humedad relativa:
Teniendo en cuenta que la mezcla de gases es un gas húmedo y la humedad relativa es la relación entre la presión presente en el aire y la cantidad máxima de presión que el aire puede mantener teóricamente a una temperatura específica, de la Ecuación 2 tenemos:
Asumiendo %HR traaa.o óptimo de 60% (Agalloco y Carleton, 2007), entonces la Ecuación 19 queda como:
En la Tabla 2 se muestran las diferentes presiones de vapor de agua en función de la presión de trabajo planteada en la Ecuación 20.
Tiempo letal 90 (Valor D) en función de la concentración de OE
Para encontrar el Valor-D en función de la concentración, se debe tener en cuenta el Valor D Ref , el cual está dado por la ficha técnica de los indicadores biológicos para Bacillus atropheus, de la Ecuación 3:
Entonces para el Valor-D y Valor-DRef la constante k es la misma, por lo tanto:
Despejando la Valor-D
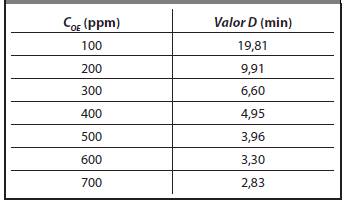
En la Tabla 3 se presentan los Valor-D para Bacillus atropheus a una %HR = 60%, CRef = 700 ppm y Valor-D ref = 2,83 min.
Para una C OE = 600ppm, como concentración de trabajo el Valor D = 3,30, a partir de este valor, se recalcularon los valores de referencia (Valor D Re f) en el rango de concentraciones (300-750 ppm) como se muestra en la Tabla 4.
Tiempo letal 90 (Valor D) en función de la temperatura
Despejando el Valor D de la Ecuación 5 se tiene:
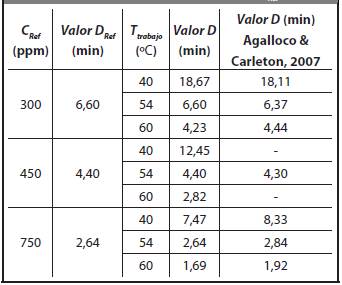
En la Tabla 5 se presentan los Valores D encontrados con la Ecuación 24, estos valores son muy cercanos a los reportados por Agalloco & Carleton (2007) para las concentraciones de referencia a 300, 450 y 750 ppm, y temperaturas de trabajo 40, 54, 60 2C sobre Bacillus arthophaeus ATTC # 9372.
Tasa de letalidad
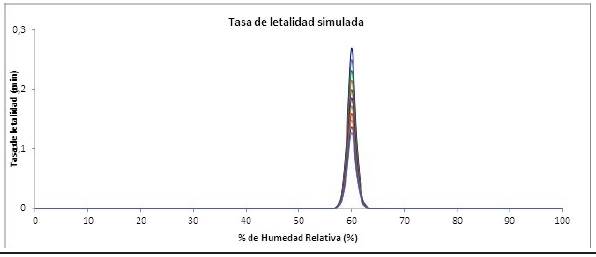
Dado que la Ecuación 6 no tiene en cuenta la humedad relativa, se modeló la tasa de letalidad en función del %HR, a diferentes temperaturas como se muestra en la Figura 1.
En la Figura 1 se puede observar que la tasa de letalidad en función del %HR, independiente de la temperatura describe una función sigmoide que se pudo representar con la siguiente ecuación:
La máxima tasa de letalidad (mayor muerte de microorganismos) se obtuvo a una %HR = 60% y una tasa de cambio de letalidad de 2, lo que quiere decir que a un incremento de 10 °C se duplica la velocidad la reacción (Agalloco y Carleton, 2007). De esta forma se ha demostrado que un %HR = 60% se puede tomar como %HR Ref para la esterilización con OE, permitiendo incluir la humedad en el modelo que describe el comportamiento de la muerte de los microorganismos.
Inactivación microbiana
El proceso de inactivación microbiana describe un comportamiento cinético de primer orden, para un número de esporas de Bacillus arthophaeus (Russel, Hugo, y Avliffe, 2004; Agalloco y Carleton, 2007), como se ilustra en la Ecuación 26:
Donde N t es el número de esporas en el tiempo t, N o es el número inicial de esporas de Bacillus atropheus y el Valor K es la constante de inactivación se expresa como:
Remplazando el Valor D de la Ecuación 24 en la Ecuación 27 tenemos:
Modificando la Ecuación 26 se tiene:
Reemplazando la Ecuación 28 en la Ecuación 29:
En la Figura 2 se muestran las isotermas de letalidad para el número de esporas de Bacillus ar-thophaeus de 3,5x106, para un Valor D Ref = 6,6. El modelo planteado en la Ecuación 30 a diferentes temperaturas en un ciclo de esterilización sigue una distribución exponencial.
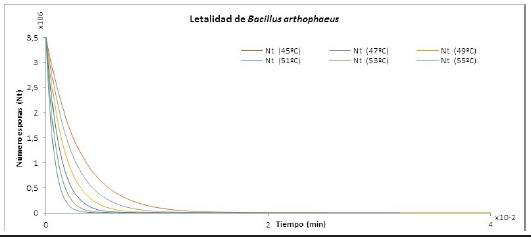
Figura 2 Isotermas de letalidad para el número de esporas de Bacillus arthophaeus en función del tiempo
Teniendo en cuenta la tasa de letalidad encontrada en función de la %HR, de la Ecuación 25, y con el fin de conservar el comportamiento cinético de primer orden de la Ecuación 26, incorporando la relación entre la tasa de letalidad y la tasa de letalidad de referencia en el segundo término tenemos:
Reemplazando las Ecuaciones 28 y 29 en la 31:
De la Ecuación 32 se tiene que el número de y %HR b como se muestra en la Ecuación 33: microorganismos en el tiempo, depende de la T (rabajo
Modelación de la letalidad en la cámara de esterilización
Con el programa MATLAB se modeló la Ecuación 33, construyendo una interfaz gráfica amigable con el fin de calcular el tiempo en los ciclos para la esterilización con óxido de etileno.
En las Figuras 3 y 4 se muestran la interfaz gráfica del efecto de la temperatura de trabajo en el número de esporas de Bacillus arthophaeus, teniendo como parámetros óptimos tales como: N 0 = 3,5xl06, C Ref = 700 ppm, T amb = 23 °C, %HR = 60 % y P trabajo . = 0,490 atm, Valor D = 3,3 min (Valor D Ref = 6,6 min).
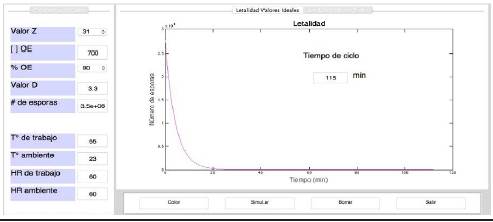
Figura 3 Interfaz gráfica en MATLAB para la determinación del ciclo de esterilización con OE a T trabajo = 55 °C
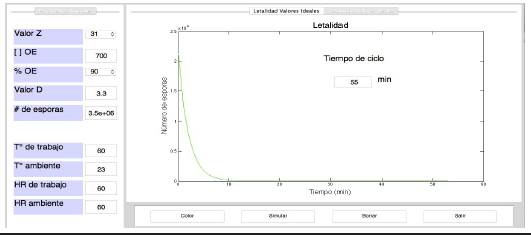
Figura 4 Interfaz gráfica en MATLAB para la determinación del ciclo de esterilización con OE a T trabajo = 60 °C
Para la T trabajo = 55 °C se presentó un ciclo de 115 minutos (Figura 3) comparado con la T trabajo = 60 °C, donde el ciclo fue de 55 minutos (Figura 4). Por lo tanto se tiene un optimización del ciclo en 60 minutos, recomendando una T trabajo = 60 °C, para la aplicación del proceso de esterilización.
4. CONCLUSIONES
Con el algoritmo desarrollado en MATLAB, se determinaron las condiciones como: la concentración de óxido de etileno (CRef= 700ppm), humedad relativa (%HR Ref = 60%) y temperatura de trabajo (T trabajo = 23 °C), seguido del ciclo óptimo (55 minutos). A demás el algoritmo permitió realizar cálculos haciendo uso del Valor D en función de la temperatura y humedad, indicando que son factores importantes a tener en cuenta en la tasa de letalidad Bacillus arthophaeus. El modelo puede ser de utilidad, dado que proporciona a los interesados la capacidad de optimizar un proceso de esterilización, evitando el uso excesivo de suministros como el óxido de etileno y el tiempo del ciclo, con el fin de asegurar una máxima letalidad de los microorganismos en dispositivos médicos.