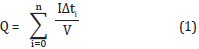1. Introducción
Los productos farmacéuticos se encuentran cada vez con más frecuencia en aguas residuales, aguas superficiales e incluso en aguas destinadas al consumo humano (Klamerth et al., 2010). Estas sustancias, aunque se encuentran en bajas concentraciones (ng L-1 de g L-1), pueden resultar peligrosas, por su persistencia y toxicidad en el medio receptor (Klamerth et al., 2010). Los compuestos farmacéuticos se consideran como contaminantes emergentes, los cuales resisten la mayoría de tratamientos biológicos convencionales, los procesos de oxidación avanzada se muestran como una alternativa debido a su eficiencia; se encuentran ligados a la formación de radicales hidroxilo quienes se caracterizan por poseer un alto potencial de oxidación, lo que permite un proceso de oxidación efectivo (Guzmán, Mosteo, Sarasa, Alba, & Ovelleiro, 2016).
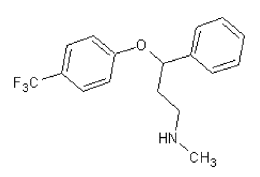
La Fluoxetina (FLX), también conocida por los nombres comerciales Prozac®, Sarafem o Fontex, es un antidepresivo fluorado (Figura 1.1) perteneciente a la clase de inhibidores selectivos de la recaptación de serotonina (ISRS, según sus siglas en inglés), es utilizada para el tratamiento de la depresión, ansiedad generalizada, desórdenes obsesivo-compulsivos, bulimia y en el desorden disfórico premenstrual (Castro, Concheiro, Quíntela, & Cruz, 2005; Méndez-Arriaga et al., 2011), (Salazar et al., 2016). La gran producción y prescripción de fluoxetina en el mundo entero ha causado su aparición en el medio acuático, principalmente en los ríos con niveles de ng L-1 (Salazar et al., 2016), la presencia de este fármaco en el medio ambiente se debe a la eliminación directa de los hogares, a la excreción en forma de orina o heces, que terminan en el suelo, las aguas superficiales, el agua potable y aguas residuales (C. Su, Bellotindos, Chang, & Lu, 2013), (Salazar et al., 2016).
La FLX se ha detectado en aguas superficiales en los EE.UU. y Canadá en concentraciones de 0.012 y 0.013 - 0.046 μg L-1, respectivamente, en los efluentes de plantas de tratamiento de aguas a concentraciones de 0.038 - 0.099 ng L-1 en Canadá, 0.0017 μg L-1 en Corea del Sur y 0.0006 - 0.0187 μg L-1 en aguas residuales en Noruega; en aguas residuales 0.021 μg L-1 (EE.UU.) y en plantas de tratamiento de aguas a concentraciones de 0.020 - 0.091 μg L-1 (Canadá); en biosólidos y sedimentos (EE.UU.) a 37.4 y 1.84 μg kg-1 , respectivamente. La FLX también se ha encontrado en el agua potable a concentraciones <0.014 μg L-1 en Estados Unidos (Honda et al., 2016).
Se ha reportado la bioacumulación de la FLX en los tejidos (de 0,14 a 1,02 μg kg-1), el hígado y el cerebro de los peces recogidos bajo las descargas de efluentes de agua [4],[5]; toxicidad en algas e invertebrados, ya que interactúa con los procesos de crecimiento y reproducción; además puede inducir el desove en algunos crustáceos y especies bivalvos (Méndez-Arriaga et al., 2011), (Salazar et al., 2016). Se ha evidenciado que la capacidad de las especies de peces híbridos de róbalo rayado (Morone saxatilisxMorone chrysops) para capturar a sus presas disminuyó después de 6 días de exposición a FLX a concentraciones de 23.2 a 100.9 μg.L-1 (Honda et al., 2016).
La FLX reacciona rápidamente con hipoclorito en agua potable y en aguas residuales, formando cloramina N-clorofluoxetina, lo que aumenta la hidrofobicidad y la tendencia a adsorber sobre sedimentos, suelos, y membranas biológicas; estas y otras características contribuyeron a la reciente inclusión de la FLX en la lista de 10 productos farmacéuticos potencialmente peligrosos para el medio ambiente (Honda et al., 2016).
La eliminación de la FLX es ineficaz por métodos fisicoquímicos y biológicos comúnmente utilizados en plantas de tratamiento de aguas residuales (Salazar et al., 2016). Por tal razón se han buscado alternativas para la degradación de este antidepresivo, entre los que encontramos procesos de oxidación avanzada como: Fenton (Honda et al., 2016; Li, Nanaboina, Zhou, & Korshin, 2011), foto Fenton (Perini, Costa, Tonetti, & Nogueira, 2016), ozonó-lisis (Zhao et al., 2017), degradación por sonoquímica acoplado a tratamiento biológico (Honda et al., 2016) y procesos de oxidación electroquímicos como: oxidación anódica con H2O2 electrogenerado, electro-Fenton y fotoelectro-Fenton con luz ultravioleta (Salazar et al., 2016).
La luz solar, es una energía gratis que consiste de tres tipos de luz, la mayor parte de esta radiación es luz infrarroja (55%), la luz visible es un 40%, y aproximadamente el 5% del nivel del suelo de la radiación solar es la radiación ultravioleta, sobre todo en el rango UV-A (Zayat, Garcia-parejo, & Levy, 2007). El uso de radiación solar como fuente de energía lumínica es una alternativa prometedora que debe ser implementada en la degradación de contaminantes por medio de procesos fotoquímicos. Se ha demostrado que los procesos asistidos por luz solar promueven la degradación, oxidación y mineralización de compuestos recalcitrantes aun estando éstos en matrices complejas como aguas residuales, además la luz solar como fuente de radiación contribuye al desarrollo de tecnologías en el marco de la sostenibilidad (eficientes y económicas).
En este trabajo se evaluó la degradación de la FLX por tres procesos fotoquímicos de oxidación avanzada: foto Fenton (FFS), fotocatálisis heterogénea con TiO2 (FCS) y foto electro-Fenton (FEFS), todos promovidos por luz solar. Se determinaron rutas de degradación y se seleccionó el proceso que ofrece mayores eficiencias y cinéticas de degradación.
2. Materiales y Métodos
2.1. Reactivos
La fluoxetina fue suministrada por Allianz Group International Ltda. El ácido sulfúrico, el alcohol isopropílico, el bisulfito de sodio, el sulfato anhídrido de sodio fue suministrado por Merck®, el TiO2 tipo Degusa P25 de Evonik® y el peróxido de hidrogeno y yoduro de potasio de Panreac®.
2.2. Sistemas de reacción
La degradación de 100 mL de FLX (40 mg.L1) por Fenton y foto Fenton solar (Figura 4.2.1.1), se llevó a cabo a diferentes de concentraciones de Fe2+ (1.8, 9 y 90 μM) con 1000 μM de H2O2 en agitación constante durante 2 h, estos experimentos se realizaron a pH acido (3.08) y pH natural (cercano a 6) en la degradación del contaminante.
La radiación solar se midió con un radiómetro Solar Light0 PMA2100 Data Logging con sensores para UV y luz visible acoplados. La relación entre tiempo de exposición solar y energía acumulada se calculó con la expresión:
Donde I es el flujo de fotones incidente (W2.s-1), Δt es el tiempo entre muestras (s) y V es el volumen de la solución tratada (L).
Se evaluó el efecto de la cantidad de catalizador en suspensión (50, 100, 300 y 500 mg.L-1 de TiO2) y el peróxido de hidrogeno (1000 μM y 4409 𝜇M H2O2 con 50 mg.L-1 TiO2) en la degradación fotocatalítica de 100 mL de FLX (40 mg.L-1) en agitación constante durante 2 h. Para determinar la contribución de los huecos fotogenerados y los radicales hidroxilos en la degradación de la FLX se utilizó yoduro de potasio e isopropanol, diez veces más concentrados que el contaminante. El H2O2 se eliminó utilizando bisulfito de sodio 0,1 M, las muestras se centrifugaron y se filtraron con membranas de acetato de celulosa 0,45 μm.
Los experimentos de oxidación anódica se llevaron a cabo en una celda electrolítica que contiene 150 mL de FLX, bajo condiciones de agitación constante, aplicando 3-4 voltios y 20 - 30 A, bajo condiciones galvanostáticas, usando un ánodo de IrO2/ RuO2 y un cátodo de difusión de aire. Como electrolito soporte se usó NaSO4 a una concentración de 0,05 mol.L-1. Los experimentos de electro Fenton y electro foto Fenton se realizaron a pH acido (3.08) y pH natural (cercano a 6) y con una concentración 18 μM de Fe2+.
2.3. Seguimiento de degradación y mineralización
El seguimiento de la degradación de la FLX se realizó por espectrofotometría UV/VIS y por HPLC usando una columna C-18 (5 μm dp 250 x 4,6 mm) y un detector UV a 227 nm. La fase móvil fue un tampón de ácido fórmico (10 mM pH 3,0)/ acetonitrilo 40/60 (%v / v), en el modo isocrático (1 mL min-1). La oxidación de la materia orgánica se determinó por medio de la demanda química de oxígeno (DQO) por el método de reflujo cerrado y la mineralización de la muestra con análisis de carbono orgánico total (COT) usando un analizador de COT con detector de IR marcha Shimadzu. La toxicidad de la solución tratada se realizó frente a Saccharomyces cerevisiae (levadura de cerveza) mediante un recuento microscópico en un una Cámara de Neubauer, por conteo de células muertas.
3. Resultados y discusión
Los procesos fotoquímicos seleccionados para establecer diferencias entre eficiencias y cinéticas de degradación de la FLX se caracterizan por ser opuestos en su montaje y operación y en la disposición de los reactantes involucrados. El proceso FCS es catalítico heterogéneo donde actúa como catalizador un semiconductor de reconocida eficiencia conocido como TiO2, el cual es capaz de foto activarse a longitudes de onda por debajo de 380 nm, la que se logra con una pequeña porción de radiación UV de la luz solar. De la misma manera, el proceso FFS es catalítico homogéneo donde se espera que, dado el amplio contacto del sustrato con el catalizador, se incrementarán las velocidades y finalmente FEFS donde gracias a una diferencia de potencial funciona una celda electroquímica que permite por medio de los electrodos la oxidación anódica y el proceso FFS.
3.1. Degradación de la FLX por foto-catálisis heterogénea con TiO 2 (FCS)
Con el fin de definir diferencias entre la eficiencia de degradación y mineralización de FLX por FCS, se llevó a cabo el proceso bajo cuatro dosis de catalizador. Las dosis más altas de catalizador mejoran la velocidad de degradación si se comparan con la velocidad a dosis menores como 50 y 100 ppm (Figura 2). Para las condiciones de reacción en el laboratorio, trabajar con 300 o 500 ppm de TiO2, implica la misma respuesta en cinética de degradación. En cuanto a mineralización se observa que con el incremento de la concentración de TiO2 se genera mayor cantidad de radicales OH* y habrá mayor disposición de superficies activas (h+) para oxidar el agua y mineralizar la materia orgánica. Se alcanza mineralización hasta del 68% (Figura 2). Trabajar por encima de concentraciones de 500 mg.L-1 podría generar apantallamiento y evitaría el paso del haz de luz hasta la superficie del catalizador (Giraldo et al., 2010).
La figura 18 presenta la respuesta de la degradación ante diferentes controles para definir la posible ruta de degradación de la FLX cuando se usa éste proceso. La adsorción de la FLX sobre el catalizador es nula durante dos horas. La fluoxetina presenta un pKa = 8.7 (Zhao et al., 2017). Si se considera que el pH de trabajo siempre fue el natural (cercano a 6), la superficie del catalizador permaneció en forma catiónica al igual que la especiación de la FLX. Cuando se adiciona el KI que es un ladrón de h+ en la superficie, no se genera alta degradación de FLX, pues no se supera el 20%, sin embargo, ésta respuesta implica que hay un aporte importante de los huecos (h+, foto Kolve) a la degradación de FLX (Giraldo-Aguirre, Erazo-Erazo, Flórez-Acosta, Serna-Galvis, & Torres-Palma, 2015). El anterior comportamiento unido a la respuesta de la degradación cuando hay isopropanol (IPA), confirma la degradación vía h+.
En éste caso, la degradación se mantiene igual con o sin IPA en el primer periodo de degradación (no más de 150 kJ/Lm2 de energía acumulada), lo que implica que aún sin radical hidroxilo se da la degradación de FLX, solo después de éste periodo (energías mayores a 200 kJ/Lm2) se observa un aporte en la degradación de los radicales hidroxilo. El IPA es un scavenger de radicales que permite evidenciar la ruta de degradación radicalaria (Giraldo-Aguirre et al., 2015) La FLX se degrada vía foto Kolbe y radicalaria al mismo tiempo, aunque en mayor proporción por la primera.
La Figura 4 presenta la respuesta de la degradación de FLX a una concentración de 50 mg.L-1 cuando se trabajó bajo 3 concentraciones de H2O2 y la mineralización alcanzada con una concentración de H2O2 de 1000 μM. La presencia de peróxido de hidrogeno modifica notoriamente la degradación de la FLX, aumentándola favorablemente (de 59% a 75%), cuando se adiciona 1000 μM de H2O2 a 50 mg L-1 de TiO2 y disminuyendo el % remoción de la FLX de 59% a 51%, cuando se adiciona 4409 μM de H2O2.
La degradación de FLX con [TiO2] = 50 mg.L-1 presenta un constante de velocidad de degradación k de 6,154 x 10-4, mientras que con la dosis de H2O2 mayor (4409μM) no se ve afectada e incluso disminuye (k = 2,34 x 10-4). Éste comportamiento se puede atribuir a que el peróxido cuando está en exceso se comporta como un scavenger de radicales. Cuando la dosis es menor (1000 μM) hay un exceso de peróxido que favorece la degradación debido a que el papel del peróxido en esa situación es promover la generación de más radicales hidroxilo y evitar la recombinación de los pares e- - h+ (Giraldo-Aguirre et al., 2015; Luna et al., 2013; Villegas-Guzman et al., 2015).
3.2. Degradación de la FLX por foto-Fenton (FFS)
Previo a la evaluación de la degradación de la FLX vía proceso FFS, se comparó ésta respuesta ante el proceso Fenton a pH natural y ácido y ante solo la presencia de peróxido de hidrógeno o solo Fe+2.
Se observa en primer lugar que el H2O2 no tiene capacidad oxidante sobre la FLX y que el Fe+2 no genera degradación, por tanto, no es visible una coagulación de materia orgánica con la sal de Fe+2.
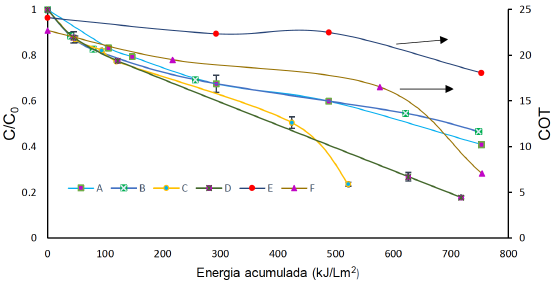
Figura 2 Degradación de 40 mg L-1 de FLX con [TiO2] y luz solar A) 50 mg L-1. B) 100 mg L-1. C) 300 mg L-1. D) 500 mg L-1. Mineralización de la FLX con [TiO2] y luz solar. E) 50 mg L-1. F) 500 mg L-1.
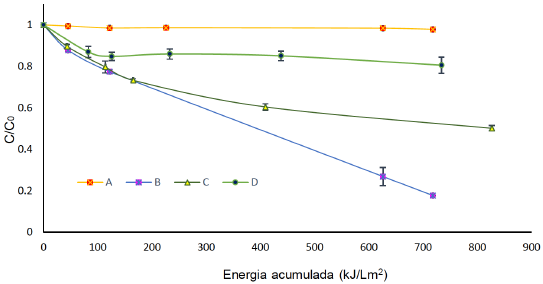
Figura 3 Degradación de 40 mg L-1 de FLX con [TiO2]= 500 mg L-1 por A) adsorción. B) TiO2 y luz solar. C) TiO2 [IPA]= 40 mg L-1 y luz solar. D) TiO2 [KI]= 40 mg L-1 y luz solar.
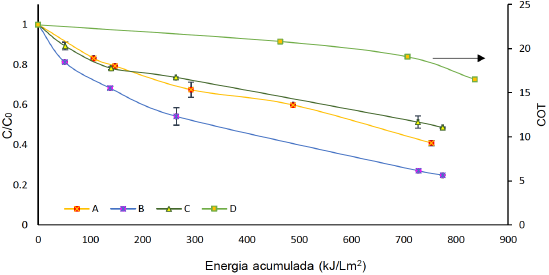
Figura 4 Degradación de 40 mg L-1 de FLX con [TiO2] = 50 mg L-1 y luz solar con A) Sin [H2O2]. B) [H2O2] = 1000 μM. C) [H2O2] = 4409 μM. Mineralización con [TiO2]= 500 mg L-1 y luz solar con D) [H2O2] = 1000 μM.
El proceso Fenton presentó una mayor eficiencia en la remoción de la FLX con 90 [μM de Fe2+ y 1000 de μM de H2O2 a pH natural después de 120 minutos de reacción (% remoción 41.8), a pH ácido, bajo estas mismas condiciones, alcanzó un 37.6% de degradación (Figura 5). Con 9 [μM de Fe2+, se observó una disminución de la remoción de FLX, alcanzando un 15.2% a pH ácido y un 11.4% a pH natural. Finalmente, a 1.8 μM de Fe2+ la degradación de la FLX fue menor en comparación a las otras dosis de Fe2+ utilizadas, con un 8.8% y 6.8% de degradación a pH ácido y natural, respectivamente (Figura 5).
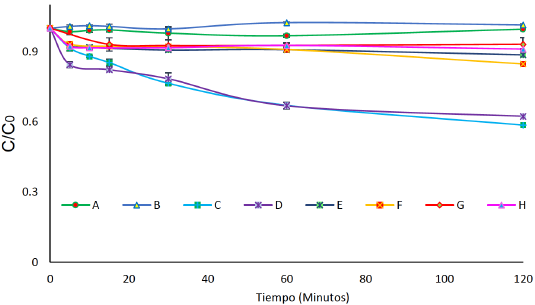
Figura 5 Degradación de 40 mg L-1 de FLX con [H2O2] = 1000 μM por: A) H2O2. B) [Fe2+] = 9 μM. C) F con H2O2 y [Fe2+] =90 μM a pH Natural. D). F con H2O2 y [Fe2+] = 90 μM a pH=3.08. E) F con H2O2 y [Fe2+] = 9 μM a pH Natural. F) F con H2O2 y [Fe2+] = 9 μM a pH=3.08. G) F con H2O2 y [Fe2+] = 1.8 μM a pH Natural. F) F con H2O2 y [Fe2+] = 1.8 μM a pH=3.08.
Las concentraciones de Fe+2 muy bajas ([Fe+2] << 90 μM) no ofrecen la concentración de catalizador suficiente para llevar a cabo la reacción Fenton. Se genera, por tanto, una baja concentración de radicales hidroxilo y esto sumado a la dificultad de la regeneración del catión de Fe+2 a patir del Fe+3 ocasiona una cinética muy lenta y una baja eficiencia de degradación. Por otro lado, se evidencia una cinética de degradación similar a pH natural y pH ácido lo que implicaría que la interacción radicalaria con la FLX es lo suficientemente rápida en cualquier pH, dado que durante la reacción está presente la forma protonada de la FLX.
En el proceso Fenton la regeneración del catión Fe2+ es lenta y está acompañada por la producción de radicales hidroperóxilo (HO2) (Li et al., 2011), al combinar la reacción Fenton con radiación solar, mejora la eficiencia del proceso Fenton, ya que la regeneración del Fe2+ es más rápida y se acompaña de la producción adicional de radicales hidroxilos (Feng & Le-cheng, 2004; Li et al., 2011), lo que permite un incremento en la velocidad de degradación de la FLX (Figura 6).
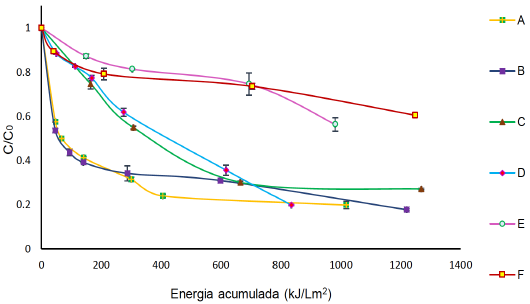
Figura 6 Degradación de 40 mg L-1 de FLX con [H2O2] = 1000 μM por: A) FFS con H2O2 y [Fe2+] = 90 μM a pH Natural B) FFS con H2O2 y [Fe2+] = 90 μM a pH ácido. C) FFS con H2O2 [Fe2+] =9 μM a pH natural. D) FFS con H2O2 y [Fe2+] = 9 μM a pH ácido. E) FFS con H2O2 y [Fe2+] = 1,8 μM a pH natural. F) FFS con H2O2 y [Fe2+] = 1,8 μM a pH=3.08.
La Figura 6 muestra que los resultados de la degradación de la FLX a 90 μM de Fe2+ y 1000 μM de H2O2, son los de mayor eficiencia y cinética de degradación y demuestran también que no hay diferencias significativas entre los porcentajes de degradación a pH ácido o pH natural (80% y 73% respetivamente). A 1.8 μM de Fe2+ la degradación de la FLX fue menor en comparación a las otras dosis de Fe2+ utilizadas, no se evidenció una diferencia significativa cuando se realizó a pH ácido y natural, con un 44% y 40% de degradación con energías acumuladas de 1.249 y 981 kJ L-1 m-2, respectivamente. De la misma forma, al comparar con la Figura 5, la presencia de la radiación solar mejora la eficiencia de la degradación y por supuesto la velocidad de degradación en aproximadamente un 35%. Lo que indica que la radiación solar promueve la reducción del Fe+3 que se encuentra en complejos orgánicos o formando complejos hidroxi-acuosos (Affam, Chaudhuri, Kutty, & Muda, 2014; De la Cruz et al., 2012; Klamerth, Malato, Agüera, & Fernández-Alba, 2013).
Los resultados obtenidos en la Figura 7 muestran que la FLX no sufre fotolisis, la combinación de la FLX con una [H2O2] de 1000μM y luz solar (Solar/H2O2) mejora la degradación (% remoción 17%) en comparación con la fotolisis. De acuerdo a éstos resultados, la ruta de degradación por el acople FFS es principalmente por vía radicalaria gracias a la reacción Fenton con radiación solar.
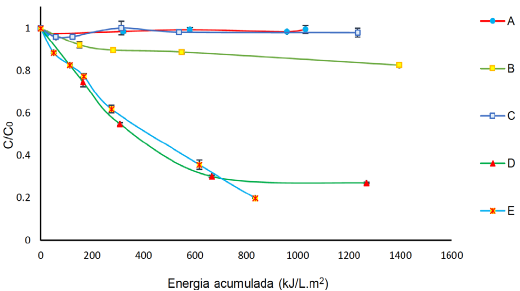
Figura 7 Degradación de FLX (40 mg L-1) por: A) Fotolisis. B) Solamente [H2O2] = 1000 μM. C) Solo Fe+2. D) FFS con H2O2 y [Fe2+] = 9 μM a pH natural. E) FFS con H2O2 y [Fe2+] = 9 μM a pH=3.08.
Era importante para la evaluación de los procesos, determinar el alcance de la mineralización alcanzado a las diferentes concentraciones de Fe+2 trabajadas en FFS (Figura 8). Se encontró que a 9 μM de Fe2+ se logró un 44% de mineralización a pH ácido y un 25% a pH natural, con energías acumuladas de 835 y 1.269 kJ L-1 m-2 respetivamente, con un alcance de la oxidación (% de remoción de DQO) de 66% y 12.8% respectivamente. Se observó que, a pesar de alcanzar la degradación de la FLX en las dos condiciones de pH (Figura 6), la mayor oxidación y mineralización de la FLX se da a pH ácido con menor cantidad de energía acumulada (Figura 8). Es claro que el Fe2+, que alcanza a estar en solución por un tiempo corto, logra vía radicalaria, el rompimiento de enlaces que obligan a la aparición de subproductos de degradación, sin embargo, ellos no se oxidan o mineralizan aún con más energía. Éste comportamiento se atribuye a la formación de los complejos de hidróxidos que se presentan a pH por encima de 3 (Bandala et al., 2010; Klamerth et al., 2013). Con 90 μM de Fe2+ también se observó una influencia del pH en la mineralización, alcanzando un 83% a pH ácido y un 65% a pH natural con energías acumuladas de 1.220 y 1.081 kJ. L-1 m-2, respectivamente, con una oxidación hasta de 50% y 44%, respectivamente. Finalmente, a 1.8 μM de Fe2+ se obtuvo un 24% (pH ácido) y un 10% (pH natural) de mineralización, con una DQO de 74% y 33%, respectivamente. Éstos comportamientos pueden atribuirse a que, aunque la radiación solar promueve la formación de especies de Fe+2 y de radicales OH* y evita la acumulación de hidróxidos, la concentración extra de radicales es suficiente para degradación mas no para llegar a mineralización.

Figura 8 Mineralización FLX (40 mg L-1) con [H2O2] = 1000 μM por: A) Fotolisis. B) FFS con H2O2 y [Fe2+] = 90 μM a pH Natural. C) FFS con H2O2 y [Fe2+] = 90 μM a pH=3.08. D) FFS con H2O2 y [Fe2+] = 9 μM a pH Natural. E) FFS con H2O2 y [Fe2+] = 9 μM a pH=3.08. F) FFS con F) FFS con H2O2 y [Fe2+] = 1.8 μM a pH Natural. G) FFS con H2O2 y [Fe2+] = 1.8 μM a pH=3.08.
3.3. Degradación de la FLX por foto-electro-Fenton
Cuando se somete la FLX a degradación vía electroquímica, evaluamos las diferencias en las cinéticas de degradación con cada uno de los procesos de electro Fenton, oxidación anódica (OA) y acoplando foto Fenton con OA y con iluminación por radiación solar.
Se observa en la Figura 9 que por medio de oxidación anódica no se alcanza degradación FLX, indicando que los radicales hidroxilos generados están quimi-adsorbidos ocupándose principalmente en la formación de un óxido superior que no es eficiente en la mineralización de la materia orgánica, éste comportamiento es típico de un ánodo tipo DSA como el usado en éste trabajo que consiste de la combinación de dos óxidos metálicos activos (Flores et al., 2015; Salazar et al., 2016). La Figura 9 también demuestra que al aplicar EF al sistema, se mejora la oxidación a un pH ácido, lo que implica que la degradación es vía únicamente Fenton y que probablemente a pH natural se están formando los complejos orgánicos o hidroxiacuosos de Fe+3.
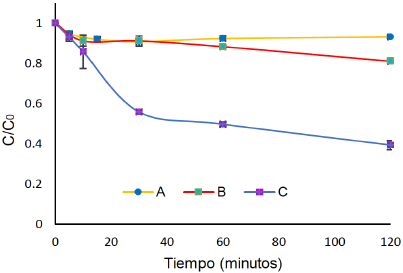
Figura 9 Degradación 40 mg L-1 de FLX con [Fe2+]=18 μM por: A) oxidación anódica. B) EF con Fe2+ a pH natural. C) EF con Fe2+ a pH=3.08.
La Figura 10 presenta la respuesta de la degradación y mineralización de FLX cuando es sometida a FEF con radiación solar (FEFS). Se observa que la degradación a pH natural, supera en velocidad a la degradación a pH ácido. Sin embargo, con energías acumuladas mayores a 800 kJ.m2 (más de 1 h de iluminación) las velocidades de degradación a los dos pH's se acercan en magnitud. Éste comportamiento se acerca al que ya conocimos para el proceso FFS de la FLX. De la misma forma, la mineralización se ve mejorada cuando el pH es ácido, comportamiento también ya conocido por FFS. Éstos resultados indican que por FEFS con un ánodo de IrO2/RuO2 la ruta de degradación no cambia por el acople electroquímico y se desarrolla únicamente FFS como se evidenció en la degradación de oxacilina hecha por proceso electroquímico en condiciones de laboratorio (Serna-galvis, Silva-agredo, Giraldo, Flórez-acosta, & Torres-palma, 2016).
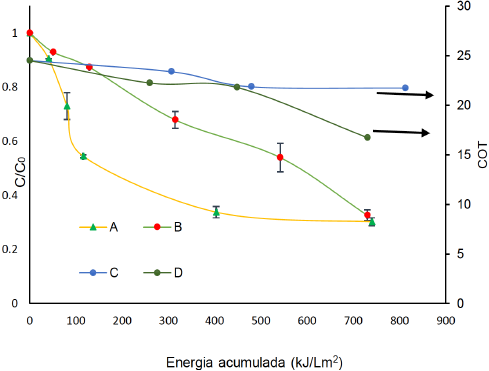
Figura 10 Degradación 40 mg L-1 de FLX con [Fe2+]=18 μM por: A) FEFS con Fe2+ a pH natural. B) FEFS con Fe2+ a pH=3.08. Mineralización de FLX 40 mg L-1 con [Fe2+]=18μM por: C) FEFS con Fe2+ a pH Natural. D) FEFS con Fe2+ a pH =3.08.
Adicionalmente se observa que utilizando FEFS, se alcanza un a degradación del 70% de la FLX con una energía acumulada de 700 kJ.L-1m-2, sin embargo a pH natural se tiene una velocidad inicial de degradación mayor que a pH ácido, permitiendo que en el sistema electroquímico se promueva el proceso FEFS aprovechando la rápida reducción del Fe+3 a Fe+2 que se alcanza en el medio salino, evitando la formación de hidróxidos que reducen drásticamente la velocidad de degradación (Bandala et al., 2010; Pimentel, Oturan, Dezotti, & Oturan, 2008; Salazar et al., 2016; C. C. Su, Chang, Bellotindos, & Lu, 2012). Comparando la eficiencia de FEFS vs FFS, se evidencia que para una energía acumulada de 700 kJ.L-1m-2, y una [Fe+2] comparable se alcanza exactamente el 70% de degradación para ambos, sin embargo las cinéticas son diferentes dependiendo del pH.
3.4. Toxicidad de la FLX y sus subproductos de degradación
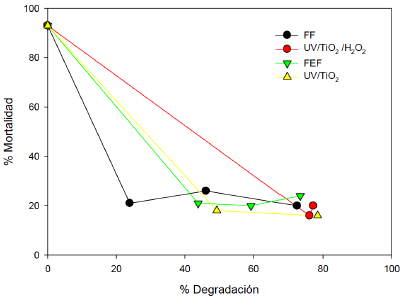
Como una forma de aproximar la toxicidad de la FLX y sus subproductos de degradación, se aplicó un bioensayo donde la levadura de cerveza se pone en contacto con agua tratada por cada de uno de los procesos aplicados a la FLX. La respuesta al porcentaje de mortalidad en diferentes porcentajes de degradación de la FLX, confirma que por medio de FF se alcanza una caída del 80% de la mortalidad de la levadura cuando se ha degradado solo el 80% de la FLX. Para los tres procesos restantes hay un descenso importante que se pronuncia marcadamente cuando se ha degradado más del 40%. Se observa que por los tres procesos e incluso por fotocatálisis con TiO2 en presencia de peróxido, se reduce el porcentaje de mortalidad hasta un 20%. A medida que se degrada la FLX, los subproductos de degradación no incrementan o sostienen la toxicidad.
3.5. Comparación de eficiencias de degradación de Fluoxetina por tres procesos de oxidación avanzada
Teniendo en cuenta que se utilizó el mismo sistema de reacción para la degradación de la FLX en los tres procesos, es decir se utilizaron 100 mL de solución de FLX con concentración inicial de 40 mg.L-1 en sistemas discontinuos (vaso de reacción) de 250 mL, dos horas de reacción y con irradiación de luz solar, es posible hacer una comparación de eficiencias de degradación y mineralización y de sus constantes cinéticas. La Tabla 1 muestra ésta comparación y permite decidir sobre el proceso que ofrece la mayor velocidad de degradación y mineralización y mayor eficiencia de degradación. El proceso FFS ofrece la velocidad de degradación más alta y el mayor porcentaje de degradación y mineralización.
TABLA 1 COMPARACIÓN DE CONSTANTES CINÉTICAS DE DEGRADACIÓN Y MINERALIZACIÓN PARA LOS PROCESOS FFS, FEFS Y FCS.
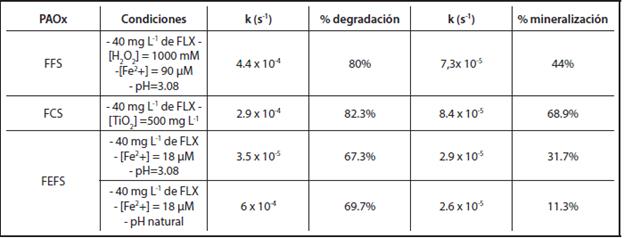
El proceso FCS presenta mayor mineralización incluso que FFS, sin embargo, al momento de pensar en una aplicación real, se prefiere un proceso como FFS que no requiere separación del catalizador y funciona eficientemente a concentraciones de Fe por debajo de los límites permitidos por la norma.
Para las condiciones del proceso FEFS, no es viable considerar éste proceso. Para ser aplicado debe utilizarse un ánodo que genere un aporte a la oxidación y mineralización por ejemplo un ánodo BDD (Serna-galvis et al., 2016).
En términos de mineralización, se alcanza mayor velocidad de mineralización vía FFS a pH ácido, lo que obliga a buscar condiciones óptimas para mejorar la respuesta a pH natural, pensando en una aplicación real.
4. Conclusiones
La degradación de FLX vía procesos fotoquímicos de oxidación avanzada es eficiente. Dentro de los procesos evaluados, fue el proceso FFS el que demostró mayor velocidad y eficiencia de degradación. El pH ácido del medio promueve mayor mineralización dado que a éste pH se mantiene una concentración elevada de radicales OH* por encima de los que se promueven a pH natural. El proceso FCS resulta eficiente en la degradación y mineralización de la FLX, sin embargo, la cinética es lenta lo que le resta practicidad al momento de plantear una aplicación con agua residual cruda. El proceso FEFS requiere el uso de un ánodo no activo como por ejemplo BDD, que promueva la formación y fisiadsorción de radicales OH* en su superficie capaces de ocasionar mineralización de FLX. Con la degradación de la FLX se generan subproductos que presentan menor toxicidad para organismos vivos como la levadura de cerveza (s. cerevisiae). La luz solar en todos los casos funciona en la fotoactivación de procesos catalíticos, permitiendo contemplar su uso en la optimización de procesos de degradación y mineralización de contaminantes emergentes presentes en aguas contaminadas reales.