1. Introducción
La generación de radicales libres, particularmente especies reactivas de oxigeno (ROS) y su alta actividad juegan un papel importante en la progresión de un gran número de alteraciones patológicas como inflamación, arterioesclerosis, enfermedades del corazón, esclerosis múltiple, enfermedad de Parkinson, enfermedad de Alzheimer, entre otras (Amari et al. 2014). En pro de la cura o prevención de estas enfermedades, se ha centrado el reciente interés de búsqueda de antioxidantes naturales seguros y eficaces, especialmente los antioxidantes que están presentes en extractos de plantas, debido a su actividad captadora de radicales libres o a la inhibición de ROS (Aceval Arriola et al. 2016). La potencial actividad antioxidante de los extractos de plantas es atribuida a la presencia de algunos compuestos bioactivos, tales como ácidos fenólicos, diferentes clases de flavonoides, carotenoides, vitamina A, E y C, los cuales están ubicados en todos los órganos de la planta (Duda et al. 2015).
La capacidad antioxidante de un extracto no viene dado por la suma de las capacidades antioxidantes de cada uno de sus componentes. Los compuestos interactúan entre sí pudiendo producirse efectos sinérgicos o inhibitorios (Kuskoski et al. 2005). Para medir la capacidad antioxidante de un extracto se han adoptado un amplio rango de ensayos espectrofotométricos, entre los más frecuentemente usados están los ensayos antioxidantes in vitro, los cuales utilizan un captador de radicales libres y son relativamente sencillos de realizar. Entre los ensayos de captación de radicales libres se encuentran el método DPPH (1,1-difenil-2-picril-hidrazilo), el ensayo de decoloración ABTS (Ácido 2,2'-azino-bis-3-etilbenzotiazolin-6-sulfónico) (Alam et al. 2013), Polifenoles totales por el reactivo (Folin-Ciocalteu) (Blainski et al. 2013), y el ensayo de la Capacidad de reducción Férrica Antioxidante (Pulido et al. 2000).
Dependiendo de las reacciones involucradas, los ensayos para determinar la capacidad antioxidante pueden ser divididos en dos categorías: ensayos basados en la reacción por transferencia de átomos de hidrógeno (HAT) y ensayos basados en la reacción por transferencia de electrones (ET). Los ensayos basados en la transferencia de electrones (ET) involucran dos componentes en la mezcla de reacción, antioxidantes y oxidantes, el cambio de color de la reacción es proporcional a la concentración del antioxidante. La mayoría de los ensayos basados en HAT aplican un esquema de reacción competitivo, en el que el antioxidante y el sustrato compiten por los radicales peroxilo generados térmicamente a través de los compuestos azoicos. (Huang et al. 2005).
Stevia rebaudiana Bertoni (Stevia) es una hierba perenne de la familia de las Arteraceae, nativa de América del Sur. Las hojas de Stevia contienen glucósidos de esteviol que se han utilizado como un edulcorante en América del Sur durante siglos y hoy en día su consumo se ha extendido por todo el mundo (Sadeghi et al. 2015).
En Colombia se están realizando grandes avances promisorios en el cultivo agrícola de Stevia, debido al alto contenido de diterpenos glucósidos edulcorantes en hoja, incluyendo esteviósidos y rebaudiósidos, que son hasta 100-300 veces más dulces que la sacarosa (Criado et al. 2015). Además del contenido de minerales, vitaminas, compuestos fenólicos, flavonoides que le otorgan un potencial beneficio para la salud humana (Barba et al. 2014). Teniendo en cuenta lo anterior, el cultivo de Stevia se viene desarrollando como una nueva alternativa económica para la agroindustria.
Gracias al poder edulcorante encontrado en las hojas de Stevia, estas tienen múltiples aplicaciones industriales en productos alimenticios, farmacéuticos y de belleza (Gawel-Beben et al. 2015).
Algunos autores han evaluado la capacidad antioxidante in vitro de diferentes extractos de hoja de Stevia en función del porcentaje de inhibición del método usado, los métodos más extensamente usados son FRAP, ABTS, DPPH y ORAC. Los métodos son a su vez correlacionados con el contenido de polifenoles totales a través del método de Folin-Ciocalteu, actividad captadora del radical hidroxilo, actividad captadora del radical anión superóxido y actividad captadora del peróxido de hidrógeno. A través de estas diferentes metodologías se ha demostrado una alta capacidad antioxidante de las hojas de Stevia (Lemus-Mondaca et al. 2012), (Shukla et al. 2009).
En el presente estudio se pretende determinar la capacidad antioxidante de extractos de tallo de Stevia a través de varios modelos in vitro y correlacionarlos con el contenido de polifenoles totales cuantificados por el método de Folin-Ciocalteu, con el fin de darle un valor agregado a los tallos de Stevia y potencializar su uso como antioxidante.
2. Materiales y métodos
Localización
Todos los ensayos se realizaron en el laboratorio del Grupo Interdisciplinario de Estudios Moleculares (GIEM), del instituto de química de la Universidad de Antioquia, en Medellín-Colombia.
Procedencia de los tallos de Stevia Rebaudiana
Los tallos de Stevia rebaudiana variedad Morita II fueron recolectados en el Municipio de Olaya-Antioquia.
Reactivos químicos
2.2'-Azino-bis (3-ethylbenzenothiazoline6-sulfonic acid) (ABTS), 2,4,6-Tri (2-pyridyl)-s-triazine (TPTZ), Trolox (6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid), DPPH (1,1-diphenyl-2-picrylhydrazyl) fueron adquiridos de Sigma-Aldrich. Reactivo de Folin-Ciocalteu, Carbonato de sodio, Cloruro férrico, Ácido acético y Ácido gálico fueron obtenidos de Merck. Metanol y otros reactivos químicos usados fueron de grado analítico.
Preparación de la muestra
Los tallos fueron deshidratados bajo un secador solar, el tallo fue molido en un molino (A11 B S1) y pasado por un tamiz # 30.
Se pesó 1 gramo de tallo en una balanza de ± 0.001 g (AR2140, OHAUS), se adicionaron 8 mL de metanol-agua (50 : 50, v/v pH 2 ajustado con ácido acético), se agito en el vortex (V1 Plus, BOECO) por 1 min, se sónico en un ultrasonido (D-78224 Singen/Htw, Elma) a temperatura ambiente por 10 min (Gasmalla et al. 2014), se centrifugo a 6000 rpm/3 min (D-78532 Tuttlingen, Hettich). Se recoge el sobrenadan te y se hace por triplicado. Luego se adiciono al residuo 8 mL de acetona-agua (70:30) seguido de agitación, sonicación y centrifugado, el procedimiento se realiza tres veces sucesivas. Los sobrenadantes son combinados y transferidos a un balón de 50 mL y se llevó a volumen final con agua destilada. Los extractos son filtrados por un papel de filtro (Whatman No. 2) y una membrana de Nitrato de Celulosa (0.20 mm) y almace nados a -20 °C. Se realizaron las mediciones antes de 24 h.
Para el extracto acuoso se repiten los mismos pasos cambiando los solventes usados por agua, sin modificar ninguna variable.
Determinación del contenido de polifenoles totales
El contenido de polifenoles totales de extractos de tallo de Stevia fue determinado usando el método de Folin-Ciocalteau (mezcla de ácido fosfotúngstico y fosfomolíbdico) y reportado como equivalentes de ácido gálico, a través de una curva de calibración (Blainski et al. 2013). Se tomaron 20 μL de muestra diluida con agua destilada, o solución estándar de ácido gálico en el caso de la curva, se adicionaron 1580 μL de agua, 100 μL de reactivo Folin-Ciocalteu y 300 μL de solución de carbonato de sodio al 20% (m/v). La mezcla fue agitada e incubada por 60 min en la oscuridad. La absorbancia fue medida a 725 nm usando como blanco agua (G10S UV-Vis). Las soluciones acuosas de ácido gálico (entre 0 y 1000 ppm) fueron usadas para la curva de calibración. Los resultados fueron expresados como mg equivalentes de ácido gálico (GAEs) por gramo de muestra seca.
Determinación de la capacidad captadora del radical DPPH
La determinación de la actividad antioxidante de los diferentes extractos se llevó a cabo por medio de la preparación de una solución del radical sintético DPPH (1,1-diphenyl-2-picrylhydrazyl) 0.5 mM en metanol (Brand-Williams et al. 1995). Se tomaron 100 μL de extracto a evaluar en un tubo de ensayo, se adicionaron 500 μL de metanol y 200 μL de DPPH, se homogenizó e incubó en la oscuridad por 30 min. Pasado este tiempo se midió la absorbancia a 515 nm usando como blanco metanol (G10S UV-Vis).
La capacidad antioxidante de los extractos se expresó como μMol Trolox / g de muestra seca, el cual tiene capacidad captadora de los radicales (Tovar del Rio 2013). Se realizó una curva de calibración del antioxidante de referencia Trolox (entre 0 y 500 |ÍM) usando metanol como solvente.
Determinación de la actividad inhibidora del catión radical ABTS
La determinación de la actividad antioxidante de los diferentes extractos se llevó a cabo de acuerdo con (Contreras-Calderón et al. 2011). 100 μL de extracto diluido con agua, o estándar de Trolox fue mezclado con 1 mL de solución de ABTS e incubar a 30 °C/30 min en oscuridad. Las lecturas fueron medidas a 730 nm (G10S UV-Vis). Se realizó una curva de calibración del antioxidante de referencia Trolox (entre 0 y 500 μM) usando metanol como solvente.
Determinación de actividad antioxidante por ensayo de FRAP
Los ensayos de FRAP fueron realizados de acuerdo a (Contreras-Calderón et al. 2011). El reactivo de FRAP contiene (2,5 ml de solución TPTZ (2,4,6-Tri(2-pyridyl)-s-triazin) con 2,5 ml de solución FeCl3 20 mM y 25 ml de buffer acético/acetato), se tomaron 900 μL de reactivo recién preparado con el fin de evitar degradación, se mezcló con 90 μL de agua destilada y 30 μL de extracto diluido en agua destilada, o solución de Trolox e incubados a 37 °C/30 min. La absorbancia fue medida pasados los 30 minutos de incubación a oscuridad a 595 nm, usando buffer de acético/acetato como blanco (G10S UV-Vis). Se realizó una curva de calibración del antioxidante de referencia Trolox (entre 0 y 500 μM) usando metanol como solvente. Los resultados fueron expresados en mmoles equivalentes de Trolox (TEs) por gramo de muestra seca.
Análisis estadístico
Los resultados fueron expresados como la media ± desviación estándar (SD). Para determinar la correlación entre los métodos de actividad antioxidante, fue la correlación Person's coeficiente (R). Los análisis fueron realizados usando Statgraphics centurión XVI, versión 16.1.18, 20012.
3. Resultados
A continuación se muestran, en la Tabla 1 y 2, los valores obtenidos para los ítems.
TABLA 1 CAPACIDAD ANTIOXIDANTE POR LOS MÉTODOS ABTS, FRAP Y DPPH) Y CONTENIDO DE POLIFENOLES TOTALES DE EXTRACTOS DE TALLO DE STEVIA
| MUESTRA | ABTS (mmol Tx/g DS) | FRAP (mmol Tx/g DS) | FOLIN (mg GAE/g DS) | DPPH (mmol Tx/g DS) |
| Extracto Orgánico | 311,01 ± 4,50 | 257,24 ± 10,07 | 35,89 ± 2,67 | 176,57 ± 6,64 |
| Extracto Acuoso | 220,32 ± 4,46 | 147,44 ± 6,86 | 29,84 ± 1,28 | 114,53 ± 4,69 |
TABLA 2 CORRELACIÓN ORDINAL SPEARMANS ENTRE LA CAPACIDAD ANTIOXIDANTE Y EL CONTENIDO DE POLIFENOLES TOTALES DE EXTRACTOS DE TALLO DE STEVIA
| FRAP | ABTS | DPPH | |
| FOLIN | 0,7953a | 0,7215b | 0,8008a |
a significant at p<0.001
b significant at p<0.002
Correlaciones
Para observar la relación existente entre el contenido de polifenoles totales y los métodos in vitro usados para determinar la capacidad antioxidante se calcularon los coeficientes de correlación descritos en la Tabla 2.
El contenido de polifenoles totales muestra la más alta correlación con la actividad antioxidante para DPPH y FRAP (r = 0.800, r = 0.795) respectivamente. Esto permitiría deducir que los fenoles son los principales causantes de esa actividad antioxidante. La correlación con respecto a ABTS también es positiva y mayor a 0.7 siendo una buena correlación, por lo cual se confirma que dicha actividad es atribuida a los grupos fenólicos presentes en el tallo.
Polifenoles totales
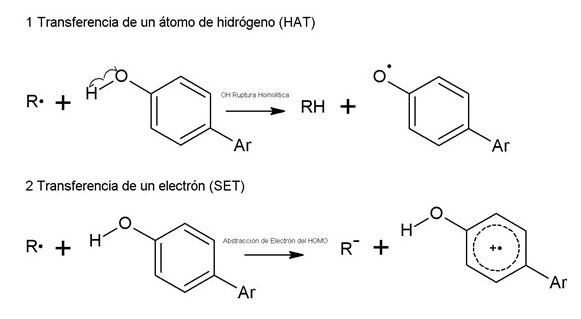
Los polifenoles como antioxidantes tienen dos mecanismos de acción, en el primero la molécula de polifenol reacciona con el radical libre, con la transferencia de un átomo de hidrógeno. En el segundo el oxidante transfiere un electrón singlete a la molécula del polifenol, Figura 1. El producto de ambos mecanismos son: un radical oxidado, un catión radical y una especie energéticamente estable (Leopoldini et al. 2011).
El contenido polifenoles totales, fue determinado por el método de Folin-Ciocalteu, y expresado como GAEs a través de una curva de calibración. En la Tabla 1 se observa la cantidad de polifenoles en el extracto acuoso y en el extracto orgánico del tallo de Stevia. Los principales grupos de polifenoles son flavonoides, ácidos fenólicos, alcoholes fenólicos, cumarinas, taninos, estilbenos y lignanos (Oroian & Escriche 2015). Se ha reportado en la literatura el contenido de algunos compuestos fenólicos en extractos metanólicos de tallo de Stevia, entre ellos polifenoles (6,5 ± 2,31 mg GAE), taninos (7,21 ± 2,95 mg TAE) y flavonoides (2,53 ± 2,75 % Quercetina) (Singh et al. 2012), en el estudio de cuatro líneas de Stevia se determinó el contenido de polifenoles totales en extractos metanólicos de tallo de Stevia entre 12,95 y 18,37 mg GAE/g (Zeng et al. 2013). En hoja también se han reportado compuestos fenólicos en extractos acuosos entre ellos el 1,2,3-Trihidroxibenceno (951,27 mg / 100 g), Ácido 4-meto-xibenzoico (33,80 mg / 100 g), Ácido p-cumárico (30,47 mg / 100 g), 4-metilcatecol (25,61 mg / 100 g), Ácido Sinápico (9,03 mg / 100 g), Ácido Cinámico (2,42 mg / 100 g) y flavonides (15,64 mg equivalentes de Quercetina/mg) (Kim et al. 2011). Además de estos estudios se ha reportado la caracterización y cuantificación de 98 compuestos polifenólicos en extractos de hoja de Stevia, entre los más representativos están el Ácido Dicafeoilquínico, Ácido Clorogénico, Quercetina 3-O-xilósido, Apigenina-7-O-glucósido, Ácido 3,4-Dimetoxicinámico, Luteolina 7-O-rutinósido, Ácido Cafeico, entre otros (Shivanna et al. 2013). La actividad captadora de los fenoles es atribuida a los grupos sustituyentes hidroxilo (-OH) y metoxi (-OCH3)(Kim et al. 2011). La presencia de varios grupos fenólicos encontrados en tallo y hoja pueden ser los responsables de la actividad antioxidante de los extractos del tallo de Stevia, comparando los reportes de la literatura con los resultados se observa que el extracto orgánico tiene un contenido de polifenoles de aproximadamente el doble respecto a uno de los reportes en extractos etanólicos.
Capacidad captadora del radical DPPH
La capacidad de reducción del radical DPPH fue determinada por la disminución de su absorbancia a 515 nm, la cual es inducida por antioxidantes presentes en los extractos y se cuantifica a través de una curva de calibración y expresado como μMol Trolox / g de muestra seca. Un resultado de DPPH positivo sugiere que los extractos son captadores de radicales libres. La capacidad captadora de los radicales libres por los oxidantes se puede atribuir a dos mecanismos, el mecanismo HAT en el cual el DPPH extrae un átomo de hidrógeno del grupo hidroxilo de ciertos ácidos y derivados fenólicos, y el mecanismo SET en el cual se transfiere un electrón del fenol al DPPH. En el caso de compuestos fenólicos, el mecanismo principal de capacidad captadora es a través de la captura del átomo de hidrógeno por parte del DPPH para crear una molécula estable (Andzi Barhé & Feuya Tchouya 2016). Se ha reportado previamente que el porcentaje de actividad captadora del radical DPPH es de aproximadamente un 70 % en extractos metanólicos de tallo de Stevia a una concentración de 800 μg / mL DPPH (Singh et al. 2012). La actividad captadora del radical DPPH de los extractos acuoso y orgánico del tallo de Stevia en términos de porcentaje fue de 38,32 y 29,38 % respectivamente, esta actividad es relativamente alta comparada con la reportada en la literatura dado que esta se determinó a una concentración de 0.5 mM de DPPH. Estos resultados indican una alta capacidad captadora del radical DPPH por parte de los extractos, lo cual confirma que éstos actúan como antioxidantes donadores de hidrógeno y de ruptura de cadena.
Capacidad captadora del radical ABTS
El método de ABTS fue determinado a través de la decoloración del radical, con una reducción de la absorbancia a 730 nm. La capacidad captadora del radical ABTS de los extractos acuoso y orgánico del tallo de Stevia fue de 220,32 ± 4,45 y 311,01 ± 4,49 μMol Trolox / g de muestra seca respectivamente, la cual se cuantificó a través de una curva de calibración, usando Trolox como patrón, . En la literatura se reporta la capacidad captadora del radical ABTS de aproximadamente 50 μMol Trolox / g en extractos metanólicos de tallo de Stevia (Zeng et al. 2013).
Capacidad antioxidante de FRAP
El ensayo de FRAP fue determinado a través de la capacidad de los extractos de tallo de Stevia y de Trolox de reducir el hierro (III) a hierro (II) por medio de una reacción de transferencia de un electrón, esto se visualiza por la formación de un complejo de color azul intenso; un valor alto de absorbancia indica un fuerte poder de reducción por lo tanto una alta capacidad antioxidante (Prior et al. 2005). La actividad captadora del radical ABTS de los extractos acuoso y orgánico del tallo de Stevia fue de 147,44 ± 6,86 y 257,24 ± 10,07 μMol Trolox / g de muestra seca respectivamente, la cual se cuantificó a través de una curva de calibración usando Trolox como patrón. No se encontraron reportes de la actividad captadora de extractos de tallo por el ensayo de FRAP, pero si se encuentra en cuanto a la hoja de Stevia, extractos acuosos y metanólicos de 38,24 ± 0,36 y 37,40 ± 1,58 mg Trolox / g DS respectivamente (Tadhani et al. 2007). Es de aclarar que no todos los metabolitos responsables de la actividad antioxidante de las hojas tienen que estar presentes en los tallos, la comparación se hace solo con el objetivo de resaltar la alta capacidad reductora en el ensayo de FRAP de los extractos de tallo de Stevia.
Las diferencias significativas en cuanto al contenido de polifenoles totales y capacidad antioxidante en los extractos evaluados demuestran que las propiedades químicas de los solventes influyen en la composición y actividad fisicoquímica de las plantas (M'hiri et al. 2015). Las diferencias en cuanto al contenido de polifenoles y capacidad antioxidante determinada por los métodos in vitro comparada con los reportes de la literatura pueden deberse a los métodos de extracción y a las condiciones climáticas como la temperatura, la precipitación, la humedad, así como las condiciones del suelo, altitud entre otros, que modifican la bioactividad de los productos vegetales (Granato et al. 2016). Esto sugiere que los tallos de Stevia cultivados en la región Antioqueña pueden ser usados como potenciadores de la actividad antioxidante en diversas aplicaciones.
4. Conclusiones
En esta investigación, se ha observado que los extractos de tallo de Stevia Rebaudiana actúan como un potencial captador de radicales libres como lo indican los tres modelos in vitro evaluados FRAP, DPPH y ABTS y el contenido de polifenoles totales por el método de Folin-Ciocalteu. Por lo tanto, los extractos de tallo de Stevia podrían ser usados como una fuente accesible de antioxidantes en el tratamiento de varios problemas relacionados con el estrés oxidativo. Además, el alto contenido de polifenoles totales y el potencial antioxidante de los tallos de Stevia, determinados en este estudio, hacen muy interesante y factible la posibilidad de darle un valor agregado a los tallos a través de la posibilidad de incorporar los extractos en alimentos con el fin de mejorar sus propiedades funcionales y medicinales.
A través de las diferentes metodologías empleadas se determinó una mayor actividad antioxidante por ABTS, seguido de FRAP, DPPH, y por último polifenoles totales, la correlación entre las actividades fue positiva y con un valor-P <0.05. Además se encontró una mayor actividad inhibidora de radicales libres de los extractos comparados con los reportes de la literatura en cuanto a hoja y tallo de Stevia. Este hecho puede deberse, a los métodos de extracción empleados o a la favorabilidad de las condiciones geográficas de Colombia para el cultivo de Stevia rebaudiana variedad Morita II, lo cual se ve reflejado en el posible aumento en el contenido de metabolitos secundarios.