1. Introducción
En Colombia, el cultivo de café involucra ca. 560,000 familias campesinas, generando ca. 2 millones de trabajos agropecuarios (Federación Nacional de Cafeteros de Colombia, 2018). En el 2017, su cultivo condujo a la exportación de cerca de 13 millones de sacos de diferentes tipos de café (tostado, molido y soluble) (United States Department of Agriculture, 2018). Respecto al café soluble, en ese mismo año se comercializaron 823 mil sacos ubicando al país dentro de los 10 principales productores mundiales (Marketwatch, 2018). La conservación del producto y la facilidad de preparación de una taza de café de buena calidad, a precios asequibles, probablemente han propiciado el incremento de ese mercado.
El aumento del consumo de café soluble implica también un crecimiento de su industria y de la cantidad de desperdicios generados en su producción. Entre ellos se encuentran principalmente la borra del café y las aguas residuales con un alto potencial contaminante (Clarke y Macrae, 1985). El reuso y/o reciclaje de la borra han sido ampliamente estudiados (Couto et al., 2009; Kondamudi et al., 2008). Sin embargo, el tratamiento eficiente de las aguas residuales (40-45 l/kg de café soluble producido) aún es un tema pendiente de gestión ambiental.
Las aguas residuales provenientes de la producción de café soluble poseen una amplia variedad de contaminantes. Se trata de aguas complejas conformadas por una mezcla de sustancias como cafeína, melanoidinas, ligninas, taninos, ácidos húmicos, polisacáridos, entre otros (Farah, 2012). En general, contienen altos valores de Demanda Química de Oxígeno (DQO), Demanda Biológica de Oxígeno (DBO5), Sólidos Suspendidos Totales (SST) y principalmente un color café marrón oscuro característico. La disposición de estas aguas residuales en cualquier cuerpo de agua sin un tratamiento previo puede generar graves daños en la biota acuática (Dinsdale et al., 1996), considerando que la relación DBO5/DQO (< 0.35) sugiere que este efluente no es fácilmente biodegradable.
Diferentes métodos de tratamiento se han evaluado para el tratamiento de las aguas residuales de la industria del café soluble. Los métodos físico-químicos convencionales, como coagulación-floculación, logran disminuir ciertos niveles de materia orgánica y color (Panchangam y Janakiraman, 2015; Zayas et al., 2007). Sin embargo, no logran alcanzar los valores límites permisibles en los vertimientos puntuales a cuerpos de agua superficiales y a los sistemas de alcantarillado público establecidos por las cada vez más exigentes legislaciones ambientales alrededor del mundo (en el caso de Colombia, la definida por el Ministerio de Ambiente y Desarrollo Sostenible, MADS, mediante la Resolución No.0631 de 2015). Complementar el tratamiento primario con un proceso biológico puede ser poco efectivo o requerir largos tiempos de reacción debido a la presencia de componentes inhibitorios y recalcitrantes (Dinsdale et al., 1997; Fernandez et al., 1993). Otras alternativas reportadas en la literatura para el tratamiento de las aguas provenientes de la industria de café soluble son los Procesos Avanzados de Oxidación (PAOs), entre ellos los procesos Fenton (Tokumura et al., 2006, 2008; Ibarra-Taquez et al., 2018), la combinación de procesos primarios con PAOs (Radjenovic y Sedlak, 2015) y los procesos electroquímicos (v.g., electrocoagulación (EC), oxidación anódica (OA)) (Cárdenas et al., 2009).
La EC es una tecnología eficiente y económica para el tratamiento de aguas residuales, que permite remover materia suspendida de tamaño sub-micrométrico, romper emulsiones como aceites y grasas, oxidar y retirar metales pesados sin la adición externa de sustancias químicas. En el proceso, el ánodo (v.g., de hierro o de aluminio) se disuelve por corriente eléctrica, generando in situ un coagulante activo (iones metálicos de Fe+2 o de Al+3) (Holt et al., 2005; Chen, 2004):
Adicionalmente, la electrolisis anódica del agua produce oxígeno e hidrógeno de la siguiente forma:
Simultáneamente, en la superficie del cátodo, se generan hidróxidos e hidrógeno gaseoso.
A continuación, los iones metálicos y el ion OH - reaccionan para formar complejos poliméricos con carga o hidróxidos amorfos de amplia área superficial los cuales se encargan, posteriormente, de la desestabilización y/o remoción de sustancias coloidales (Akbal y Camci, 2010; Martínez y Brillas, 2009). La formación de estas especies depende del pH de la solución, la concentración de iones metálicos, la relación OH - /M +n y el tipo de iones en solución (Cañizares et al., 2009a). La EC se ha utilizado con éxito para eliminar el color (Kliaugaite et al., 2013) y contaminantes de las aguas residuales de la industria alimentaria (Thirugnanasambandham et al., 2015). Sin embargo, hasta donde sabemos, su aplicación para el tratamiento de efluentes de la industria del café soluble es muy escasa en la literatura.
Igualmente, la OA se ha convertido en una tecnología prometedora para el tratamiento de aguas residuales (Zhu et al., 2010). En este proceso, la materia orgánica se puede oxidar de dos maneras: (i) por oxidación directa, sobre la superficie anódica, para producir principalmente H2O y CO2; y (ii) por oxidación indirecta, que ocurre en presencia de oxidantes fuertes producidos electroquímicamente (v.g., cloro, hipo-clorito, peroxodisulfato y ozono), que reaccionan con compuestos orgánicos y que pueden conducir a su mineralización completa a CO2, H2O y/u otros componentes inorgánicos (Martínez-Huitle y Ferro, 2006). Aunque durante la oxidación de los compuestos orgánicos se pueden presentar ambos mecanismos, el material del ánodo promueve selectivamente uno de ellos (García et al., 2018). De hecho, este lo determina el tipo de interacción entre el ánodo y especies activas de oxígeno. Así, las interacciones débiles (fisisorción) se logran con un ánodo no-activo. Este tipo de ánodo se caracteriza principalmente por tener un amplio número de sitios disponibles para la adsorción de radicales hidroxilo y baja afinidad química por el oxígeno de las moléculas de agua. Su clasificación se deriva de su baja actividad electroquímica para la generación de O2 lo que induce una rápida descarga de los radicales hidroxilos en las vecindades del ánodo. El grupo de electrodos no-activos está conformado por Diamante Dopado con Boro (DDB), óxido de estaño dopado con antimonio, dióxido de plomo, entre otros (Comninellis, 1994; Swain et al., 1998). La conformación especifica del diamante tiene la capacidad de promover la partición de las moléculas de agua y de conformar el intermediario Ánodo(•OH) que libera fácilmente el radical para la posterior mineralización de los contaminantes. Por otro lado, las interacciones fuertes (quimisorción) se pueden desarrollar a través de los electrodos activos. Este tipo de electrodos posee una alta concentración de sitios activos y un importante número de vacantes para recibir el oxígeno dentro de su estructura (Comninellis, 1994). Adicionalmente, su alta actividad catalítica promueve la producción de oxígeno y, como consecuencia, su sobrepotencial de O2 es bajo. Esa alta actividad catalítica genera fuertes interacciones con las moléculas de agua de la solución y por lo tanto altos valores de entalpias de adsorción. Los electrodos activos están fabricados en materiales como grafito, IrO2, RuO2, Pt entre otros. Este grupo de ánodos adicionalmente tiene alta actividad electro-catalítica para oxidar iones cloruro y producir especies de cloro activo, que pueden constituir una vía alterna para el tratamiento de las aguas. Esto quiere decir que su uso promueve el mecanismo descrito para la generación de agentes oxidantes a partir de aniones en solución (principalmente cloruros) (Brillas y Martínez, 2015). Recientemente, el proceso de OA ha demostrado alta capacidad para el tratamiento de aguas residuales de diferentes orígenes. Algunos de estos estudios (Subba Rao y Venkatarangaiah, 2018; Fernandes et al., 2015; Villanueva et al., 2014; Cañizares et al., 2009b) han aplicado esta tecnología para oxidar aguas residuales con alto contenido de color, para degradar específicamente alguna de las sustancias constitutivas del efluente proveniente de la producción de café (v.g., melanoidinas, cafeína y polifenoles) o para aguas relacionadas con otros procesos de producción del café (v.g., lavado y despulpado). Sin embargo, en la literatura abierta, hasta el momento no existe reportada una evaluación de la OA como tratamiento específico para las aguas residuales provenientes de la industria de café soluble.
En un estudio previo sobre el tratamiento de aguas residuales provenientes de la industria de café soluble (Ibarra-Taquez et al., 2017), demostramos que es posible alcanzar un importante rendimiento, en términos de la reducción del color, DQO, los gastos energéticos y de los costos operacionales, utilizando un esquema secuencial EC-OA. Este fue evaluado utilizando los electrodos de aluminio y grafito para los dos procesos electroquímicos acoplados (i.e., EC: Al/grafito y OA: grafito/Al). En extensión del trabajo anterior, se analizará el efecto del material de los electrodos, así como del tipo de electrolito de soporte (Na2SO4 o NaCl), en la eficiencia del proceso secuencial EC-OA con el fin de maximizar la degradación de contaminantes y minimizar los costos operacionales. Específicamente, se consideraron dos tipos diferentes de ánodos: un ánodo activo, grafito, y uno no-activo, DDB, y seis diferentes materiales de cátodos (acero inoxidable, titanio, hierro, aluminio, grafito y DDB). Se determinó su efecto sobre el rendimiento de la degradación mediante OA, en términos de la reducción de color y de la DQO, así como de la formación de SST y pH. Adicionalmente, para cada caso, se realizó un análisis integral de los costos operacionales.
2. Materiales y Métodos
2.1. Reactivos
Todos los reactivos se usaron como se adquirieron, sin ninguna purificación adicional. Cloruro sódico (NaCl, ≥98% m/m, Merck) and sulfato sódico (Na2SO4, 99% m/m, Duksan) fueron utilizados como electrolitos de soporte. Ácido clorhídrico (HCl, 37% m/vol., Honeywell) y ácido sulfúrico (H2SO4, 95-97% m/vol., Merck) se aplicaron para el lavado y pre-tratamiento de electrodos.
2.2. Métodos analíticos
Se siguieron los métodos estándar (APHA, 2017) tanto para el análisis cuantitativo del efluente industrial como para el seguimiento del proceso de tratamiento: conductividad (2510-B, conductivímetro LAB-960 Analytics); pH (pH-metro LAB-850-Analytics); DQO (5220D, método de reflujo cerrado con mediciones espectrofotométricas, NANOCOLOR® UV/VIS); DBO5 (5210 B, método respirométrico de 5 días); COT (5310B, combustión catalítica a 950 °C en oxígeno ultra puro (99.999 vol./vol. %), Multi N/C 3100 de Analytik Jena®, rango de detección = 155 μg/l - 30000 mg/l.); y las mediciones cuantitativas de color (método 2120C, unidades Pt-Co, NANOCOLOR® UV/ VIS); SST (método 2540D).
2.3. Muestra de agua residual industrial
Las muestras del efluente bajo estudio se tomaron directamente de la corriente de aguas residuales de una planta industrial de café soluble, ubicada en la región cafetera colombiana (Departamento de Caldas). Para determinar sus características representativas, el muestreo se realizó bimensualmente durante periodo de un año (un total de 18 muestras; 3 réplicas de 6 muestras). El muestreo, la conservación, el transporte y el almacenamiento, se realizó conforme a: La Norma Técnica Colombia y de la Organización Internacional de Normalización (ISO) (NTC-ISO 5667-3), las guías establecidas por el IDEAM, específicamente para el monitoreo y preservación de muestras (IDEAM, 2010), y a los Standard Methods for the Examination of Water and Wastewater Analysis (APHA, 2017). Esto con el fin de garantizar un control de calidad adecuado y proporcionar y mantener un nivel de confianza en la integridad y precisión de los datos tomados. La Tabla 1 presenta los valores promedio, junto con sus desviaciones, correspondientes a los parámetros principales analizados de las aguas residuales bajo estudio.
TABLA 1 PRINCIPALES CARACTERÍSTICAS FÍSICO-QUÍMICAS DEL AGUA RESIDUAL PROVENIENTE DE UNA INDUSTRIA DE CAFÉ SOLUBLE UBICADA EN LA REGIÓN CAFETERA COLOMBIANA JUNTO CON LOS VALORES LÍMITES MÁXIMOS PERMISIBLES SEGÚN EL MINISTERIO DE AMBIENTE Y DESARROLLO SOSTENIBLE DE COLOMBIA (2015)
| Parámetro | Unidades | Agua residual | Valor máximo permitido* |
|---|---|---|---|
| Conductividad | μS/cm | 465 ± 34 | No reporta |
| pH | 4.7 ± 0.15 | 6.0 - 9.0 | |
| Demanda Química de Oxígeno (DQO) | g/l | 3.610 ± 0.061 | 1.000 |
| Demanda Biológica de Oxígeno (DBO5) | g/l | 0.726 ± 0.026 | 0.600 |
| Carbón Orgánico Total (COT) | g/i | 1.322 ± 0.026 | No reporta |
| Color | U Pt-Co | 3518 ± 17 | Análisis y reporte |
| Solidos suspendidos totales (SST) | g/i | 0.051 ± 0.015 | 0.400 |
* Resolución No.0631 de 2015 del MADS
El efluente presenta un intenso color marrón oscuro y un pH ácido, que podrían interferir con la normal radiación solar hacia los organismos acuáticos y alterar la cadena trófica de cualquier cuerpo de agua, si es vertido sin un tratamiento previo. Adicionalmente, el valor de la DQO de esta agua residual es tres veces más alto que el límite permitido en Colombia, lo que implica la presencia de gran cantidad de materia orgánica. Además, la relación inicial DBO5/DQO de 0.201±0.011 sugiere que el efluente analizado no es susceptible a biodegradación. Finalmente, el índice del estado de oxidación promedio del efluente (AOS por sus siglas en inglés de Average Oxidation State, Ecuación (4), (Vogel et al., 2000)) presenta un valor de -0.096±0.012.
Esto implica un muy bajo grado de mineralización, considerando que el AOS puede tomar valores entre -4 (para el estado más reducido de carbono, CH4) y +4 (para el estado más oxidado de carbono, CO2). Altos valores de AOS son frecuentemente asociados con soluciones bio-compatibles cuando dentro de su matriz no contienen trazas de componentes altamente tóxicos (Vogel et al., 2000). Lo contrario indica el efluente rico en los componentes con bajo estado de oxidación.
2.4. Configuración experimental y procedimiento
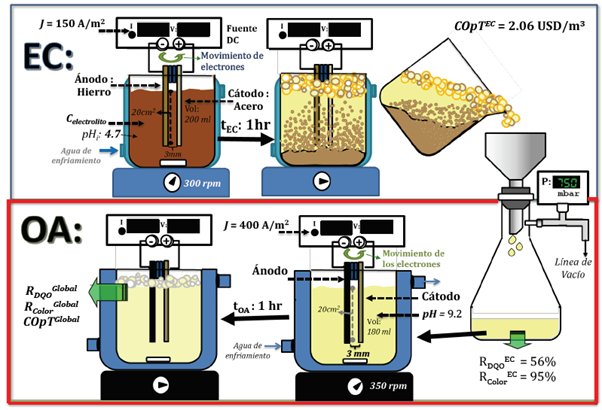
El esquema de tratamiento estaba conformado por dos celdas electrolíticas, de EC y OA, fabricadas de borosilicato, enchaquetadas, de 250 ml de capacidad (Figura 1).
En la parte superior de cada celda, se ubicó un sensor PT-100 (± 0.01 °C) para medir la temperatura de la solución tratada. Todos los experimentos se llevaron a cabo a una temperatura de 20°C (±0.05 °C), controlada usando un baño termostático (F-12, Julabo - Germany) conectado a la chaqueta de la celda. En cada caso, la solución se agitó mecánicamente usando una placa de agitación magnética (Fisher Scientific Isotemp) y un agitador magnético (2.5 cm). Cada celda electrolítica contuvo dos electrodos planos, rectangulares, dispuestos verticalmente y con un área efectiva de 20 cm2 (5 cm de ancho x 4 cm de altura). Las pruebas electrolíticas se llevaron a cabo a condiciones galvanostáticas, garantizadas a través del control de una fuente de corriente continua (Gw Instek GPS-3303; 0-30V; 0-3A). El voltaje celda se midieron con un multímetro (FLUKE 76 True RMS).
En la etapa de EC, la celda electrolítica fue cargada al 80% de su capacidad con el agua residual a tratar (200 ml). Los electrodos utilizados fueron de hierro (pureza 99.5% m/m, ánodo) y acero (Tipo 316, cátodo), ubicados en una distancia de 3 mm. Se utilizaron las siguientes condiciones de operación, optimizadas previamente (Ibarra-Taquez, 2018): pH = 4.7 (pH original del agua residual), densidad de corriente = 150 A/m2, C electrolito : NaCl = 1.78 g/l o Na2SO4 = 4.321 g/l, velocidad de agitación = 350 rpm, y tiempo de operación = 1 hora. A estas condiciones, la EC permitió obtener: una reducción de DQO igual a 55.7 % ±2.3 (1.599 g/l ±0.043); una reducción del color del 94.7 % ±0.9; pH final de 9.2 ±0.1, cantidad de los lodos 3.863 g/l ±0.085; COT de 0.534 g/l ±0.024; AOS de -0.492 ±0.071, y un costo total de operación de 2.06 USD/m3 ±0.02. Teniendo en cuenta que el proceso de EC no permitió alcanzar la reducción de DQO requerida por la legislación colombiana (1.000 g/l), se planteó acoplar una etapa adicional de OA al tratamiento de EC con el fin de aprovechar de manera sinérgica las ventajas de cada de las tecnologías. Así, al final del proceso de EC, el agua residual tratada se filtró utilizando un papel con retención media (11μm, grado 1, Whatman®) a una presión de 750 mbar. Luego, el filtrado (180 ml) fue cargado a la celda de OA.
En la etapa de OA, la celda electrolítica operó a las siguientes condiciones (determinadas según los resultados de los ensayos preliminares reportados por Ibarra-Taquez (2018)): densidad de corriente = 400 A/m2, velocidad de agitación = 350 rpm, pH = 9.2 (correspondiente al pH final del filtrado de EC), tiempo de operación = 1 hora, distancia entre electrodos = 3 mm. Los electrodos evaluados para el proceso de OA fueron: (i) como ánodo: grafito (grado: EC-12) o DDB (Diamante Dopado con Boro, 700 ppm, soportado en silicio, fabricante: NeoCoat®); y (ii) como cátodo: se examinaron cuatro electrodos metálicos (aluminio (Al-1100, pureza > 99.5% m/m), hierro (pureza 99.5% m/m), acero (tipo 316), titanio (grado 2, 99% de pureza)) y los mismos materiales de los ánodos. Todos los experimentos se desarrollaron por triplicado.
Antes de cada ensayo, los electrodos se adecuaron según el siguiente procedimiento: (i) el electrodo de grafito: se sumergió en agua destilada durante 3 horas para desorber cualquier sustancia presente en el material y posteriormente se sometió, en forma aislada, a calentamiento durante 24 horas en un horno a una temperatura de 107°C para así evaporar los remanentes de agua de su superficie; (ii) el electrodo de DDB: se polarizó su superficie con una corriente de 300 A/m2 durante 30 minutos en una disolución de ácido sulfúrico 1 M (con el fin de activar sus centros de adsorción y limpiar su superficie); (iii) los cátodos metálicos: se lijaron y se sumergieron en ácido clorhídrico concentrado (3M) por 5 minutos y posteriormente se lavaron con abundante agua.
El desempeño de cada pareja de electrodos (en la etapa de OA), en el proceso secuencial EC-OA, fue evaluado teniendo en cuenta la decoloración, la reducción de DQO y de SST, y el pH final del efluente tratado. Estos parámetros fueron seleccionados considerando su importancia en la medida de la contaminación del agua según lo establecido por la legislación colombiana (Res. 0631 del 2015, MADS). Como parámetro comparativo del desempeño de los procesos de EC-OA, desde una perspectiva económica, adicionalmente se evaluaron los costos operacionales totales (COpT, en USD/m3). Los precios base de reactivos, materiales, servicios y disposición de los lodos generados que se utilizaron para su evaluación se tomaron del mercado colombiano para el año 2018 (DANE, 2018; EPM, 2018). Sus valores de referencia se reportan en la Tabla 2.
TABLA 2 PRECIOS DE REACTIVOS, ELECTRODOS Y SERVICIOS PARA LA EVALUACIÓN DE COSTOS OPERACIONALES DE LOS PROCESOS PROPUESTOS
| Reactivos | Pureza | Precio (mercado colombiano/ 2018)* |
|---|---|---|
| Cloruro sódico (NaCl) | 99% | 0.073 USD/kg |
| Sulfato sódico (Na2SO4) | 99% | 0.080 USD/kg |
| Electrodos | Precio (mercado colombiano/ 2018)* | |
| Electrodo de aluminio | 1.195 USD/kg | |
| Electrodo de hierro | 0.705 USD/kg | |
| Electrodo de acero | 1.343 USD/kg | |
| Servicios | Precio (mercado colombiano/ 2018)* | |
| Manejo y disposición de lodos con aluminio | 0.0398 USD/kg | |
| Manejo y disposición de lodos con hierro | 0.0420 USD/kg | |
| Energía eléctrica | 0.174 USD/kWh | |
*Tasa de cambio empleada para conversión de pesos colombianos (COP) a dólares americanos (USD): 2956 COP/USD (valor promedio del año 2018)
Para el proceso de EC, los costos operacionales totales por volumen de agua tratada consideran los requerimientos energéticos, el desgaste de los electrodos y el manejo de los lodos producidos así:
donde E elec representa el consumo de energía en kWh por metro cúbico de agua tratada calculado como:
donde t es el tiempo en horas de tratamiento; V el volumen de la celda en litros; I y U son la corriente eléctrica en amperios y el promedio del potencial eléctrico de la celda de EC en voltios. En la Ecuación (5), G ánod y G cat corresponden al desgaste de los electrodos (ánodo y cátodo, respectivamente) por volumen de la solución tratada, determinado según la Ecuación (7):
donde V es el volumen de solución en la celda en litros, m electrodo 0 representa la masa del electrodo al inicio del proceso (t=0) y m electrodo fin la masa al final del proceso, ambas en gramos. C electrolito corresponde a la concentración del electrolito de soporte, NaCl o Na2SO4, agregado a la solución. P Energ , P ánod , P cát y P electrolito es el precio de la energía eléctrica, el precio del electrodo consumido y el precio del electrolito de soporte (con una pureza de 99%), respectivamente.
El cálculo de la generación de lodos, G lodos , se realizó a partir de la Ecuación (8):
donde V es el volumen de solución en la celda en litros, m filt 0 es la masa de papel seco y m filt fin es la masa de la torta de filtración seca junto con el papel filtro en gramos.
Para el proceso de OA, los costos operacionales totales se calcularon teniendo en cuenta los requerimientos energéticos, el desgaste del cátodo y el manejo de lodos. Para el caso de OA la corrosión del ánodo fue mínima durante los ensayos, razón por la cual no se tuvo en cuenta el término relacionado (Gánod=0). De esta forma la Ecuación (5) para OA se simplifica en la siguiente manera:
Considerando que el esquema secuencial es un tratamiento conformado por EC y OA, el cálculo de sus costos totales operacionales es la suma de los costos de cada una de las etapas:
3. Resultados y Discusión
Los resultados del desempeño del proceso de OA usando ánodo de grafito o DDB y seis diferentes cátodos se presentan en la Figura 2. La línea punteada muestra, simultáneamente, los límites establecidos por la legislación colombiana para la DQO, el pH y los SST (ver Tabla 1). Así, para garantizar el cumplimiento de requisitos de ley, las barras de color gris deben estar debajo de la línea punteada (i.e., DQO y SST) mientras que las barras de color blanco (i.e., pH) deben estar por encima de ella.
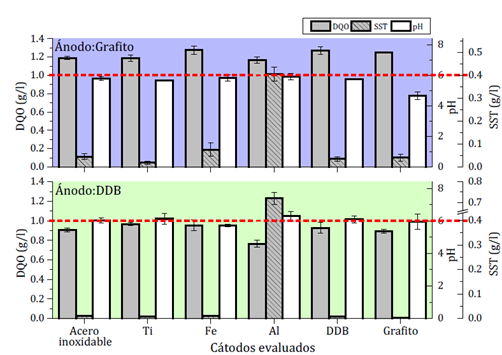
Figura. 2 Comparación de electrodos para la etapa de OA en el proceso secuencial EC-OA respecto a los parámetros exigidos por la legislación colombiana. Ánodos evaluados: Grafito y DDB. Cátodos evaluados: acero inoxidable, titanio, hierro, aluminio, DDB y grafito (J = 400 A/m2, C NaCl = 1.78 g/l, VA = 350 RPM, t = 60 min, pH ¡ = 9.2 y Dist = 3mm)
Como se puede observar en la Figura 2, parte superior, a las condiciones operacionales evaluadas, utilizando electrodos de grafito, con cualquier material evaluado como cátodo, no es posible alcanzar los niveles de reducción de DQO exigidos por la ley. Sin embargo, con un incremento en la densidad de corriente y en la concentración del electrolito de soporte (v.g., NaCl) superar tal límite podría ser factible. De hecho, existe la posibilidad que tales incrementos promuevan la formación de una mayor cantidad de agentes oxidantes fuertes, tales como hipoclorito, y así la reducción de contaminantes. Con grafito como ánodo, el pH final del tratamiento estuvo cercano al exigido por la legislación, principalmente para los cátodos de acero inoxidable, hierro y aluminio.
Respecto a los SST formados, su concentración se mantuvo por debajo del límite máximo permisible según la ley colombiana, usando cualquiera de los cátodos a excepción del cátodo de aluminio. Este material del cátodo puede sufrir corrosión química por los iones hidroxilos producidos durante la electrólisis del agua. Dicha corrosión ocurre principalmente cuando los valores de pH en solución son altos, según la siguiente reacción:
De esta manera se pueden generar flóculos de diferentes especies de aluminio. Su presencia, en el esquema acoplado, implicaría el uso de una nueva etapa de filtración (o sedimentación) y la consecuente generación de residuos que finalmente implicarán mayores costos operacionales y una mayor polución secundaria. Por otro lado, al parecer la corrosión química en esta etapa no promovió ningún mecanismo de descontaminación sinérgico (del tipo coagulación-floculación). Esto es evidente si se compara la pareja grafito-aluminio con los otros pares que no se corroen químicamente. Los niveles de eficiencia para este sistema son los esperados debido a que la mayoría de coloides que podrían haber sido retirados por las especies de aluminio, provenientes del cátodo, fueron previamente removidos durante el paso de EC. En conclusión, si se utiliza una pareja de electrodos adecuada, el tratamiento propuesto se puede llevar a cabo con una única etapa de sedimentación o filtración (etapa intermedia entre la EC y la OA) ofreciendo una ventaja operativa y de capital frente a otros esquemas de tratamiento.
Por otro lado, varios materiales del cátodo permitieron alcanzar los requisitos exigidos por la legislación colombiana cuando se usó el ánodo de DDB (Figura 2, parte inferior). Con todos los cátodos se alcanzaron valores de DQO incluso inferiores a los requeridos por la ley y un pH de 6 o cercano. No obstante, el efluente no cumplió con los límites establecidos para SST cuando se utilizó aluminio como cátodo. En este caso, la corrosión química del electrodo generó una alta cantidad de sólidos, incluso superior a la obtenida cuando se usó el grafito. Esto último se debió, posiblemente, a la mayor producción de agentes oxidantes que consiguieron extenderse incluso hasta el cátodo de aluminio para disolverlo. La alta disponibilidad de especies de aluminio en solución pudo a su vez promover la precipitación de algún tipo de coloide remanente ya que con esta pareja de electrodos se consiguió la mayor reducción de DQO. Sin embargo, como se mencionó en el caso del grafito como ánodo, su uso implicaría una unidad adicional de filtración y una mayor generación de residuos.
Respecto a la remoción de color, aunque esta no es una variable restringida por la legislación colombiana, es un factor que puede causar gran impacto sobre los procesos fotosintéticos del cuerpo de agua donde finalmente se dispondrá el efluente. Por esta razón fue una variable de constante monitoreo. Son destacables los resultados obtenidos mediante todos los materiales de electrodos evaluados. En general, los valores de la concentración de color en el efluente final se encuentran por debajo de los 140 U Pt-Co. De esta forma, las reducciones de color oscilaron entre el 96 y el 99%, siendo cercanas a 99% usando un ánodo de DDB (Figura 3).
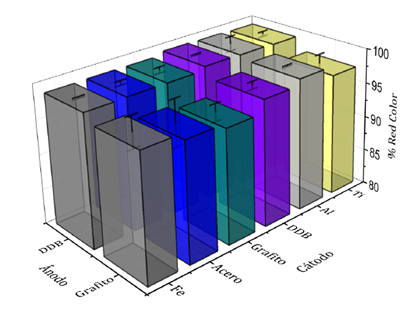
Figura. 3 Comparación del desempeño de diferentes materiales de electrodos para la etapa de OA en un proceso secuencial EC-OA respecto a la reducción de color global
A través del análisis anterior se evidenció que el ánodo de DDB fue más eficiente para la remoción de contaminantes. En contraste, extendiendo el análisis a la evaluación de costos operacionales del tratamiento completo, se puede observar que el uso de un ánodo de DDB representa mayores costos que los generados con un ánodo de grafito (Figura 4).
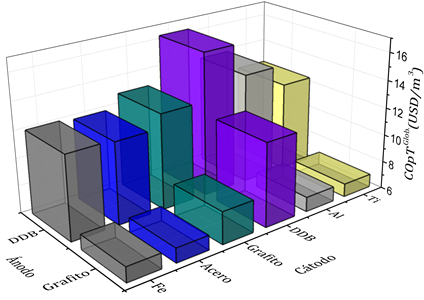
Figura. 4 Comparación del desempeño de diferentes materiales de electrodos para la etapa de OA en un proceso secuencial EC-OA respecto a los costos operacionales del tratamiento completo
El principal costo operacional del esquema secuencial está relacionado con el gasto energético. Entre más baja la conductividad eléctrica del electrodo, mayor será el gasto energético y por lo tanto mayor será el costo operacional. Debido a que el electrodo de DDB es el electrodo con menor conductividad eléctrica (1.1x105 S/m), la pareja DDB-DDB fue la que presentó el mayor costo operacional de todos los pares evaluados. Esta conductividad es función de la concentración de boro en su dopaje (para el caso bajo estudio, los electrodos fueron fabricados con una concentración de 700 ppm de boro). El grafito tiene la segunda menor conductividad dentro de los materiales evaluados (1.3x105 S/m), de allí que también se hizo evidente un cambio en los costos operacionales cuando este material fue utilizado como cátodo. En la mayoría de cátodos su desgaste y la formación de sólidos en solución fueron despreciables a excepción del aluminio. Sin embargo, dentro de la evaluación de costos estos dos aspectos solo representaron el 3 y 5% para la pareja DDB-aluminio y grafito-aluminio, respectivamente. Las parejas que representaron los menores costos operacionales fueron: grafito-titanio, grafito-hierro, grafito-aluminio y grafito-acero. Sus valores fueron muy similares; sin embargo, el uso de acero inoxidable como cátodo puede dar algunas ventajas operativas debido a su estabilidad química, su menor ensuciamiento y un mayor tiempo de recambio por desgaste.
Los resultados obtenidos generan dos perspectivas de investigación: (i) el caso de DDB usado como ánodo eficiente en el acople de las tecnologías para la reducción de contaminantes y (ii) el caso del ánodo de grafito con menores costos operacionales, pero menos efectivo. Resulta además evidente que, para acompañar a estos ánodos en el proceso de OA, el acero inoxidable sería el candidato como material del cátodo debido a su resistencia mecánica y química, su destacada conductividad (1.4x106 S/m) y su bajo precio. Con estos pares de electrodos, se evaluó el efecto del tipo de electrolito en la etapa de OA. Se llevaron a cabo ensayos experimentales para evaluar el efecto de cambiar NaCl como electrolito de soporte por Na2SO4 manteniendo cantidades equivalentes de moles en solución (las demás condiciones operacionales utilizadas hasta el momento en EC y OA se preservaron). El objetivo de usar Na2SO4 es el de eliminar la presencia de iones cloruro de la solución y la posible generación de especies de cloro que pueden afectar el cuerpo de agua donde se dispondrán los efluentes. Los resultados se presentan en la Figura 5. Con el cambio de electrolito el proceso de EC fue menos eficiente para la reducción de DQO (57 % para NaCl frente a 52% para Na2SO4) y color (95% para NaCl frente al 87% para Na2SO4). Este hecho se debió a una menor estabilidad del flóculo obtenido usando Na2SO4, según las observaciones experimentales. Por otro lado, el cambio de electrolito no afectó el desempeño de la etapa de OA siguiente (aunque, como se observa en la Figura 5, el valor de DQO al finalizar el tratamiento fue mayor para Na2SO4 debido a la menor eficiencia de la etapa de EC). En ese caso la DQO se redujo en la etapa de OA el 43%, valor igual al alcanzado usando NaCl como electrolito de soporte. De acuerdo a esto, si la etapa de EC tuviera un mejor desempeño, el proceso de OA lograría cumplir las restricciones ambientales. No obstante, se puede observar que el valor de DQO está cercano a cumplir la norma y posiblemente con leves modificaciones en las condiciones de operación se llegaría a alcanzarlas. Por el contrario, el uso del par de electrodos grafito-acero con Na2SO4 como electrolito de soporte no generó una reducción de contaminantes (1% en la etapa de OA frente al 20% cuando el electrolito es NaCl). Esto evidencia que la oxidación indirecta por especies activas de cloro es el mecanismo más importante de eliminación de contaminantes que promueve el ánodo de grafito.
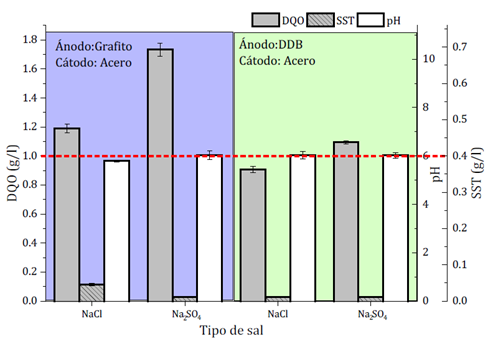
Figura. 5: Comparación del desempeño de dos electrolitos de soporte para el tratamiento secuencial EC-OA respecto a los parámetros exigidos por la legislación colombiana (J: 400A/m2; tEC: 60 min; tOA: 60 min; C NaCl :: 0.0304 M (1.777 g/l) o C Na2SO4 : 0.0304 M (4.321 g/l))
Para el ánodo de DDB, el cambio de electrolito no parece tener un efecto significativo sobre el pH final del efluente tratado y la cantidad de los sólidos suspendidos formados. Esto muestra que, a las concentraciones estudiadas, los iones cloruro no aportan una corrosión apreciable de los electrodos en comparación con los iones sulfatos de tal forma que la cantidad de sólidos suspendidos que se pudieron generar en ambos casos fueron mínimos. Por otro lado, usando el ánodo de grafito, la presencia de cloruros parece incrementar la cantidad de sólidos suspendidos, probablemente por la corrosión química causada directamente por las especies de cloro activo que se generaron in situ aunque ambos valores fueron muy inferiores a los de la norma colombiana.
Se observa que el uso de NaCl es primordial como electrolito de soporte cuando la etapa de OA se efectúa con el ánodo de grafito. De allí que la oxidación de los compuestos orgánicos mediada por las especies de cloro activo sea la principal y posiblemente única forma de degradar los contaminantes contenidos en la solución bajo la configuración presentada.
En perspectiva de este estudio, se plantea determinar el efecto de los principales parámetros operacionales (v.g., densidad de corriente de EO, C electrolito : NaCl o Na2SO4, velocidad de agitación, tiempo de operación, pH inicial, distancia entre electrodos) en la reducción de DQO y del color mediante los dos esquemas de tratamiento seleccionados: DDB-acero inoxidable + Na2SO4 y grafito-acero inoxidable + NaCl. Esto con el fin de optimizar las condiciones operacionales de los procesos secuenciales EC-OA.
4. Conclusiones
El proceso secuencial EC-OA se aplicó como una alternativa para el tratamiento de las aguas residuales resultantes de la producción de café soluble. Se analizó el efecto del material de los electrodos, específicamente dos tipos diferentes de ánodos: un ánodo activo, grafito, y uno no-activo, DDB, y seis diferentes materiales de cátodos (acero inoxidable, titanio, hierro, aluminio, grafito y DDB), así como del tipo de electrolito de soporte (Na2SO4 o NaCl), en la eficiencia del proceso secuencial EC-OA y costos operacionales totales. Las siguientes conclusiones principales se pueden extraer de este estudio: (i) el ánodo no-activo de DDB resulta ser muy eficiente en la reducción de contaminantes, aunque presenta costos operacionales elevados, mientras que el ánodo activo de grafito implica menos costos operacionales, aunque es menos efectivo; (ii) el material más apropiado para el cátodo fue el acero inoxidable; (iii) el electrolito más adecuado en el caso del uso de electrodo de DDB fue Na2SO4; mientras que el NaCl fue primordial para el proceso de degradación utilizando electrodo de grafito; (iv) dos posibles esquemas de tratamiento (ánodo-cátodo + electrolito de soporte) fueron seleccionados como los más prometedores para la etapa de OA: DDB-acero inoxidable + Na2SO4: muy eficiente pero costoso (reducción de DQO = 75% y del color = 87%, con COpTGlob de 12 USD/m3) y grafito-acero inoxidable + NaCl: menos eficiente y más económico (reducción de DQO = 67% y del color = 95%, con COpTGlob de 7 USD/m3).