Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nova
Print version ISSN 1794-2470
Nova vol.11 no.19 Bogotá Jan./June 2013
Evaluación del potencial antibacterial in vitro de Croton lechleri frente a aislamientos bacterianos de pacientes con úlceras cutáneas
In vitro evaluation of antibacterial potential of Croton lechleri against bacterial isolates from patients with skin ulcers
Lucia Corrales Ramírez1, Adriana Castillo Castañeda2, Andrea Melo Vargas2
1 Docente Investigador. Universidad Colegio Mayor de Cundinamarca, Bogotá, D.C., Colombia
2 Estudiantes del Programa de Bacteriología y Laboratorio Clínico de la Universidad Colegio Mayor de Cundinamarca, Bogotá, D.C., Colombia
Correspondencia:lcorralesr07@gmail.com
Recibido: 07/03/2013 Aceptado: 16/05/2013
RESUMEN
Esta investigación tuvo como objetivo la evaluación del potencial antibacterial in vitro de Croton lechleri frente a aislamientos bacterianos aeróbicos de pacientes con úlceras cutáneas del Sanatorio de Agua de Dios, Cundinamarca, Colombia. La metodología utilizada incluyó el aislamiento e identificación de los aislamientos bacterianos utilizando el sistema automatizado BBL-CrystalTM. Para la evaluación de la susceptibilidad antimicrobiana in vitro, se realizaron pruebas de difusión en disco, dilución en agar y difusión en pozo, métodos estandarizados por The Clinical and Laboratory Standards Institute (CLSI); usando como sustratos el extracto etanólico y de éter de petróleo de Croton lechleri. Se obtuvieron siete aislamientos bacterianos a partir de las úlceras cutáneas de pacientes del sanatorio, el estudio también incluyó ensayos con cepas de referencia ATCC: Staphylococcus aureus (ATCC) y de Escherichia coli (ATCC) como control. En los ensayos de sensibilidad antimicrobiana in vitro, se evidencio que los extractos de Croton lechleri fueron efectivos frente a la mayoría de aislamientos bacterianos del estudio, siendo el extracto etanólico el de mayor potencial antibacterial y la técnica de difusión en pozo la que presento mejor sensibilidad y reproducibilidad.
Palabras Clave: Croton lechleri, úlceras cutáneas, bacterias aeróbicas, sensibilidad antimicrobiana.
ABSTRACT
This study evaluated the in vitro antibacterial potential of Croton lechleri against aerobic bacterial isolates from patients with skin ulcers from Agua de Dios Sanitarium, (Cundinamarca, Colombia). Bacterial isolates were isolated and identified using the BBL-CrystalTM automated system. In vitro antimicrobial susceptibility was evaluated through disk diffusion, agar dilution and well diffusion, using standardized methods from the Clinical and Laboratory Standards Institute (CLSI). Ethanol extract and petroleum ether from Croton lechleri were used as substrates. Bacterial isolates were obtained from skin ulcers of patients in the hospital. ATCC reference strains were included in the assays as controls: Staphylococcus aureus (ATCC) and Escherichia coli (ATCC). The antimicrobial sensitivity tests demonstrated that Croton lechleri extracts were effective against almost all strains included in this study. Ethanol extract showed the greater antibacterial potential. The technique that showed the best sensitivity and reproducibility in vitro was the diffusion well.
Keywords: Croton lechleri, skin ulcers, aerobic bacteria, antimicrobial susceptibility.
INTRODUCCIÓN
La etnofarmacología es la ciencia que estudia la utilidad de los productos naturales y las propiedades medicinales que le son atribuidas a las plantas (1). Diversos estudios realizados proveen validación científica de los resultados obtenidos frente a los sistemas médicos tradicionales, hecho que se ve reflejado en la aplicación de estos productos en diversos campos como; la dermatología, inmunología, bacteriología, virología y parasitología, entre otros (1-3).
En el caso particular de las úlceras cutáneas se ha reportado que el uso de extractos vegetales ayudan a evitar tratamientos prolongados con antibióticos que pueden terminar en abandono del tratamiento, surgimiento de bacterias multirresistentes y además, como lo afirma Barbeito en el 2005 (4) en su trabajo de revisión sobre las úlceras crónicas, se pueden evitar futuros problemas que afecten la calidad de vida del paciente tales como: baja autoestima, amputaciones, invalidez e incapacidad, etc.
Es importante mencionar que para la obtención de los extractos de plantas se pueden usar diversos solventes orgánicos, por ejemplo: etanol, éter de petróleo, metanol, diclorometanol, entre otros. Dependiendo de cuál de estos se elija será el resultado de los metabolitos secundarios obtenidos y la polaridad del extracto, características claves al momento de evaluar las propiedades farmacológicas de estas sustancias (5).
Las especies de Croton spp pertenecen a la familia Euphorbiaceae, árboles nativos de Sur América, principalmente en países como Colombia, Perú y Ecuador (6-8), llamados comúnmente por las poblaciones indígenas: “Sangre de Drago” por el látex característico de color rojizo de gran similitud a la sangre humana que es exudado al rasgar la corteza del árbol (9-10). El látex ha sido usado como parte de conocimientos ancestrales y de forma empírica por los pueblos indígenas. Sus principales usos se relacionan con el tratamiento de afecciones como cáncer, diarrea, enfermedades gastrointestinales, afecciones dérmicas y dolor. Según hallazgos científicos, este extracto vegetal tiene diferentes propiedades inmunomoduladoras, desinflamatorias, antivirales, antibacterianas, antiparasitarias y antioxidantes, entre otras (11-12).
Las anteriores propiedades son debidas a metabolitos secundarios pertenecientes a diferentes grupos: fenoles, terpenoides, alcaloides, leptinas, polipéptidos (5-6), tales como: la taspina y la 3’-4-O-dimetilcedrusina, con importantes propiedades cicatrizantes (7-13), la proantocianidina SP-303 con su actividad antiviral frente a virus de la familia Herpesvirus, virus de la hepatitis A y B e incluso frente al virus de la inmunodeficiencia humana (VIH) (13,14), la actividad antimicrobiana es debida a metabolitos tales como el: ácido clorequínico, las coberinas A y B y el 1,3,5-trimetoxibenceno y el 2,4,6-trimetoxifenol potentes frente a Bacillus subtilis, entre otros (13).
Ahora bien, como se reporta en la literatura, las úlceras cutáneas crónicas representan una interrupción en la continuidad de la piel, que trastornan la estructura anatómica y la funcionalidad del tejido; en estas, procesos bioquímicos como la hemostasia, inflamación, proliferación y remodelación del tejido se ven alterados por diferentes factores que dificultan la regeneración de la piel. Entre los cuales está el exceso de inflamación no controlada, la sobreinfección de la úlcera y la enfermedad de base del paciente (4).
Dentro de los principales agentes bacterianos de crecimiento aeróbico que han sido asociados a las úlceras cutáneas se encuentran: los Streptococcus de los grupos A y G, Staphylococcus aureus yPseudomonas aeruginosa, asociados al retraso de cicatrización del injerto (4).
Otros agentes sobreinfectantes de lesiones dérmicas son: Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter cloacae, Serratia marcescens, Morganella morganii, Acinetobacter baumannii, Pseudomonas aeruginosa, Stenotrophomonas maltophilia. Todos los anteriores han cobrado gran interés ya que han venido presentando altas tasas de resistencia a los antibióticos, principalmente frente los P-lactamicos (14,15).
Con relación a la gran variedad de mecanismos que confieren resistencia a los agentes bacterianos frente a los fármacos se encuentran; la destrucción o inactivación del fármaco (producción de enzimas), la evasión de la penetración del fármaco en su sitio de acción dentro del microorganismo, las bombas de expulsión y la alteración de los sitios de acción del fármaco (16-18).
El estudio inicial de los patrones de sensibilidad antimicrobiana requiere de la ejecución de técnicas estandarizadas. La normatividad relacionada con el desarrollo de las pruebas de sensibilidad antimicrobiana está determinada por los estándares y protocolos del Clinical Laboratory Standars Institute (CLSI) y la Organización Mundial de la Salud (OMS).
Algunos de los documentos relacionados son: el Protocolo M07-A8 Vol. 29 No. 2 CLSI: Métodos de dilución para determinar la sensibilidad a los antimicrobianos de bacterias que crecen en condiciones aeróbicas; en este documento se describen la dilución en caldo y las técnicas de dilución en agar e incluye una serie de procedimientos para normalizar la ejecución de las pruebas para medir la sensibilidad in vitro de las bacterias frente a los agentes antimicrobianos, también describe el desempeño, las aplicaciones y las limitaciones de los métodos actuales recomendados por el CLSI (19).
Así mismo, el Documento M100-S21 en 31- N°1 CLSI: “Aplicación de los estándares para test de susceptibilidad antimicrobiana: 21 °”, información suplementaria destinada para el uso en los test de susceptibilidad antimicrobiana publicada en los documentos del CLSI: M02-A10 y M07-A8 (20).
Por otra parte la OMS con el documento de las Pautas Generales para las Metodologías de Investigación y Evaluación de la Medicina Tradicional (General Guidelines for Methodologies on Research and Evaluation of Traditional Medicine - WHO/ EDM/TRM/2000.1) (21), aborda temas de interés como: definiciones relacionadas, métodos de investigación y evaluación de los medicamentos herbarios, investigación y evaluación de la inocuidad y la eficacia, metodología de la investigación y evaluación de las terapias basadas en procesos de la medicina tradicional, requisitos para la investigación clínica, aspectos éticos, y cuestiones pragmáticas entre otros aspectos.
Finalmente, la información pertinente de la Normatividad Colombiana relacionada con el uso, producción, y comercialización de productos farmacéuticos con base en recursos naturales: Artículo 245 Ley 100 de 1993, Ley 86 de 1993, Decreto 677 de 1995, Decreto 377 de 1998, Resolución 3131 de 1988, Decreto 309 de 2000, Decreto 2266 de 2004, Resolución 2834 de 2008 (21-22).
MATERIALES Y MÉTODOS
La actual investigación se desarrolló en cuatro fases, las cuales se subdividen en múltiples ejercicios que permitieron el cumplimiento del objetivo del estudio.
En la primera fase, se llevó a cabo el acercamiento a los pacientes del Sanatorio de Agua de Dios, Cundinamarca, Colombia, siguiendo el protocolo estipulado por el comité de ética e Investigaciones del Sanatorio, la sensibilización de los cinco pacientes seleccionados para participar en el estudio y la obtención de consentimientos informados. Las características de inclusión que se consideraron para los pacientes del sanatorio fueron: tener úlceras cutáneas crónicas sobreinfectadas de acuerdo con el criterio medico y no haber iniciado tratamiento antibiótico.
En la segunda fase, se realizó la identificación de cepas bacterianas de crecimiento aeróbico aisladas de las úlceras cutáneas crónicas de los pacientes.
Toma de muestras. Siguiendo los protocolos de toma de muestras en lesiones cutáneas, se realizó un lavado a chorro con solución salina estéril sobre la úlcera, y con una gaza estéril se removió el tejido muerto de la lesión. Se frotaron dos hisopos de algodón estériles en el centro de la úlcera; uno para realizar el frótis directo para la coloración de Gram y el otro para introducirlo en el medio de transporte Stuart. Luego de haber tomado las muestras estas se transportaron en nevera de icopor con geles refrigerantes, para asegurar la viabilidad de las muestras hasta su llegada al laboratorio para el posterior procesamiento.
Aislamientos bacterianos. Las muestras transportadas en los medios Stuart fueron inoculados mediante siembra por agotamiento en agar sangre, agar nutritivo y agar Mcconkey, enseguida las placas fueron incubadas durante 24 horas a 37°C; después de este tiempo, se analizaron las características macroscópicas de las Unidades Formadoras de Colonia (UFC) y la afinidad con tinción de Gram de las bacterias y se procedió a purificar las cepas bacterianas obtenidas para la identificación bioquímica presuntiva.
Identificación fenotípica. Los parámetros que se tuvieron en cuenta como directrices para la identificación bacteriana fueron las características macroscópicas de las UFC, afinidad tintorial en la coloración de Gram, características bioquímicas tales como hemólisis, prueba de catalasa, fermentación de azúcares, entre otras. Para la identificación del género y especie se utilizo el sistema automatizado BBL-CrystalTM para Gram Positivos y para Gram Negativos.
En la tercera fase de la investigación se llevaron a cabo las pruebas de sensibilidad antimicrobiana usando como sustratos los extractos etanólico y de éter de petróleo de C. lechleri.
Obtención de los extractos de C. lechleri. La metodología usada para la preparación y obtención de los extractos de C. lechleri está soportada en la patente de Paul J. Bobrowski (23), a lo largo del protocolo el autor da la opción al investigador de escoger entre diferentes opciones, el solvente orgánico de uso, la técnica de agitación y la concentración del extracto.
Teniendo en cuenta estas posibilidades, los solventes orgánicos usados en este ensayo fueron: etanol absoluto y éter de petróleo, con el fin de obtener extractos de afinidad apolar y polar respectivamente (23,24), lo que permitió evaluar la actividad del extracto de acuerdo con sus diferencias de afinidad y de componentes. Se utilizó rotaevaporador con el fin de asegurar la total eliminación del solvente orgánico usado y eliminar trazas de estos que pudieran competir con la acción antibiótica propia del extracto, la temperatura máxima usada en este procedimiento no excedió los 60°C para evitar inactivar o destruir algunos compuestos de importancia en la actividad farmacológica del extracto (23-25).
Pruebas de sensibilidad
Aspectos a tener en cuenta: el medio en el que se realizaron las pruebas de sensibilidad fue el Agar Mueller-Hinton, recomendado en los protocolos del CLSI para la ejecución de estas pruebas (19); para los tres ensayos de sensibilidad se preparó una suspensión del inoculo bacteriano en solución salina hasta alcanzar una turbidez equivalente a la concentración 0.5 del patrón de McFarland. A su vez, se prepararon diluciones seriadas en base 2 de cada extracto a evaluar (1:1, 1:2, 1:4) previo al inicio del ensayo, usando como diluyente Dimetil sulfoxido (DMSO); estas diluciones se conservaron refrigeradas a 4°C (25).
Ensayo de difusión en pozo. El agar Mueller-Hinton se inoculo masivamente en la superficie con la suspensión bacteriana y los controles (turbidez equivalente al patrón 0.5 McFarland), y se esperó 15 minutos para permitir la absorción de este en la superficie del medio. Con un sacabocados estéril se perforó el medio de cultivo buscando obtener un pozo de 6mm de diámetro, con bordes uniformes y hasta el fondo de la caja de petri. Se evaluó un extracto por caja, un pozo por concentración del mismo; en cada pozo se inocularon 20pL de la dilución del extracto a probar, usando un pozo para el DMSO como control negativo. Los medios fueron incubados a una temperatura aproximada de 37°C durante 18 - 24 horas. Finalmente se realizó la lectura de la susceptibilidad antimicrobiana, por observación y medición del halo de inhibición alrededor de cada pozo. Los ensayos se realizaron por duplicado para cada aislamiento bacteriano.
Ensayo de difusión en disco. Los sensidiscos fueron preparados el día anterior al ensayo. En una caja de petri se colocaron los sensidiscos de papel filtro de manera que no se sobrelaparan, y cada uno se impregno con 20pL de la dilución del extracto a evaluar; adicionalmente se prepararon sensidiscos con DMSO. Finalmente se taparon y se llevaron a incubar durante 24 horas a 37°C para permitir la completa absorción de la solución del extracto en el disco.
Al día siguiente se inoculó masivamente la superficie del agar Mueller-Hinton con la suspensión bacteriana (0.5 patrón McFarland) y los controles, y se esperó 15 minutos para permitir la absorción de este en la superficie. Luego de este tiempo, se colocaron los diferentes sensidiscos con cada una de las diluciones del extracto a evaluar y el sensidisco de DMSO; al igual que el disco que contiene el antibiótico de referencia para cada especie bacteriana. Las cajas se llevaron a la incubadora a una temperatura aproximada de 37°C durante 18 a 24 horas. Finalmente, se realizó la lectura de la susceptibilidad antimicrobiana por observación y determinación del halo de inhibición alrededor de cada disco. Los ensayos se realizaron por duplicado para cada aislamiento bacteriano.
Ensayo de dilución en agar. Se preparó el Agar Mueller-Hinton siguiendo las indicaciones del fabricante y se mantuvo en estado líquido hasta la incorporación del extracto correspondiente (temperatura entre los 45°C - 50°C). Se agregó una parte de la solución diluida de la sustancia en estudio a nueve partes del Agar Mueller-Hinton; mezclando hasta obtener una solución homogénea del extracto con el agar. Este medio modificado se vertió en cajas de petri de manera que el grosor del medio de cultivo fuera de 4 mm y se esperó hasta su solidificación. Como control negativo se utilizaron cajas de agar Mueller-Hinton con DMSO. Se inoculó la bacteria previamente suspendida con una turbidez equivalente a la escala 0.5 de McFarland, asegurándose de que la totalidad de la superficie del medio quedara inoculada masivamente. Se dejaron las placas inoculadas a temperatura ambiente durante 15-20 minutos para garantizar la total absorción, posteriormente fueron incubadas a 37°C durante 18 a 24 horas. Finalmente se realizó la lectura de la susceptibilidad antimicrobiana, por observación de la presencia o ausencia de crecimiento en la superficie del agar.
Finalmente, en la cuarta fase se llevo a cabo la socialización de los resultados obtenidos ante el comité de ética e Investigación del Sanatorio de Agua de Dios, y de esta forma posibilitar el surgimiento de nuevas interrogantes, llegar a conclusiones y plantearse nuevas perspectivas en cuanto al manejo de las úlceras cutáneas de los pacientes del sanatorio usando terapias basados en la medicina alternativa.
RESULTADOS
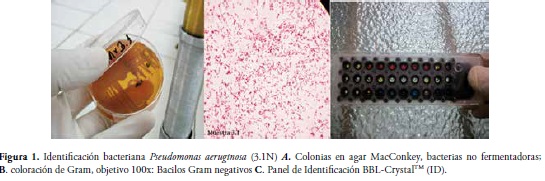
En las úlceras cutáneas sobreinfectadas de los cinco pacientes del Sanatorio de Agua de Dios se obtuvieron siete aislamientos bacterianos de crecimiento aeróbico, de las cuales; un 57.2% son bacterias Gram Positivas: “Streptococcus agalactiae, codificada con el número (1.2p), Streptococcus uberis (2.2p), Streptococcus uberis (4p), Streptococcus sanguis (5.2p)” y el otro 42.8% son bacterias Gram Negativas: “Pseudomonas aeruginosa (3.1), Burkholderia cepacia (2.2N), Stenotrophomonas maltophilia (1.1N)”. Figura 1.
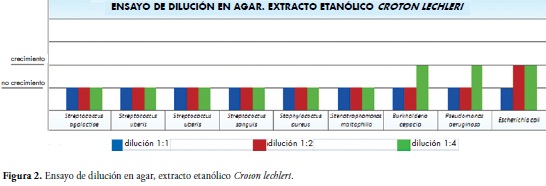
En cuanto a los resultados obtenidos a nivel de las pruebas de sensibilidad antimicrobiana, se evidencio que en el ensayo de dilución en agar con el extracto etanólico en la dilución 1:1 obtuvo una eficacia antibacteriana (ausencia de crecimiento) del 100% de las bacterias evaluadas: S. agalactiae, los dos diferentes aislamientos de S. uberis, S. sanguis, S. aureus (ATCC); S. maltophilia, B. cepacia, P. aeruginosa y E. coli (ATCC).
En la dilución 1:2 en un 88.88% de las bacterias: S. agalactiae, los dos diferentes aislamientos de S. uberis, S. sanguis, S. aureus (ATCC); S. maltophi-lia, B. cepacia, P. aeruginosa y finalmente para la dilución 1:4 se obtuvo efecto antimicrobiano en el 66.66% específicamente sobre: S. agalactiae, los dos diferentes aislamientos de S. uberis, S. sanguis, S. aureus (ATCC); S. maltophilia, B. cepacia, P. aeruginosa, Figura 2.
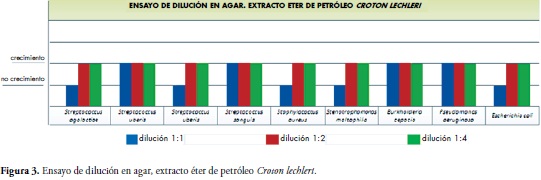
El mismo ensayo con el extracto de éter de petróleo mostró resultados diferentes; en la dilución 1:1 se obtuvo una eficacia antibacteriana (ausencia de crecimiento) en el 55.55% de las bacterias del estudio: S. agalactiae, S. uberis, S. aureus (ATCC) y E. coli (ATCC), y 0% de eficacia para las diluciones 1:2 y 1:4, Figura 3.
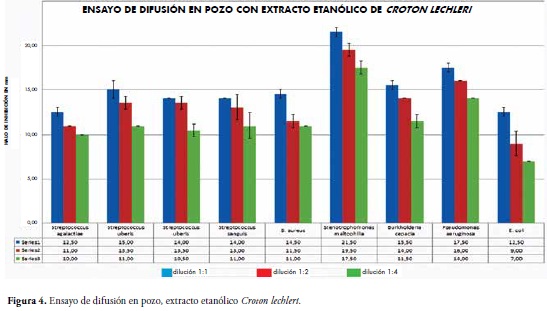
Para el ensayo de difusión en pozo con el extracto etanólico, S. maltophilia evidenció un patrón importante de sensibilidad, esta bacteria presentó los mayores halos de inhibición en las tres diferentes diluciones evaluadas; 1:1, 1:2 y 1:4 con diámetros de 21.5mm, 19.5mm y 17.5mm respectivamente. En contraste, E. coli (ATCC) fue la bacteria con los menores halos de inhibición siendo estos de 12.5mm en dilución 1:1, 9.0mm en dilución 1:2 y 7.0mm en dilución 1:4. Figura 4.
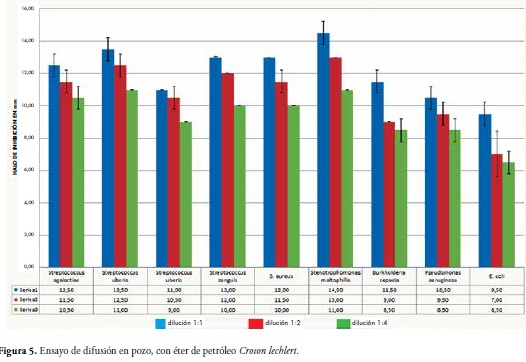
En el método de difusión en pozo para el extracto de éter de petróleo, se observó un patrón de eficacia similar a los datos obtenidos para el extracto etanólico. Sin embargo, el diámetro de los halos de inhibición presentó una marcada disminución en comparación con los obtenidos en el ensayo con el extracto etanólico de C. lechleri, tal como se observó en S. maltophilia, con la cual se obtuvieron halos de inhibición de l4.5mm en la dilución 1:1; 13.0mm en la dilución 1:2 y finalmente ll.Omm en la dilución 1:4. E. coli fue la bacteria que presentó los halos más pequeños en el ensayo con el extracto etanólico, datos similares a los que se encontraron con el extracto de éter de petróleo: 9.5mm en dilución 1:1, 7.00mm en dilución 1:2 y 6.5mm en dilución 1:4, Figura 5.
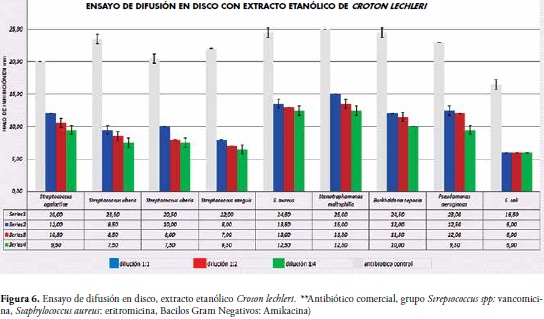
Para los ensayos de difusión en disco usando el extracto etanólico, el diámetro del mayor halo de inhibición fue de 15.0 mm para S. maltophilia con la dilución 1:1 y el menor diámetro de halo fue presentado por E. coli que correspondió a 6 mm en las tres diferentes diluciones (dilución 1:1, dilución 1:2 y dilución 1:4), Figura 6.
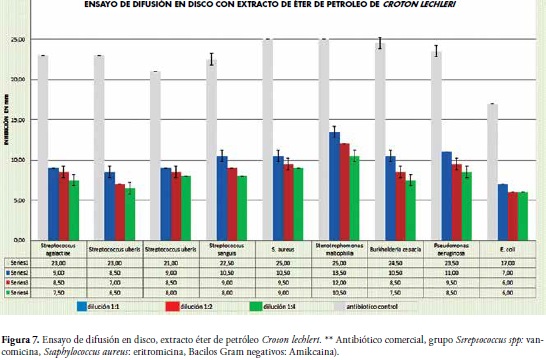
En este mismo método con el extracto de éter de petróleo se presentó disminución en el diámetro de los halos de inhibición en comparación con los del ensayo con extracto etanólico. Para S. maltophilia el mayor halo de inhibición fue de 13.5mm en la dilución 1:1, y E. coli presentó los menores halos de inhibición con 7.00 mm en dilución 1:1 y 6.0mm de diámetro tanto en dilución 1:2 como en 1:4. Figura 7.
DISCUSIÓN
Barbeito et al en 2005 (4), reportan en su estudio que los principales agentes bacterianos asociados a la sobreinfección de ulceras cutáneas son Staphylococcus aureus y Streptococcus. pyogenes, seguidos de otras especies de Streptococcus, Pseudomonas spp, Proteus sp y Klebsiella sp las cuales son responsables de piodermas y sepsis gangrenosos y que se asocian al retraso de la cicatrización (4-15). Resultados que se correlacionan con los resultados obtenidos en este estudio, en el cual se aislaron siete cepas bacterianas, pertenecientes a estos géneros: 57.2% de bacterias Gram Positivas "Streptococcus agalactiae (1.2p), Streptococcus uberis (2.2p), Streptococcus uberis (4p), Streptococcus sanguis (5.2p)” y el 42.8% bacterias Gram Negativas "Pseudomonas aeruginosa(3.1N), Burkholderia cepacia(2.2N), Stenotrophomonas maltophilia (1.1N)”.
En cuanto a los extractos de Croton lechleri, se demostró que la polaridad es un aspecto importante que permite comprender las diferencias entre la actividad y eficacia que los extractos de una misma planta puedan presentar frente a las bacterias (5). En este sentido, el extracto etanólico de Croton lechleri se caracteriza por ser apolar, caso contrario del extracto obtenido con éter de petróleo, lo que se correlaciona con la diferencia en los resultados del potencial antibacteriano obtenidos para cada uno.
El extracto etanólico fue más potente ya que como lo exponen Ramírez L en 2009 y Murillo P., en su investigación relacionada con la evaluación de la resistencia antimicrobiana en aislamientos deS. aureus asociados a mastitis bovina en un hato lechero en el año 2008: “cuando las bacterias son expuestas a los agentes antimicrobianos, el grupo con carga positiva (polar) se asocia con los grupos fosfato de los fosfolípidos de la membrana, mientras que la porción no polar penetra en el interior de la membrana la cual se caracteriza por ser hidrófobo, esto induce la pérdida de la semiper-meabilidad de la membrana, permitiendo así que más componentes penetren en la célula y desnaturalicen las proteínas de la misma” (26).
Al igual que la polaridad, los metabolitos secundarios que se consiguen en cada uno de los extractos dependen del solvente usado para su obtención. Estos metabolitos son los responsables de las propiedades farmacológicas de las plantas, esto se ve reflejado en la mayor eficacia presentada por el extracto etanólico de C. lechleri en comparación con el extracto obtenido con éter de petróleo. El primero presenta un mayor número de compuestos con actividad antimicrobiana, tales como: taninas, polifenoles, poliacetilenos, flavonoles, terpenoides, esteroides, alcaloides y propóleos y para el segundo extracto, éter de petróleo, la composición de metabolitos secundarios se ve reducido a la mitad conteniendo: alcaloides, aceites esenciales, terpenoides y cumarinas (3, 5,11).
La explicación que se tiene con respecto a las diferencias de sensibilidad entre las bacterias Gram positivas y las Gram negativas se centra en la estructura de las membranas y la pared celular bacteriana tanto a nivel morfológico como fisiológico; adicional a estas dos estructuras, las bacterias Gram negativas poseen una membrana externa responsable de cierto grado de resistencia frente a los agentes antibacterianos (27). Las paredes celulares de las bacterias Gram negativas contienen peptidoglucano, lipoproteína exterior y lipopolisacáridos las cuales emergen hasta la superficie bacteriana, en general, esta es permeable sin selectividad específica. Sin embargo, la membrana externa es semipermeable, por lo que restringe el paso de moléculas relativamente grandes, como es el caso de los metabolitos secundarios presentes en los extractos etanólicos y de éter de petróleo (5).
Ahora bien, es necesario resaltar la importancia de elegir las técnicas y metodologías a utilizar en el caso de realizar investigaciones relacionadas con la actividad antimicrobiana de extractos provenientes de plantas, por cuanto dependiendo de la técnica escogida variaran los resultados, así como su sensibilidad y reproducibilidad de acuerdo con las características de los extractos (25). Como se evidencio en esta investigación, hay una disminución significativa entre el diámetro de los halos de inhibición presentados entre los dos métodos de difusión ejecutados; difusión en disco y difusión en pozo, siendo este último el que mostró halos de inhibición más significativos en cada una de las diluciones usadas con cada aislamiento evaluado. Ya que como lo mencionan Ramírez L (25); y Klancnik et al (28) que la técnica de difusión en disco presenta desventajas en el caso de que se requiera evaluar un extracto vegetal que contenga compuestos catiónicos y polares. De igual forma, ellos reportan que el método de difusión en disco, es apropiado solo como un test de screening previo a la determinación cuantitativa del MIC por métodos de dilución.
Lo anterior se debe a que el papel filtro de Whartham está compuesto por celulosa y una alta cantidad de grupos hidroxilo libres que le confieren propiedades hidrofílicas al disco, lo que afecta directamente algunos compuestos catiónicos de los productos naturales, por cuanto estos son absorbidos por la superficie del disco impidiendo su difusión en el medio (25), falseando así los resultados acerca del verdadero potencial antibacteriano del producto evaluado. En concordancia con estas afirmaciones, los resultados hallados en esta investigación revelan las diferencias entre las técnicas de difusión usadas, como se observa en el resultado obtenido con S. maltophilia la cual dio como resultados en el halo para difusión en pozo 21.5 mm y para el ensayo de difusión en disco 15.0 mm con el extracto etanólico.
Contrario a las afirmaciones anteriores, la técnica de difusión en disco es la de elección para investigadores como Selowa et al (29), quienes hallaron buenos resultados en la evaluación de extractos de tres especies de Croton spp contra bacterias Gram Positivas, al igual que Rojas et al en su investigación con extractos de plantas usadas en la medicina folklórica Colombiana para quienes los resultados obtenidos fueron significativos tanto en bacterias Gram Positivas como en Gram Negativas (30).
Debido a esta discrepancia de opiniones y con el fin de obtener una mayor sensibilidad en estas pruebas, muchos investigadores realizan la técnica de difusión en pozo; como es el caso del estudio realizado por Panda et al (31), quienes utilizaron este método, siendo esta técnica mucho más sensible, debido a que el extracto difunde libremente en el agar.
Por último, la técnica de dilución en agar que se utilizó presenta una variedad de ventajas que aumentan la sensibilidad para cantidades pequeñas de muestra, lo cual es importante cuando se trabaja con productos naturales; porque además permite determinar no solo el potencial bactericida sino también el bacteriostático de los extractos.
Prescott et al consideran que esta es una técnica valiosa que brinda una identificación confiable y precisa de la actividad antibacteriana de la planta (32). Así mismo Ncube et al (33), mencionan en su artículo de revisión relacionado con las técnicas para comprobar las propiedades antimicrobianas de los componentes de origen natural de las plantas, que la prueba de dilución en agar es más versátil en comparación con el ensayo de dilución en caldo, puesto que no presenta problemas de recuento y la determinación de los puntos de interrupción de MIC.
CONCLUSIONES
Croton lechleri presenta actividad antibacteriana frente a las bacterias aisladas de úlceras cutáneas sobreinfectadas de los pacientes del estudio.
El extracto etanólico tiene un mayor potencial antibacterial frente a los aislamientos bacterianos del estudio en comparación con el del extracto con éter de petróleo, gracias a su afinidad polar y su mayor variedad de componentes que le confieren esta propiedad. El extracto etanólico obtuvo halos de inhibición de gran significancia, los cuales pueden ser comparables con los presentados frente a los estandarizados con el uso de antibióticos de rutina en la clínica.
El ensayo que mostró una mayor sensibilidad y reproducibilidad fue el de difusión en pozo como se esperaba según los informes de investigaciones anteriores; pues como se asumía, los ensayos de difusión en disco evidenciaron una marcada reducción en los halos de inhibición.
La Escherichia coli ATCC, fue la bacteria que presentó la menor sensibilidad frente al extracto de Croton lechleri y Strenotrophomonas maltophilia la mayor sensibilidad.
Croton lechleri es una planta con importantes propiedades antibacterianas, que la pueden hacer candidata para ser usada en la industria farmacéutica alternativa en el mercado actual.
REFERENCIAS
1. Rivera D, Obon C. Etnobotánica: Manual de Teoría y Prácticas. Capítulo 5. [en línea]. 2007 [revisado el 22 de marzo de 2012]. Disponible en: https://docs.google.com/viewer?a=v&q=cache:K-0oEoc15UT:ocw.um.es/ciencias/etno-botanica/Material%2520de%2520clase/etnobotanicacapit-ulo52007+BRUHN+y+HOLMSTEDT+en+1981hl=es419gl=copid=blsrcid=ADGEESiDHlW8BiHTm306ge3 3d7BP0khB9Yik7RtMvaZmK7ISHwiq5rROX40KovA7X-zpkKBaoG2ThXlnkMdqrhEN3hEDixtzUMWEUegsEve9XPSUtc4rQAruSbgf0YCYdA8hZ0Vsig=AHIEtbS3bwD TiCcGC5g3ma1RSKPCo7HlTA. [ Links ]
2. Gómez F, Plantas Medicinales aprobadas en Colombia. Universidad de Antioquia. 2da Edición. 2007. [ Links ]
3. Cabrera Y, Fadragas A, Guerrero L Antibióticos naturales. Mito o realidad. Revista Cubana Medicina General Integral [en línea], 2005 [revisado el 20 de febrero de 2012]; 21 (3-4). Disponible en: http://bvs.sld.cu/revistas/mgi/vol21_3-4_05/mgi253-405.htm [ Links ]
4. Barbeito S et al. Úlceras crónicas: modelo de integración entre patología vascular, inmunológica e infecciosa. Vitae [en línea], 2011 [en línea], julio-septiembre 2005. [ Links ]
5. Cowan M. Plant Products as Antimicrobial Agents. Clinical Microbiology. Reviews, [en línea]. 1999 [revisado el 15 de Noviembre de 2012], 12(4):564. Disponible en: http://cmr.asm.org/content/12/4/564.long. [ Links ]
6. Risco E, Iglesias T. Interés Terapéutico del látex de Croton le-chleri. Forum De Natura Rerum.París, 20-21 de Octubre. 2001 [ Links ]
7. Taiz L y Zeiger E. Fisiología Vegetal. 2006. [ Links ]
8. Votano J et al. No title. Chemistry & Biodiversity [Internet]. 2004 [cited 2013 Feb 17]; 1: 1829-1841. doi: 10.1002/ cbdv.200490137. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/cbdv.200490137/abstract. [ Links ]
9. Llanes D. Actividad inmunomoduladora de extractos de 10 plantas de la familia Euphorbiaceae: Trabajo de Grado. Universidad Nacional de Colombia. Facultad de Ciencias. Maestría en Ciencias Biotecnológicas. [en línea], 2009 [revisado el 06 de abril de 2012], disponible en: http://www.bdigital.unal.edu.co/1787/1/37277968.2009.pdf. [ Links ]
10. Coronel L. Actividad inmunomoduladora de extractos de 10 plantas de la familia Euphorbiaceae. Trabajo de grado presentado como requisito para optar por el título de Magister en Ciencia - Biotecnología. Universidad de Antioquia. Medellín 2009. [ Links ]
11. Yi et al .Characterization and determination of six flavonoids in the ethnomedicine "Dragon's Blood" by UPLC-PAD-MS. Chemistry Central Journal.2012; 6:116. [ Links ]
12. Gupta D. Bioprotective properties of Dragon's blood resin: In vitro evaluation of antioxidant activity and antimicrobial activity. Complementary and Alternative Medicine. 2011:11-13. [ Links ]
13. Jones K .Review of Sangre de Drago (Croton lechleri)-A South American Tree Sap in the Treatment of Diarrhea,Inflammation, Insect Bites, Viral Infections, and Wounds: Traditional Uses to Clinical Research. The Journal Of Alternative And Complementary Medicine. 2003; 9: 877-896. [ Links ]
14. Gupta D, Bleakley B, Gupta RK. Dragon's blood: botany, chemistry and therapeutic uses. Journal of ethnopharmacology [Internet]. 2008 Feb 12 [cited 2012 Oct 17]; 115 (3):361-80. Available from: http://www.ncbi.nlm.nih.gov/pubmed/18060708. [ Links ]
15. Zampini I, Cudmani N, Isla M. Actividad antimicrobiana de plantas medicinales argentinas sobre bacterias antibiótico-resistentes. Acta Bioquímica clínica Latinoamericana [en línea]. 2007 [revisado el 22 de marzo de 2012]; 41(03). Disponible en: http://scholar.googleusercontent.com/scholar?q=cache:FyOS4EvVtToJ:scholar.google.com/&hl=es&assdt=0,5. [ Links ]
16. Tafur J. Mecanismos de resistencia a los antibióticos en Bacterias Gram Negativas: Articulo de Revisión. Infectio. Asociación de infectologia 2008; 12 (3). [ Links ]
17. Brusselaer N et al. The rising problem of antimicrobial resistance in the intensive care unit. Annals of Intensive Care a Springer Open Journal. [en línea], 2011. [revisado el 20 de Enero de 2013].1:47. Disponible en: http://www.annalsofintensiveca-re.com/content/1/1/47. [ Links ]
18. Suarez C y cols. Mecanismos de resistencia a carbapenems en P. aeruginosa, Acinetobacter baumanii y Enterobacteriaceae y estrategias para su prevención y control. Revista Infectio. Asociación Colombiana de Infectologia. 2006; 10(2): 85-93. [ Links ]
19. Clinical and Laboratory Standards Institute. Métodos para Pruebas de Sensibilidad a los antimicrobianos por dilución para bacterias que crecen en condiciones aeróbicas. Estándar aprobado-8a Edición. Documento CLSI M07-A8. Wayne, PA: Clinical and Laboratory Standards Institute; 2009. [ Links ]
20. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty-First Informational Supplement. M100-S21.2011; 31(1). [ Links ]
21. Guevara H y cols. Revisión documental de los productos naturales legalmente autorizados para su mercadeo en Colombia. Revista Colombia Médica. 2010; 41 ( 2). [ Links ]
22. Bernal H, García H y Quevedo G. Pautas para el conocimiento, conservación y uso sostenible de las plantas medicinales nativas en Colombia. Ministerio de Ambiente, Vivienda y Desarrollo Territorial. 2001. [ Links ]
23. Bobrowski P. Methods and preparation of the latex from the Croton species. United States Patent: Patent N° US 7280183B2. Abril 24 2007. [ Links ]
24. Mendoza D. Actividad antifúngica frente al hongo Fusarium oxysporum de los extractos en éter de petróleo, cloroformo y etanol de la semilla de Thevetia ahouai apocynaceae. Trabajo de grado. Universidad de Sucre. Sincelejo 2004. [ Links ]
25. Ramírez L. Metodologías para evaluar in vitro la actividad antibacteriana de compuestos de origen vegetal. Scientia et Technica Año XV, No 42, Agosto de 2009. Universidad Tecnológica de Pereira. ISSN 0122-1701. [ Links ]
26. Murillo P Evaluación de la resistencia antimicrobiana en aislamientos de Staphilococcus aureus asociados a mastitis bovina en un hato lechero. Tesis como requisito parcial para obtener el título de Químico Farmacobiológico. Universidad Michoacana de San Nicolás de Hidalgo. Michoacan, Morelia. 2008. Disponible en: http://bibliotecavirtual.dgb.umich.mx:8083/jspui/bitstream/123456789/5023/1/EVALUCAIONDELARESIS-TENCIAANTIMICROBIANAENAISLAMIENTOSDES-TAPHYLOCOCCUSAUREUSASOCIADOSAMATITIS-BOVINAENUNHATOLECHERO.pdf. [ Links ]
27. Zaidan et al. In vitro screening of five local medicinal plants for antibacterial activity using disc diffusion method. Tropical Biomedicine [en línea], 2005. [revisado el 02 de febrero de 2013]. 22(2): 165-170. Disponible en: http://www.msptm.orgfilesZ165_-_170_In_vitro_screening.pdf. [ Links ]
28. Klancnik et al. Evaluation of diffusion and dilution methods to determine the antibacterial activity of plant extracts. Journal of Microbiology Methods [en línea], 2010. [revisado el 02 de febrero de 2013]. 81(2):121-6. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/20171250. [ Links ]
29. Selowa et al. Antibacterial activity of extracts of three Croton species collected in Mpumalanga region in South Africa. Afr J. Traditional. Complementary and Alternative Medicine [en línea], 2010. [revisado el 02 de febrero de 2013]. (7) 2: 98-103. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3021162/pdf/AJTCAM0702-0098.pdf. [ Links ]
30. Rojas et al. Screening for antimicrobial activity of ten medicinal plants used in Colombian folkloric medicine: A possible alternative in the treatment of non-nosocomial infections. BioMed Central. Complementary and Alternative Medicine [en línea], 2006. [revisado el 02 de febrero de 2013]. 6:2. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1395329/pdf/1472-6882-6-2.pdf. [ Links ]
31. Panda et al. Antibacterial activity of Croton roxburghii Balak. against the enteric pathogens. Journal of Advances and Pharmaceutical Technology [en línea], 2010. [revisado el 02 de febrero de 2013]. 1(4): 419-422. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3255396/. [ Links ]
32. Prescott et al. Comparative ethnobotany and in-the-field antibacterial testing of medicinal plants used by the Bulu and inland Kaulong of Papua New Guinea. Journal of Ethnopharmacology [en línea], 2012. [revisado el 02 de febrero de 2013]. 1(4): 139(2):497-503. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/22154578. [ Links ]
33. Ncube NS, Afolayan AJ, Okoh AI. Assessment techniques of antimicrobial properties of natural compounds of plant origin: current methods and future trends. 2008;7(12):1797-806. [ Links ]