Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nova
Print version ISSN 1794-2470
Nova vol.11 no.20 Bogotá July/Dec. 2013
Cultivo de la línea celular HEp-2: doblaje poblacional y coloración con Giemsa
Perspectivas para el estudio de la infección con Chlamydia trachomatis
Cultivation of the cell line hep-2: dubbing of population and coloring with Giemsa
Jutinico Shubach AP.1.2, Malagón Garzón. J1.2, Manrique Chacón J N1.2, Gómez M1.3, Gómez M. Esp1.3, Sánchez Mora RM. MSc. PhD1.3.
1Grupo Biotecnología y Genética. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia2Programa Bacteriología. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia
3Docente Programa Bacteriología. Universidad Colegio Mayor De Cundinamarca. Bogotá, Colombia
Correspondencia: rmsanchezm@unicolmayor.edu.co
Recibido: 12/02/2014 / Aceptado: 26/03/2014
RESUMEN
Los cultivos celulares se han convertido en herramientas esenciales para la investigación básica. Se aplican en inmunología, virología, biología molecular, ingeniería genética y farmacología, entre otras áreas. Se usan también en procesos industriales farmacéuticos, en técnicas de diagnóstico clínico y para estudio de trasplante de tejidos. En bacteriología, estos cultivos permiten confirmar una infección, evaluar la eficiencia de antimicrobianos, realizar estudios de infectividad, investigar sobre nuevas especies, obtener gran cantidad de microorganismos no cultivables para optimizar técnicas y examinar las relaciones entre la célula huésped y los microorganismos intracelulares (virus, bacterias y parásitos).
La línea celular HEp-2 (Human Epidermoid Cancer Cells) es utilizada en estudios de infección con diferentes bacterias, entre ellas Chlamydia trachomatis (CT), con el fin de determinar los mecanismos por los cuales este patógeno sobrevive en la célula huésped. También se emplea para observar la acción de péptidos antimicrobianos y de extractos para combatir la infección causada por dicha bacteria. Para este estudio se realizaron curvas de crecimiento en la línea celular HEp-2 con medios DMEM-F12 y MEM. Se estandarizó, además, la coloración con Giemsa y se calculó el doblaje poblacional con diferentes inóculos para evaluar el desarrollo de la línea celular en cultivo y seleccionar las condiciones óptimas para realizar futuros ensayos de infección con parásitos intracelulares, en particular con CT serovar L2.
Palabras clave: Chlamydia trachomatis, cultivo celular, doblaje poblacional, infección, línea celular HEp-2.
ABSTRACT
Cell cultures have become essential tools for basic research. They are applied in immunology, virology, molecular biology, genetic engineering and pharmacology, among other areas. They are also used in pharmaceutical industrial processes, in techniques of clinical diagnostic, and to study tissue transplantation. In bacteriology, these crops allow us to confirm an infection, assess the efficiency of antimicrobials, carry out studies of infectivity, investigate on new species, obtaining a large number of microorganisms non-arable to optimize techniques, and to examine the relationship between the host cell and intracellular microorganisms (bacteria, viruses, and parasites).
The HEp-2 cell line (Human epidermoid cancer cells) is used in studies of infection with different bacteria, including Chlamydia trachomatis (CT), in order to determine the mechanisms by which the pathogen survives in the host cell. It is also used to observe the action of antimicrobial peptides and extracts to combat the infection caused by the bacterium. For this study, growth curves of the HEp-2 cell line were carried out with DMEM-F12 and MEM media. In addition, the staining with Giemsa was standardized, and the population dubbing was calculated with different inocula for assessing the development of the cultured cell line and select the optimal conditions for future tests of infection with intracellular parasites, in particular with CT serovar L2.
Keywords: cell culture, cell line HEp-2, chlamydia trachomatis, dubbing population, infection
INTRODUCCIÓN
En 1952, Alice E. Moore, Lillian Sabachewski y Helene W. Toolan establecieron el protocolo para el cultivo celular de HEp -2. La línea celular se obtuvo a partir de tumores inducidos en ratas jóvenes, tras inocularlas con tejido de carcinoma epidermoide proveniente de un paciente de 56 años de edad. El aislamiento de células in vitro se realizó con una mezcla de líquido amniótico bovino, extracto embrionario, solución salina y sueros equino y humano (1).
Las HEp-2 son células que se encuentran ampliamente distribuidas y se utilizan en distintos estudios con virus como el del Herpes Simplex, Sarampión, Adenovirus, Poliovirus, Sincitial Respiratorio, ECHO-virus y el Coxsackie, entre otros (2). Estas células se caracterizan por servir en un sistema in vitro apropiado para el estudio y diagnóstico, además de virus, también de bacterias como Chlamydia pneumoniae, Listeria monocytogenes, Stenotrophomonas maltophilia, Brucella abortus, Staphylococcus aureus, Escherichia coli y Trypanosoma cruzi, entre otras. Esta línea celular, además,tiene una amplia aplicación en medicina para el diagnóstico de anticuerpos antinucleares (ANA); en biología celular, para el estudio de receptores y para la investigación en cáncer (3).
La Chlamydia trachomatis (CT) es una bacteria intracelular obligada (4), Gram negativa, no móvil y aeróbica, patógena del humano, perteneciente a la familia Chlamydiaceae y considerada como uno de los microorganismos de transmisión sexual más prevalentes en el mundo (5). La CT es sensible a varios antibióticos, sin embargo no se puede dar un tratamiento oportuno debido a la ausencia de síntomas en los individuos afectados. Esta bacteria utiliza el glutamato como fuente primaria de carbono y su principal fuente de energía es el ATP de la célula huésped (5). Se pueden identificar distintas serovariedades de CT, dentro de las cuales están las causantes de tracoma (A-C), de infecciones transmitidas por vía sexual (D - K) y las que causan linfogranuloma venéreo LGV (L1 - L2 - L3) (6-7).
Con respecto a la serovariedad L2 de CT, se conocen varias características, como su propiedad invasiva y su ataque a los tejidos linfáticos y subepiteliales del tracto genital, compromiso con la formación de linfoadenopatía, hasta una diseminación sistémica. Además de las células epiteliales, se cree que los linfocitos pueden ser vehículo potencial para la difusión de la infección (7). No obstante, los mecanismos por los cuales CT se siembra en el organismo son aún desconocidos (8).
Los estudios en CT, llevados a cabo en la actualidad, se realizan sobre líneas celulares susceptibles a su infección (9). En ese sentido, el objetivo del trabajo que se presenta es estandarizar las condiciones del cultivo de la línea celular HEp-2 y determinar la efectividad de los medios, a partir de curvas de crecimiento y doblaje poblacional, con el fin de poder utilizar éstas en futuros ensayos de infección con el serovar L2 de CT.
METODOLOGÍA
Estandarización del cultivoLa estandarización del cultivo de la línea celular HEp-2 se realizó sobre una placa de 24 pozos. Inicialmente, se descongeló el crio vial obtenido en el Instituto Nacional de Salud (INS) con base en el protocolo normalizado en el laboratorio de Biotecnología y Genética de la Universidad Colegio Mayor de Cundinamarca (UCMC). El porcentaje de viabilidad y muerte celular se estableció por el método de azul tripán. En cada pozo se generalizó el número de células por adicionar con el agregado de 500 µl de medio MEM o DMEM-F12 Gibco®, concentración de Suero Fetal Bovino (SFB) al 5% y 10%. En algunos pozos se añadieron 5µl de la mezcla de antibiótico y 5µl de glutamina. Como control, algunos de los pozos se dejaron con células HEp-2 sin ninguno de los tratamientos. La caja se incubó a una temperatura de 37°C con 5% de CO2 y se monitoreó durante tres días. El ensayo se realizó por triplicado usando los medios de MEM y DMEM-F12 Gibco®.
Coloración de las células HEp-2 con Giemsa
Para realizar la estandarización de la coloración con Giemsa, se hicieron crecer las células HEp-2 en cajas de 24 pozos sobre laminillas de vidrio, en medio DMEM-F12, bajo condiciones de 5% de CO2, a una temperatura de 37°C, hasta obtener una confluencia de 90%-100%. Luego se lavaron las células con solución salina estéril, se les retiraron posibles detritos y se fijaron con metanol concentrado durante 15 minutos para iniciar la coloración. Con el fin de normalizar el tiempo y la concentración del colorante adecuados para la observación óptima de las células HEp-2, a través de microscopio óptico. El ensayo se llevó a cabo con la utilización de diferentes concentraciones de los reactivos (solución colorante de trabajo) y distintos tiempos de contacto con las células.
Doblaje poblacional y tiempo de duplicación de la línea celular HEp-2
Con el propósito de determinar el doblaje poblacional y el tiempo de duplicación, las células HEp-2 se sembraron en una placa de 24 pozos, con densidades iniciales de 2,0 x 104; 6,0 x 104; 10,0 x 104 en 1mL de medio DMEM-F12 (en una mezcla 1:1). En otra placa, las células HEp-2 se sembraron en densidades de 2,0 x1 04; 6,0 x 104; 10,0 x 104 en 1mL de medio MEM. Las mezclas fueron complementadas con 10% de SFB y 1% de antibiótico, y se incubaron a una temperatura de 37°C con 5% de CO2. Este procedimiento se efectuó por duplicado y las placas fueron monitoreadas durante 48 horas. La monocapa de células HEp-2 fue despegada de la placa utilizando 0,6% de Tripsina-EDTA y se realizó la viabilidad celular por el método de azul tripán. Al finalizar el ensayo, el número de células que se obtuvieron a las 48 horas permitió examinar el doblaje poblacional (NPD) de las células HEp-2, con base en la siguiente fórmula:
NPD=3.33*log10 (N/no)
Dónde:
NPD es el número de doblaje poblacional.
N, el número de células sembradas en un tiempo igual a X.
No, el número de células sembradas en tiempo igual a 0.
Análisis estadístico
Las observaciones se hicieron empleando el programa R© versión 2.8.1 (B. D. Ripley and D. J. Murdoch, Boston, USA, 2005). Se efectuaron análisis de varianza (ANOVA) de los diferentes tratamientos, con un intervalo de confianza para una p = 0,05 y 1-oo = 0,95.
RESULTADOS
Las células HEp-2 se obtuvieron a partir crioviales conservados a menos 70°C que fueron donados por el grupo de virología del INS. El porcentaje aproximado de viabilidad de los crio viales fue 85% (2,9 X 106 células HEp-2 por micro litro), determinado por el método de exclusión de azul tripán.
Estandarización de cultivo de células HEp-2
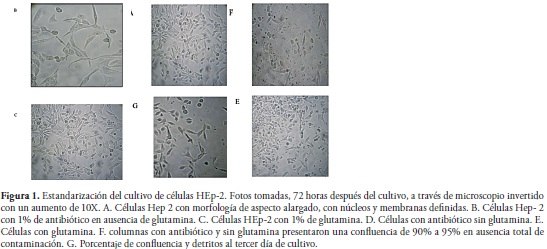
La cantidad de células adicionadas en cada pozo fue 2,9 x 106. El primer día se observó ausencia de contaminación, sin cambios en color y aspecto del medio; se percibieron muy pocas células adheridas. Las células HEp-2 presentaron, en todos los pozos, una morfología de aspecto alargado, con núcleos y membranas definidas (figura No 1a). La confluencia de los pozos que contenían 1% de antibiótico en ausencia de glutamina fue de aproximadamente un 45%; allí se observó un bajo porcentaje de detritos (figura No 1b). La confluencia de las células HEp-2 en los pozos que contenían 1% de glutamina fue menor con respecto a los demás pozos. Se alcanzó un 25% de confluencia y se encontraron detritos (figura No 1c).
En el segundo día, los pozos control continuaron en condiciones estériles y con baja cantidad de células adheridas. Los pozos que contenían antibiótico sin glutamina reflejaron un aumento en el número de células adheridas, con una confluencia aproximada de 80% a 82%, sin presencia de detritos (figura No 1d). En contraste con lo anterior, los pozos de las columnas con glutamina mostraron mayor presencia de detritos, sin un aumento significativo en el número de células confluentes, aproximadamente entre un 28% y un 30% (figura No 1e). Por lo encontrado en estos pozos, fue notable cómo la presencia de glutamina afectó el cultivo de las HEp-2 bajo tales condiciones de cultivo.
Al tercer día, los pozos control continuaron en condiciones estériles y con baja cantidad de células adheridas. Los pozos de las columnas con antibiótico y sin glutamina presentaron una confluencia de 90% a 95% en ausencia total de contaminación (figura No 1f). En contraste, los pozos con glutamina fueron descartados debido a la alta cantidad de detritos y a la disminución casi total del número de células.
Los porcentajes de confluencia y de adhesión celular fueron evaluados durante los tres días de seguimiento del cultivo mencionado. Los datos para el tercer día se muestran en la figura 1g. Para comprobar cambios en la confluencia y crecimiento celular durante el ensayo, se utilizaron concentraciones de SFB. Sin embargo, no se evidenció un cambio significativo en la confluencia de los diferentes pozos (datos no mostrados).
Los ensayos se cumplieron con medio MEM y la mezcla de DMEM-F12 en relación 1:1. No obstante, los resultados obtenidos no mostraron cambios significativos, a partir de lo cual se determinó que las condiciones óptimas para cultivar las HEp-2 son: presencia de 5% de CO2, temperatura de 37°C, antibiótico y componentes nutricionales que les brinda los medios DMEM-F12 y MEM, en una mezcla o por separado.
Se realizó doblaje poblacional para poder determinar la efectividad de los medios y el tiempo de crecimiento de la línea celular. Se utilizaron los dos medios con el fin de poder concluir con cuál se obtenía la mejor confluencia en menor tiempo, lo cual facilitó la ejecución de los ensayos de infección con CT serovariedad L2.
Estandarización de la coloración de células HEp-2 con Giemsa
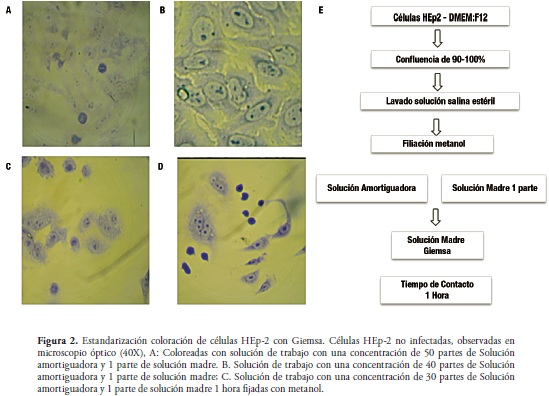
La coloración con Giemsa se realizó fijando las células a laminillas con metanol, tal como se describe en el procedimiento. Las células expuestas a esta coloración fueron observadas en microscopio invertido 40X. Con el objetivo de determinar la concentración de colorante y el tiempo al cual la lámina con las células debería ser sometida para realizar la observación en detalle, inicialmente se tomaron 50 partes de solución amortiguadora más 1 parte de solución madre, en diferentes tiempos (15 min, 20 min y 25 min).
De esta manera se obtuvieron células débilmente coloreadas y morfológicamente difíciles de visualizar (figura No 2a). Ante esta situación, se recurrió a 40 partes de solución amortiguadora más 1 parte de solución madre; la coloración se analizó en los diferentes tiempos. Bajo estas condiciones, la coloración en las células mejoró, pero la morfología de las células HEp-2 no fue clara ni definida (figura No 2b). Se pasó entonces a emplear una nueva combinación de trabajo, compuesta por 30 partes de solución amortiguadora más 1 parte de solución madre, con períodos de tiempo distintos a los anteriores (1 h, 15 min, 50 min). Estos cambios permitieron resaltar las características morfológicas como el núcleo y la membrana de las células.
Finalmente, fue necesario usar la misma concentración de trabajo (30 partes de solución amortiguadora más 1 parte de solución madre) pero con 1 hora de exposición en todas las células. No obstante, se incluyó una variación al colorear las células sin fijarlas con metanol, en comparación con las células que se encontraban fijadas. Por tanto, se pudo concluir que las condiciones de tiempo y solución de trabajo utilizadas en este último ensayo fueron las más adecuadas y mejoraron la visualización de las células HEp-2 (figura No 2d).
Doblaje poblacional y tiempo de duplicación de la línea celular HEp-2
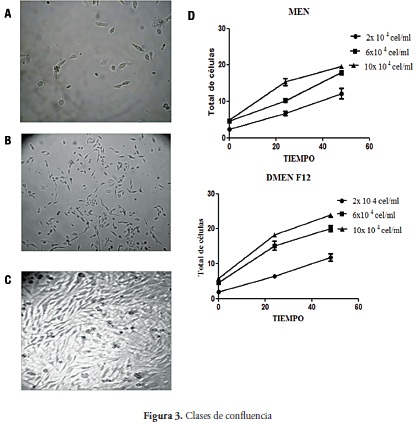
Las células HEp-2 descongeladas se sembraron a diferentes densidades iniciales con el fin de determinar el doblaje poblacional (2,0 x 104; 6,0 x 104, y 10,0 x 104 células/ml). Se realizaron siembras por triplicado para cada medio y se incubaron en atmósferas húmedas con 5% de CO2 a 37° C. El crecimiento y viabilidad celular se determinaron por medio de recuento con azul tripán a diferentes tiempos de cultivo (0, 24 y 48 horas). La confluencia se observó y clasificó utilizando el microscopio invertido con el objetivo de 40X, sin confluencia (figura 3a), sub confluente (figura 3b) y confluente (figura 3c).
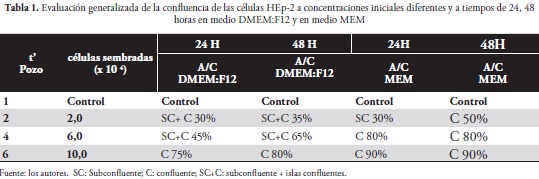
En los tres ensayos, con el medio DMEM-F12, se evidenciaron aumentos en la confluencia y la adherencia durante los diferentes periodos de tiempo (tabla No 1). La evaluación de la confluencia en los cultivos de células HEp-2, bajo distintas concentraciones, permitió confirmar que a mayor densidad de células inoculadas en el tiempo 0 se produce mayor confluencia a las 48 horas.
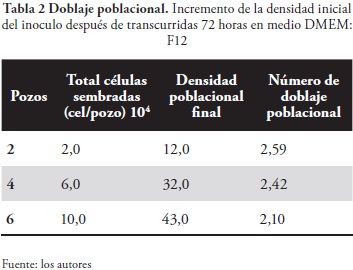
Las células HEp-2, durante su desarrollo en DMEM-F12, presentaron un crecimiento en monocapas subconfluentes hasta llegar a una confluencia total a las 72 horas, como se observa en la tabla No 2. La mezcla de medio DMEM-F12 aporta los factores de crecimiento, los aminoácidos y nutrientes adecuados, dando a la línea celular las condiciones óptimas de viabilidad durante el tiempo de evaluación de las mismas. El crecimiento permanente y la confluencia a través del tiempo que reflejaron las células HEp-2 en la mezcla de medios DMEM-F12, fueron similares a los resultados obtenidos en el medio MEM (figura No 2d).
Con frecuencia, en la mayoría de los cultivos celulares, la población del cultivo primario confluente se usa para dar origen a dos nuevas poblaciones celulares. De esta forma, con cada pasaje, se obtiene un doblaje poblacional (NDP). El nivel de este doblaje es un número que se utiliza para describir las "duplicaciones" que haya sufrido una población celular de un pasaje a otro (10). En tal sentido, se encontró que el número de doblaje poblacional (NPD) es inversamente proporcional a la concentración inicial de células HEp-2 inoculadas; por lo cual, en concentraciones de 2,0 x 104 células HEp-2/ml se encuentra un NPD de 2,59 (tabla No 3).
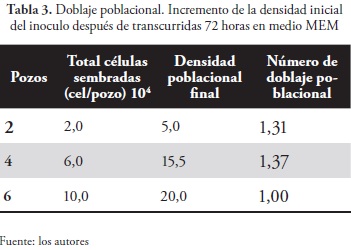
Cuando se compararon los dos ensayos de doblaje poblacional realizados en sendos medios -DMEM-F12 y MEM- se comprobó el desarrollo de la línea celular sin ningún problema. Tales medios aportan los requerimientos necesarios para que haya un buen crecimiento. El medio DMEM-F12 contribuye con los factores de crecimiento, aminoácidos y nutrientes adecuados para que las células se encuentren viables durante mucho tiempo y que, además, el doblaje poblacional sea mayor que las células expuestas al medio MEM.
Al comparar el crecimiento celular a las 48 horas, a partir de una inoculación inicial de 10,0 x 104 células HEp-2 por mililitro de medio, se apreciaron los siguientes resultados: en medio DMEM-F12 se obtuvo un conteo de 23,0 x 104 células HEp-2. En el medio MEM el conteo fue de 20,0 x 104. De ahí se puede deducir que aunque no existe una gran variación en el número final de células obtenidas, el crecimiento celular con medio DMEM-F12 fue mejor que con el medio MEM. En ambos ensayos se observó un crecimiento exponencial. El incremento en células expuestas a medio DMEM-F12 fue mayor en el intervalo 48 a 72 horas después de la siembra, según todos los datos recogidos en el estudio.
En el ensayo DMEM-F12, los doblajes poblacionales (NDP) correspondientes fueron los siguientes: bajo concentración de 2,0 x 104 células HEp-2/ml, 2,59; en concentración de 6,0 x 104 células HEp-2 /ml, 2,42, y con inoculación de 10,0 x 104 células HEp-2/ml, el NDP fue de 2,10. Por consiguiente, cuando la inoculación es menor, las células adquieren mayor capacidad de duplicación. De igual manera ocurrió en el ensayo con MEM: para las concentraciones de 2,0 x 104; 6,0 x 104; y 10,0 x 104 células HEp-2/ml, las duplicaciones respectivas fueron 1,31; 1,37; y 1,0.
DISCUSIÓN
En la era de las ciencias ómicas (genómica, proteómica, peptidómica y metabolómica, entre otras), los modelos celulares se han convertido en una herramienta valiosa para el estudio de los diferentes procesos que se llevan a cabo dentro de la célula. Los cultivos celulares permiten corroborar procesos importantes en la función del gen y de su proteína en ambientes celulares específicos; a su vez, analizar las vías de señalización intracelular en las que participa. Estos modelos han servido de base para la formulación, producción y evaluación de agentes terapéuticos más precisos, dirigidos a nuevos blancos molecularmente definidos.
El cultivo celular de la línea HEp-2 está establecido desde el año 1952 por Alice Moore, Sabachewski Lillian y Helene W. Toolan (11). A partir de ese momento las condiciones del cultivo y la actividad proliferativa de dicha línea celular ha sido objeto de estudio. Con base en ello, en el presente trabajo se estandarizaron las condiciones para el crecimiento óptimo de esta línea en el Laboratorio de Biotecnología y Genética de la UCMC, con el fin de utilizar los resultados en investigaciones futuras de infección con una cepa de CT serovar L2. Los estudios que comprometen la línea celular HEp-2 han utilizado como medio de crecimiento a MEM (9-3) o DMEM (12) enriquecidos con 1% de glutamina, con los cuales se logra una confluencia adecuada de aproximadamente 90% a 100%. No obstante, en este proyecto, al estandarizar el cultivo de la línea celular, se observó que la confluencia celular en presencia de medio MEM y de 1% de glutamina fue menor; por tal motivo, se utilizó una mezcla en partes iguales de medio DMEM y medio F12 Gibco®.
Es importante anotar que los medios MEM o DMEM no contienen glutamina (13, 14), mientras que el medio F12 contiene 146 mg/l de glutamina (15), utilizada comúnmente para el crecimiento de HEp-2 (16). La adición externa de este producto puede ser causa de posible presencia de detritos y contaminación, como se observó durante los tres días de seguimiento del cultivo celular con 1% de glutamina sin antibiótico. Por esta razón, se usó un medio que contenía dicho aminoácido, disminuyendo así la posibilidad de contaminación.
Los medios DMEM-F12 y MEM, utilizados en el cultivo celular, son esenciales ya que aportan los requerimientos necesarios para que haya un crecimiento exponencial y un desarrollo de la línea celular HEp-2, tal como se observó en los ensayos realizados. La experimentación se comparó con el proyecto realizado por Marian M. Draganov, (1) en el cual se estudió el desarrollo de la línea celular desde el momento de su inoculación hasta su confluencia, empleando igualmente una placa de 24 pozos con distintas densidades celulares (0,8x104 a 8x104 células/mL y la mezcla de medio DMEM-F12, en donde se observó una monocapa confluente entre las 24 y 48 horas cuando la inoculación fue de 8x10 4 células/cm3, mientras que en concentraciones de 0,8x10 4 células /cm3 ocurrió después de las 144 horas (1).
Al mismo tiempo, en el estudio Draganov se evaluó también el NDP. Allí se obtuvieron resultados similares a los encontrados en la presente investigación: el doblaje poblacional fue inversamente proporcional a la cantidad de células inoculadas, y se observó que cuando la población inicial fue de 0,8x104 células HEp-2/cm3, la duplicación llegó a 3,84, mientras que al emplear 8x104 células HEp-2/cm3, se consiguió un doblaje de 2,53, mucho menor al que se esperaría por tener una inoculación con mayor cantidad de células (1).
Lo expuesto explica el hecho de que los pozos inoculados con mayor densidad de células tienen una mayor adhesión, lo cual provoca una etapa confluente donde la división de las células y el aumento del número de estas tienden a desacelerar. Esto se determina por el agotamiento de los productos nutricionales del medio, los metabolitos secretados y el cambio de color del medio, que es un indicador de acidificación. Así pues, la cantidad del sustrato para el cultivo y la calidad del medio son factores que regulan el crecimiento de la población celular.
Una vez estandarizado el cultivo de la línea celular HEp-2 se realizó la tinción de Giemsa, lo que permitió especificar la estructura celular, su núcleo y citoplasma. Además, se pudo confirmar la importancia del tiempo de exposición de las células y la fijación de las mismas con metanol. La coloración de Giemsa fue inventada por Bethold Gustav Carl Giemsa, motivado por los altos índices de malaria existente en áfrica oriental durante los años cuarenta (17). El método se implementó con el fin de visualizar estructuras parasitarias. Sin embargo, conforme se desarrollaban estas técnicas se recurrió a la aplicación de esta tinción con el propósito de colorear células hospedadoras de diversos microorganismos. Uno de esos casos es el manejado en el presente estudio, en la línea celular HEp-2, que ha servido para diversas investigaciones sobre artritis reumatoidea y virus sincitial respiratorio, entre otros tipos de microorganismos como CT (16).
La detección de CT por Giemsa se ha utilizado para observar la presencia de inclusiones citoplasmáticas de líneas celulares infectadas con dicho microorganismo. Es así como López, E. (16) determinó el grado de infección con base en dicha técnica, logrando visualizar las células infectadas.
Ahora bien, un modelo de línea celular HEp-2, como el expuesto, permitirá desarrollar otros estudios como los que se vienen efectuando con nuevos agentes antimicrobianos, que han sido aislados de diferentes microorganismos para combatir diversas enfermedades. Un ejemplo claro de esto son los péptidos antimicrobianos (PAM: AMP, por sus siglas en inglés) que se encuentran en los venenos naturales (como en las toxinas de la hormiga araña, Lachesana tarabaevi) (18). Tales péptidos no solo atacan las membranas celulares sino que también presentan diferentes espectros de actividad; además, no son tóxicos para la célula huésped. El veneno de la Lachesana tarabaevi contiene un gran número de PAM, los cuales tienen la capacidad de suprimir la infección por Chlamydia trachomatis (18).
Esta característica se logró determinar porque dichos péptidos fueron probados en células HEK293 y se consiguió una inhibición en la formación de inclusiones dentro de las células (18). Por otra parte, gracias a los avances en el estudio de los PAM, se ha encontrado su aplicación contra las infecciones causadas por CT. Así, en un estudio realizado por Skinner y colaboradores (8) se evidenció que el uso de péptidos antimicrobianos como el WLBU2 y el lípido 3-O-Octyl-sn-Glycerol tienen actividad citotóxica contra bacterias Gram positivas y Gram negativas. Por otro lado, Novispirin G10 es un octapéptido antimicrobiano, cuya actividad contra CT fue probada por un grupo de investigadores (19). Ellos evaluaron la eficacia del péptido al ex-ponerlo a una línea celular, previo contacto con el microorganismo.
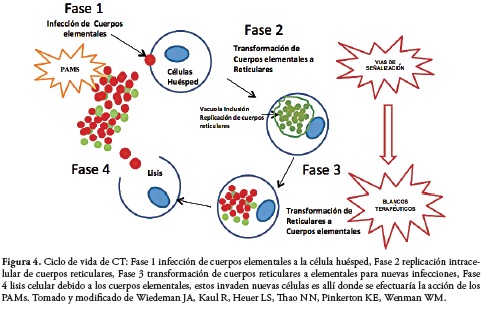
Por las razones expuestas, es importante contar con un modelo de línea celular infectada con CT para realizar estudios que permitan determinar la aplicación de los PAM frente a la invasión de CT en la línea celular HEp-2, ya sea revisando diferentes vías de señalización que permitan aclarar el mecanismo de infección o mirar en los PAM que sean capaces de inhibir la infección de cuerpos elementales a nuevas células (figura No 4).
REFERENCIAS
1. Draganov M, Fransazov S, Draganov D, Murdjeva M, Popov N. Two new serum free and protein free cell strains, derived from HEp-2 cell line: cultural conditions and proliferation activity. Journal of Culture Collections 2009;6(1):112-21. [ Links ]
2. Hotez PJ, Bottazzi ME, Franco-Paredes C, Ault SK, Periago MR. The neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and distribution and a roadmap for control and elimination. PLoS Negl Trop Dis 2008;2(9):e300. [ Links ]
3. Cervantes E. Infecciones causadas por Chlamydia trachomatis. Rev Fac Med UNAM 2009;52(1):18-22. [ Links ]
4. Kubo T, Ishida K, Matsuo J, Nakamura S, Hayashi Y, Sakai H, et al. Chlamydia trachomatis serovar L2 infection model using human lymphoid Jurkat cells. Microb Pathog 2012 Jul;53(1):1-11. [ Links ]
5. López E. Estudio de las características del ciclo de desarrollo de Chlamydia trachomatis relacionadas a la presencia del plásmido 7.5 Kb Instituto Politecnico Nacional; 2009. [ Links ]
6. Kameswaran TR, Ramanibai R. Indirubin-3-monooxime in-duced cell cycle arrest and apoptosis in Hep-2 human laryngeal carcinoma cells. Biomed Pharmacother 2009 Feb;63(2):146-54. [ Links ]
7. Wiedeman JA, Kaul R, Heuer LS, Thao NN, Pinkerton KE, Wenman WM. Tobacco smoke induces persistent infection of Chlamydophila pneumoniae in HEp-2 cells. Microb Pathog 2004 Sep;37(3):141-8. [ Links ]
8. Hao H, Aixia Y, Dan L, Lei F, Nancai Y, Wen S. Baicalin sup-presses expression of Chlamydia protease-like activity factor in Hep-2 cells infected by Chlamydia trachomatis. Fitoterapia 2009 Oct;80(7):448-52. [ Links ]
9. Life Technologies Corporation. http://www.invitrogen.com/site/us/en/home/support/Product-Technical-resources/media_formulation.1.html 20-2-2013. Ref Type: Online Source [ Links ]
10. Sigma. http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Formulation/m4655for.Par.0001.File.tmp/m4655for.pdf. 20-2-2013. Ref Type: Online Source. [ Links ]
11. Invitrogen. http://www.jbc.org/content/suppl/2009/02/26/M900773200.DC1/Schmidetal_Supplements.pdf. 20-2-2013. Ref Type: Online Source. [ Links ]
12. Skinner MC, Kiselev AO, Isaacs CE, Mietzner TA, Montelaro RC, Lampe MF. Evaluation of WLBU2 peptide and 3-O-octyl-sn-glycerol lipid as active ingredients for a topical microbicide formulation targeting Chlamydia trachomatis. Antimicrob Agents Chemother 2010 Feb;54(2):627-36. [ Links ]
13. Lazarev VN, Polina NF, Shkarupeta MM, Kostrjukova ES, Vassilevski AA, Kozlov SA, et al. Spider venom peptides for gene therapy of Chlamydia infection. Antimicrob Agents Chemother 2011; Nov; 55(11):5367-9. [ Links ]
14. Life Technologies Corporation. HYPERLINK " http://www.invitrogen.com/site/us/en/home/support/Product-Technical-Resources/media_formulation.1.html. 20-2-2013. Ref Type: Online Source. [ Links ]
15. López E. Estudio de las características del ciclo de desarrollo de Chlamydia trachomatis relacionadas a la presencia del plásmido7.5 Kb Instituto Politecnico Nacional; 2009. [ Links ]
16. Sasiaín J, Instituto Nacional de Salud (Colombia). Reseña de "cien años del colorante Giemsa". Biomédica 2003 Mar;23:5-18. [ Links ]
17. Lazarev VN, Polina NF, Shkarupeta MM, Kostrjukova ES, Vassilevski AA, Kozlov SA, et al. Spider venom peptides for gene therapy of Chlamydia infection. Antimicrob Agents Chemother 2011 Nov;55(11):5367-9. [ Links ]
18. Yasin B, Pang M, Lehrer RI, Wagar EA. Activity of Novispirin G-10, a novel antimicrobial peptide against Chlamydia trachomatis and vaginosis-associated bacteria. Exp Mol Pathol 2003; Apr;74(2):190-5. [ Links ]