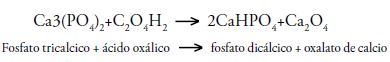Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nova
Print version ISSN 1794-2470
Nova vol.12 no.22 Bogotá July/Dec. 2014
Artículo original producto de la investigación
Bacillus: género bacteriano que demuestra ser un importante solubilizador de fosfato
Bacillus: a genus of bacteria that exhibits important phosphate solubilizing abilities
Lucía Constanza Corrales Ramírez1, Ligía Consuelo Sánchez Leal1, Zuly Yurieth Arévalo Galvez2, Vanessa Estefanía Moreno Burbano2
1Docentes investigadoras Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
2Estudiantes. Programa de Bacteriología y Laboratorio Clínico, Facultad de Ciencias de la Salud. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
Correspondencia: lcorrales@unicolmayor.edu.co
RESUMEN
Objetivo: Identificar la actividad solubilizadora de fosfato de cepas del género Bacillus, como alternativa al mejoramiento del suelo para la producción agrícola.Materiales y métodos: Se utilizaron 11 cepas del género Bacillus recolectadas de rizósferas de plantas y de chimeneas de asaderos de pollo para el estudio y 2 como control negativo, conservadas a -70°C y reactivadas para la identificación de la actividad solubilizadora de fosfato. Resultados: La solubilización de fosfato se evidenció en las 11 cepas del estudio. Los índices de solubilidad fueron diferentes para cada cepa en estudio.
Palabras clave: Bacillus, solubilización de fosfato, suelo, agar Pikovskaya.
ABSTRACT
Objective: Identify phosphate solubilizing activity of strains of the genus Bacillus, as an alternative to improving soil for agricultural production. Materials and methods: For the study, 11 strains of the genus Bacillus were collected from rhizosphere of plants and fireplaces of broiler chicken producers. Two strains were used as negative control, and stored at -70C prior to reactivation for identifying phosphate solubilizing activity. Results: 11 strains showed Phosphate solubilizing abilities. Each strain studied exhibited different solubility rates.
Key words: Bacillus, phosphate solubilization, soil, Pikovskaya agar
INTRODUCCIÓN
Los objetivos del milenio son claros en cuanto reflejan en su integralidad las necesidades más apremiantes para el planeta y sus pobladores, 2 de los cuales orientaron este trabajo; (i) el objetivo número 1 que plantea erradicar el hambre como meta alcanzable al 2015, ya que se calcula que existen 842 millones de personas desnutridas en el mundo, (ii) el objetivo 7 que propone garantizar la sostenibilidad del medio ambiente y reducir la pérdida de la diversidad biológica, entre otros.
El suelo como ecosistema es un complejo natural donde se desarrollan la mayor parte de los ciclos vitales microbianos, además es una fuente de nutrientes que contiene elementos como el potasio, calcio, magnesio, nitrógeno, y el fósforo, siendo este último uno de los elementos necesarios para el desarrollo vegetal. Sin embargo, dicho nutriente se encuentra en baja disponibilidad debido a que su movilidad en el suelo es restringida, de tal forma que la planta absorbe el elemento de su entorno en mínimas cantidades (1, 2).
Por ello los agricultores utilizan fertilizantes químicos que suplen las necesidades nutricionales de las plantas y promueven el crecimiento vegetal; sin embargo, este tipo de agroquímicos se acumula como sales y daña el ecosistema del suelo evitando el intercambio catiónico lo cual contribuye con el deterioro de la calidad del mismo. En consecuencia la degradación del ecosistema que se genera, disminuye la producción agrícola, con productos de baja calidad (2,3).
Colombia es un país rico en diversidad agrícola, gracias a que en su geografía cuenta con variedad de pisos térmicos, entre los principales cultivos están: algodón, cebada, soya, trigo, arroz, maíz amarillo, maíz blanco, papa, sorgo, arveja, haba, zanahoria, banano y café (9), los cuales necesitan de fósforo para el crecimiento y desarrollo óptimo de los frutos ya que su función en la planta no puede ser sustituido por otro elemento; y por esto se clasifica dentro de los nutrientes primarios (4).
Los alimentos con mayor exportación a nivel mundial son el café y el banano.”En cuanto a variaciones entre el año 2001 y 2008 estudios realizados por Proexport demuestran un crecimiento constante en las exportaciones que oscila entre el 3 % y el 30 % lo que es una excelente perspectiva para la economía del país”, sin embargo para alcanzar dichas cifras se utiliza una cantidad considerable de fertilizantes químicos (5).
Según las estadísticas del instituto Colombiano agropecuario (ICA), entre los años 2008-2010, en Colombia se importaron un total de 2.749.373.438 Kg/fertilizantes y 173.218.962 Kg/ fertilizantes de fosfato para apoyar la producción agrícola. En el año 2013 según información del portal www.dataexim.com, llegaron al país casi 1,4 millones de toneladas de fertilizantes básicos que incluyen úrea, fosfato y potasio, importados principalmente de Alemania, Rusia, Canadá, China, Estados Unidos, Venezuela y México. Los precios en Colombia de estos fertilizantes en puerta de fábrica superan entre el 30 y 50% el precio mundial.
Los reportes indican que hay un alto empleo de fertilizantes en suelos y como consecuencia se genera un gasto representativo para la economía que en muchos de los casos no es recuperado con la cosecha. En el caso de la producción de arroz, algodón, papa y maíz blanco, por ejemplo, los precios de los fertilizantes representan entre el 20 y el 30% de sus costos. Por el lado del café, el cacao, la palma y la caña panelera, van desde el 15 hasta el 30%. (6).
Realizar un uso adecuado de los fertilizantes químicos es importante para una agricultura sostenible, el mal uso de los mismos puede llevar a cabo procesos de eutrofización que conlleva a un aumento excesivo de nutrimentos como P, K, N que pueden provocar antagonismo con otros nutrientes debilitando las plantas, esto en consecuencia puede producir carencias en el organismo humano por el aporte nutricional y perdida de la biodiversidad a nivel ambiental (7).
La movilidad del fósforo en el suelo es limitada, tan solo del 0.1 % - 0.4% del fósforo natural está disponible (8), por esta razón cuando el nutriente se adiciona como fertilizante se debe localizar donde a las raíces se les facilite su absorción, pero la aplicación constante de estos agroquímicos eleva la capacidad de retención de fósforo dejando en el suelo aproximadamente un porcentaje del 91% de residualidad (9).
Mediante la biotecnología se han propuesto alternativas con el fin de reemplazar los productos químicos. Una de estas son los biofertilizantes que mejoran el rendimiento de los cultivos, favoreciendo el crecimiento de productos sanos, más resistentes a las plagas, saludables y fáciles de aplicar además, poseen una serie de propiedades físicas, químicas y biológicas que son apropiadas para el mantenimiento de la fertilidad del suelo, lo cual implica incremento en la productividad, esta es la llamada agricultura conservativa.
La producción de estos fertilizantes biológicos se sustenta en los metabolismos microbiológicos, como es el caso del potencial de algunas bacterias que actúan como mediadoras al liberar el ion fosfato soluble para la planta y de esta forma facilitan la absorción de éste elemento. Estas bacterias además actúan en múltiples funciones vitales, como realizar el control de fitopatógenos y recuperar la estructura de la rizósfera, lo que se constituye en aspectos de gran interés para la producción agropecuaria. Entre los géneros de bacterias descritas que poseen la capacidad de solubilizar el fosfato están: Bacillus sp, Stenotrophomonas, Burkholderia, Pseudomonas sp, Rhizobium sp, Vibrio proteolyticus, Enterobacter aerogenes y Streptomyces, entre otros (10).
El grupo de investigación Ceparium vio la necesidad de realizar el presente estudio con el objetivo de identificar las cepas del género Bacillus con potencial solubilizador de fosfato, con el fin de continuar con estudios posteriores que permitan comprobar si pueden ser aplicados en formulaciones industriales para obtener productos biológicos óptimos que permitan mejorar la producción de alimentos dentro del esquema de una agricultura conservativa.
MATERIALES Y MÉTODOS
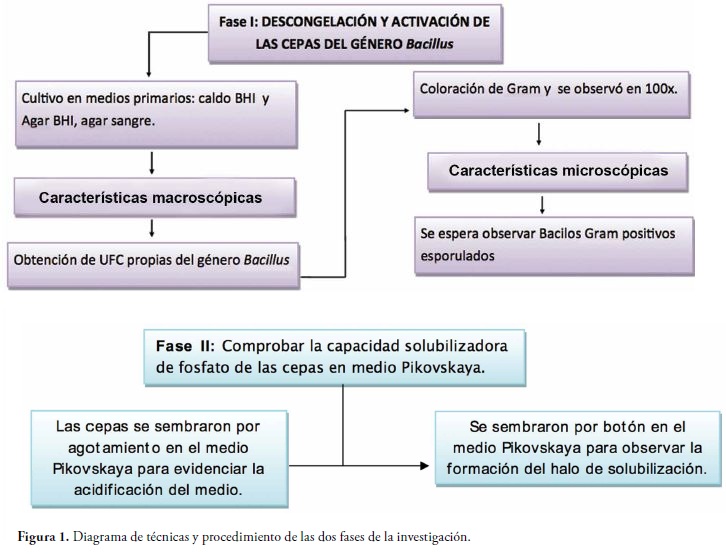
Fase I: Descongelación y activación de las cepas seleccionadas pertenecientes al género Bacillus que presenten las mejores condiciones de viabilidad y pureza en los medios básicos.
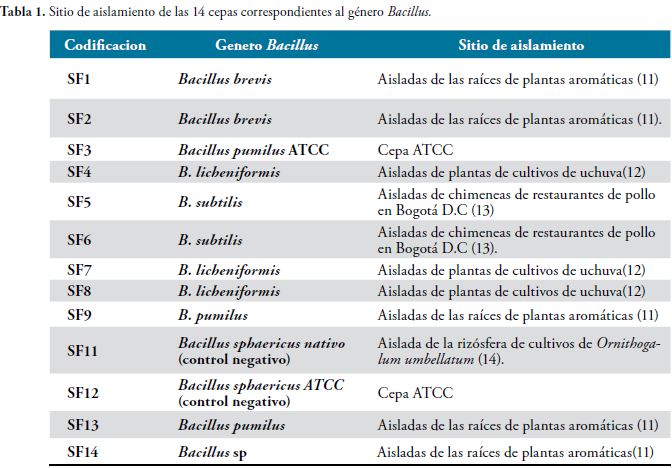
Los microorganismos del estudio fueron aislados a partir de rizósferas de diferentes plantas, tomando porciones del suelo adherido a la raíz el cual fue desprendido y disgregado manualmente hasta completar 15 gramos, de los cuales se tomó un gramo y se agregó a caldo BHI como preenriquecimiento, se incubó por 18 horas a 24°C, procedimiento que se realizó por duplicado. Luego se realizó siembra en los medios primarios agar sangre, agar Mac Conkey y agar BHI, tomando una asada a partir del crecimiento en el medio líquido con asa redonda de 100 microlitros, por la técnica de agotamiento para obtener colonias aisladas de las bacterias cultivables. Una vez se obtuvieron los cultivos se procedió a realizar coloración de Gram y los aislamientos secundarios de acuerdo con las características micro y macroscópicas de las colonias, para finalizar con la identificación mediante pruebas bioquímicas. En el caso de la muestra de chimeneas se tomó muestra de las trampas con escobillón estéril humedecido con solución salina estéril y se procedió de igual manera. Los microorganismos identificados fueron congelados en caldo BHI con glicerol al 10% a - 70°C, para posteriores estudios y conservar las características genotípicas y fenotípicas de cada uno. Las cepas seleccionadas para el estudio correspondieron al género Bacillus, para un total de 13 cepas provenientes de diferentes ambientes, como se muestra a continuación:
Descongelación
La descongelación de las cepas, se realizó siguiendo el protocolo descrito por Sánchez y Corrales (15).
Viabilidad y Pureza
Características macroscópicas
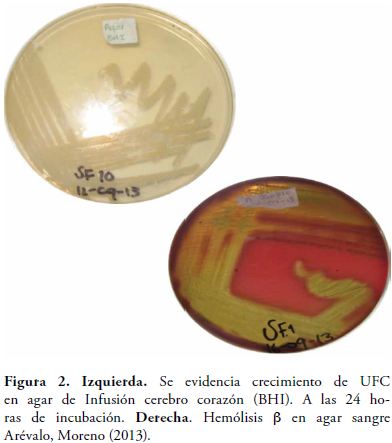
La viabilidad se evaluó mediante el crecimiento de las UFC en los medios de cultivo agar BHI y agar sangre en los cuales se observó color, textura, tamaño, forma y hemólisis.
Características microscópicas
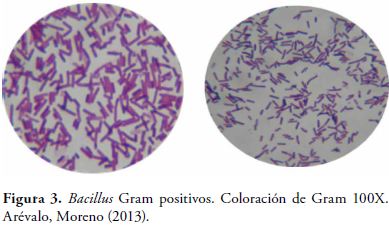
Mediante coloración de Gram, se verificó la morfología y se descartó contaminación en el cultivo.
Diferenciación en medio cromogénico e Identificación Bioquímica
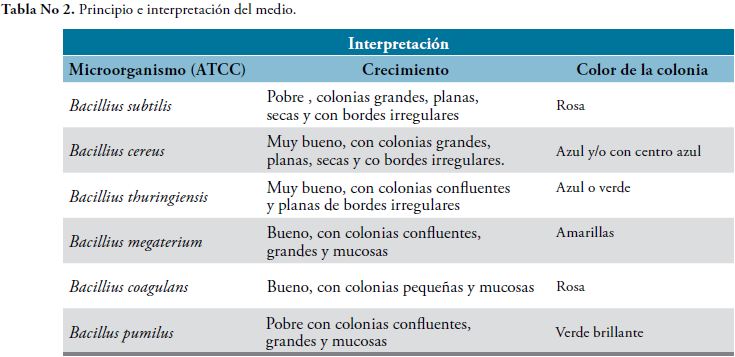
A partir del crecimiento en los medios primarios de los Bacillus se sembró en el medio Hi Chrome Bacillus, se incubó por 24 horas a 37°C, con el fin de diferenciar las especies por el color expresado en las colonias como resultado de las reacciones enzimáticas específicas de especie. El medio contiene en gramos / litro: Digerido péptico de tejido animal 10.0, extracto de carne 1.0, D-manitol 10.0, cloruro de sodio 10.0, mezcla cromogénica 3.20, rojo de fenol 0.025 y agar 15.0; con un pH final de 7.1 ± 0.2, si se quiere mayor selectividad en el medio se agrega polimixina B.
Principio e interpretación del medio
El medio Hi Chrome Bacillus Agar, se basa en la formulación de PAI formulado por Mossel en 1963, para la diferenciación de Bacillus cereus y Bacillus thuringiensis. El digerido péptico de tejido animal y el extracto de carne proporcionan los compuestos nitrogenados que requiere el microorganismo para su nutrición, el manitol sirve como el hidrato de carbono fermentable, detectado por el rojo fenol.
De igual forma se realizó la identificación bioquímica mediante el sistema BBL CRYSTAL para Gram positivos, según el protocolo estandarizado, con el fin de confirmar las especies. Este sistema es un método de identificación en miniatura que utiliza substratos convencionales, fluorogénicos y cromogénicos modificados. Los procedimientos de análisis usados en los sistemas BBL Crystal ID, son modificaciones de métodos clásicos, incluyendo pruebas para la fermentación, la oxidación, la degradación y la hidrólisis de diferentes substratos. La hidrólisis enzimática de los substratos fluorogénicos que contienen derivados cumarínicos del 4-metil-umbeliferona (4MU) o del 7-amino-4-metilcumarín (7-AMC) resulta en un aumento de la fluorescencia que se detecta fácilmente a simple vista con una lámpara de luz ultravioleta. Los substratos cromogénicos, después de ser hidrolizados, producen cambios de color que pueden detectarse visualmente.
Fase II: Capacidad solubilizadora de fosfatos de las bacterias nativas en el medio de cultivo selectivo Pikovskaya.
El medio Pikovskaya contiene en gramos / litro: glucosa 10.0, Ca3(PO4)2 fosfato de calcio 5.0, (NH4)2SO4 sulfato de amonio 5.0, KCl cloruro de potasio 0.2, MgSO4·7H2O sulfato de magnesio 0.1, MnSO4·2H2O sulfato de manganeso 0.0001, FeSO4 sulfato ferroso 0.0001, extracto de levadura 0.5 y agar 15.0.
El extracto de levadura y las diferentes sales proporcionan nitrógeno y otros nutrientes necesarios para el crecimiento bacteriano, la dextrosa es fuente de energía. Las bacterias solubilizadoras de fosfato crecen en este medio y forman una zona clara alrededor de la colonia, debido a la solubilización de fosfato mediada por enzimas bacterianas como las fosfatasas, que catalizan la hidrólisis de esteres y anhídridos del ácido fosfórico. Estas fosfatasas se clasifican de acuerdo con el tipo de enlace y compuestos sobre los que actúan en: fosfatasas que actúan sobre enlaces de tipo ester que se dividen en monoesterfosfato hidrolasa, diesterfosfato hidrolasas, trifosfato monoester hidrolasas, difosfato monoester hidrolasas y triesterfosfato hidrolasas (16).
La presencia de ácidos orgánicos como el oxálico permiten la acidificación del medio y facilitan el proceso de absorción a las bacterias que son capaces de convertir el fosfato tricálcico Ca3(PO4)2 en fosfato di y monobásicos con la producción de halos de solubilización en el medio.
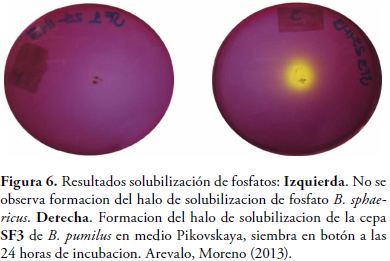
Las 11 cepas seleccionadas y los 2 controles fueron sembradas inicialmente por agotamiento en el agar Pikovskaya, se incubó por 24 horas a 37°C. Se considera positivo para la solubilización de fosfato cuando el indicador púrpura de bromocresol vira en el medio de morado a amarillo. Una vez comprobado el crecimiento y cambio en el color del medio de cultivo se procedió a sembrar por duplicado y por la técnica de botón con asa calibrada en el medio Pikovskaya para evidenciar la formación del halo de solubilización (halo claro alrededor de las UFC). Se realizó lectura a las 24 y 48 horas para observar cambios en el tamaño del halo de solubilización y se realizaron los respectivos cálculos aplicando la formula descrita a continuación para hallar el índice.
En la figura 1 se presenta el procedimiento.
RESULTADOS
FASE I: Descongelación, activación e identificación fenotípica de las cepas
Características macroscópicas
En los medios primarios (Agar BHI, agar sangre y caldo BHI) se obtuvo crecimiento de colonias cremosas, blanquecinas, grandes y uniformes. Las cepas presentaron hemólisis variables (γ y β) (Figura 2).
Características microscópicas
En la coloración de Gram, se observaron bacilos Gram positivos esporulados.
Diferenciación de especies del género Bacillus en medio cromogénico
Con este aislamiento se obtuvo la primera identificación presuntiva.
Verificación con BBL CRYSTALTM
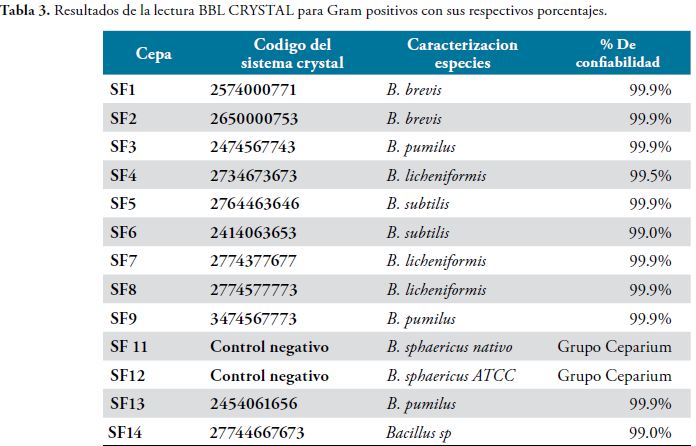
Los resultados obtenidos de la lectura del BBL CRYSTAL TM,Tabla 2,son los siguientes:
FASE II: Capacidad solubilizadora de fosfatos del género Bacillus en el medio Pikovskaya
Formación de halos de solubilización
En las figuras 6 y 7 se presentan los resultados obtenidos en el medio Pikovskaya donde se evidencian los halos de solubilización para las cepas de estudio.
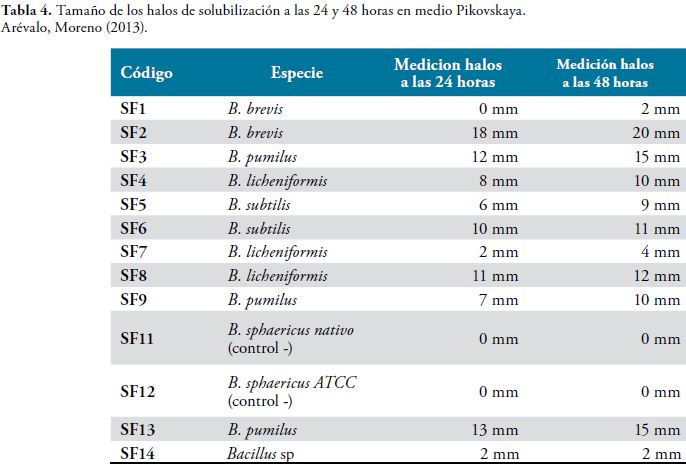
En la tabla 3 se presentan los resultados obtenidos a las 24 y 48 horas de incubación tomando el promedio de las lecturas en milímetros obtenida en los dos montajes.
El índice de solubilización (IS) de cada cepa se presenta en la Tabla 4.
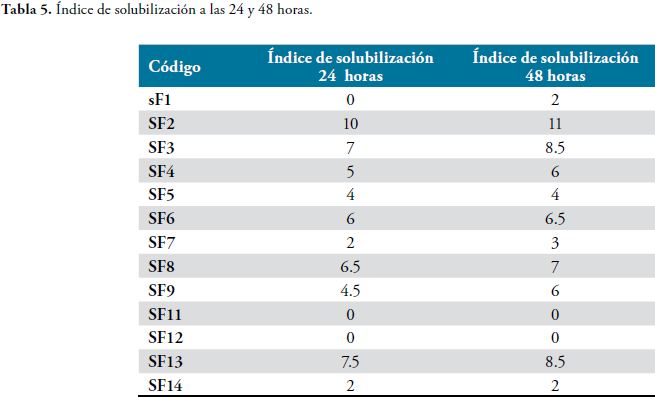
El índice de solubilización (IS) de cada cepa se presenta en la Tabla 5.
Comparación de los índices de solubilización
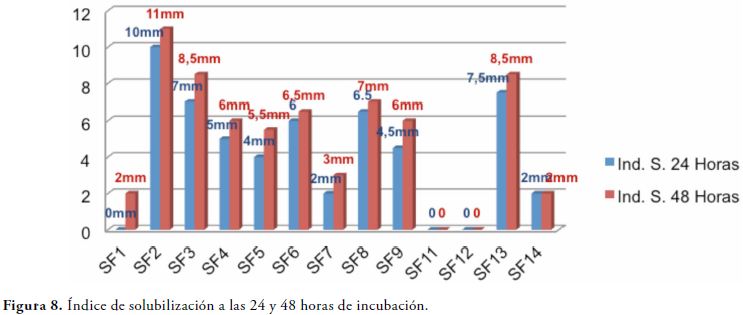
En la figura 8 se observan los índices de solubilización de las 11 cepas seleccionadas para el estudio y los 2 controles negativos, en donde se puede evidenciar que hay comportamientos diferentes para cada una de ellas.
Análisis estadístico
En el diseño experimental del estudio se utilizaron 11 cepas del género Bacillus para la identificación de la actividad solubilizadora de fosfato y 2 controles negativos, el índice de solubilización se determinó luego de medir el halo formado por las colonias como se describe en la tabla 4. Para determinar que especie del género Bacillus tuvo mayor actividad se realizó la gráfica de barras comparando las 11 especies y el índice de solubilización, la correlación entre el tiempo de incubación y el mayor índice se representa en la figura 7, demostrando que la diferencia en cuanto a la relación de tiempo en incubación fue de 0.5 a 2 mm de diámetro.
DISCUSIÓN
La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) nombró el 2014 como el año internacional de la agricultura familiar por la importancia de esta actividad a nivel mundial y de la cual muchas familias dependen para sobrevivir (17).
El uso apropiado de prácticas agrícolas, protege la biodiversidad, la seguridad alimentaria, el desarrollo sostenible de los recursos naturales y con ello concientizar a los países desarrollados y en vía de desarrollo de buenas prácticas que contribuyen a mejorar la calidad de vida de los habitantes y erradicar la pobreza extrema y el hambre y por lo tanto un mayor acceso a alimentos de calidad (17).
En el ecosistema del suelo existe diversidad de bacterias solubilizadoras de fosfato con distintas morfologías Gram positivas o Gram negativas, capaces de intervenir en el ciclo del fósforo transformando este elemento en un compuesto soluble para las plantas. éstos se encuentran principalmente en suelo con una alta cantidad de materia orgánica y realizan el proceso de solubilización mediante la producción de enzimas como fosfatasas, fitasas o ácidos orgánicos (18).
En la fase I del estudio se comprobó la viabilidad y se descartó contaminación en las cepas de Bacillus, recolectadas de diferentes microambientes ycongeladas a -70°C. El proceso inició con la reactivación, para la viabilidad se utilizaron los medios primarios agar sangre y agar caldo Infusión cerebro corazón (BHI), con la obtención crecimiento bacteriano abundante, y colonias que presentaron características propias del género. A nivel microscópico se observaron bacilos Gram positivos esporulados y se procedió a la identificación macroscópica de especies en el medio Hi Chrom Bacillus, para finalmente ser confirmadas por pruebas bioquímicas con el BBL CrystalTM para Gram positivos, lo que permitió comprobar que las cepas de Bacillus del estudio coincidían con las identificaciones realizadas en los trabajos previos de donde se aislaron estas bacterias (11, 12, 13,14).
Los resultados obtenidos permitieron evidenciar que las características propias de las cepas pertenecientes a Bacillus se mantuvieron durante el proceso y tiempo de congelación. Esta conservación puede deberse a una característica sobresaliente de esta especie como lo es la posibilidad de formar esporas frente a condiciones ambientales extremas, permitiéndoles permanecer viables por largos periodos de tiempo (19).
En la fase II se identificó el potencial solubilizador de fosfato de las cepas en el medio Pikovskaya (fosfato tricálcico) mediante la aplicación de protocolos utilizados en estudios previos como los de Chen Y.P, Rekha P et al y en el trabajo de Usha Seshachala et al en 2012 (20, 21).
El presente estudio determina la función solubilizadora de fosfato de forma cualitativa por observación de la formación del halo en el medio y su capacidad solubilizadora mediante la medición del mismo. La relación del halo y el índice de solubilización nos indica procesos de producción de fosfatasas, fitasas y ácidos orgánicos, así como la acidificación del medio dada por la disminución del pH (22).
Al determinar los índices de solubilización para cada una de las especies bacterianas, se evaluó la relación del tamaño de la colonia y el tamaño del halo de solubilización en mm. Se calculó el diámetro de la colonia y del halo formado alrededor del inoculo mediante la fórmula: Diámetro de la colonia + Diámetro del halo de solubilización / Diámetro de la colonia, lo que indica el radio de acción de la bacteria sobre el fosfato tricalcico, expresado en mm, en relación al tamaño de la colonia (23).
La formación del halo transparente que se observa alrededor de las colonias ocurre en la medida que sucede la solubilización, lo que establece un indicador de la actividad solubilizadora de fosfato por las bacterias (23).
La solubilización de fosfato se evidenció en las 11 cepas del estudio, obteniendo la acidificación del medio el cual es inversamente proporcional a la cantidad de fósforo según Pablo álvarez Figueroa y Sady García Bendezú (24), por lo tanto se puede concluir que el 90 % de las cepas son capaces de solubilizar el fósforo insoluble a partir de fosfato tricálcico.
Las especies del género Bacillus demostraron capacidad solubilizadora de fosfatos, con diferentes tamaños de halo, en la prueba de siembra en botón en el medio Pikovskaya, similares a los reportados por Gupta (2007), quienes reportan haber obtenido halos entre 14 y 41 mm (25).
Las 11 cepas del estudio no mostraron cambios significativos en el índice de solubilización en el medio Pikovskaya durante las 24 y 48 horas de incubación, cabe destacar que el ensayo se realizó por duplicado, durante la fase logarítmica de las bacterias, obteniendo halos de máximo 18 mm a las 24 horas y 20 mm a las 48 horas en el caso de Bacillus brevis. El rango promedio para las cepas que presentaron los índices más bajos, oscilo entre 2 y 3 mm y se pueden clasificar como potenciales solubilizadoras de fosfato ya que presentan un resultado igual o mayor que otras bacterias también consideradas solubilizadoras de fosfato en medio sólido como Pantoea sp y Pseudomonas sp, las cuales demostraron esta función en un mayor tiempo de incubación, tal como lo describen Jorge Cordero et al y Shekhar Nautiyal en sus investigaciones (19, 26).
Las cepas correspondientes a Bacillus sphaericus nativo y B. sphaericus ATCC correspondieron a controles negativos, por lo tanto no formaron halo de solubilización. El mayor halo de solubilización lo obtuvo B. brevis (20 mm) seguido de B. pumilus (15mm) y B. licheniformis (12mm) este último fue reportado por Berto Tejera Hernández et al como solubilizador de fosfato en cultivos de arroz (27).
Bacillus subtilis presento un menor halo e índice de solubilización respecto a las bacterias ya mencionadas, sin embargo, en el trabajo realizado por Usha Seshachala et al demostró capacidad para solubilizar otras formas de fosfato: fosfato de roca (RP), fosfato tricálcico (TCP) y fosfato di hidrógeno de potasio (KHP) (21).
La ausencia o halos de solubilización pequeños en el medio de cultivo Pikovskaya no indica necesariamente que el microorganismo no posee la función; los sitios de aislamiento y el ambiente donde se encuentran las bacterias también influye en su capacidad solubilizadora, ya que existen mecanismos inductores o de represión genética reguladas por la disponibilidad de fósforo, es decir los genes se expresan de acuerdo a las condiciones en las que el organismo se encuentre, lo que demuestra que a pesar que todos los microorganismos aislados comparten características genéticas y se encuentren en las mismas condiciones nutricionales en el estudio, son independientes en cuanto a su actividad solubilizadora de fosfato (28, 29), como es el caso del B. subtilis que proviene de chimeneas de restaurantes de pollo, en contraste con las bacterias que presentaron mayor índice de solubilización como fueron B. brevis, B. licheniformis y B. pumilus que provienen de las rizósfera de diferentes cultivos y estuvieron en contacto con los nutrientes disponibles en el suelo.
Por lo tanto con éste método es posible observar la presencia o ausencia de la actividad solubilizadora de fosfato, pero no es un prueba que confirme si realmente los microorganismos en estudio no tienen dicha capacidad, para esto es necesario comprobar esta función en medios líquidos ya que también se ha demostrado que no todos los microorganismos tienen la capacidad de solubilizar fosfatos en medio sólido (19, 30).
De acuerdo con los resultados B. brevis y B. pumilus presentan los mejores resultados en ambas mediciones y se constituyen como cepas prometedoras y eficientes para realizar el proceso de solubilización de fosfato. Existen escasos reportes sobre estas dos especies como bacterias promotoras de crecimiento vegetal, sin embargo el presente estudio demuestra que dentro del género Bacillus son las especies que más se destacaron e interesan para el desarrollo de investigaciones acerca de su relación con ésta y otras funciones.
Optar por alternativas como los biofertilizantes constituye un aprovechamiento de los microorganismos como Bacillus sp, un género que se caracteriza por ser un excelente solubilizador de fosfato y ofrece mejorar la disponibilidad de nutrientes en los microambientes, máxime cuando el fósforo es considerado un elemento limitado en la agricultura y que es necesario para optimizar e incrementar la producción en los cultivos vegetales (31).
REFERENCIAS
1.Asociación Internacional de la Industria de los Fertilizantes (IFA). Los fertilizantes y su uso. Paris; 2011. [ Links ]
2.Fixen Paul. Dinámica del fosforo en el suelo y en el cultivo en relación al manejo de los fertilizantes fosfatados [Fecha de acceso 12 de abril de 2013].URL disponible en: http://www.researchgate.net/publication/228551560_DINAMICA_DEL_FOSFORO_EN_EL_SUELO_Y_EN_EL_CULTIVO_EN_RELACION_AL_MANEJO_DE_LOS_FERTILIZANTES_FOSFATADOS [ Links ]
3.Organización de las Naciones Unidas para la alimentación y la agricultura (FAO), Grupo de ventas y comercialización. (2005).Roma. Boletín de suelos de la FAO. [ Links ]
4.Ministerio de agricultura y desarrollo rural. Encuesta nacional agropecuaria. Colombia;servicio de información agropecuaria;2010. ISSN-8449 [ Links ]
5.Destino exportación: Principales rumbos de los alimentos colombianos. Colombia; revistaialimentos. Edicion 10. [ Links ]
6.Instituto Colombiano Agropecuario (ICA). Subgerencia de Protección y Regulación Agrícola. Boletín técnico: Comercialización de fertilizantes y acondicionadores de suelos; Colombia; 2010. [ Links ]
7.Junyent Fadon Beatriz, Diez AbalosAlfonso. Contribuciones para unas buenas prácticas  agrarias. Paisaje, ecología y género:1-32. [ Links ]
8.Asociación internacional de la industria de los fertilizantes (IFA). Los fertilizantes y su uso. Paris, 1992.632 paginas. [ Links ]
9.Alvarado Alfredo, Iturriaga Isabel, et al. Efecto residual del fertilizante fosfatado adicionado al cultivo de papa en un andisol de Juan viñas, Costa Rica. Agronomia costarricense.2008; 33(1):63-76. [ Links ]
10.Fernandez Leticia. Bacterias solubilizadoras de fosfato inorgánico aisladas de suelos de la región de Sojera. Scielo. 2005; 23 (1). [ Links ]
11.Maldonado Edna, Monroy Luisa, Layton Cristian. Evaluacion del potencial genético antibiótico de Bacilos nativos UCMC-TB2 y UCMC -E2 como aporte al conocimiento de su acción biocontroladora contra el genero Fusarium sp en plantas aromáticas [Trabajo de grado] Colombia. 2011. [ Links ]
12.Melo Javier, Rodríguez Anyela, Evaluación de microorganismos rizosféricos de uchuva Physalis peruviana L, con capacidad solubilizadora de fosfatos. Trabajo de grado de la Universidad Colegio Mayor de Cundinamarca 2009. [ Links ]
13.Soto Lisbeth, Vargas Jenny. Aislamiento e identificación fenotípica de microorganismos Adaptados a chimeneas de restaurantes de pollo en Bogotá D.C, Trabajo de grado de la Universidad Colegio Mayor de Cundinamarca. 2009 [ Links ]
14.Gómez Romero Sara Esmeralda, Hernández Rodríguez Cindy Zulay. Identificación del fragmento de 231pb del gen que codifica la toxina Bin b de la cepa nativa Bacillus sphaericus por reacción en cadena de la polimerasa, Trabajo de grado de la Universidad Colegio Mayor de Cundinamarca.2009. [ Links ]
15.Corrales L, Sánchez L, Evaluación de la congelación para conservación de especies autóctonas bacterianas. Revista NOVA (ISSN 1794-2470) .2005; 3(4): 21- 29 [ Links ]
16.Horton, H. Robert ; Moran, Laurence A. et al. Principios de bioquímica. Cuarta edición 2008 [ Links ]
17.Organización de las naciones unidas para la alimentación y la agricultura (FAO). Agricultura familiar. Boletin informativo. 2014. Santiago de Chile. [ Links ]
18.Bolívar Ivette, Brito Mery, et al, Identificación de posibles controladores biológicos de Sclerotinia sclerotiorum en los cultivos de Solanum quitoense. Trabajo de grado de la Universidad Colegio Mayor de Cundinamarca 2006 [ Links ]
19.Cordero Elvia Jorge, Ortega Rodés Patricia, Ortega Eduardo. La inoculación de plantas con Pantoea sp., bacteria solubilizadora de fosfatos, incrementa la concentración de P en los tejidos foliares. Rev. Colomb. Biotecnol. 2008;X(1). [ Links ]
20.Chen Y.P, Rekha P.D, Arun A.B, Shen F.T et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil ; 34(1) [ Links ]
21.Seshachala Usha, Tallapragada Padmavathi. Phosphate solubilizers from the rhizosphere of piper nigrum l. in karnataka, India. Chilean Journal of agricultural research. 2012; 72(3). [ Links ]
22.Rodríguez-Gámez Odalys, Aguilera-Rodríguez Isabel, Pérez-Silva Rosa María. Adaptation of a Colorimetric Micro Method for Quantification Soluble Phosphorus in Microbial Cultures. Revista Cubana de química. 2012;XXV (1). [ Links ]
23.Otero Jiménez Vanessa. Aislamiento, Selección e Identificación de Actinomicetos, Bacterias Fotosintéticas No Sulfurosas y Bacterias ácido Lácticas con Potencial Biofertilizante, a Partir de Suelos Asociados al Cultivo de Plátano en la Costa Atlántica Colombiana. [Tesis de grado].Colombia; 2011. [ Links ]
24.Rodríguez H, Fraga R, Gonzalez T, Bashan Y. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria. Plant and Soil .2006;102. [ Links ]
25.Gupta, N., Sabat, J., Parida, R., and Kerkatta, D. Solubilization of tricalcium phosphate and rock phosphate by microbes isolated from chromite, iron and manganese mines. Acta Botanica Croatica. 2007; 66(2):197-204. [ Links ]
26.Nautiyal C. Shekhar. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology.1999 . 265-270. [ Links ]
27.Tejera-Hernández Berto, Heydrich-Pérez Mayra, Rojas-Badía Marcia M. Aislamiento de bacillus solubilizadores de fosfatos asociados al cultivo del arroz. Agronomía Mesoamericana.2013;24(2):357-364. [ Links ]
28.álvarez Figueroa Pablo, García Bendezú Sady. Selección y evaluación de microorganismos solubilizadores de fosfatos en suelos calcáreos del Valle del Mantaro 2012; 1-25 [ Links ]
29.Patiño Torres Carlos Omar. Solubilización de fosfatos por poblaciones bacterianas aisladas de un suelo del valle del cauca. Estudio de biodiversidad y eficiencia. [Tesis doctoral].Colombia; 2010. [ Links ]
30.Bobadilla Henao C, Rincón Vanegas S. Aislamiento y producción de bacterias fosfato solubilizadoras a partir de compost obtenido de residuos de plaza. [Tesis de grado]. Colombia; 2008. [ Links ]
31.Hernández Tania ,Carrión Gloria , Heredia Gabriela. Solubilización in vitro de fosfatos por una cepa de Paecilomyces lilacinus (Thom) Samson. Rev. Scielo. Agrociencia. 2011; 45(8). [ Links ]