Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nova
versão impressa ISSN 1794-2470
Nova vol.13 no.23 Bogotá jan./jun. 2015
Artículo original producto de la investigación
Cambios morfológicos e inhibición del crecimiento de Candida albicans en presencia de una solución de sulfato de zinc
Morphological changes and inhibition of the growth of Candida albicans in the presence of solution sulfate of a zinc sulfate of zinc
Julián Gallón Nausa
OD. ,Esp. Cirugía Oral, Magister en Ciencias Pontificia Universidad Javeriana, Docente Hospital San Blas servicio Maxilo Facial. Bogotá, Colombia.
Correspondencia: julianfgallon@gmail.com
Recibido: 13/03/2015 / Aceptado: 05/06/2015
Resumen
Objetivo. Identificar aislamientos de C. albicans, en niños de cuatro a doce años, de una población de 189 individuos y evaluar dichos aislamientos frente a tres concentraciones (3%, 5% y 7%) de Sulfato de Zinc. Método. Se utilizaron las técnicas de la Concentración Mínima Inhibitoria (CMI, la técnica de Kirby Bauer, según los parámetros del Clinical Laboratory Standards Institute (CLSI) y análisis de microscopia y barrido electrónico. Resultados: En el método de CMI, con las concentraciones de 3% y 5% se encontró una disminución en las Unidades formadoras de Colonias (UFC) relacionadas con el tiempo (24, 48 y 72 horas), comparadas con la cepa control. En cuanto a la concentración del 7%, no se presentaron unidades formadoras de colonias en ninguno de los tres tiempos observados. Con la técnica de Kirby Bauer, la concentración del 3% no presentó inhibición del crecimiento; a las concentraciones del 5% y 7% se presentó un halo de 16 mm y 20 mm respectivamente. El análisis de microscopia y barrido electrónico (MBE), revela que el Sulfato de Zinc de 3% y 5% presentan formación de biopelicula y pseudomicelio, a diferencia de la concentración del 7% donde se observó lisis celular en todos los campos.
Palabras clave: Candida albicans, sulfato de zinc, inhibición del crecimiento, resistencia, antifúngicos.
Abstract
Objective. Identify isolations of C. albicans, in children from 4 to 12 years, of a population of 189 individuals and to evaluate the above mentioned isolations opposite to three concentrations (3 %, 5 % and 7 %) of Sulfate of Zinc. Methods. There were in use the technologies of the Minimal Inhibitory Concentration (CMI) and Kirby Bauer's technology, according to the parameters of the Clinical Laboratory Standards Institute (CLSI). Results: In CMI's method, with the concentrations of 3 % and 5 % one found a decrease in the forming Units of Colonies (UFC) related to the time (24, 48 and 72 hours) compared with the vine-stock control. As for the concentration of 7 %, they did not present forming units of colonies in any of three observed times. With Kirby Bauer's technology, the concentration of 3 % did not present inhibition of the growth; to the concentrations of 5 % and 7 % one presented a halo of 16 mm and 20 mm respectively. The analysis of Microscopy and Electronic Sweep (MBE), it reveals that the Sulfate of Zinc of 3 % and 5 % they present formation of biopelicula and pseudomicelio, unlike the concentration of 7 % where it was observed lisis cellular in all the fields.
Keywords: Candid albicans, sulfate of zinc, inhibition of the growth, resistance, antifúngicos.
Introducción
Candida albicans, es el agente responsable de la mayoría de las infecciones micóticas en los seres humanos (1-3). El incremento de estas infecciones, junto a la aparición de resistencias a diversos antifúngicos hace necesario estudiar otras sustancias con probable acción fungicida como sería el caso del sulfato de zinc.
La mayoría de las micosis orales (4-6), son producidas por levaduras del género Candida, principalmente por la especie C. albicans se considera que cuatro de cada mil pacientes que acuden a una consulta odontológica general presentan síntomas de infección candidiásica. Además, una gran parte de las candidiasis orales son asintomáticas y es muy probable que la prevalencia de este proceso sea mucho mayor. Son frecuentes en lactantes, ancianos y personas con factores predisponentes generales o locales.
Adicionalmente, la candidiasis oral y orofaríngea (7, 8), son las infecciones fúngicas más comunes en pacientes oncológicos sometidos a tratamiento antineoplásico; paciente con grandes estadías hospitalaria (9), también se encuentra presente en algunos estados fisiológicos como enfermedades metabólicas, endocrinopatías, síndrome de inmunodeficiencia adquirida, uso de medicamentos, intervenciones quirúrgicas, en donde se pueden presentar posibles fallas en los tratamientos instaurados con antimicóticos, adquiriendo resistencia (10-20).
Es bien conocida la capacidad de adaptación genética y fenotípica de la Candida albicans, le permite mejorar sus estrategias de supervivencia especialmente en la cavidad oral cuando la respuesta inmune es deficiente y la respuesta de los tejidos es alterada como barrera primaria. Este cambio genera un retrasó en los tiempos de cicatrización y esto facilita la colonización de C. albicans y la consiguiente cronicidad de las infecciones por dicho microorganismo, de ahí la preocupación para estar en constante búsqueda de sustancias que puedan controlar su crecimiento (17-18).
Actualmente se ha visto este hongo, también implicado en procesos de resistencia a sustancias anti fúngicas ya existentes (10-12), razón por la que se considera de gran importancia la investigación en productos que inhiban el crecimiento de este microorganismo.
En este estudio se pretende evaluar los cambios morfológicos e inhibición del crecimiento del hongo Candida albicans en presencia de una solución de sulfato de zinc en cepas aisladas en una población de niños de cuatro a doce años. Esta población en particular presenta factores de riesgo como caries dental, enfermedad periodontal, asociados probablemente a dietas ricas en carbohidratos, mal oclusiones, respiradores orales, hábitos higiénicos deficientes y epitelios reactivos. Adicionalmente esta población corresponde a una región deprimida sin recursos de atención odontológica.
En este trabajo se pretende enfrentar al hongo a diferentes concentraciones de sulfato de zinc (3.0%, 5.0% y 7%) y observar los cambios morfológicos mediante microscopia de fluorescencia y electrónica y la inhibición del crecimiento de la Cándida albicans por medio de los métodos de crecimiento en placas de agar, mediante la técnica de Kirby Bauer y mediante la técnica en medio líquido de la Concentración Inhibitoria Mínima (CIM).
Materiales y métodos
Se realizó un estudio descriptivo transversal para observar los cambios morfológicos e inhibición del crecimiento de Candida albicans en presencia de tres (3%,5% y 7%) concentraciones de sulfato de zinc. Se utilizaron aislamientos de Candida albicans de niños del colegio Madre Teresa Titos de la ciudad de Bogotá y cepa control Candida albicans ATCC 90028.
La muestra correspondió a 13 cepas de Candida albicans y como control se utilizó la cepa Candida albicans ATCC 90028 recomendada para este efecto. Las pruebas se corrieron por triplicado en cumplimiento de los estándares de calidad.
Genotipificación de cepas. Las cepas de Candida fueron genotipificadas por el Instituto de Ciencias Básicas, Enfermedades Infecciosas y Enfermedades Tropicales de la Universidad del Rosario por el método de Reacción en Cadena de la Polimerasa PCR.
Pruebas de actividad del Sulfato de Zinc. Se realizaron dos métodos para valorar la actividad de las levaduras al sulfato de Zinc; elMétodo de Kirby Bauer y el método de la Concentración Mínima Inhibitoria (CMI). Los dos sistemas se realizaron según los parámetros indicados en el método estándar referenciado en el Clinical and Laboratory Standards Institute (CLSI) protocolo enero 2007 Volumen 27.
Cambios morfológicos de la levadura. Se practicó estudio en Microscopia de barrido electrónico para observación de los cambios morfológicos y estructurales de la levadura Candida albicans.
Resultados
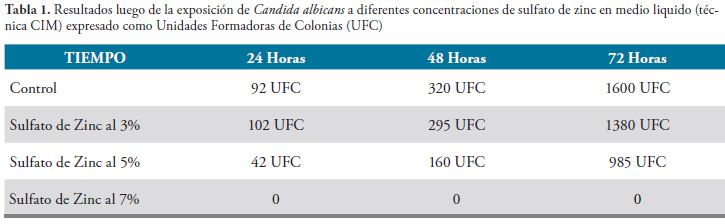
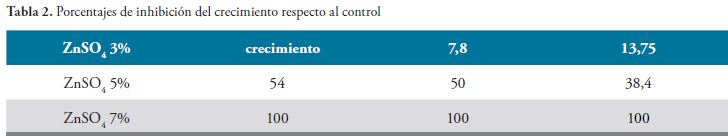
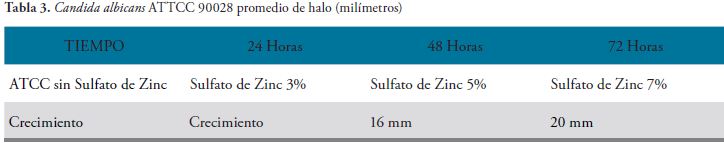
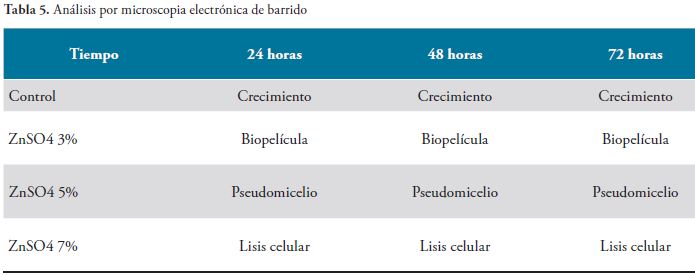
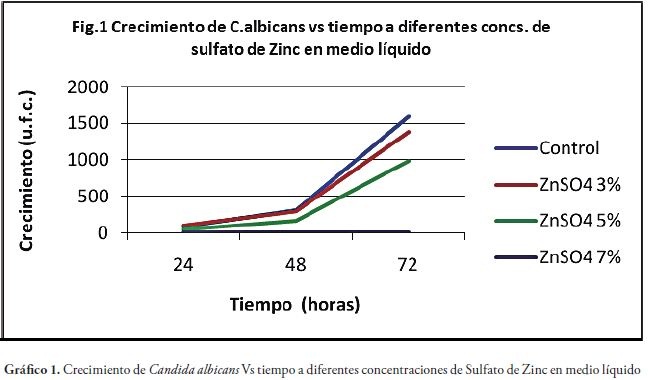
Los hallazgos encontrados se presentan a continuación en las Figuras 1, 2, 3 y 4, Tablas 1, 2, 3, 4 y 5, y gráfico 1.
En la figura 3A se observa que el microorganismo aún conserva su forma levaduriforme. Sin embargo hay una gran proliferación de gemas y matriz de exoplisacaridos, lo que indicaría un comienzo incipiente de una biopelícula. En la figura 3B se observa el comienzo de la formación de un pseudomicelio. En la figura 3C pseudomicelio bien desarrollado con predominio en todos los campos observados.
En la figura 4A, las células son de gran tamaño y su morfología no corresponde ni a levadura ni a pseudomicelio y también se observa una pérdida de la turgencia e inicios del proceso de lisis celular. En la figura 4B las células han perdido su arquitectura y pareciera que la mayoría se encuentra en proceso de lisis. En la figura 4C hay desaparición total de las células, en todos los campos hay lisis celular.
A partir de estos resultados se podría inferir que a una concentración del 7% el microorganismo es totalmente inhibido en cuanto a su crecimiento.
El comportamiento de la cepa control en este caso Candida albicans ATCC 90028, a las 48 horas y a las 72 horas presento un promedio de halos de 16 y 20 mm respectivamente y crecimiento normas en ausencia del sulfato de zinc.
Si se asume que el término “crecimiento” indica que no hay halo de inhibición, se puede comprobar en medio sólido que el sulfato de zinc al 5% es la Concentración Minina Inhibitoria, produciendo un halo de inhibición de 16 mm y que un halo de 20 mm al 7% aumenta la inhibición un 20% más, en cualquier tiempo de incubación
Los datos de Microscopia de Barrido Electrónico, indican que una concentración de Sulfato de Zinc de 7%, es capaz de producir lisis celular en la Candida albicans, mientras que concentraciones menores no lo hacen. Como conclusión, para que haya inhibición total del crecimiento, la Concentración Minina debe ser del 7%.
Se observa en la gráfica 1 que entre la muestra control y el Sulfato de Zinc al 3%, hasta las 48 horas no hay diferencia. A las 72 horas ya se nota una diferencia que corresponde al 13.75 del control. La Concentración Minina Inhibitoria es de 5%, ya que inhibe el crecimiento a partir de las 24 horas. La concentración del 7% inhibe el 100% del crecimiento en todos los tiempos observados.
Discusión
Candida albicans, presenta una mayor capacidad de adherencia y penetración en relación con las otras especies de Candida, que se facilita por la transformación de levadura a micelio (16).
Estos cambios morfológicos se observaron en las concentraciones del sulfato de zinc del 3% y el 5%%, con crecimientos celulares en ambas concentraciones. Lo anterior se relaciona con lo informado por Rios (13), quien encontró esta transición morfológica de Candida albicans, concluyendo que esta característica está relacionada con su patogenicidad.
En presencia de las concentraciones de 3% y 5%, se observó formación de biopelícula y pseudomicelio, en todos los tiempos. Los tamaños celulares se encontraban entre 3 y 5 micras y observan canales comunicantes, característica muy importante de la arquitectura de las biopelículas. A una concentración de 7% de sulfato de zinc se presentó lisis celular a las 24, 48 y 72 horas. Es de resaltar que la inhibición del crecimiento fue absoluta comparada con las concentraciones de 3% y 5%, donde sí se presentó crecimiento.
Los aislamientos utilizados en este estudio corresponden a una población infantil de cuatro a doce años, portadores asintomáticos, con factores de riesgo como caries dental, enfermedad periodontal, maloclusiones y dietas ricas en carbohidratos, pertenecientes a una zona deprimida económicamente de la ciudad de Bogotá sin atención odontológica, al igual que la población escogida por Kadyr, Uygun y Akyüz, quienes observaron una prevalencia de 26.3%, donde Cándida albicans fue la especie más frecuente (84.4%) Otras especies fueron parapsilosis, krusei, kefyr, famata y tropicalis. Estos autores concluyeron que la frecuencia del estado de portador variaba en función de la edad y la dieta.
Al igual que Souza (14), este estudio también observo que las cepas de Candida, presentan cambios morfológicos, asociados a su virulencia y a las condiciones del microambiente de la cavidad oral.
Mendicote (15), Carl y Emrich observaron que el zinc inhibía el crecimiento bacteriano y aumentaba la respuesta inflamatoria con una disminución del tamaño de las heridas y mejoraba el control de la infección.
Los resultados obtenidos en la mayoría de los ensayos clínicos, sugieren que el zinc puede ser un tratamiento eficaz como estimulante de los procesos de cicatrización. Esta actividad se podría alternar con estudios in-vitro, que demuestren un posible efecto sobre crecimiento de microorganismos.
En conclusión, las pruebas de fenotipificación y genotipificación corroboraron que los aislamientos correspondían al hongo Candida albicans. La formación de tubo germinal fue positiva, lo cual corrobora el potencial patógeno del microorganismo. La formación de clamidosporas también ocurrió, con lo que se demuestra el cambio fenotípico a su forma más resistente en condiciones adversas.
Con el método de la Concentración Mínima Inhibitoria en las concentraciones del 3% y 5% de sulfato de zinc, se presentó una disminución de las UFC, con respecto al control, en los diferentes tiempos evaluados (24, 48 y 72 horas), con la concentración del 7% de sulfato de zinc no se presentó crecimiento, con respecto al control, en ninguno de los tiempos evaluados (24, 48 y 72 horas).
Cuando la Candida albicans se expuso a una concentración de sulfato de zinc al 3%, con el método de Kirby Bauer presento crecimiento en todos los tiempos evaluados (24, 48 y 72 horas), con respecto a la cepa control. A una concentración de sulfato de zinc al 5%, presento un halo de 16 mm, en todos los tiempos evaluados (24, 48 y 72 horas), con respecto a la cepa control a una concentración de sulfato de zinc al 7%, presento un halo de 20 mm, en todos los tiempos evaluados (24, 48 y 72 horas), con respecto a la cepa control.
La exposición de Candida albicans a la concentración del 3% mostró formación de biopelícula a las 24, 48 y 72 horas, observable mediante Microscopia de Barrido Electrónico. La concentración de sulfato de zinc del 5% presentó formación de pseudomicelio a las 24, 48 y 72 horas, En la concentración de 7% de Sulfato de Zinc, no se observaron biopéliculas ni pseudomicelio y a esta concentración se presentó lisis celular a las 24, 48 y 72 horas. Es de resaltar que la inhibición del crecimiento fue absoluta comparada con las concentraciones de 3% y 5%, donde sí se presentó crecimiento.
Si se asume que el término “crecimiento” indica que no hay halo de inhibición, se puede comprobar con la técnica de Kirby Bauer, que el sulfato de Zinc al 5%, tiene la mínima concentración inhibitoria produciendo un halo de inhibición de 16 mm y que al 7% aumento la inhibición de 20% más para cualquier tiempo de incubación.
En la concentración de Sulfato de Zinc al 3% , comparado con el control, hasta las 48 horas no hay diferencia; mientras que a las 72 horas ya se observa una diferencia correspondiente al 13.75% con referencia al control. La Mínima Concentración Inhibitoria es 5%, porque se demuestra crecimiento desde las 24 horas. La concentración del 7% inhibe al 100% el crecimiento, en todos los tiempos observados.
Los datos de microscopia de barrido electrónico indican que la concentración se sulfato de zinc al 7%, es capaz de producir lisis celular de C. albicans, mientras que concentraciones menores no. De lo anterior se puede concluir que para que haya inhibición total del crecimiento, la concentración mínima debe ser del 7%. La solución de sulfato de zinc al 7% interfiere el desarrollo de Candida albicans, generando un cambio en su morfología, que le impide un crecimiento normal en modelos in-vitro.
Referencias
1. Hernández-Solís SE, Rueda-Gordillo F, Pereira-Góngora JR, Villamil-Urzaiz JL.Frecuencia de portadores de C. albicans en un grupo de niños de una comunidad rural del estado de Yucatán. México. Revista Odontológica Latinoamericana. 2008; 0(1): 1-4. [ Links ]
2. Rueda-Gordillo F, Hernández-Solís SE. Prevalencia de Candida albicans aislada de la cavidad oral de pacientes con cáncer. México. Revista Odontológica Latinoamericana. 2008; 0(2): 38-41. [ Links ]
3. Alejandra Jaimes Aveldañez, Francisco Hernández Pérez, Erick Martínez Herrera, Alma Angélica, Rodríguez Carreón, Roberto Arenas Guzmán Portadores de Candida en la mucosa oral: tipificación de 35 cepas con Chomoagar Candida. Med Int Mex.2008; 24(4):262-6. [ Links ]
4. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeats; Approved Standard, Second Edition. Clinical Laboratory Standards Institute (CLSI). 2007; 22(15). [ Links ]
5. Gordon Ramage, Stephen P. Saville, Derek P. Thomas, and Jose L. Lopez-Ribot. Candida Biofilms. Eukaryotic Cell. 2005; 4: 633-638. [ Links ]
6. Murciano C, Villamon E, Gozalbo D, Roig P, O'Connor JE, Gil ML. Toll-Like Receptor 4 defective mice carrying point or null mutations do not show increased susceptibility to Candida albicans infections. Med Mycol. 2006 Mar; 44(2):149-57. [ Links ]
7. Xin H, Cartmell J, Bailey JJ,Dziadek S, Bundle DR, Cutler JE. Self-adjuvanting glycopeptide conjugate vaccine against disseminated candidiasis. PLoS One. 2012; 7(4):e35106. Epub 2012 Apr 26. [ Links ]
8. Gladys Velazco, Reynaldo Ortiz, Leylan Arellano, Lorena Bustillos, Anajulia. Evidencia microscópica de la presencia de Candida albicans en bases protésicas retiradas de la cavidad bucal. Revista Cubana de Estomatología. 2009; 46(2). [ Links ]
9. Jorge Alberto Cortés, Patricia Reyes, Carlos Gómez, Giancarlo Buitrago, Aura Lucía Leal. Fungal bloodstream infections in tertiary care hospitals in Colombia. Revista Iberoamericana de Micología. 2011; 28(2):74-78. [ Links ]
10. Paula Andrea Orozco, Jorge Alberto Cortés. Colonización por levaduras en recién nacidos y personal de salud en la unidad de cuidados intensivos neonatales de un hospital universitario en Bogotá, Colombia. Parra. Rev Iberoam Micol. 2009; 26(2):108-111. [ Links ]
11. Christopher F. Hoehamer, Edwin D. Cummings, George M. Hilliard, and P. David Rogers. Changes in the Proteome of Candida albicans in response to Azole, Polyene, and Echinocandin antifungal agents. Antimicrobial Agents And Chemotherapy. 2010; 54(5): 1655-1664. [ Links ]
12. Laura Estela Castrillón Rivera, Alejandro Palma Ramos, María del Carmen Padilla Desgarennes. Importancia de las biopelículas en la práctica médica Dermatología. México. Rev Mex. 2010; 54(1):14-24. [ Links ]
13. Govindsamy Vediyappan, Tristan Rossignol, and Christophe d'Enfert. Interaction of Candida albicans Biofilms with Antifungals: Transcriptional Response and Binding of Antifungals to Beta-Glucans. Antimicrobial agents and Chemotherapy. 2010; 54(5):2096-2111. [ Links ]
14. Souza, N. , Ferreira, W, Cardoso C. Dias, S. M. , Pimentaimenta, F. C.1 and Toledo. Phenotypic aspects of oral strains of Candida albicans in children with down's syndrome. Braz. J. Biol.2006; 66(3): 939-944. [ Links ]
15. Mendicote Leon, F. Toxicidad y tratamientos de soporte en oncología radioterápica: toxicidad en el área de O.R.L. (Barcelona. ). En: Prevención y tratamiento Oncología. 2005; 28(2):30-34. [ Links ]
16. Yáñez A, Flores A, Murciano C, O'Connor JE, Gozalbo D, Gil ML.Cell Signalling through TLR2/MyD88 induces differentiation of murine bone marrow stem and progenitor cells to functional phagocytes in response to Candida albicans. Microbiol. 2010 Jan;12(1):114-28. Epub 2009 Sep 11. [ Links ]
17. Moyes DL, Shen C, Murciano C, Runglall M, Richardson JP, Arno M, Aldecoa-Otalora E, Naglik JR. 19.Protection against epithelial damage during Candida albicans infection is mediated by PI3K/Akt and mammalian target of rapamycin signaling. J Infect Dis. 2014 Jun 1;209(11):1816-26. Epub 2013 ec. [ Links ]
18. Ogata K, Matsuda K, Tsuji H, Nomoto K. Sensitive and rapid RT-qPCR quantification of pathogenicCandidaspecies in human blood. J Microbiol Methods. 2015 Jul 29. pii: S0167-7012(15)30030-0. [ Links ]
19. Cossu A, Wang MS, Chaudhari A, Nitin N. Antifungal activity againstCandida albicansof starch Pickering emulsion with thymol or amphotericin B in suspension and calcium alginate films. Int J Pharm. 2015 Jul 28. pii: S0378-5173(15)30083-1. [ Links ]
20. Luna-Tapia A, Peters BM, Eberle KE, Kerns ME, Foster TP, Marrero L, Noverr MC, Fidel PL Jr, Palmer GE. ERG2 and ERG24 are required for normal vacuolar physiology as well as Candida albicans pathogenicity in a murine model of disseminated but not vaginal candidiasis. Eukaryot Cell. 2015 Jul 31. pii: EC.00116-15. [ Links ]