Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nova
versión impresa ISSN 1794-2470
Nova vol.13 no.24 Bogotá jul./dic. 2015
Artículo de revisión
Bacterias anaerobias: procesos que realizan y contribuyen a la sostenibilidad de la vida en el planeta
Anaerobic bacteria: processes they perform and their contribution to life sustainability on the planet
Lucia Constanza Corrales MSc1, Diana Marcela Antolinez Romero2, Johanna Azucena Bohórquez Macías2, Aura Marcela Corredor Vargas2
1 Docente investigadora. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
Correspondencia: lcorrales@unicolmayor.edu.co
Recibido: 09/01/2015 Aceptado: 08/06/2015
Resumen
Objetivo. Se realiza una revisión sobre los aspectos degradativos de materia orgánica, obtención de energía y nutrientes de las bacterias anaerobias. La importancia de estos microorganismos es el papel que desempeñan en los procesos que contribuyen al mantenimiento de la vida misma. Dentro del metabolismo para la descomposición de macromoléculas, estos microorganismos realizan varios procesos: hidrólisis, acetogénesis y metanogénesis, entre otros, cobija reacciones que se realizan dependiendo de las características particulares de la bacteria y de las funciones que cumplen dentro del ciclo degradativo, para la obtención de nuevos productos dependiendo de las rutas bioquímicas o procesos fermentativos que allí se desarrollan.
Palabras clave: bacterias anaerobias, rutas bioquímicas, hidrólisis, acetogénesis, metanogénesis.
Abstract
Objective. A review of the degradation aspects of organic matter, obtaining energy and nutrients from anaerobic bacteria is performed. The importance of these organisms is the role they play in the processes contributing to the maintenance of life itself. Within the metabolism for the decomposition of macromolecules, these microorganisms perform several processes: hydrolysis acetogenesis and methanogenesis, among others, it covers reactions performed depending on the particular characteristics of the bacteria and of the roles in the degradative cycle for development of new products depending on the biochemical pathways or fermentation processes that take place there.
Keywords: anaerobic bacteria, biochemical pathways, hydrolysis, acetogenesis, methanogenesis.
Introducción
Las bacterias anaerobias cuentan con un metabolismo que genera su energía a partir de sustancias que carecen de oxígeno, lo hacen generalmente a través de procesos de fermentación, aunque en ocasiones, como en el caso de las que se encuentran en grietas hidrotermales marinas a grandes profundidades, que lo hacen mediante reacciones que emplean compuestos químicos inorgánicos.
Estudios estiman que la vida se inició en el planeta hace unos 3800 millones de años; durante los primeros 2000 a 2500 millones de años estuvo poblado exclusivamente por comunidades bacterianas, que a través de su evolución lograron cambiar las condiciones de la tierra, favoreciendo así, la posterior aparición de formas de vida más complejas (1). Además, la diversificación evolutiva de las bacterias condujo a la aparición de las formas de nutrición que hoy existen. La actividad secuencial y acompasada de las bacterias fotosintéticas, heterótrofas, saprofitas y quimiosintéticas permitió y permite que la materia se recicle y pueda seguirse utilizando indefinidamente (2). El desarrollo de todas estas formas de nutrición tuvo, por tanto, como consecuencia un hecho trascendental: se cerraron los ciclos biogeoquímicos del planeta, con lo que la vida pudo perpetuarse a expensas de la energía solar (1,3,4).
Muchos consideran a las bacterias como organismos insignificantes y carentes de interés, manejando un discurso referido a ver en ellas un conjunto de agentes infecciosos a los que hay que combatir porque hacen daño (1). Sin embargo, la comunidad científica ha comenzado a tener una mirada diferente acerca del mundo bacteriano, ya que se conocen los procesos metabólicos que desarrollan y las aplicaciones de estos para el beneficio de la sostenibilidad de la vida y finalmente se comprende que tienen mucho que enseñar, por algo son los habitantes más viejos de la Tierra.(3) El hecho de que hayan sido capaces de sobrevivir a todas las grandes catástrofes planetarias, que han acarreado la extinción masiva de muchas especies de mayor tamaño y, en apariencia, de mayor capacidad e importancia, hace volver sobre la grandeza y complejidad de estos seres tan pequeños (2,4).
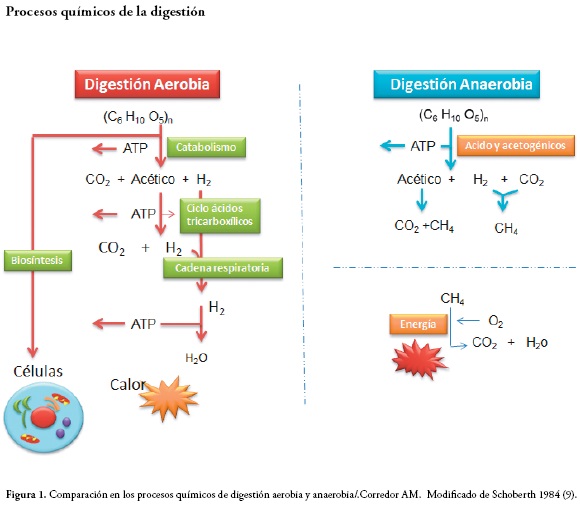
La actividad metabólica de los diversos grupos bacterianos da lugar a la formación de distintos microambientes en los que cada grupo va a encontrar los más adecuados a sus necesidades y va a estar protegido de factores ambientales potencialmente tóxicos (altos niveles de oxígeno, alta intensidad de luz, exposición a la radiación ultravioleta, desecación, estrés osmótico etc.). Estas asociaciones facilitan el intercambio de nutrientes, gases y metabolitos, y reflejan un estilo de vida mutualista y sinérgico, donde el crecimiento, la reproducción y los ciclos biogeoquímicos son llevados a cabo de forma más eficiente que en poblaciones aisladas (2,3). En la Figura 1 se hace una diferenciación de los diferentes procesos de digestión que puede llevar una bacteria siendo aerobia o anaerobia.
La vida en comunidad permite que los desechos, que genera un grupo de bacterias, se conviertan en nutrientes y posibilite condiciones ambientales aptas para el desarrollo de otros grupos bacterianos. Con frecuencia se observa que estas comunidades, que están en todos los espacios naturales, se disponen en láminas estratificadas, en las que las bacterias fotosintéticas, productoras de oxígeno y materia orgánica como las cianobacterias, se sitúan en la parte superior con mayor exposición a la luz solar; debajo de éstas se sitúan las bacterias heterotróficas aerobias, consumidoras de oxígeno y materia orgánica, y las bacterias quimioautotróficas, que necesitan oxígeno para oxidar los compuestos, como el amonio, de donde obtienen la energía necesaria para sintetizar su propia materia orgánica (5). La actividad de estas bacterias, que consumen oxígeno, origina condiciones anaerobias en las capas más profundas, donde van a residir los distintos grupos de bacterias anaerobias (6).
Procesos metabólicos de las bacterias anaerobias
El proceso fermentativo de las bacterias anaerobias comprende una serie de procesos, que interactúan entre sí, en una serie de reacciones metabólicas complejas en ausencia de oxígeno, haciendo parte importante de los ciclos biogeoquímicos del Carbono, Nitrógeno y Azufre, entre otros (7). Estos procesos metabólicos se han divido en 3 grupos o etapas principales: 1) Hidrólisis y fermentación, 2) Acetogénesis y 3) Metanogénesis; la primera etapa del proceso involucra la hidrólisis de sólidos insolubles, es decir partículas orgánicas (celulosa o hemicelulosa) o coloides orgánicos (proteínas), en compuestos solubles simples que pueden ser absorbidos a través de la pared celular, para que posteriormente, dichas moléculas hidrolizadas sean catalizadas por bacterias fermentativas en alcoholes y ácidos grasos, teniendo como resultado de este proceso, la producción de hidrógeno y dióxido de carbono. Luego, durante la Acetogénesis, se produce ácido acético a través de la oxidación de ácidos grasos de cadena corta o alcoholes o a través de la reducción del CO2, usando hidrógeno como donador de electrones para la reacción (7). El último paso que corresponde a la Metanogénesis, es llevada a cabo por arqueas las cuales obtienen su energía de la conversión de un número restringido de sustratos a metano (8).
Procesos químicos de la digestión
La digestión anaerobia es una fermentación microbiana en ausencia parcial o total de oxígeno que da lugar a una mezcla de gases, en los cuales principalmente se encuentra el metano y el dióxido de carbono. El producto principal obtenido de la digestión anaerobia es el biogás, mezcla gaseosa de metano en una proporción de 50 a 70% y dióxido de carbono (CO2) de 30 a 50%, con pequeñas cantidades de otros componentes como nitrógeno (N), oxígeno (O2), hidrógeno (H), sulfuro de hidrógeno (H2S), estos valores dependen tanto de los microorganismos que se encuentren presentes como del proceso en sí (9,10).
Los procesos en donde las bacterias anaerobias hacen degradación se llevan a cabo en ausencia de oxígeno (O2). Los microorganismos trabajan en serie o grupo donde degradan la materia orgánica a través de etapas sucesivas, cada una desencadenando la siguiente etapa (7). Los microorganismos anaerobios de importancia clínica obtienen principalmente su energía mediante la utilización de las vías fermentativas, en donde los compuestos orgánicos como los ácidos y alcoholes, entre otros, sirven básicamente como aceptores finales de electrones (11).
Elementos en la digestión
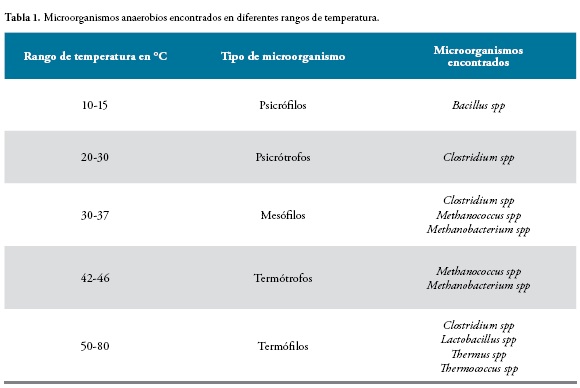
Para que las bacterias puedan realizar estos procesos deben verse condicionadas por algunos factores físicos y químicos, que posibilita su adecuado desarrollo, estos factores son: cargas de materia orgánica, ácidos grasos volátiles, temperatura, alcalinidad, nutrientes y presencia de N y P, entre otros (12). La presencia de materia orgánica y la temperatura son fundamentales para el metabolismo de las bacterias. Este último aspecto es un factor condicionante en las interacciones biológicas y de supervivencia que desarrollan las bacterias. En la Tabla 1. se muestra los diferentes rangos de temperatura y algunos microorganismos anaerobios facultativos y anaerobios estrictos que hacen parte en cada uno de éstos (12, 13).
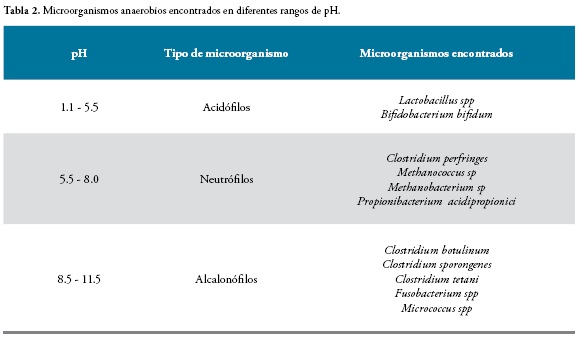
Por otro lado, el pH influye en el crecimiento bacteriano, casi todas las bacterias muestran un crecimiento óptimo en un intervalo de pH de 6.5 - 7.5, en la tabla 2 se muestran las escalas de pH y microorganismos anaerobios asociados a estos (13).
Durante el proceso anaerobio, hay ciertos factores que pueden afectar el pH en una reacción, como por ejemplo el ácido carbónico y los ácidos volátiles. Generalmente los rangos de pH de las bacterias están entre 6.0 y 7.5 y la capacidad que tiene el buffer, se muestra de una forma dependiente del sistema gas carbónico/alcalinidad, el cual, en equilibrio con la disociación del ácido carbónico, tiende a regular la concentración del ion hidrógeno así:
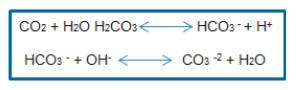
La capacidad buffer de los ácidos grasos volátiles sobre la alcalinidad ocurre en una franja de pH entre 3.75 y 5.75, siendo por tanto de poca importancia en un proceso anaerobio (14).
Los nutrientes que utilizan las bacterias generalmente son tomados del ambiente en donde se desarrollan, por lo cual se dice que éstos son tomados de la materia orgánica o inorgánica en donde se encuentren, por eso las bacterias anaerobias pueden crecer en presencia de N, P, S, C, entre otros compuestos (14). Como se ha mencionado anteriormente las bacterias interactúan entre sí en una serie de reacciones metabólicas en ausencia de oxígeno, haciendo parte importante de los diferentes ciclos biogeoquímicos.
Bacterias sulfatoreductoras
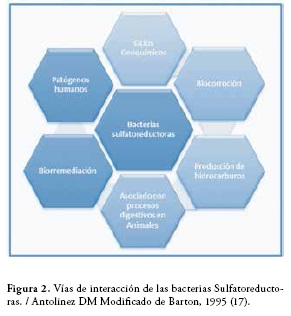
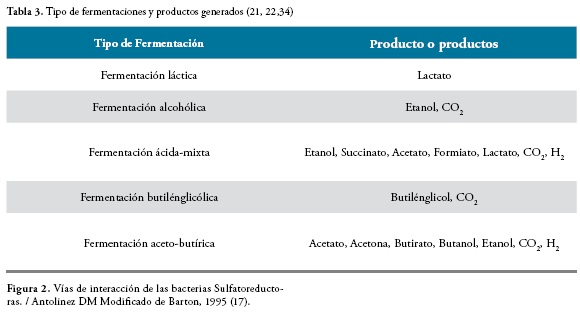
Las bacterias sulfatoreductoras son organismos anaerobios que pueden utilizar los sulfatos como aceptores finales en la respiración, reduciéndolo sin asimilarlo. Los sulfatos son las sales o los ésteres del ácido sulfúrico, contienen como unidad común un átomo de azufre en el centro de un tetraedro formado por cuatro átomos de oxígeno (15). Estas bacterias se pueden adaptar a diferentes lugares o situaciones y pueden ser encontradas en numerosos ambientes terrestres y acuáticos en los cuales se ha disminuido el oxígeno debido a la descomposición aeróbica de la materia orgánica, esta adaptación de las bacterias en los diferentes ambientes se ve reflejada en las vías de interacción, Figura 2. En estos ambientes anaeróbicos, bacterias fermentadoras pueden extraer energía de las grandes moléculas orgánicas, dando como resultado pequeñas moléculas tales como ácidos orgánicos y alcoholes que son oxidados por acetógenos y metanógenos (16).
Estas bacterias se encuentran principalmente en ambientes anóxicos ricos en sulfatos. Han sido descubiertas en suelos, lodos de estuarios, en aguas dulces, de alcantarillado y marinas, salobres, termales y áreas geotermales, depósitos de sulfuro, en pozos petroleros y de gas, y en el intestino de mamíferos e insectos, las bacterias reductoras de sulfato son comunes en entornos anaeróbicos en los que ayudan en la degradación de la materia orgánica (17).
Fases de la digestión anaerobia
Hidrólisis
La hidrólisis es la descomposición biológica de polímeros orgánicos en moléculas más pequeñas (monómeros y dímeros) que son capaces de atravesar la membrana celular, este proceso se lleva a cabo por medio de enzimas denominadas hidrolasas, capaces de solubilizar la materia orgánica y romper enlaces específicos con ayuda de agua para poder ser utilizadas (18).
La degradación anaerobia principalmente se da en polímeros como celulosa y hemicelulosa, con la participación de enzimas celulasas. De esta enzima se conocen tres tipos: endocelulasa, encargadas de romper los enlaces 1,4-β glucosídicos internos del polímero para convertirlo en moléculas más pequeñas; exocelulasas encargadas de romper los enlaces 1,4-β glucosídicos de los polímeros reducidos por las endocelulasas obteniendo tetrámeros o dímeros y por último, las celobiasas o β-glucosidasas las cuales hidrolizan las moléculas resultantes de la última hidrolisis en dos moléculas de glucosa (8).
Dentro de las bacterias anaerobias que participan en las fases de hidrólisis y acidogénesis se encuentran Peptostreptococcus, Propionibacterium, Bacteroides, Micrococcus y Clostridium que interactúan con algunas bacterias de la familia Enterobacteriaceae (19).
Fermentación anaerobia
La fermentación anaeróbica incluye un complejo número de microorganismos con diferentes características y capacidades, durante el proceso de producción del metabolito los productos finales son sustancias orgánicas, por ejemplo, ácido láctico, ácido propiónico, ácido acético, butanol, etanol y acetona. En los procesos anaerobios los microorganismos producen mucho menos energía que en los aerobios, y para suplir sus necesidades de energía metabolizan una mayor cantidad de azucares y por consiguiente elaboran una mayor cantidad de metabolitos. Estos microorganismos llevan a la producción de metano en la última etapa del proceso de digestión anaerobia. Las bacterias productoras del biogás son estrictamente anaeróbicas y por lo tanto sólo podrán sobrevivir en ausencia total de oxígeno atmosférico (20).
En esta etapa, principalmente, los productos de la hidrolisis son convertidos en ácidos orgánicos, y en la fermentación como paso siguiente a la hidrólisis el material orgánico soluble es transformado en acetato, ácidos grasos de cadena corta, alcoholes, hidrógeno y dióxido de carbono (8). Las bacterias anaerobias fermentativas utilizan rutas catabólicas de polisacáridos, aminoácidos y glicerol para la producción de glucosa, la cual puede ser utilizada en las rutas de fermentación alcohólica, láctica y acética. Como resultado de esta fermentación se obtienen alcoholes y ácidos grasos (21).
Entre los principales productos de la fermentación de carbohidratos se encuentran los ácidos grasos volátiles. Estos son importantes intermediarios para la producción de metano y su concentración es muy importante para la eficiencia de la Metanogénesis (21).
Procesos fermentativos
Fermentación alcohólica
Es el tipo de fermentación más antigua que se conoce, es un proceso biológico que se lleva a cabo en ausencia de O2, originado por la actividad de algunos microorganismos. Produce etanol a partir de glucosa, aunque otras bacterias también producen alcohol, éste es elaborado por otras vías (23). Lafermentación alcohólicaes unproceso biológicodefermentaciónen plena ausencia deaire(oxígeno-O2), originado por la actividad de algunos microorganismos que procesan loshidratos de carbono(por regla general azúcares de tipo hexosa: como por ejemplo laglucosa, lafructosa, la sacarosa para obtener como productos finales: unalcoholen forma deetanolcuya fórmula química es:(CH3-CH2-OH), dióxido de carbono (CO2) en forma degasy unas moléculas deATP que consumen los propios microorganismos en sumetabolismocelular energético anaeróbico (24).
La reacción de fermentación se representa por la siguiente ecuación:
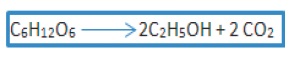
La fermentación alcohólica tiene como finalidad biológica proporcionar energía anaeróbica a partir de la glucosa a losmicroorganismosunicelulares(levaduras) en ausencia deoxígeno (24).
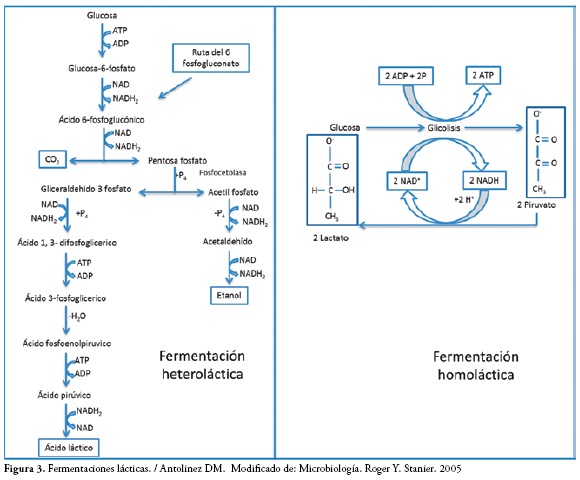
Fermentación heteroláctica
En esta fermentación, su producto final no es exclusivamente el ácido láctico, como lo es la fermentación homolactica, Figura 3. En este tipo de fermentación se pueden producir otros productos finales como ácido acético y ácido fórmico generados por bacterias del género Bifidobacterium (25). Las bifidobacterias son un grupo predominante de la microflora del colon que puede representar hasta el 25% del número total de bacterias presentes (26, 27). Debido a su naturaleza heterofermentativa, las bifidobacterias pueden producir ácido láctico y etanol, así como varios ácidos grasos de cadena corta tales como ácido acético y ácido fórmico.Algunos investigadores también mencionan la producción de pequeñas cantidades de dióxido de carbono y ácido succínico (28).
La reacción se representa por la siguiente ecuación:

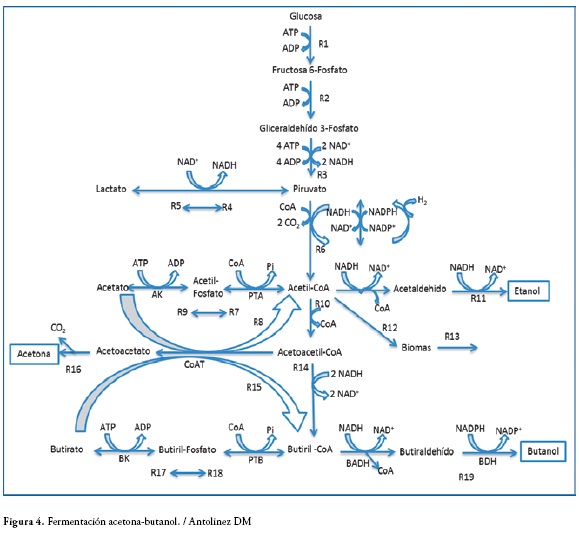
Fermentación acetona-butanol
Es una variación de la fermentación ácido-mixta, figura 4, en la que también se forman butanol, etanol, acetona e isopropanol, esta es una característica de algunas especies del géneroClostridium (29). La ruta metabólica para la producción de acetona-butanol-etanol está dada en dos diferentes fases, pero que tienen ciertas características de la fermentación que son nombradas comúnmente como fases de acidogénesis y solventogénesis. La primera fase está comprendida por la formación de ácido acético, butírico y ATP durante el crecimiento exponencial de las células. A este le sigue una fase otra donde el crecimiento va a ser estacionario, es en esta parte del proceso en que la solventogénesis toma lugar, los ácidos son asimilados, y la acetona-butanol-etanol aparecen como metabolitos secundarios (30).
Las enzimas PTA: Fosfotransacetilasa; AK: Acetatokinasa; CoAT: CoA transferasa; PTB: Fosfotransbutirilasa; BK: Butirato kinasa; BADH: Butiraldehido deshidrogenasa; BDH: Butanol deshidrogenasa.
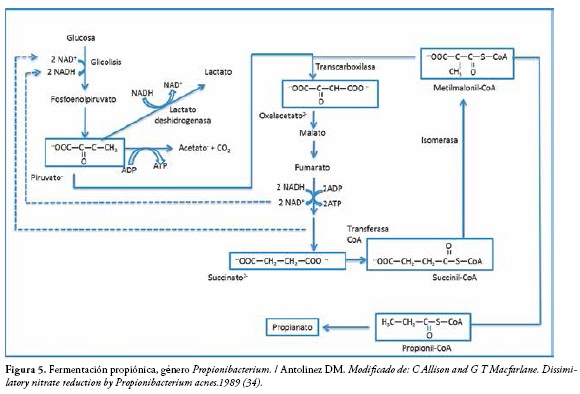
Fermentación propiónica
Los productos principales de esta fermentación son ácido propiónico, ácido acético, ácido succínico y dióxido de carbono, como se muestra en la Figura 5. Es característica de las bacterias del género Propioni bacterium,Veillonellay Clostridium propionicum, que pueden producir ácido propiónico utilizando el ácido láctico como sustrato, y algunas también a partir de polialcoholes, aminoácidos y otros ácidos orgánicos distintos al ácido láctico (31).
Los mecanismos de la fermentación propiónica de las hexosas se hace de dos maneras:
· Hexosas → ácido láctico → ácido propiónico
· Hexosas → ácido pirúvico → ácido propiónico (32).
En este proceso fermentativo la mayoría de bacterias presentes son del géneroPropionibacterium, aunque también participan otras bacterias anaerobias estrictas, las cuales realizan principalmente fermentación secundaria de los productos de las fermentaciones lácticas primarias. Pueden fermentar la glucosa y glicerol para producir ácido propiónico y ácidos acético y succínico como dos subproductos (33).
Su ecuación fundamental es la siguiente:

Fermentación del ácido butírico
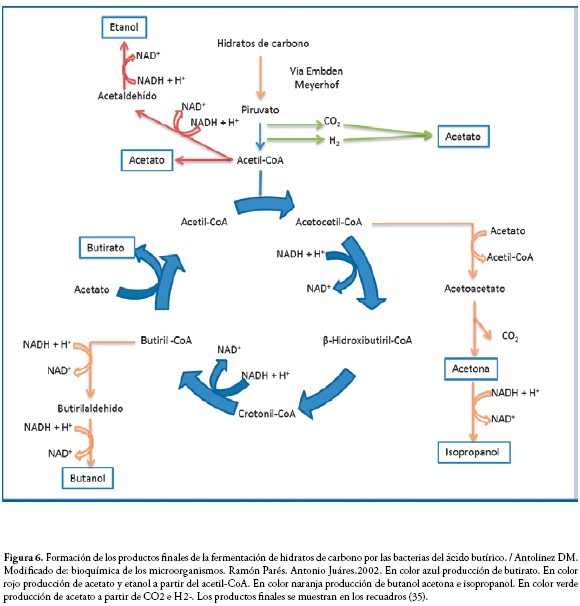
Se presenta generalmente en bacterias del género Clostridium. Si bien hasta ahora la referencia ha sido la fermentación de hidratos de carbono como procedimiento para obtener energía, sin embargo, se debe mencionar que otros compuestos orgánicos pueden ser fermentados, por ejemplo: aminoácidos (alanina, glicina) (24,35). En la Figura 6 se muestra el proceso de la fermentación butírica y la obtención de los productos finales.
En color azul producción de butirato. En color rojo producción de acetato y etanol a partir del acetil-CoA. En color naranja producción de butanol acetona e isopropanol. En color verde producción de acetato a partir de CO2 e H2-. Los productos finales se muestran en los recuadros (35).
Acetogénesis
Esta es una fase en la cual se aceleran los procesos metabólicos bacterianos, con transformación enzimática o hidrólisis, de lípidos, polisacáridos, proteínas y ácidos nucleicos, en otros compuestos que serán utilizados como fuentes de energía y como transformación a carbono celular (36).
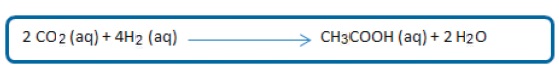
En la acetogénesis, los ácidos grasos volátiles se convierten en ácido acético, dióxido de carbono e hidrógeno. El ácido acético es producido por dos diferentes mecanismos: acetogénesis por hidrogenación, en la cual se produce acetato (CH3COO-) como producto final de la reducción de dióxido de carbono (CO2) más hidrogeno (H) y la acetogénesis por deshidrogenación en donde las bacterias son inhibidas por pocas cantidades de oxígeno (O2) y por lo tanto solo sobreviven en asociaciones con microorganismos que consumen hidrogeno como las bacterias homoacetogénicas (fermentación láctica) y bacterias sulfato reductoras.
Las bacterias homoacetogénicas son microorganismos anaerobios estrictos los cuales catalizan la formación de acetato a partir de hidrogeno (H) y dióxido de carbono (CO2). La reducción del dióxido de carbono en todos los homoacetógenos se produce por la ruta de la acetil-CoA, esta ruta también es útil para la fijación de carbono por las bacterias sulfatoreductoras y la fermentación de homoacetógenos para producir acetato como producto final (8).
Dentro de los géneros más sobresalientes de las bacterias homoacetogénicas se encuentran Clostridium aceticum, Clostridium formicoaceticum y Acetobacterium wooddi (19,37,43)
Metanogénesis
La metanogénesis es la etapa final de la digestión anaerobia. La formación de metano se da a partir de dos rutas principales la primera es la acetoclástica en la cual los microorganismos crecen principalmente en su sustrato (acetato) y la segunda es la hidrogenotrófica en donde los microorganismos crecen en sustratos como hidrógeno (H) y dióxido de carbono (CO2). Su metabolismo se caracteriza por integrar las vías biosintéticas y bioenergéticas para la producción de ATP, además en ausencia de hidrógeno, oxidan compuestos para la obtención de electrones (35).
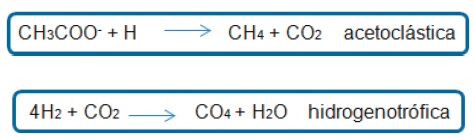
El producto final es el metano (CH4) y el aporte de la vía hidrogenotrófica es del 27 al 30 % y por la vía acetoclástica es del 70% (39).
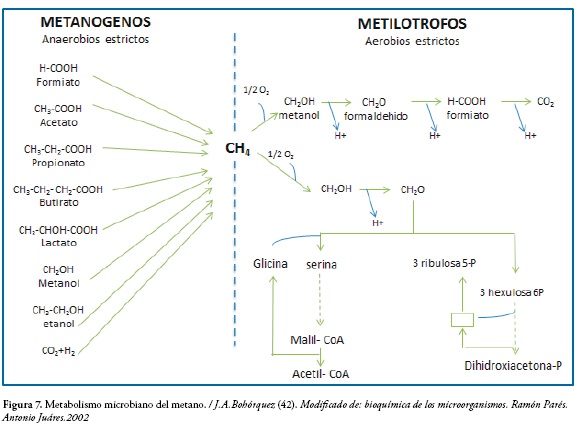
Por otro lado, las bacterias metanogénicas pueden ser consideradas como las más importantes dentro del consorcio de microorganismos anaerobios ya que tienen la capacidad de producir gas metano (CH4) a través de la conversión de substratos monocarbonados o con átomos de carbono unidos por un enlace covalente como el acetato, H2, CO2, formato, metanol y algunas metilaminas, figura 7 (40). Existen otras formas que permiten la metanogénesis, esto depende de los sustratos que se utilicen o se encuentren en el ambiente, puede ser a partir de ácidos orgánicos, alcoholes y pequeñas moléculas que son utilizadas por los anaerobios estrictos, así como el metano puede ser el sustrato de diferentes microorganismos entre ellos los aerobios estrictos (41).
En el gráfico se observa la oxidación de CO2 que se observa de color azul, mientras que la formación de esqueletos carbonados tiene lugar asimilando el formaldehido, que puede ser por la vía de la serina (izquierda) o bien por el ciclo de la rubilosa monofosfato (derecha). La caja en esta vía representa reacciones catalizadas por aldosas y trancetolasas (42).
El análisis del ARNr 16S ha permitido identificar aproximadamente unas 90 especies de metanógenas distribuidas en 5 clases distintas:Methanobacteria, Methanococci, Methanomicrobiota, Methanopyri y Methanosarcinales. Estas bacterias abundan en ambientes donde se encuentran aceptores de electrones tales como O2, NO3-, Fe3+, y SO4 2-. Se encuentran en hábitats típicos como digestores anaerobios, sedimentos anóxicos, suelos de humedales y tractos gastrointestinales (42).
Los organismos metanogénicos se clasifican dentro del dominio Archaea, y, morfológicamente, pueden ser bacilos cortos y largos, cocos con diferentes asociaciones celulares, células en forma de placas y metanógenos filamentosos, existiendo tanto Gram positivos como Gram negativos dependiendo del sustrato sobre el que crecen, se pueden dividir en tres clases principales: los que usan un sustrato de tipo CO2; las que utilizan un sustrato de tipo metilo ó un sustrato de tipo acetato, a partir de los cuales obtienen energía por medio del proceso denominado metanogénesis (43).
En el primer paso de este proceso, suponiendo que se usa un sustrato CO2, interviene una coenzima llamada metanofurano que realiza la reducción del CO2a formilo. En el siguiente paso la metanopterina se une al C1de dicho formilo y lleva a la futura molécula de metano desde su estado de formilo hasta metilo, realizándose en el proceso una serie de reducciones por la coenzima F420, quien transporta electrones obtenidos del H2para producir dicha reducción a metilo (8).
Después, es la coenzima M quien interviene sobre el grupo metilo, que es reducido a metano, en el último paso de la metanogénesis, con la intervención del complejo enzimático reductasa metil-F430 y la coenzima B. Este proceso es enlazado con la síntesis de compuestos orgánicos por medio de un corrinoide al que la metanopterina cede el grupo metilo en lugar de hacerlo a la coenzima M, por lo que la bacteria ahorra en enzimas, rutas y energía. La reacción de producción de metano es fuertemente exoenergética, y la emplean como fuente de energía (44).
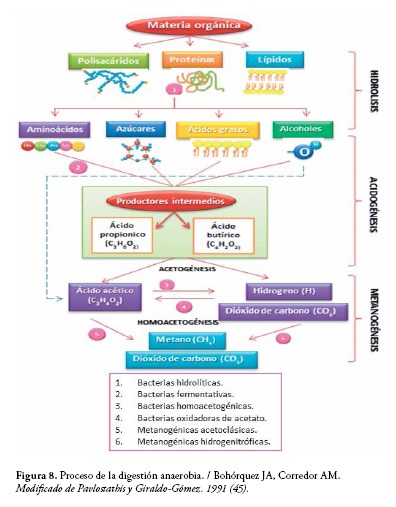
En la figura 8 se muestran varios microorganismos anaerobios estrictos y algunos facultativos que participan en cada uno de los procesos de las diferentes fases de la digestión anaerobia.
- Fase no metanogénica: Bacteroides sp, Clostridium sp, Bifidobacterium sp, Sphaerophorus sp, Fusobacteium sp, Veillonella sp, Peptococcus sp, Desulfovibrio sp. y otros como: Lactobacillus sp, Actinomyces sp, Corynebacterium sp, Micrococcus sp, Spirillum sp, Sarcina sp (10).
- Fase metanogénica: Bacteroides sp, Clostridium sp, Bifidobacterium sp, Sphaerophorus sp, Fusobacteium sp, Veillonella sp, Peptococcus sp, Desulfovibrio sp. y otros como: Methanobacterium sp, Methanococcus sp, Methanospirillum sp, Methanobrevibacter sp, Methanomicrobium sp (46).
Bacterias sintróficas
Dentro del metabolismo de la digestión anaerobia existen grupos de bacterias sintróficas cuya principal característica es la unión de varias especies para realizar una reacción química. Existen 4 categorías de bacterias que participan en los pasos de conversión de la materia hasta moléculas sencillas como metano o dióxido de carbono y que van cooperando de forma sinérgica, estas son:
Grupo 1: Bacterias hidrolíticas. Son un conjunto de bacterias cuya finalidad es romper los enlaces complejos de proteínas, celulosa, lignina o lípidos en monómeros o moléculas como aminoácidos, glucosa, ácidos grasos y glicerol, los cuales pasan al siguiente grupo de bacterias. En este proceso participan principalmente Clostridium y Bacteroides (47).
Grupo 2: Bacterias fermentativas acidogénicas. Las cuales se encargan de convertir azúcares, aminoácidos y lípidos en ácidos orgánicos, alcoholes y cetonas, acetato, CO2 y H2, siendo Clostridium el microorganismo que se encuentra principalmente realizando este proceso, aunque Lactobacillus y Bacillus, también lo hacen (47).
Grupo 3: Bacterias acetogénicas. Estas solo se desarrollan como productoras de H2 junto a otras bacterias consumidoras de este. Syntrophobacter wolinii, especializada en la oxidación de propionato, y Syntrophomonas wolfei, que oxida ácidos grasos de 4 a 8 átomos de carbono, convierten el propiónico, butírico y algunos alcoholes en acetato, hidrógeno y dióxido de carbono, el cual se utiliza en la metanogénesis (47).
Grupo 4: Bacterias metanógenicas: son aquellas bacterias capaces de generar gas metano como última fase de la digestión anaerobia descrita anteriormente (45,47).
Otros procesos metabólicos
Metabolismo del nitrógeno
Los microorganismos actúan sobre el nitrógeno mediante: las proteinasas y peptidasas, las cuales hidrolizan las proteínas a péptidos y aminoácidos libres; los aminoácidos libres son utilizados directamente para la síntesis de proteínas y constituyentes celulares como la pared celular y ácidos nucleicos; los aminoácidos son también catalizados a ácidos grasos volátiles, otros ácidos, CO2 y amoníaco; la urea es hidrolizada a amoníaco por acción de la ureasa; los nitratos son reducidos a amoníaco y el amoníaco se utiliza en la síntesis de los componentes celulares microbianos como las proteínas, entre otros (48).
Todas las bacterias no tienen la misma capacidad para degradar por la vía anaerobia proteínas, peptonas, polipéptidos y aminoácidos. Las que tienen esta propiedad se denominan bacterias putrefactivas porque a menudo generan productos de olor desagradable. Las bacterias putrefactivas son las que pueden llevar a cabo la degradación catabólica de compuestos nitrogenados en condiciones anaeróbicas y con frecuencia, las sustancias resultado del proceso pueden suministrar el carbono y el nitrógeno necesarios para su desarrollo (48).
Las bacterias putrefactivas son sobre todo especies del género Clostridium, como C. botulinum, C. perfringens, C. sporongenes, C. tetani y C. tetanomorphum. Además de éste género encontramos otras especies putrefactivas pertenecientes a grupos taxonómicos distintos, como la de los géneros Fusobacterium, Streptococcus, Micrococcus y Proteus (48).
Las bacterias putrefactivas son alcalófilas y a su vez tienden a alcalinizar los medios de cultivo, debido a que se libera amoniaco con formación de ácidos débiles, o se liberan bases orgánicas. Es conocido el hecho de que los organismos fermentadores y los putrefactivos son antagónicos y que, una vez que se ha desarrollado uno de ellos en un medio, difícilmente puede desarrollarse el otro (49).
Las macromoléculas proteicas no pueden penetrar dentro de la célula bacteriana, por esto muchas de ellas se liberan al medio, donde enzimas que las hidrolizan las transforman en aminoácidos o en péptidos de bajo peso molecular, con mayor facilidad para ingresar. Estas enzimas proteolíticas son endopeptidasas y exopeptidasas; las primeras rompen la cadena polipeptídica en cualquier punto con una misma probabilidad, mientras que la segunda sólo lo hace por los extremos. Las exopeptidasas se subdividen en aminopeptidasas, que requieren un grupo amino terminal y son dependientes de un ion metálico para su actividad, y las carboxipeptidasas, que hidrolizan péptidos con un carboxilo terminal. Los aminoácidos y otros compuestos heterocíclicos producto de la hidrólisis de sustancias nitrogenadas más complejas, se consideran los verdaderos sustratos del catabolismo fermentativo de los microorganismos putrefactivos (49).
Fijación del nitrógeno
El nitrógeno es un elemento necesario en la composición de proteínas, ácidos nucleicos y otros componentes celulares, siendo así una molécula esencial para el crecimiento de todos los organismos. Aunque es extremadamente común (80% por volumen) en la atmósfera en forma de gas (N2) es generalmente inaccesible biológicamente debido a su alta energía de activación. Aproximadamente el 78% de atmósfera está formado por N2, sin embargo el nitrógeno atmosférico representa sólo el 1.2% del nitrógeno que hay sobre el planeta. Se debe tener en cuenta que el nitrógeno lo podemos encontrar presente en rocas y minerales, que representan un 98% aproximadamente del total del nitrógeno que hay en la Tierra (50).
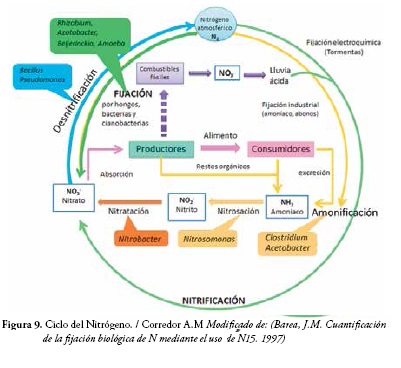
El proceso por el cual los microorganismos reducen el nitrógeno hasta una forma utilizable se conoce como fijación biológica del nitrógeno (FBN) Figura 9. La reducción del nitrógeno atmosférico es un proceso bastante complejo porque requiere un gran aporte de energía para reducirse. El nitrógeno está compuesto de dos átomos de nitrógeno los cuales están unidos por un triple enlace covalente, con lo que la molécula se vuelve altamente inerte y no reactiva.Los organismos responsables de la fijación de nitrógeno contienen la enzima nitrogenasa y se llaman diazótrofos. La nitrogenasa cataliza la ruptura de esta unión y adiciona tres átomos de hidrógeno a cada átomo de nitrógeno.Los microorganismos que fijan el nitrógeno requieren 16 moles de adenosin trifosfato (ATP) para reducir cada mol de nitrógeno (51).
En toda la naturaleza, solamente las bacterias especializadas son capaces de realizar la fijación de nitrógeno, convirtiéndolo en amoniaco (NH3) que es asimilado fácilmente por todos los organismos. Estas bacterias, por lo tanto, son muy importantes ecológicamente y son a menudo esenciales para la supervivencia de ecosistemas grandes. Esto es especialmente cierto en el océano, en donde las Cyanobacterias fijadoras de nitrógeno son a menudo las únicas fuentes de nitrógeno. También es muy importante en el suelo, existiendo simbiosis especializadas entre legumbres y bacterias fijadoras de nitrógeno, imprescindibles para el crecimiento de estas plantas (52).
La fijación de nitrógeno se puede encontrar en varios géneros bacterianos y en otros microorganismos pero no es universal, depende del tipo de microorganismo, el ambiente en el cual se desarrolla y las condiciones para el mismo, además de la presencia de enzimas que les ayudan en los diferentes procesos metabólicos que suceden para llegar finalmente a la fijación. La enzima nitrogenasa, responsable de la fijación de nitrógeno, es muy sensible al oxígeno, por lo que un pequeño contacto con este la inhibirá irreversiblemente, por esto los organismos fijadores de nitrógeno deben contar con mecanismos que le permitan mantener la concentración de oxigeno baja (52).
Los mecanismos utilizados son:
· Heterocistos (célula especializada en la fijación de nitrógeno atmosférico) en los agregados o filamentos celulares en bacterias del género como Cyanobacteria (por ejemplo Anabaena) en donde una célula no realiza la fotosíntesis sino que solamente fija el nitrógeno para sus socias que a cambio la proveen de energía.
· Nódulos en las raíces de las plantas (por ejemplo, Rhizobium), en donde la planta le proporciona oxígeno a la bacteria a través de moléculas de hemoglobina (53).
· Forma de vida anaerobia (por ejemplo, Clostridium pasteurianum).
· Metabolismo muy rápido (por ejemplo, Azotobacter vinelandii) (54).
La producción y actividad de la nitrogenasa se regula muy en detalle, tanto porque la fijación del nitrógeno es un proceso costoso energéticamente (ya que se requieren 16 a 24 ATPs por N2 fijado) como por la sensibilidad extrema de la nitrogenasa al oxígeno (55).
Los microorganismos se han adaptado y han tomado diferentes estrategias para evitar la inactivación de las nitrogenasas. Los mecanismos empleados para integrar la fijación biológica del nitrógeno (FBN) a los requerimientos fisiológicos son diversos y específicos, entre ellos se pueden destacar la evasión del O2 y el desarrollo en ambientes anaeróbicos, la generación de barreras físicas de protección que impidan la difusión del O2 y la eliminación metabólica del O2 para reducir su concentración a niveles aceptables e inocuos cerca de los complejos enzimáticos (55).
Las principales bacterias anaerobias asociadas a este proceso pertenecen a los géneros Thiobacillus, Clostridium, Desulfovibrio, Desulfotomaculum y Methanobacillus y otros anaerobios asociativos como: Agrobacterium, Azospirillum, Azotobacter, Bacillus y Beijerinckia (56).
Oxidación del hierro ferroso
En condiciones anoxigénicas el hierro ferroso puede ser oxidado por bacterias autótrofas anaerobias, y en este caso el hierro es utilizado como donador de electrones para el crecimiento. En ausencia de oxígeno el Fe2+ es estable a pH neutro, al cual se lleva a cabo la fotosíntesis anoxigénica. El descubrimiento de bacterias fotótrofas oxidadoras de Fe2+, permite explicar la evolución de la fotosíntesis y de los grandes depósitos de hierro férrico que están presentes en sedimentos desde hace mucho tiempo, pues parece probable que el ión férrico se formara mediante fotótrofos anoxigénicos que oxidaron el Fe2+ en ambientes anóxicos (43,49,57).
Deshidrogenación
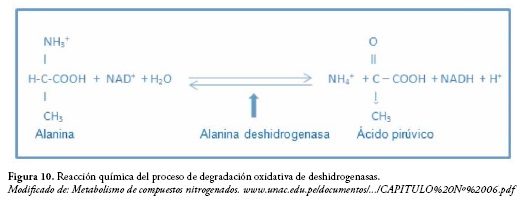
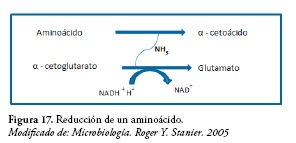
La glutamato deshidrogenasa y la alanina deshidrogenasa son enzimas ligadas al NAD+ o al NADP+ que convierten al respectivo sustrato en ácido α-cetoglutárico y pirúvico y liberan NH3. Para esta reacción el oxígeno no es esencial. Figura 10.
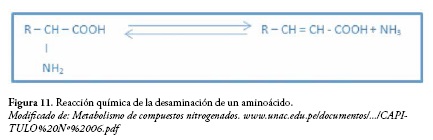
Las bacterias pueden desaminar los aminoácidos de distintas formas. La desaminación por instauración, tiene como producto final un ácido graso insaturado.
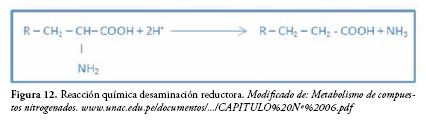
Normalmente, las bacterias anaerobias y facultativas que tienen deshidrogenasas, cuando actúan en ambientes anaerobios, realizan desaminación reductora y pueden utilizar el hidrógeno molecular como reductor.
El compuesto que se obtiene de la desaminación puede ser oxidado por vía anaerobia, para este proceso se necesita un aceptor de electrones estable, el cual puede proveerse libremente, como en la fermentación acoplada de aminoácidos, o puede resultar de la propia degradación metabólica del ácido orgánico. Por ejemplo, en el caso de Clostridium tetanomorphum este hidrógeno da lugar a una desaminación reductora(figura 12). En general, la fermentación de aminoácidos produce ácidos orgánicos, CO2, H2 y NH3 (58).
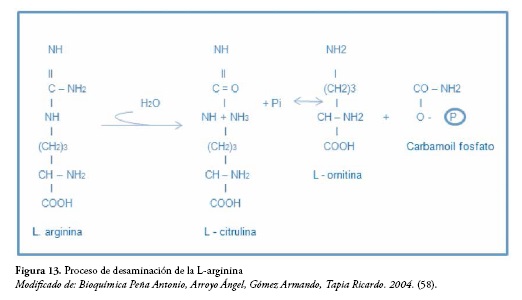
La L-arginina es desaminada en primera instancia por la arginina-desaminasa que la convierte en citrulina y luego la ornitina-carbamoil-transferasa mediante fosfato inorgánico la convierte en ornitina y carbamoil fosfato, figura 13 (58).
El triptófano es fermentado lentamente por Clostridium sporogenes con la formación de ácido indol propionico; Clostridium propìonicum lleva a cabo desaminación de la treonina a acetobutírico por una treonina-deshidratasa; Clostridium pasteurianum utiliza una serina hidroximetiltransferasa, con lo que rompe la treonina en glicina y acetaldehído, este último es reducido a etanol con reoxidación de NAD+.
Procesos metabólicos con aminoácidos
Oxidación de la Lisina
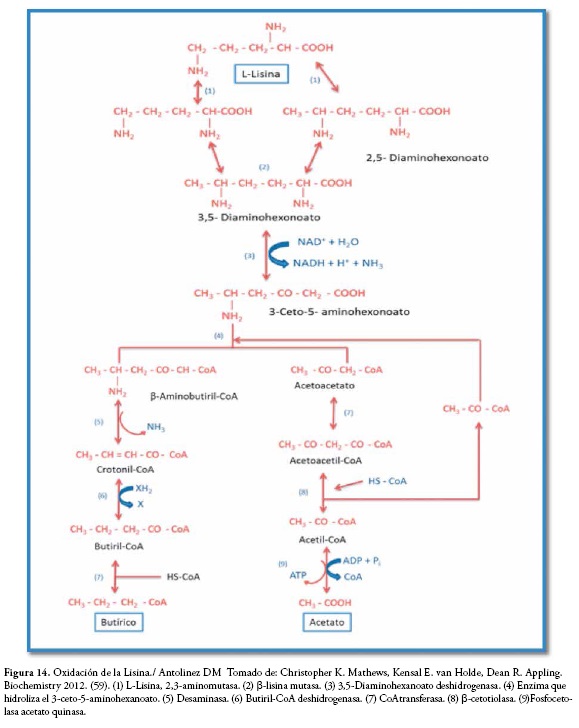
Clostridium sticklandii y otros clostridios utilizan la lisina como única fuente de carbono en condiciones anaerobias, en la cual se requiere la coenzima B12 como cofactor, y se suceden una serie de reacciones hasta la obtención de ácido butírico y acetato. Figura 14, estas reacciones hacen parte de procesos oxido-reducción.
Oxidación de la Ornitina
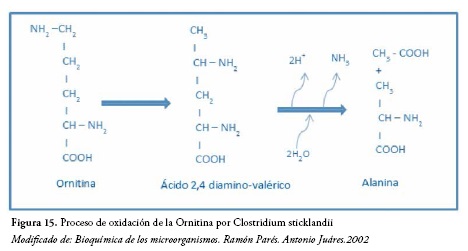
Clostridium sticklandii fermenta la ornitina por una vía parecida a la de la lisina, con la formación de acetato y alanina. Figura 15.
Reacción de Stickland
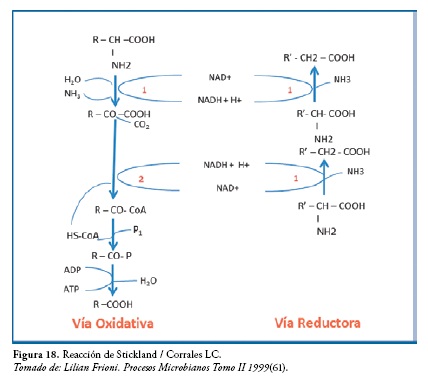
Muchos Clostridium que crecen en medios con hidrolizados de proteínas o con mezclas de aminoácidos obtienen su energía de una reacción de óxido - reducción acoplada entre dos aminoácidos o entre un aminoácido y un compuesto ternario (compuestos formados por tres átomos de distinta naturaleza), como los hidróxidos, los oxoácidos y las oxosales (60).
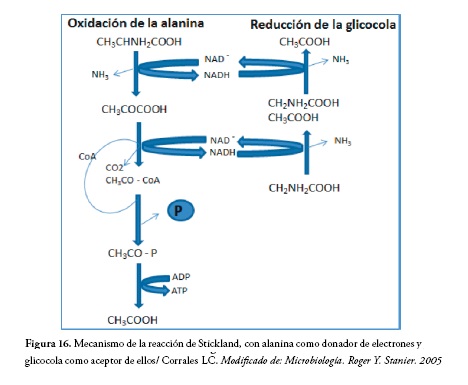
Esta reacción de acoplamiento entre dos aminoácidos, se denomina reacción de stickland y se caracteriza porque los aminoácidos por separado no se descomponen en forma rápida, mientras que la pareja de aminoácidos si lo hace, figura 16. En este caso uno de ellos es oxidado y el otro es reducido. Esta reacción constituye la base en como las bacterias utilizan las proteínas como fuente de energía. En los Clostridium proteolíticos, la fermentación de aminoácidos más característica es la reacción de Stickland (60)
En esta reacción el donador de electrones es la alanina, la cual es desaminada oxidativamente a piruvato, para sufrir luego una ruptura tiolítica dando acetil-CoA y CO2. El ATP se forma mediante la conversión del acetil-CoA en acetato y el NADH es reoxidado por una desaminación reductora de la glicocola a acetato.
Los aminoácidos que actúan como reductores pueden dividirse en tres grupos:
· Aminoácidos alifáticos que son más reducidos que los α cetoácidos (alanina, leucina, isoleucina, norleucina y valina)
· Aminoácidos alifáticos con el mismo grado de oxidación que los α cetoácidos (serina, treonina, cisteina, metionina, arginina, citrulina y ornitina)
· Otros aminoácidos, generalmente menos oxidados que los α cetoácidos (histidina, fenilalanina, triptófano, tirosina, aspartato y glutamato), figura 17.
Las bacterias que utilizan la reacción de Stickland son Clostridium proteolíticos, entre los que se encuentran Clostridium como: C. acetobutvlicum, C. aerofaetidum, C. bifermentans, C. camis , C. botulinum, C. caproicum, C. indolis, C. mitelmani, C. saprotoxicum, C. sordellii, C. sporogenes, C. sticklandii, C. valerianicum, C. ghoni y C. hystoliticum.
En la figura 18, se observa: (1) Sistema de la L-aminoácido deshidrogenasa. (2) Sistema de la 2-cetoacido deshidrogenasa. Requiere lipoamida, TPP y HS - CoA. Si R es un grupo metilo y R un átomo de hidrogeno, entonces el esquema representa la fermentación conjunta de la glicina y de la alanina que proporciona acetato y COâ según la siguiente estequiometria:
La fermentación de alanina y glicina
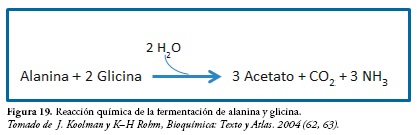
Reacción de Fermentación de un Aminoácido junto a un Cetoácido
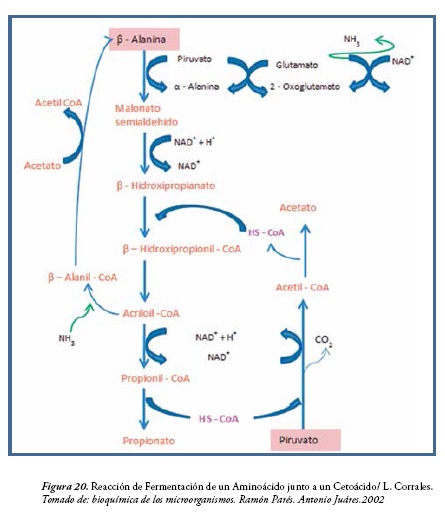
Clostridium propionicum usa la reacción de Stickland para metabolizar la β-alanina a ácido propiónico, utilizando el piruvato como oxidante. El conjunto del sistema degradativo se presenta en la figura 20. Un sistema degradativo similar se encuentra en Clostridium aminobutyricum que convierte α -aminobutirico y como en el caso anterior también se produce acetato (64).
Descarboxilacion de aminoácidos
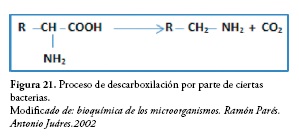
Cierto número de bacterias catalizan la descarboxilación de algunos aminoácidos según la siguiente reacción, figura 21.
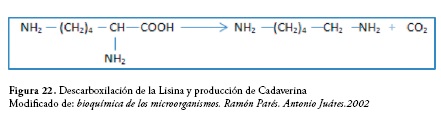
Los aminoácidos más frecuentemente descarboxilados de esta forma son histidina, arginina, ornitina, lisina, triptófano y glutamato. La descarboxilación de la lisina genera cadaverina, sustancia básica de olor muy desagradable, figura 22.
La reacción de descarboxilación se lleva a cabo principalmente en medio relativamente ácido. Las bases producidas tienden a elevar el pH, estas reacciones de descarboxilación de aminoácidos han sido utilizadas por su significación taxonómica (64).
Conclusiones
La vida en la tierra se debe en gran parte a las interacciones bacterianas presentes hoy en día (mutualismo y sinergismo), ya que éstas introdujeron diferentes maneras de supervivencia. Estas interacciones permiten que en el planeta toda materia sea reutilizada, gracias a que las bacterias utilizan diversos compuestos para la obtención de energía necesaria para llevar a cabo todos los procesos biológicos y químicos requeridos para su desarrollo y que les demanda el microambiente en donde se encuentran.
La utilidad del metabolismo de las bacterias anaerobias, y los procesos bioquímicos que realizan, se ve reflejado en diferentes escenarios de la vida en el planeta, principalmente se observa a nivel industrial con la producción de variedad de compuestos, como el metano para la generación de combustibles orgánicos, con el fin de producir energía renovable lo cual contribuye a la conservación del medio ambiente. Así mismo, procesos en los que participan conformando consorcios para el tratamiento y /o recuperación de aguas contaminadas y sobre materias orgánicas para su degradación a fuentes de energía posiblemente renovables.
Los diferentes ciclos biogeoquímicos en los que participan estos microorganismos hacen que las bacterias aerobias puedan desempeñarse adecuadamente, es allí donde se mencionan los procesos fermentativos como el metabolismo de los animales rumiantes donde bacterias metanogénicas contribuyen en la degradación de la materia orgánica y por ende con la nutrición animal. Otros procesos destacados son los de fijación, amonificación o nitrificación que se dan en el ciclo del nitrógeno para que de esta manera pueda ser usado como alimento para las plantas, que a gran escala beneficia la producción de recursos vegetales para consumo humano, animal, industrial y la sostenibilidad del medio ambiente.
Referencias
1. Margulis L, Sagan D. Cuatro mil años de evolución desde nuestros ancestros microbianos. Barcelona: Microcosmos; 1995. [ Links ]
2. Winn (h.), Allen, Janda, Koneman, Procop, Schreckenberger, Woods. Bacterias anaerobias. En: Elmer W. Koneman . Koneman diagnóstico microbiológico texto y atlas en color. 6a ed. Buenos Aires: Editorial Médica Panamericana; 2006. p. 836-897. [ Links ]
3. Hugo Humberto Montoya Villafañe. Microbiología básica para el área de la salud y afines. 2a ed. Medellín- Colombia: editorial universidad de Antioquia; 2008. [ Links ]
4. Lucia Constanza Corrales Ramírez, Sara Lilia Ávila de Navia, Sandra Mónica Estupiñán Torres. Bacteriología Teoría y Práctica. Bogotá- Colombia: Editorial Universidad Colegio Mayor De Cundinamarca; 2013. [ Links ]
5. Eduardo Fernández V. La importancia de lo pequeño. Comunidades bacterianas y sociedad humana. Política y Sociedad [revista en internet]* 2002 [acceso 14 febrero 2014]; 39(3). Disponible en: http://revistas.ucm.es/index.php/POSO/article/view/POSO0202330575A. [ Links ]
6. Pearl H, Pinckney J. A mini review of microbial consortia: their role in aquatic production and biogeochemical cycling. Microbial Ecology [revista en internet]* 1996 [acceso 28 abril 2014]. Disponible en: http://link.springer.com/article/10.1007/BF00171569#page-1. [ Links ]
7. Bernhard schink. Energetics of syntrophic cooperation in methanogenic degradation. Microbiology and molecular biology reviews [revista en internet]* 1997 [acceso 14 febrero 2014]; 61 (2). Disponible en: http://mmbr.asm.org/content/61/2/262.abstract. [ Links ]
8. Almeida A, Nafarrate R, Alvarado A, Cervantes O, Luevanos, Oropeza R, Balagurusamy N. Expresión genética en la digestión anaerobia: un paso adelante en la comprensión de las interacciones tróficas de esta biotecnología. Revista Científica de la Universidad Autónoma de Coahuila [revista en internet]* 2011 [acceso 28 febrero 2014]; 3(6). Disponible en: http://www.posgradoeinvestigacion.uadec.mx/AQM/No.%206/3.html. [ Links ]
9. Schoberth SM. Biomethane, production and uses. En John Wiley & Sons. The microbiology of anaerobic digestion. London: Turret-Weatland; 2003. p. 61-78. [ Links ]
10. Yaniris Lorenzo A, Ma Cristina Obaya A. La digestión anaerobia. Aspectos teóricos. Parte I. ICIDCA. Sobre los Derivados de la Caña de Azúcar [revista en internet]* 2005 [acceso 02 Marzo 2014]; 39(1). Disponible en: http://www.redalyc.org/articulo.oa?id=223120659006. [ Links ]
11. A. González González, F. Cuadros, A. Ruiz-Celma, F. López-Rodríguez. Energy-environmental benefits and economic feasibility of anaerobic codigestion of Iberian pig slaughterhouse and tomato industry wastes in Extremadura (Spain). Elsevier [revista en internet]* 2013 [acceso 02 Marzo 2014]. Disponible en: http://www.sciencedirect.com/science/article/pii/S096085241300254X. [ Links ]
12. Andrea Pérez, Patricia Torres. Índices de alcalinidad para el control del tratamiento anaerobio de aguas residuales fácilmente acidificables. Ingeniería y Competitividad [revista en internet]* 2008 [acceso 10 Marzo 2014]; 10(2). Disponible en: http://webcache.googleusercontent.com/search?q=cache:bs8vvT9B4eMJ:bibliotecadigital.univalle.edu.co/bitstream/10893/1636/1/vol.10%2520no.2%2520art.3.pdf+&cd=2&hl=es&ct=clnk&gl=co. [ Links ]
13. Azeem Khalida, Muhammad Arshadb, Muzammil Anjuma, Tariq Mahmooda, Lorna Dawsonc. The anaerobic digestion of solid organic waste. Elsevier [revista en internet]* 2011 [acceso 10 Marzo 2014]; 31(8). Disponible en: http://www.researchgate.net/publication/51086548_The_anaerobic_digestion_of_solid_organic_waste. [ Links ]
14. Alvaro Andres Cajigas C, Andrea Pérez V, Patricia Torres. Importancia del pH y la alcalinidad en el tratamiento anaerobio de las aguas residuales del proceso de extracción de almidón de yuca. Scientia et Technica [revista en internet]* 2005. [acceso 15 Marzo 2014]; 11(27). Disponible en: http://www.redalyc.org/articulo.oa?id=84911698045. [ Links ]
15. J. R. Torrado Rincón, D. M. Calixto Gómez, A. E. Sarmiento Caraballo, J. H. Panqueva Álvarez. Evaluación del molibdato y nitrato sobre bacterias sulfato-reductoras asociadas a procesos de corrosión en sistemas industriales. Revista argentina de microbiología [revista en internet]* Marzo 2008. [acceso 10 Julio 2015]; 40(1). Disponible en: http://www.scielo.org.ar/scielo.php?pid=S0325-75412008000100012&script=sci_arttext. [ Links ]
16. Alicia Cecilia Decheco E. Metabolismo microbiano. Universidad del callao. 2011. [acceso 10 Marzo 2014]. Disponible en: http://www.unac.edu.pe/documentos/organizacion/vri/cdcitra/Informes_Finales_Investigacion/Octubre_2011/IF_DECHECO%20EGUSQUIZA_FIPA/CAPITULO%20N%BA%2005.pdf. [ Links ]
17. Larry L. Barton, Francisco A. Tomei. Characteristics and activities of sulfate-reducing bacteria. En: Larry Barton. Sulfate-Reducing Bacteria. New York: Biotechnology Handbooks; 1995. p.1-18. [ Links ]
18. Rodríguez Cavallini, Evelyn Gamboa C, María del Mar Gamboa, Francisco Hernández. Bacteriología General: Principios Y Prácticas de Laboratorio. Costa Rica: Editorial Universidad de Costa Rica; 2005. [ Links ]
19. Maria C. Diaz, Sandra E. Espitia, Francisco Molina. Microbiología de la digestión anaerobia. En: Colciencias. Digestión anaerobia: una aproximación a la tecnología. 1ª ed. Colombia: Uneditorial - Instituto de biotecnología; 2002. p. 45-71. [ Links ]
20. Alicia Hernández, Ileana Alfaro, Ronald Arrieta. Las fermentaciones. En: Alicia Hernández. Microbiología industrial. UNED; 2003. p. 37-39. [ Links ]
21. Campbell, Reece. Respiración celular: obtención de energía química. En: Alberto Alcocer. Biologia. 7ª ed. Madrid- España: Panamericana; 2005. p. 170-176. [ Links ]
22. Beyer, Walter. Manual de química orgánica. 19ª ed. Barcelona: Reverte; 1987. [ Links ]
23. H.J. Vázquez, O. Dacosta. Fermentación alcohólica: Una opción para la producción. Ingeniería Investigación y Tecnología [revista en internet]* 2007 [acceso 11 Abril 2014]; 8(4). Disponible en: http://www.journals.unam.mx/index.php/ingenieria/article/view/13478. [ Links ]
24. María C. Vincent Vela, Silvia Álvarez Blanco, José L. Zaragozá Carbonell. Química industrial orgánica. Valencia: Universidad Politécnica de Valencia; 2006. [ Links ]
25. Lee Yuan Kun. Microbial Biotechnology: principles and Applications. Second edition. London. World Scientific Publishing Co. Pte. Ltd; 2006. [ Links ]
26. Macfarlane GT, Macfarlane S. Microbiota humana colon: la ecología, la fisiología y el potencial metabólico de las bacterias intestinales. Scand J. Gastroenterol Suppl [revista en internet]* 1997 [acceso 28 Marzo 2014]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/9145437. [ Links ]
27. Sridevi Devaraj, Peera Hemarajata, James Versalovic. La microbiota intestinal humana y el metabolismo corporal: Implicaciones con la obesidad y la diabetes. Acta bioquímica clínica latinoamericana [revista en internet]* 2013 [acceso 30 Mayo 2014]; 47(2). Disponible en: http://www.scielo.org.ar/scielo.php?pid=S0325-29572013000200019&script=sci_arttext. [ Links ]
28. Roel Van der Meulen, Lazlo Avonts, Luc De Vuyst. Short Fractions of Oligofructose Are Preferentially Metabolized by Bifidobacterium animalis DN-173 010. Applied and environmental microbiology [revista en internet]* 2004 [acceso 30 Mayo 2014]; 70 (4). Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC383053/. [ Links ]
29. Juan J.J. Obando, Carlos A. Cardona. Análisis de la producción de biobutanol en la fermentación acetobutilica con clostridium saccharoperbutylacetonicum N1-4 ATCC13564. [revista en internet]* [acceso 30 junio 2014]. Disponible en: http://aprendeenlinea.udea.edu.co/revistas/index.php/ingenieria/article/view/14597/12761. [ Links ]
30. H. Shinto, Y. Tashiro, M. Yamashita, G. Kobayashi, T. Sekiguchi, T. Hanai, Y. Kuriya, M. Okamoto, K. Sonomoto. Kinetic modeling and sensitivity analysis of Acetone-Butanol-Ethanol production. Journal of Biotechnology. [revista en internet]* 2007 [acceso 15 Junio 2014]; 131 (1). Disponible en: http://www.sciencedirect.com/science/article/pii/S0168165607003549. [ Links ]
31. Sheng Tsiung, Hsu, Shang Tian Yang. Propionic acid fermentation of lactose by Propionibacterium acidipropionici: effects of pH. Biotechnol Bioeng. [revista en internet]* septiembre 1991 2007 [acceso 30 Junio 2014]; 38 (6). Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/18604876. [ Links ]
32. Alicja Kosmider, Agnieszka Drozdznska, Kalina Blaszka, Katarzyna Leja, Katarzyna Czaczyk. Propionic Acid Production by Propionibacterium freudenreichii ssp. shermanii Using Crude Glycerol and Whey Lactose Industrial Wastes. Journal of environmental studies [revista en internet]* 2010 [acceso 18 julio 2014]; 19 (6). Disponible en: http://www.pjoes.com/abstracts/2010/Vol19/No06/15.html. [ Links ]
33. Zhongqiang Wang, Shang Tian Yang. Propionic acid production in glycerol/glucose co-fermentation by Propionibacterium freudenreichii subsp. Shermanii. Bioresource Technology [revista en internet]* June 2013 [acceso 18 julio 2014]; 137. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/23584412. [ Links ]
34. C Allison and G T Macfarlane. Dissimilatory nitrate reduction by Propionibacterium acnes. Appl Environ Microbiol. 1989 Nov; 55(11): 2899-2903. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC203188/?page=1. [ Links ]
35. Ramon Parés i Farràs, Antonio Juárez Giménez. Bioquímica de los microorganismos. Barcelona España: Reverte S.A; 1997. [ Links ]
36. Nuria Martí Ortega. Phosphorus Precipitation in Anaerobic Digestion Process. Boca Raton, Florida USA. Universal-Publishers; 2006. [ Links ]
37. Harol L. Drake. Acetogenesis. New York: Springer Science & Business Media; 2012. [ Links ]
38. Paola A. Acuña González, Lisvet S. Ángel, Elizabeth B. Montoya, Lucia C. Corrales, Ligia C. Sánchez. Aislamiento e identificación de microorganismos del género Methanococcus y Methanobacterium de cuatro fuentes de Bogotá D.C. NOVA [revista en internet]* Diciembre 2008 [acceso 30 julio 2014]; 6 (10). Disponible en: http://webcache.googleusercontent.com/search?q=cache:JY25opZ3M8wJ:www.unicolmayor.edu.co/invest_nova/NOVA/NOVA10_ARTORIG5_METHAN.pdf+&cd=1&hl=es&ct=clnk&gl=co. [ Links ]
39. Juan C. Carmona, Diana M. Bolívar, Luis A. Giraldo. El gas metano en la producción ganadera y alternativas para medir sus emisiones y aminorar su impacto a nivel ambiental y productivo. Revista Colombiana de Ciencias Pecuarias [revista en internet]* 2005 [acceso 15 Agosto 2014]; 18 (1). Disponible en: http://rccp.udea.edu.co/index.php/ojs/article/view/6. [ Links ]
40. Azeem Khalida, Muhammad Arshadb, Muzammil Anjuma, Tariq Mahmooda, Lorna Dawsonc. The anaerobic digestion of solid organic waste. Elsevier,Waste Management [revista en internet]* August 2011 [acceso 20 Agosto 2014]; 31(8). Disponible en: http://www.sciencedirect.com/science/article/pii/S0956053X11001668. [ Links ]
41. Amy Claire Rosenzweig , Stephen W. Ragsdale. Methods in Methane Metabolism: Methanogenesis. 1a ed. USA: Academic Press of Elsevier; 2011. [ Links ]
42. Dimitar Karakashev, Damien J. Batstone, Irini Angelidaki. Influence of Environmental Conditions on Methanogenic Compositions in Anaerobic Biogas Reactors. Applied and environmental microbiology [revista en internet]* 2005 [acceso 10 Agosto 2014]; 71(1). Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC544252/. [ Links ]
43. Madigan M.T, J.M. Martinko, J. Parker. Brock biology of Microorganisms. 8a ed. New Jersey: Hardcover; 1998. [ Links ]
44. L. M. Prescott, J. P. Harley, D. A. Klein. Microbiología. 4ª ed. Madrid: McGraw-Hill-Interamericana; 1999. [ Links ]
45. Gaspar M, Mejía Sánchez. Digestión anaerobia. Yucatán, México: Mérida; 1996. [ Links ]
46. Yoandy Ferrer, Heidy Pérez. Los microorganismos en la digestión anaerobia y la producción de biogás. Consideraciones en la elección del inóculo para el mejoramiento de la calidad y el rendimiento. ICIDCA [revista en internet]* enero-abril 2010. [acceso 20 Agosto 2014]; 43(1). Disponible en: http://www.redalyc.org/pdf/2231/223120681002.pdf. [ Links ]
47. Marisol Gallegos García, Lourdes B. Celis, Elías Razo-Flores. Competencia por sustrato durante el desarrollo de biomasa sulfatorreductora a partir de un lodo metanogénico en un reactor UASB. Revista internacional de contaminación ambiental [revista en internet]* Mayo 2010. [acceso 20 Mayo 2015]; 26(2). Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0188-49992010000200002. [ Links ]
48. David L. Nelson, Michael M. Cox. Principios de Bioquímica. 4ª ed. Barcelona: Omega; 2005. [ Links ]
49. Michael T. Madigan, John M. Martinko, Jack Parker. Microbiología de los microorganismos. 13ª ed. Benjamin Cummings; 2010. [ Links ]
50. Adriana C. Flores Gallegos, Raúl Rodríguez Herrera, Juan C. Contreras Esquivel. La fijación biológica de nitrógeno por microorganismos; su importancia en la agricultura y conservación del medio ambiente. Cienciacierta [revista en internet]* Julio - septiembre 2009 [acceso 22 Agosto 2014]; 5(19). Disponible en: http://www.researchgate.net/publication/233387183_La_fijacin_biolgica_de_nitrgeno_por_microorganismos_su_importancia_en_la_agricultura_y_conservacin_del_medio_ambiente. [ Links ]
51. Stephen C. Wagner. Biological Nitrogen Fixation. Nature Education Knowledge. [revista en internet]* 2011. [acceso 22 Marzo 2015]; 3(10). Disponible en: http://www.nature.com/scitable/knowledge/library/biological-nitrogen-fixation-23570419. [ Links ]
52. C. Rodríguez Barrueco, F. Sevillano García, P. Subramaniam. La Fijación De Nitrógeno Atmosférico Una Biotecnología En La Producción Agraria. 1ª ed. Subramaniam; 1985. [ Links ]
53. Urzúa H. Beneficios de la Fijación Simbiótica de Nitrógeno en Chile. Pontificia Universidad Católica de Chile. Ciencia e Investigación Agraria [revista en internet]* Agosto 2005 [acceso 10 Septiembre 2014]; 32(2). Disponible en: http://www.rcia.uc.cl/index.php/rcia/article/view/313/239+&cd=1&hl=es&ct=clnk&gl=co. [ Links ]
54. Lucía Soto Urzúa, Beatriz E. Baca. Mecanismos de Protección de la Nitrogenasa a la Inactivación por Oxígeno. Revista Latinoamericana de Microbiología [revista en internet]* 2001. [acceso 03 noviembre 2014]. Disponible en: www.medigraphic.com/pdfs/lamicro/mi-2001/mi011f.pdf. [ Links ]
55. John R. Postgate. The fundamentals of nitrogen fixation. Cambridge-Inglaterra: Ilustrada; 1982. [ Links ]
56. José. M. Barea. Cuantificación de la fijación biológica de N mediante el uso de N15. En fijación y movilización biológica de nutrientes. Madrid-España: RAYCAR S.A 1991. [ Links ]
57. Héctor A Peláez Morales, María C Prada Fonseca, Gerardo Caicedo pineda, Claudia X Moreno Herrera y Marco A Márquez Godoy. Influencia de la relación inicial de Fe3+/Fe2+, en un proceso de biodesulfurización de carbones en suspensión. Revista internacional de contaminación ambiental [revista en internet]* Mayo 2013. [acceso 23 Mayo 2015]; 29(2). Disponible en: http://www.scielo.org.mx/scielo.php?pid=S0188-49992013000200007&script=sci_arttext. [ Links ]
58. Pena. A, Arroyo, Gómez, Tapia, Gómez. Bioquímica. 11ª ed. México D.F: Limusa; 2004. [ Links ]
59. Christopher K. Mathews, Kensal E. van Holde, Dean R. Appling. Biochemistry. 4a ed. Pearson; 2012. [ Links ]
60. Roger Y. Stanier, Jhon L. Ingraham, Mark L. Wheelis, Page R. Painter. Microbiología 2ª ed. Barcelona - España: Reverte; 2005. [ Links ]
61. Lilian Frioni. Procesos Microbianos Tomo II. Córdoba: Editorial de la fundación Universidad Nacional de Río Cuarto; 1999. [ Links ]
62. Koolman. J, K. H. Rohm. Bioquímica: Texto y Atlas. 3ª ed. Buenos Aires; Panamericana; 2004. [ Links ]
63. R. Reggiani, A. Bertani. Anaerobic Amino Acid Metabolism. Russian Journal of Plant Physiology [revista en internet]* November 2003 [acceso 28 noviembre 2014]; 50(6). Disponible en: http://link.springer.com/article/10.1023%2FB%3ARUPP.0000003270.33010.22#page-1. [ Links ]
64. Teresa Audesirk, Gerald Audesirk, Bruce E. Byers. Biología: La vida en la tierra. 6ª ed. México: Pearson; 2003. [ Links ]