Introducción
El interés creciente de generar alimentos de buena calidad para satisfacer las necesidades de los seres vivos y responder de manera eficiente al objetivo número dos planteado por las Naciones Unidas, para este milenio "poner fin al hambre, lograr la seguridad alimentaria y la mejora de la nutrición y promover la agricultura sostenible" 1, genera la necesidad de aplicar estrategias amigables y sostenibles que mejoren la productividad del suelo y la obtención de productos en óptimas condiciones.
Una de esas estrategias está relacionada con la capacidad fijadora de nitrógeno y solubilizadora de fosfato de Bacillus spp., que ha despertado el interés de investigadores por conocer sobre los procesos metabólicos por medio de los cuales estos microorganismos brindan sus beneficios a la agricultura y al ambiente. La capacidad de estos microorganismos para producir compuestos orgánicos, realizar fijación biológica de nitrógeno (FBN) y solubilizar fosfatos (SF), son actividades que efectúan mediante enzimas como nitrogenasas y fitasas, con un efecto positivo en la promoción del crecimiento vegetal y en el aumento del potencial productivo.
En este sentido, la formulación y el uso de biofertilizantes es una opción que está tomando especial importancia para el mejoramiento de la disponibilidad de nutrientes cuando se aplica a los cultivos 2, por cuanto facilita la fijación biológica de nitrógeno y la solubilización de fosfato, reemplazando positivamente la fertilización química y brindando protección al medio ambiente.
Los microorganismos fijadores de nitrógeno y solubilizadores de fosfato han sido objeto de estudio en la microbiología del suelo y en el desarrollo de productos biológicos comerciales de uso agrícola como los biofertilizantes 3; por tanto, el interés por determinar qué microorganismos contienen las enzimas fitasas y nitrogenasas es vital para la producción agrícola.
La importancia de los biofertilizantes en la industria agrícola se sustenta también en que son una opción amigable para el suelo, ya que el uso excesivo de las tierras fértiles para cultivo y el manejo indiscriminado de fertilizantes químicos desgasta este recurso, y en este caso, los biofertilizantes contribuyen a mitigar el problema de deterioro y/o contaminación ambiental 4 y de esta forma se contribuye con el objetivo número quince de los propuestos para el milenio "proteger, restablecer y promover el uso sostenible de los ecosistemas terrestres, gestionar sosteniblemente los bosques, luchar contra la desertificación, detener e invertir la degradación de las tierras y detener la pérdida de biodiversidad"1).
En los últimos años, instituciones en Colombia han estudiado y evaluado la acción biofertilizante de microorganismos eficientes que participan en la fijación de nitrógeno y la solubilización de fosfatos. El Instituto Colombiano Agropecuario (ICA) define "un inoculante biológico" como un producto elaborado a partir de una o más cepas de microorganismos benéficos que al aplicarse al suelo o a las semillas promueven el crecimiento vegetal o favorecen el aprovechamiento de los nutrientes 5. De otro lado, estudios como los realizados por la Pontificia Universidad Católica de Chile han demostrado que del 100% del nitrógeno aplicado en los cultivos, solo del 10% al 50% es absorbido por las plantas y del 50% al 90% terminan en las aguas subterráneas y superficiales 6.
La mayoría de los microorganismos (bacterias) y plantas (algas y actinomicetos) dependen, por una parte, de la disponibilidad tanto de los grupos PO4 como de la presencia del fósforo inorgánico (Pi), debido a que estos grupos son intermediarios en muchas reacciones en las que se obtiene energía.
De otra parte, el nitrógeno (N2) reacciona en forma inorgánica mediante reacciones de reducción en las que cada átomo gana electrones y se estabiliza dando origen a iones tales como NO3 (Nitrato) ó NH4 (Amonio) que son los que al tener mayor afinidad se pueden fijar (7. Los fijadores biológicos de nitrógeno y solubilizadores de fosfato ejercen un gran impacto agronómico al ser aplicados en suelos degradados, en donde la microbiota ha sido afectada negativamente por el uso inapropiado de técnicas agrícolas, que seleccionan y/o eliminan organismos de la diversidad, o que afectan su efectividad 8.
La capacidad de Bacillus spp., para formar esporas que permanecen metabólicamente inactivas pero viables bajo condiciones adversas, los hace apropiados para la formulación de productos estables que benefician los cultivos agrícolas a través de mecanismos indirectos. 9
Este trabajo es una revisión documental que permite proporcionar información sobre las investigaciones realizadas en relación con el uso de las fitasas y nitrogenasas bacterianas en la producción agrícola como biofertilizantes y el beneficio del uso de éstos a nivel ambiental.
Antecedentes
La producción de biofertilizantes en el mundo inició a finales del siglo XIX, a partir de los estudios realizados por Winogradsky, Waksman y Lipman, pioneros de la microbiología del suelo, al enfocarse en la investigación de microorganismos y su capacidad metabólica para degradar nutrientes importantes en la fertilización del suelo 8.
La fijación del nitrógeno ha sido estudiada desde hace más de 100 años. En 1901, Beijerinck reporta la interacción de microorganismos como Azospirillum, Azotobacter, Bacillus, Clostridium y Klebsiella, que lo fijan por asociación y algunos que forman simbiosis como Rhizobium y Bradyrhizobium9. En 1907, Ashby realizó estudios con Azotobacter en un medio libre de nitrógeno, medianamente selectivo para bacterias fijadoras de éste, que permite el crecimiento de bacterias fijadoras de nitrógeno y que se conoce como medio Ashby 10.
A comienzos del siglo XX, Smith realizó estudios con el medio Ashby modificado, los cuales se enfocaron en el crecimiento de bacterias como Azotobacter sp., y Azospirillum sp. 11. En la década de 1960 se inician estudios que buscan el desarrollo de nuevas técnicas para determinar la capacidad fijadora de nitrógeno de las bacterias, donde se mencionó por primera vez la presencia de la enzima nitrogenasa como responsable de la capacidad de esta fijación 12. Posteriormente, en 1968, Hardy, Jackson y Burns determinaron la presencia de dicha enzima 13.
La crisis energética de la década de 1970 y los problemas de contaminación debido al uso indiscriminado de fertilizantes nitrogenados impulsaron investigaciones sobre la fijación simbiótica de nitrógeno, centrando la atención sobre el sistema Rhizobium-leguminosa el cual constituye una importante alternativa para la producción agrícola de leguminosas, grano y forrajeras 14.
Seldin y colaboradores en 1984 presentan a Bacillus azotofixans y Bacillus polymyxa como fijadores de nitrógeno 15. Ibarra, en su trabajo de grado menciona que Baldani en el año 1986, dedujo que en pH alcalino la nitrogenasa reduce su actividad y además afirma que éste también influye en la disponibilidad de nutrientes de manera general para los organismos 16. En 1995, Merrick nombró a los genes que codifican la síntesis de la enzima nitrogenasa como Nif17, lo que impulsó la realización de métodos moleculares para la identificación de dichos genes en cepas bacterianas.
En 1998 Xie y colaboradores realizaron experimentos con muestras de suelo de las cuales fueron aisladas endosporas generadoras de cepas con ARA (actividad de reducción de acetileno); por lo cual, en dicho estudio se verificó la fijación de nitrógeno en las cepas de Bacillus licheniformis, B.subtilis, B. cereus, B. pumilus, B. brevis, B. firmus,18. En 1999, Susan Fisher realizó una revisión de la regulación del metabolismo del Nitrógeno en B. subtilis nombrando el sistema Ntr que regula los genes Nif, información que complementa el estudio genético previamente realizado por Merrick en 1995 19.
En el año 2000, Orozco y Martínez afirmaron que los microorganismos que llevan a cabo procesos de fijación del nitrógeno representan aproximadamente el 5% de la población bacteriana total y se encuentran en superficies de los tejidos radiculares, foliares, suelo y tubérculos de ectomicorrizas 20.
Orhan y colaboradores, en los años 2003 y 2005, evaluaron dos cepas de Bacillus OSU-142 (N2-fijación) y M3 (N2-fijación y fosfato solubilización) en un cultivo ecológico de frambuesa en la provincia de Erzurum (Turquía), en el cual se evidenció la promoción del crecimiento vegetal. Los resultados mostraron que la cepa de Bacillus M3 estimuló el crecimiento y la nutrición de la planta de frambuesa en condiciones de crecimiento orgánico 21.
Kloepper y colaboradores en 2004 describen al género Bacillus spp. como promotor de crecimiento en plantas debido a los mecanismos de resistencia sistémica inducida (ISR) que poseen frente a bacterias y hongos patógenos, virus sistémicos y nematodos de la raíz 22.
La fijación biológica de N2 (FBN) es el primer paso del ciclo del N2 que va desde la atmósfera hasta la biósfera. Estudios realizados en Brasil por Beneduzi y colaboradores en 2008 reportan cepas del género Bacillus spp., aisladas de siete zonas de producción de trigo, como fijadoras de nitrógeno, donde además se observó la producción de compuestos indólicos: indol-3-acético-ácido (IAA) y ácido indolpirúvico (IPyA). La identificación se realizó mediante secuenciación del gen 16S rRNA de las cepas, que podrían ser útiles en la formulación de nuevos inoculantes para la mejora de cultivos, ya que demostraron un aumento significativo del follaje en plantas de trigo 23.
Acuña y colaboradores en 2010 comprobaron que en suelos contaminados con hidrocarburos, la fijación biológica de nitrógeno (FBN) es difícil debido a que la disponibilidad de nitrógeno (N2) es limitada para los microorganismos, lo cual dificulta su desarrollo. Se evidenció también que la baja disponibilidad y solubilidad en el agua conlleva a la disminución en la fijación del nitrógeno 24.
De otro lado, Arthur Harden. y William Young, en 1905 expusieron la importancia del fósforo en las células, y en los estudios realizados a través de lo s años, se ha demostrado que el fósforo es el segundo nutriente más importante para el desarrollo y el crecimiento de los microorganismos presentes en el suelo después del nitrógeno. Hace parte de los ácidos nucleicos, del ATP y de otras moléculas que tienen el ion fosfato (PO4), demostrando que contribuyen al aumento de la biomasa, las reacciones de respiración, la obtención de nutrientes y biosíntesis de macromoléculas, entre otras, como lo señalan Sanyal y De Data 25.
En 1994, Richardson, en su estudio sobre los microorganismos del suelo y la disponibilidad del fósforo, señala que la presencia de este elemento para las plantas, microorganismos y otros seres vivos, tiene especial importancia ya que se encuentra en cantidades reducidas y en formas insolubles, a pesar de suministrarse en forma de fertilizantes 26.
Shin y colaboradores, en 2001, señalan en el estudio realizado sobre el mecanismo catalítico y las propiedades de las fitasas que existen reacciones de fosforilación y desfosforilación fundamentales para la vida que son catalizadas por enzimas y utilizadas para almacenar y recuperar energía química, facilitar las señales de transducción y promover el metabolismo, en las cuales participan microorganismos del suelo mediante procesos de mineralización del fósforo orgánico a través de actividades enzimáticas 27.
Wakelin y colaboradores, en 2004, infieren que mediante la actividad bioquímica de microorganismos en el suelo rizosférico se puede aumentar la solubilidad del fósforo, demostrado la actividad enzimática que realizan especies de bacterias y hongos, lo cual se traduce en el incremento de la disponibilidad del fósforo cuando existe buena actividad microbiana en el suelo 28.
Fernández y Rodríguez, en 2005, describen la importancia del fósforo en la nutrición vegetal y el papel de los microorganismos solubilizadores en la adquisición de éste, de tal forma que los microorganismos se convierten en los principales protagonistas para el desarrollo de biofertilizantes 29. De la misma manera, en 2005, Oberson y Joner confirman que los microorganismos que influyen en la transformación del fósforo con la consecuente disponibilidad en el suelo, involucran a toda la microbiota que está entre 0 y 100|im de diámetro, siendo las bacterias los microorganismos de este tamaño más numerosos presentes en términos de biomasa 30.
Las bacterias solubilizadoras de fosfato son protagonistas del aumento de la disponibilidad del fósforo (P) en el suelo, ya que tienen la capacidad de intervenir en los procesos de fijación de éste, demostrando que su empleo en diversos cultivos favorece el rendimiento de las cosechas y mejora la fertilidad del suelo 31. Estudios realizados por Khan y colaboradores en 2007 32 y Zaidi y colaboradores en 2009 33, en los cuales ensayan con Bacillus, Pseudomonas, E.coliy Aspergillus, ponen en evidencia la capacidad solubilizadora de fosfatos.
De otro lado, diferentes investigaciones describen las fitasas como endoenzimas producidas por bacterias, las cuales tienen mayor afinidad reactiva por el ácido fítico (C6H18O24P6) como sustrato para generar una forma asimilable del fósforo (P) 34. Los avances biotecnológicos han permitido la caracterización de muchas fitasas provenientes de microorganismos, como Aerobacter aerogenes, tal como lo describe Greaves y colaboradores en 1967 35; Pseudomonas sp., por Irving y Cos-grove en 1971 36; Bacillus subtilis por Powar y Jagannathan en 1982 37, y E. coli por Greiner y colaboradores en 1993 38, también se encuentra el reporte de algunas especies de hongos como Aspergillus flavus y Penicillium spp., por Shieh y Ware en 1968 39; y levaduras como Candida sp. por Rojas en 2009 40.
Estudios de laboratorio realizados por Hayes y colaboradores en 2000, y posteriormente por Richardson en 2001, demostraron que la inoculación de microorganismos con actividad fitasa o la adición de fitasas microbianas purificadas a las raíces de plantas, incrementan el fósforo suministrado por el fitato, permitiéndole solubilizarse para su absorción, lo cual contribuye en la nutrición de las plantas y se observa en las condiciones de crecimiento de las mismas 41.
Mediante técnicas moleculares, los genes que codifican la actividad de fitasas (Phy) han sido clonados a partir de bacterias, hongos y plantas. También se han podido conocer algunas características de éstos genes relacionados con la estabilidad a temperaturas altas; como es el caso de las de Bacillus sp. DS11 y Bacillus subtilis VVT E-68013, que son térmicamente estables a determinados pH, mientras que los genes de B. subtilis y B. licheniformis actúan mejor a pH neutro 34.
Esto mismo ha pasado con los genes de nitrogenasas (Nif), los cuales mediante técnicas de biología molecular también han sido aislados e introducidos en diferentes plantas de interés agrícola (42). Recientemente, la expresión del gen nifH ha sido estudiada mediante PCR con transcripción inversa (RT-PCR) para evaluar la actividad de fijación de nitrógeno de la bacteria endofita Azoarcus spp, de las comunidades microbianas fijadoras de nitrógeno en el intestino de termitas, del suelo, y del agua marina 34. Por otro lado, gracias al desarrollo de nuevas investigaciones se ha logrado identificar la actividad de fitasas en diferentes especies bacterianas, bajo estimulo in vitro 43.
En aislamientos obtenidos a partir de Bacillus subtilis, Aspergillus niger y Escherichia coli se ha evidenciado que tienen actividad enzimática fosfatasa como las BPPs. Otras enzimas como las fosfatasas ácidas púrpura (Purple acidic phosphatases "PAP") o fitasas cisteínicas, son comunes en microorganismos, plantas y mamíferos. Estas enzimas tienen como cofactores iones metálicos y fueron encontradas en bacterias anaeróbicas como Selenomonas ruminantium del rumen, y de acuerdo con su mecanismo catalítico se sugiere que presentan la secuencia conservada de HCXX-GXXR (T/S) en su sitio activo. Las fitasas más comúnmente usadas en la industria son microbianas; las de hongos filamentosos son extracelulares y las bacterianas son intracelulares a excepción de las del género Bacillus, y las de levaduras que son mixtas 44.
Nitrógeno
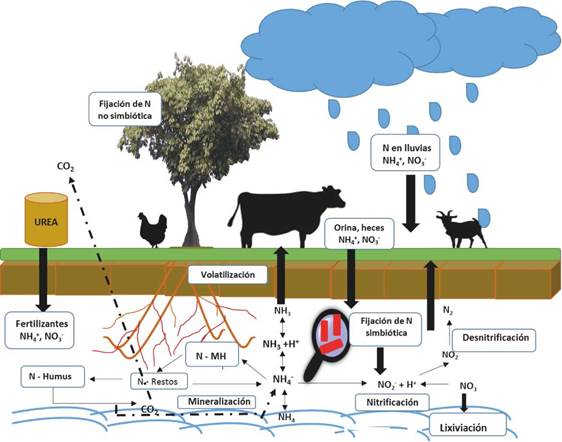
El nitrógeno es uno de los elementos más abundantes en la naturaleza. En su forma molecular (N2) se calcula que en el planeta hay más de 60.000 billones de toneladas de nitrógeno, de los cuales aproximadamente el 94% está ubicado en la corteza terrestre; del 6% restante, el 99,86% se halla en la atmósfera y el 0,04% en los organismos vivos, suelos y aguas en forma de compuestos orgánicos e inorgánicos, como macronutriente que los organismos utilizan para sintetizar proteínas 45.
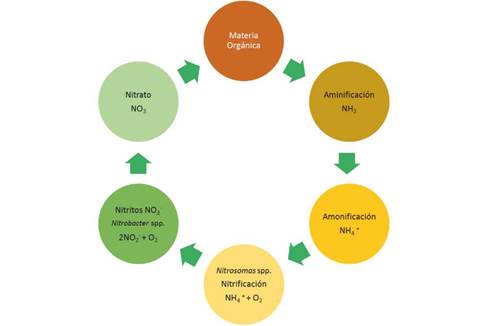
Se han descrito algunas especies de bacterias y algas capaces de fijar Nitrógeno para formar amoníaco (NH3), el cual se incorpora al suelo donde bacterias nitrificantes lo oxidan a nitritos (NO2 -1) y posteriormente a nitratos (NO3 -1), proceso conocido como nitrificación. La mayoría de los microorganismos y las plantas son dependientes de este elemento en forma inorgánica, es decir, en forma de iones de nitratos (NO3 -1) o de amonio (NH4 +1), o en algunas ocasiones como moléculas sencillas. Por el contrario, los animales necesitan del nitrógeno orgánico, es decir, formando parte de compuestos como aminas, amidas o aminoácidos, que son obtenidos de forma directa o indirecta de las plantas 45.
Nitrógeno y plantas
La fuente de nitrógeno para las plantas está constituida por el amonio y el nitrato disuelto en el suelo (N asimilable), sin embargo, el 98% del N presente en el suelo está combinado en moléculas orgánicas y por lo tanto no está disponible para la nutrición vegetal. Entre el 1 y 3% de éste, es mineralizado en un año por los procesos biológicos denominados amonificación y nitrificación. La otra parte se volatiliza por procesos de desnitrificación como NH3, NO y N2O, mientras que el compuesto NO3 se precipita al no ser absorbido por suelos arcillosos, evento que evita la captación inmediata por los vegetales o microorganismos 45.
Ciclo biogeoquímico del Nitrógeno
El ciclo del nitrógeno está compuesto por 5 procesos que se definen como mineralización, nitrificación, desnitrificación, asimilación y fijación. La asimilación es el único proceso que no es realizado por las bacterias 45.
Como se estableció anteriormente, el nitrógeno molecular (N2), está presente en la atmósfera en un 80% y es considerado una molécula casi inerte debido al triple enlace que presenta entre sus dos átomos de nitrógeno. Esta unión no le permite ser asimilado directamente por las plantas y necesita ser fijado previamente por microorganismos que lo liberan transformándolo en amonio o nitratos que son asimilados por la planta 45.
Estudios muestran que la temperatura es inversa al contenido de nitrógeno y materia orgánica en el suelo; es decir, al incrementar la energía cinética del medio, disminuye la cantidad de nitrógeno presente en el suelo, mientras que, al incrementar la pluviosidad aumenta la vegetación y por ende la concentración de nitrógeno 47. De otra parte, con relación al tipo de suelo, este influye en la cantidad de nitrógeno presente. Los suelos arcillosos son los que presentan este elemento en mayor cantidad, en comparación con los suelos arenosos y limosos 45.
Transformaciones del nitrógeno en el suelo
El nitrógeno que entra en el suelo está sujeto a muchas transformaciones. El nitrógeno de las fuentes orgánicas pasa a formar parte de la materia orgánica del suelo y una parte de éste se convierte en nitrógeno inorgánico a través del proceso llamado mineralización. El suelo contiene: amonio (NH4 +1) y nitrato (NO3 -1). El NH4 +1 es atraído electrostáticamente por las cargas aniónicas y las sustancias coloidales del suelo (arcillas y humus) a través de reacciones iónicas. Por otro lado, el NO3 -1, se solubiliza en el agua del suelo y +1 no es retenido por las cargas aniónicas. El NH y el NO3 -1 son las únicas formas de Nitrogeno que pueden ser absorbidas por las raíces de las plantas 1,48.
El nitrógeno en fertilizantes para la planta
El nitrógeno orgánico se encuentra en forma de materia orgánica, pero no es aprovechable por las plantas. El nitrógeno inorgánico se encuentra en forma NH4 + y NO3 - como fertilizante inorgánico, como se observa en la Tabla 1.
Fósforo
El fósforo (P) es uno de los macronutrientes más importantes encontrados en la naturaleza y como elemento químico es absolutamente necesario, porque participa en el crecimiento de las plantas y en procesos metabólicos como la fotosíntesis, la transferencia de energía y la degradación de carbohidratos. "El fósforo en los vegetales se encuentra de forma inorgánica en pequeña proporción y la mayor parte se encuentra unido al ácido fítico que contiene aproximadamente un 28% en forma de radicales de ácido fosfórico. Estos radicales tienen afinidad por diversos cationes como: Fe+3, Ca+2, Cu+, Zn+2, citados en orden decreciente de afinidad" 50
El fósforo como constituyente de sustancias orgánicas da origen a fracciones lábiles y resistentes a la mineralización, cuyo componente orgánico más importante es la biomasa microbiana que degrada y libera diferentes compuestos fosfatados. El fósforo orgánico se genera a partir de restos vegetales y animales, este tipo de fósforo es absorbido en mayor cantidad en suelos arcillosos 50. El fósforo inorgánico, está conformado por diferentes minerales que liberan fósforo por meteorización, es decir de forma muy lenta. Las formas de fosfato inorgánico, son de menor solubilidad en comparación al fósforo orgánico 2
Fósforo y plantas
El fósforo es absorbido por las plantas a través de su raíz y las capas externas de las células del sistema radicular. Se absorbe principalmente como ión de ortofosfato primario (Fosfato diácido -H2PO4 -) o también por medio iones de fosfato secundario (Fosfato ácido - HPO4=) Esta última forma incrementa los niveles de pH. Una vez fijado al sistema radicular, el fósforo tiende a distribuirse por toda la planta a través de reacciones químicas que le permiten incorporarse a compuestos orgánicos donde queda disponible para otros tipos de reacciones. No obstante, en el suelo más del 90% de éste pasa a forma insoluble, es decir no disponible, por eso es importante resaltar que la biodisponibilidad de este elemento es vital en reacciones energéticas, procesos fotosintéticos, transferencia genética y transporte de nutrientes en estos organismos 2.
El fósforo también interviene en el proceso de fotosíntesis:
6 CO2 + 12 H2O -->> C6H12O6 + 6 O2
Reacción Neta
Esta reacción ocurre en dos etapas:
Fase lumínica: la absorción de la energía solar por las moléculas de clorofila propicia un transporte de electrones y aunado al gradiente de protones se produce adenosin trifosfato (ATP). Durante este proceso, la molécula de agua se escinde y se libera O2, los electrones son absorbidos por el NADP+ con la consecuente formación del NADPH.
Fase oscura: es una ruta metabólica que se sucede en los cloroplastos. En este ciclo, se utiliza el ATP (Energía Química) y el NADPH obtenidos en la fase lumínica, con el fin de reducir moléculas inorgánicas de CO2, NO3 y SO4 en sustancias reducidas de carácter orgánico que propician la construcción de moléculas más complejas. De manera general, se puede establecer que en ésta fase ocurre lo siguiente:
Fijación del CO2 a la ribulosa 1,5 difosfato y obtención de dos moléculas de ácido fosfoglicérico
Reducción del ácido fosfoglicérico a gliceraldehído-3-Fosfato con la intervención del ATP y el NADPH.
En estos resultados generales de la reacción se obtienen moléculas que se constituyen en fuentes de energía química para diversas reacciones en la planta que conllevan a la liberación de oxígeno 51. De otra parte, los fosfatos constituyen los ácidos nucleicos y los fosfolípidos esenciales en la división celular, fundamentales para el desarrollo de tejidos meristemáticos 52.
Mineralización de fósforo
El fósforo es abundante en los suelos, contribuye a la nutrición y desarrollo de los seres vivos debido a los procesos de hidrólisis y liberación de fosfatos libres 53. Las fosfatasas son enzimas catalizadas a medida que se van liberando de acuerdo a los procesos orgánicos naturales 54. De estas enzimas las más estudiadas son las fosfomonoes-tereasas, grupo enzimático que actúa sobre compuestos fosfatados de bajo peso molecular con enlaces monoéster, incluyendo mononucleótidos, fosfatos de azúcar y polifosfatos. Estas enzimas no pueden iniciar el clivaje del ácido fítico (myo-ino-sitolhexaquifosfato) aunque el proceso de catalización se puede llevar a cabo por medio de la hidrólisis de inositoles fosfato de orden menor 55.
En un estudio realizado en 2002 se menciona que estimar la cantidad de fósforo orgánico disponible a través de la mineralización es importante, considerando los cambios en el fosfóro orgánico extraído con NaHCO3 como una medida de éste elemento potencialmente mineralizable. Sin embargo, los cambios netos en fósforo orgánico son generalmente pequeños en relación al tamaño de los reservorios totales, determinando que la variedad climática de los suelos influye sobre la actividad microbiana, ocasionando un aumento significativo de la mineralización neta del P orgánico 56.
Ciclo del fósforo
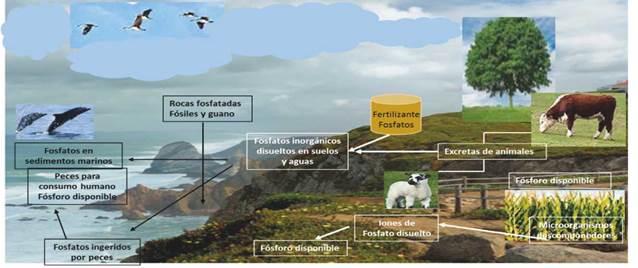
El ciclo del fósforo en el suelo, involucra tanto a la biomasa microbiana, como a la materia orgánica e inorgánica, incluyendo diferentes fuentes de fósforo, por eso este ciclo es catalogado como complejo y dinámico. Las fuentes de fósforo encontradas se dividen en fósforo inorgánico disponible (Pi), fósforo orgánico, fósforo absorbido, y fósforo mineral primario 57.
El fósforo se mueve lentamente desde los depósitos de fosfato en la tierra y los sedimentos de los mares a los organismos vivos, para luego regresar a la tierra y al océano. El suelo contiene minerales ricos en fósforo, los cuales permanecen ahí por largos periodos de tiempo y lentamente el fósforo se hace disponible para las plantas, gracias a las variaciones en las constantes de solubilidad de los diferentes minerales. Cuando ocurre el fenómeno de precipitación, el fósforo se comporta como un nutriente no disponible; y la reacción ocurre entre el Pi y elementos metálicos tales como calcio, hierro y aluminio formando sales de fosfato 47.
Microorganismos fijadores de nitrógeno y solubilizadores de fosfato
Los microorganismos fijadores de nitrógeno y solubilizadores de fosfato requieren fuentes químicas y naturales de energía. Éstos mediante sus procesos metabólicos generan enzimas que catalizan la ruptura de los enlaces del nitrógeno y del ácido fítico constituyéndose en precursores de reacciones químicas. Las bacterias intermediadoras de vida libre que participan en estos procesos son: Bacillus spp., Clostridium spp., Klebsiella spp., Pseudomonas spp., Enterobacter spp., Azotobacter spp., y Azospirillum spp., las que han sido aísladas de la rizosfera, donde el número de microorganismos diazótrofos es generalmente mayor por la liberación y concentración disponible de nutrientes en forma de compuestos orgánicos 57.
Los microorganismos solubilizadores de fósforo conocidos como PSM hacen parte del grupo de microorganismos promotores de crecimiento vegetal (PGPM), que suplen las necesidades de fósforo en las plantas a través de la solubilización, usando mecanismos como la liberación de ácidos orgánicos, gradientes de protones y mecanismos de catálisis (acción de las fosfatasas). Dentro del grupo de bacterias solubilizadoras de fósforo más eficientes, se han reportado los géneros Bacillus spp., Pseudomonas spp., Rhizobium spp., Burkholderia spp., Achromobacter spp., Agrobacterium spp., Microccocus spp., Aerobacter spp., Azotobacter spp. y Erwinia spp., y hongos saprófitos, como Aspergillus niger, Penicillium bilaii, Penicillium simplicissimun, Trichoderma harzianum, y Clados-porium herbarum9.
Cuando el fósforo ya ha sido solubilizado por la intervención de PSM, puede reaccionar de nuevo con elementos metálicos del suelo. De esta manera, la dinámica microbiana seguirá siendo una solución viable a los problemas de baja disponibilidad de fosfato en suelos 59.
En la Tabla 2, se observan las bacterias que realizan actividad enzimática nitrogenasa o fitasa y su mecanismo de acción.
Tabla 2 Microorganismos con actividad enzimática Nitrogenasa o Fitasas.
| Microorganismos | Mecanismo de acción | Actividad enzimática Nitrogenasa | Actividad enzimática Fitasas |
|---|---|---|---|
| Azotobacter spp. | • pH: óptimo para crecer cuando fijan nitrógeno es 7.0 - 7.5. • Produce gran cantidad de exopolisacáridos. • Posee mecanismos de protección de la nitrogenasa: fija nitrógeno en aerobiosis. • Forma estructuras de resistencia (heterocistes) a la desecación y a la radiación. | X | |
| Rhizobium spp. | • Síntesis de auxinas el ácido indol-acético (AIA). • Alivia efectos de salinidad y acidificación. • Inducen resistencia a estrés. | X | |
| Azospirillum spp. | • Producción de fitohormonas estimuladoras. | X | |
| Acinetobacter spp. | •Producción de sideróforos. •Síntesis de fitohormonas. | X | |
| Pseudomonas spp. | • Liberan ácido indol-acético (AIA) citoquininas en la rizosfera de las plantas. • Efecto estimulador del crecimiento. • Control de patógenos sintetizando moléculas antifúngicas. • Producción de sideróforos. • Síntesis de proteasa lítica, inhibe hongos. | X | |
| Serratia spp. | • Alivia efectos de salinidad y acidificación. • Síntesis de fitohormonas. • Producción de sideróforos. | X | |
| Bacillus spp. | • Liberan ácido indol-acético (AIA) o citoquininas en la rizosfera de las plantas • Efecto estimulador del crecimiento. • Biocontrolador. | X |
Fuente: Las autoras.
Género Bacillus
El género Bacillus fue descrito por primera vez por Ferdinand Julius Cohn entre 1870 y 1880, su heterogeneidad en la fisiología ecológica dificulta su clasificación genética o su generalización (60). Mediante técnicas moleculares para el estudio del RNAr 16s, se ha logrado subdividir en cuatro grupos: el primer grupo se conoce como Bacillus senso stricto donde encontramos el Bacillus subtilis, el segundo grupo Bacillus sensu lato que incluye principalmente B. anthracis, B. thuringiensis y B. cereus, finalmente se han descrito dos grupos más con nuevas especies, destacando a B. horti, B. carboniphilus, B. chitinolycus, y B.infernus, entre otros 61.
Bacillus es un género de interés, dado que aporta un amplio perfil de diversidad fisiológica (acidofilia, alcalofilia, psicrofilia, termofilia y parasitismo), virtud que es otorgada por la formación de su espora, cualidad que le permite estar en diferentes hábitats tanto acuáticos como terrestres 61.
La interacción del género Bacillus con el hábitat terrestre puede ocurrir de forma directa o indirecta. La forma directa, cuando actúa como agente rizosférico, el cual tiene la capacidad de degradar sustratos derivados de la fauna, la flora y los compuestos de origen orgánico como los hidrocarburos; promueve la producción de antibióticos, promoción de crecimiento vegetal y los procesos de fijación de nitrógeno y solubilización de fosfatos y de forma indirecta, cuando actúa en la producción de sustancias antagonistas de patógenos o induciendo mecanismos de resistencia 62.
Nitrogenasas de Bacillus
Estas enzimas reducen la molécula de N2 y constan de dos componentes:
Componente I o dinitrogenasa: posee un cofactor que es una asociación entre hierro y molibdeno (FeMo) también llamado heterotetrámero, el cual forma parte del centro activo. La proteína Fe-M, donde el metal (M) puede ser molibdeno, vanadio o hierro, es un tetrámero α2β2 constituido por 30 átomos de hierro y dos del metal correspondiente, distribuidos en dos tipos de cúmulos: los empaques cúbicos o tipo "P" (8 Fe, 7 S2) y el cofactor Fe-M 63. Esta proteína es inactivada por el oxígeno.
Componente II o dinitrogenasa reductasa, la cual pasa los electrones al componente I, con consumo de ATP y el componente I cede posteriormente los electrones al sustrato. De la enzima hace parte el cofactor, que es donde se lleva a cabo la reacción con el sustrato. Puede estar asociado de manera permanente a la enzima, conociéndose entonces como grupos prostéticos, o de forma transitoria, denominándose cosustratos. 63. Como resultado, las nitrogenasas, simultáneo a la reducción de nitrógeno molecular, efectúan procesos de fijación de nitrógeno convirtiéndolo en amoniaco fácilmente asimilable por las plantas.
Para formar la enzima activa nitrogenasa se requiere una molécula del componente I y dos moléculas del componente II.
De acuerdo con el metal representativo en el centro activo se distinguen tres nitrogenasas, cuya diferencia radica en el catión hexacoordinado presente en el cofactor Fe-M:
Nitrogenasa de Mo. La más abundante, encontrada en todas las especies que contienen la enzima nitrogenasa.
Nitrogenasa de V. La segunda en abundancia y en ser descubierta. Se encuentra en Azotobacter vinelandii.
Nitrogenasa de Fe. Se encuentra en una proporción mucho menor a las anteriores. Aislada de Rhodobacter capsulat. 64
Fitasas de Bacillus
Con relación a las fitasas, se puede establecer que son enzimas pertenecientes a la subfamilia de las fosfatasas. Estas constituyen un conjunto diferenciado de enzimas que se clasifican en fosfatasas alcalinas, ácidas de alto y bajo peso molecular y fosfatasas-proteína, las cuales se diferencian por los valores de pH óptimos en los que catalizan las hidrólisis de los enlaces éster, afinidad por los cationes metálicos, especificidad por los substratos y, posiblemente, por los mecanismos de reacción 65.
Las fitasas (myoinositol hexafosfato hidrolasas) se encuentran de forma común en la naturaleza y pueden ser de origen microbiano, vegetal o animal. Un reciente grupo de proteínas fosfatasas tirosínicas que degrada ácido fitico (AF) se añadió a la lista de fitasas (Protein Tyrosin Phosphatases, "PTP"). Además, se han aislado (PAP's 5-fitasas) desde especies vegetales como alfalfa, porotos, arvejas, y del polen de la Lilia; y las de origen animal como las Selenomonas ruminantium, capaces de hidrolizar ácido fítico a ortofosfato inorgánico y una serie de ésteres fosfóricos menores liberando finalmente el myoinositol 66.
La IUPAC-IUB reconoce la 3-fitasa y la 6-fitasa, denominadas así por las posiciones en las que se inicia la reacción de hidrólisis sobre el enlace éster. La 3-fitasa se encuentra en animales y microorganismos mientras que la 6-fitasa está presente en vegetales. Existen evidencias de que las fitasas pueden incrementar significativamente la utilización y la disponibilidad de fósforo proveniente del ácido fítico y supone una reducción en la excreción de fósforo 67.
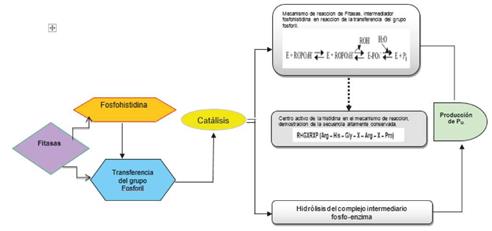
Estructuralmente las fitasas son enzimas que se clasifican como fosfohidrolasas, las cuales intervienen en la hidrólisis del ácido fítico (hexafosfato de inositol) o fitatos. Las fitasas bacterianas de acuerdo con los mecanismos catalíticos y la especificidad de hidrólisis se pueden categorizar en dos clases principales: (a) fitasas ácidas histidinas HAP y (b) fitasas alcalinas.
El género Bacillus produce fitasas alcalinas, es decir actúan a un pH que va de neutro a básico y a una temperatura de 70°C, lo que le confiere termo-resistencia. La capacidad hidrolítica que posee B. subtilis permite la reducción del ácido fítico impidiendo que se presente quelación de los minerales que se encuentran en la biomasa y así se evita que el fósforo y las diferentes trazas de elementos se vuelvan insolubles y se precipiten. En esto radica la importancia de la acción de estas bacterias frente al ciclo del fósforo y su función de beneficio a la biodiversidad de la flora y los suelos. 68
Estudios realizados por Haefner y colaboradores, en 2005, evidenciaron que la equivalencia de fósforo en las fitasas microbianas evaluadas mejoran las concentraciones de Ca, Mg y otros metales tales como Zn, Cu, Fe y Mn por efecto directo o indirecto. La producción de fitato inhibe enzimas proteolíticas que le permiten secuestrar ciertos azúcares, lo que favorece la producción de energía (fotosíntesis) para un óptimo desarrollo de los ciclos biológicos sobre los que influye 68.
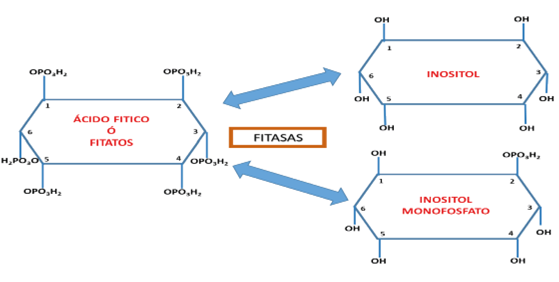
Dentro de los compuestos catalizados por las fitasas se ha detectado con mayor proporción el ácido fítico o myo-inositol 1, 2, 3, 4, 5, 6 - hexaquis dihidrógeno fosfato (IUPAC and IUPACIUB, 1968; IUPAC-IUB, 1977). Su fórmula química es C6H18O24P6 y presenta una masa mol de 659,86 g/mol. Se caracteriza por poseer un alto contenido en fósforo, de aproximadamente un 28,2%, se trata de un líquido de color amarillo claro y se encuentra en un mayor porcentaje en el reino vegetal, es soluble en solventes polares e insoluble en solventes no polares; suele aislarse en compañía de las sales de sodio y calcio que le otorgan estabilidad. Se ha descrito que las fitasas mediante hidrólisis pueden remover grupos fosfatos presentes en ácido fitico, convirtiéndolos en myo-inositol, fosfatos y fosfatos orgánicos 66.
Estudios han evidenciado que la interacción entre el fitato y los minerales ponen de manifiesto la existencia de una relación inversamente proporcional en cuanto a la absorción de micronutrientes y el AF, que alteran de manera visible las condiciones físicas y químicas de las plantas. La participación de la enzima fitasa es importante porque cataliza los procesos de desfosforilación de los grupos fosfoéster liberando secuencialmente hasta 6 grupos ortofosfatos libres. Por cambios bioquímicos que actúan a un pH neutro permiten la movilización de Pi hacia la planta generando reservas de fósforo para el adecuado crecimiento y desarrollo fisiológico 2.
Un gran número de fosfatasas ácidas, de procariotas y eucariotas comparten dos regiones similares, alrededor de un residuo de histidina conservado, la cual participa en procesos de catálisis enzimática actuando de dos formas: la primera se localiza en la sección N-Terminal y forma un intermediario de fosfohistidina; mientras que la segunda se localiza en la sección C-Terminal y posiblemente actúa como donador de protones. La capacidad de producción de fosfatasas, por parte de los microorganismos, sugiere el gran potencial de los mismos para contribuir a la mineralización del P. 70,71).
La reacción de la fitasa, requiere de un intermediario de fosfohistidina en la reacción de transferencia del grupo fosforil catalizándose la hidrólisis como aparece en la Figura 5:
Ácido fítico y cationes
Investigaciones realizadas en 1987 y 1988 permitieron deducir que las interacciones que se presentan entre el AF y los cationes, conllevan a la formación de una variedad de sales de myo-inosi-tol hexaquisfosfato. Estas sales presentan distintas características dependiendo del tipo de catión que las constituya y del pH en que se encuentre el ácido fítico. Las sales que se forman a partir de esta interacción se denominan fitatos formándose con cationes de Na+, Mg+2, K+, Ca+2, Zn+2, Cu+1+2 y Fe+2+3. La fitina se define a partir de la mezcla de sales de Ca y Mg con AF, estas son predominantes en la asociación planta-microorganismo cuando cumple la función de fosfato, myo-inositol y liberación de cationes durante la germinación.
La solubilidad de sales y proteínas está relacionada con el pH, el número de protones y la formación de complejos a partir de sus cargas eléctricas: iones libres de los grupos fosfato 66,67.
En respuesta a la acción enzimática de fosfori-ladores, se puede decir que en la última década se han incrementado los estudios experimentales sobre el análisis bioquímico y su interacción entre microorganismos y vegetales, evidenciándose el aumento en la concentración del fósforo disponible en formas asimilables y en el proceso continuo de la absorción de otros tipos de nutrientes, los cuales generan una respuesta positiva frente a las características de los suelos y las plantas 2.
Uso de las nitrogenasas y fitasas en la actualidad
Las nitrogenasas de Bacillus tienen como función principal un interés agronómico y ecológico, aunque su mecanismo de acción no está bien definido, la fijación del nitrógeno significa un aporte fundamental en los ecosistemas naturales que se ven saturados por la aplicación de fertilizantes debido a que estos contaminan los mantos acuíferos, son de altos costos y suelen perderse grandes cantidades de N por lixiviación 73.
La fijación biológica del nitrógeno mediada por Bacillus mejora la fertilidad del suelo en comparación con la fertilización química y orgánica que genera altos niveles de contaminación con sales nitrogenadas, metales pesados, y microorganismos patógenos para el ser humano y los animales. Especies como B. fusiformis aislados de maíz, trigo y arroz, han sido caracterizados con una elevada actividad nitrogenasa, demostrando su excelente fijación de nitrógeno. Estudios han mostrado que la especie B. firmus tiene la capacidad de potenciar la actividad nitrogenasa de microorganismos aislados de otras plantas como Dactylus glomerata, aumentando la cantidad de nitrógeno fijado por la planta, lo cual conlleva a una reducción considerable en el uso de fertilizantes nitrogenados de origen químico 74.
Bacillus cereus se ha usado en consorcio con Rhizobium, permitiendo la formación del nódulo, y aumentando la actividad nitrogenasa para obtener un incremento en la producción de guandul (Cajanus cajan L)75. Por otro lado, se han realizado co-inoculaciones en cultivos de soya con especies de Azospirillum que aumentan la actividad nitrogenasa, favoreciendo así la fijación del nitrógeno atmosférico 76. Así mismo, el fósforo y la solubilización de éste, también tiene diversas maneras en las que se puede aprovechar mediante el uso de las fitasas; la relación entre la capacidad de solubilización de fosfatos por microorganismos y su influencia positiva en la naturaleza generalmente pasa por diferentes procesos como la producción de ácidos orgánicos, quelación y reacciones de intercambio.
Las fitasas de Bacillus suelen ser usadas como aditivo en los cereales y alimentos de producción animal para mejorar la biodisponibilidad del fosfato y cationes divalentes del fitato 77. Diversos estudios experimentales han mostrado el efecto en la disponibilidad del fósforo y otros nutrientes, en animales como camarones, aves y cerdos que poseen estómagos simples con poca actividad fitasa digestiva. Este tipo de animales no son capaces de utilizar el fitato-P y por ende necesitan suplementos alimenticios de fosforo inorgánico, que es costoso y no renovable de tal forma que se mejora su asimilación y aumenta la producción animal, lo cual representa reducción de la contaminación causada por el fósforo. 78. El fitato-P que no es usado en la dieta es excretado y puede causar una fuerte polución en áreas donde se maneja producción intensiva de estos animales 79.
La eutrofización es el proceso de cambio de un estado trófico a otro de nivel superior por adición de nutrientes. La agricultura es uno de los factores principales de eutrofización de las aguas superficiales. En cuanto a la acuicultura, los costos de alimentación representan aproximadamente el 70% del costo total de producción, los peces no pueden utilizar el fósforo de la fitina que provee el alimento por lo cual este es excretado en el agua siendo un foco de contaminación; por otro lado, las fitasas bacterianas son un excelente medio para favorecer la asimilación del fósforo y mantener los niveles de éste aceptables en el agua 80.
Las fitasas tienen la capacidad de mejorar la bio-disponibilidad de minerales y oligoelementos al ser adicionadas en el proceso de elaboración de los alimentos, ya que impactan positivamente el proceso de producción, el rendimiento y la calidad final del producto 81. En la producción de alimentos a base de plantas, la introducción de una fitasa exógena representa un aumento considerable en la cantidad de proteínas, mejora la biodisponibilidad mineral, su composición de aminoácidos, y la digestibilidad in vitro de la proteína; por lo cual es muy usada en formulaciones de alimentos para niños 82.
La adición de fitasas junto con otras enzimas que degradan la pared celular vegetal en el proceso de maceración en la molienda del maíz facilita la obtención del licor de maíz, suaviza el grano, mejora el rendimiento del almidón y la separación del gluten y la fibra; así como facilita la reducción en los tiempos de remojo en la molienda. El licor de maíz libre de fitato, es muy usado en la industria de la fermentación para la producción de compuestos enzimáticos, levadura, polisacáridos, antibióticos y aminoácidos como ingrediente en alimentos para animales 83,84.
En la nutrición humana, las fitasas han sido empleadas para mejorar la calidad nutricional de los alimentos y hacerlos funcionales. Estas enzimas comienzan la defosforilación del myo-inositol en las posiciones 3 y 6 respectivamente. La 3-fita-sa se encuentra en animales y microorganismos mientras la 6-fitasa está presente en vegetales. La aplicación de fitasas exógenas como las de Bacillus spp., durante el procesamiento de alimentos como cereales y leguminosas mejora la hidrólisis del ácido fítico permitiendo una mayor asimilación de éste y así reducir el riesgo de padecer déficit de minerales en la nutrición 85.
Desde el punto de vista genético, la expresión de fitasas inducida en bacterias, es regulada y se utiliza para desarrollar nuevas estrategias en la solubilización del fósforo en el suelo, siempre y cuando exista una disponibilidad de Pi y Po 86.
Se observa un aumento considerable a escala mundial de la inclusión de estas enzimas en la producción de bioinsumos como productos que favorecen la agricultura sostenible y brindan alternativas emergentes a la sostenibilidad de las necesidades del campo. Un bioinsumo está constituido por abono orgánico natural, micorrizas, feromonas, parasitoides, extractos de plantas y entomopatógenos, los cuales ayudan a que los sistemas agrícolas se recuperen más rápidamente para volverse a cultivar, son menos costosos que los productos químicos, son de alta especificidad y actualmente, se ha encontrado mayor efectividad con el uso de bacterias como Bacillus thu-ringiensis y hongos como Metarhizium anisopliae y Beauveria bassiana. Por otro lado, a nivel de productividad en las industrias agrícolas, tenemos que la soya en Suramérica, en su mayoría es fertilizada con inoculantes de alta calidad, producidos a partir de Bradyrhizobium japonicum87 y en México, gran parte de los cultivos de maíz son biofertilizados con la bacteria fijadora de nitrógeno Azospirillum brasilense 88.
Biofertilizantes
Los biofertilizantes mejoran la disponibilidad de nutrientes a los cultivos, y conservan el suelo desde su diversa función biológica. La importancia de los microorganismos y su relación con el ambiente se ha ido enfocando actualmente en la necesidad de aprovechar la versatilidad benéfica de ciertos agentes biológicos a la agricultura y a favorecer la interacción fitoestimulante, al suministro de nutrientes por acción de los ciclos biogeoquímicos, al mejoramiento de la estructura con formación de agregados estables, a la función del control biológico, eliminación de productos xenobióticos y al mejoramiento ecofisiológico, mediante el incremento de la resistencia de las plantas al estrés tanto biótico como abiótico 89.
La actividad de los biofertilizantes se centra en los diferentes ciclos biológicos dado que por medio de reacciones enzimáticas se sintetizan, solubilizan o fijan los diferentes elementos químicos, donde pueden generar dos tipos de reacciones: la primera es la síntesis de nuevas sustancias benéficas frente a la restauración, por la producción de sustancias antagónicas frente a patógenos y la segunda, se centra en la promoción de crecimiento vegetal 90.
El manejo de los inoculantes debe ser analizado previamente teniendo en cuenta la deficiencia de nutrientes, la fluctuación de crecimiento de los microorganismos nativos, su capacidad de colonización, síntesis de sustancias que promueven el crecimiento de la planta, fijación del nitrógeno atmosférico, solubilización del hierro, fósforo inorgánico y mejoramiento de la tolerancia al estrés exógeno natural o inducido 91.
Aunque en muchos países desarrollados se manejen tecnologías muy avanzadas y novedosas para producir estos inoculantes hay cierta renuencia para su aplicación en áreas rurales debido a que han sido asociados con enfermedades en humanos y animales; muchos de estos agentes biológicos (Bacillus spp, Pseudomonas spp., Trichoderma spp., Rhizobium spp., Azotobacter spp., Azospiri-llum spp, etc.)
El género Bacillus ha sido estudiado por poseer una variedad de mecanismos, entre ellos la fijación biológica del nitrógeno y la solubilización de fosfatos, que ha impulsado diferentes estudios en el sector agrícola que buscan la disminución, y en el mejor de los casos, la erradicación de los fertilizantes químicos, acción que representaría un impacto positivo sobre el medio ambiente Sumado a estos beneficios se destaca la capacidad de degradación de sustratos de plantas y animales, la producción de antibióticos, la capacidad de sobrevivir en múltiples condiciones ambientales y la actividad antagónica e inhibidora entre otras, pone al género Bacillus en un lugar destacado para su uso en la agricultura sostenible 92.
Conclusiones
Los fertilizantes químicos solubles, de acción lenta y con propiedades quelantes generan grandes cantidades de compuestos y elementos que no pueden ser usados por las plantas y que tienden a bioacumularse, contaminando con sustancias tóxicas al suelo, las cuales afectan la microbiota y biomasa en general.
De acuerdo con la literatura consultada el género Bacillus se reporta más con capacidad solubilizadora de fosfato y muy poco con la fijación de nitrógeno.
El género Bacillus presenta diversas características y versatilidad para su aplicación, haciéndolo un excelente candidato en el mejoramiento de la disponibilidad de nutrientes para las plantas y para la recuperación de suelos.
Los suelos agrícolas tienen cantidades de fosfatos insolubles que solo pueden ser aprovechados por las plantas mediante la acción enzimática microbiana. Las fitasas, producidas por Bacillus desempeñan un papel muy importante en la nutrición de las plantas mejorando la disponibilidad de fósforo, por lo que son usadas como biofertilizantes.
Existen muchas referencias en relación con la capacidad de fijación de nitrógeno por microorganismos; sin embargo, no hay suficientes fuentes que describan el mecanismo de acción de las nitrogenasas del género Bacillus. Se encuentran reportes que clasifican este género bacteriano como fijador de nitrógeno junto a otros microorganismos formando consorcios y demostrando que tienen actividad nitrogenasa, lo cual se ha demostrado en medios selectivos.
Las especies del género Bacillus y el potencial de sus enzimas amplían las perspectivas de uso para una agricultura sostenible, lo que permite la conservación del medio ambiente y un mejoramiento de la calidad y la producción en cultivos de interés agrícola. Lo anterior, a su vez, genera excelentes resultados y reduce su impacto en la saturación de los suelos, costos en la producción y contaminación al medio ambiente.
Mediante esta revisión se evidencia que el género Bacillus spp. es un agente biofertilizante que ha sido estudiado en las ultimas 5 décadas con un crecimiento significativo, relacionado con las actividades físico-químicas de las enzimas nitro-genadoras y fosforiladoras que contribuyen a la promoción de crecimiento vegetal.
El uso de fertilizantes biológicos, favorece el desarrollo de asociaciones de micorrizas incrementando la disponibilidad del fósforo, y brindando un suministro continúo de micronutrientes al suelo; por tanto, reduciendo el desarrollo de ciertas enfermedades en las plantas. También contribuye al mantenimiento de concentraciones de nitrógeno y fósforo disponibles, minimizando la lixiviación e incrementando la retención de agua.
Debido a la riqueza genética de los ecosistemas del trópico, el uso de la biodiversidad vegetal y/o microbiana es una apuesta natural para resolver la necesidad de producción de alimento de tipo vegetal y así contribuir a erradicar el hambre y mantener los ecosistemas.