Introducción
En los últimos años se han realizado investigaciones dirigidas a buscar nuevas terapias antimicrobianas como opciones alternas a los tratamientos con an tibióticos conocidos 1,2, debido a la alta tasa de resistencia que presentan los patógenos microbianos en todo el mundo. Este importante problema de sa lud pública involucra a todos los países y estamentos mundiales debido a su impacto en la salud, como en el costo-beneficio que implica tratar estas patologías 1.
Estudios realizados por la Organización Mundial de la Salud (OMS), Comunidad Andina de Naciones (CAN) y la Universidad Nacional de Colombia 3, entre otros estamentos nacionales e internaciona les 4, establecen que mediante la bioprospección y aprovechando los recursos naturales, se podrían diseñar alternativas de tratamiento 5-6. Uno de los organismos con los cuales se está trabajando para obtener nuevos compuestos antimicrobianos son las plantas.
El género Bauhinia está ampliamente distribui do (familia: Caesalpiniaceae) caracterizada por ser árboles, arbustos trepadores y de fácil adaptación. Ciertas especies de Bauhinia tienen una larga histo ria de usos medicinales tradicionales 7. La planta Bauhinia sp., conocida comúnmente como "pata de vaca" es ampliamente utilizada en la medicina tra dicional. Su corteza, raíces, hojas, semillas y flores se usan por sus propiedades medicinales. Se ha utilizado en dispepsia, bronquitis, lepra, úlcera; para prevenir la obesidad, como astringente, tónico y an tihelmíntico 8.
Otra planta usada por nuestros ancestros es Sambucus nigra (Familia: Caprifoliacea), conocida como "Sauco", una planta arbustiva de origen europeo. Sus frutos, hojas, corteza y raíces son ampliamente utilizados en la medicina tradicional por sus propie dades terapéuticas identificadas (diuréticas, antipi réticas, antisépticas, cicatrizantes, antiinflamatorias y contra los problemas respiratorios) 9-10.
Eichhornia crassipes, conocida comúnmente como "buchón de agua" o "jacinto de agua" y originaria de Brasil, es una planta acuática perteneciente a la familia Pontideriaceae. El buchón de agua es una planta flotante, que se caracteriza por formar densas poblaciones en el agua y el barro 11, puede tener efectos negativos sobre el medio ambiente, la salud humana y desarrollo económico por la invasión que realiza en los cuerpos de agua 12. Estudios han de mostrado la eficacia del extracto crudo de Eichhornia crassipes y varias fracciones frente a bacterias Gram positivas y Gram negativas, encontrándose diversas actividades antibacterianas atribuidas a algunas de las fracciones aisladas 13-14.
Taraxacum officinale es una planta herbácea peren ne de la familia Asteraceae, conocida comúnmente como "diente de león". La planta crece en las regio nes templadas del mundo. Esta planta es utilizada tradicionalmente para la indigestión, retención de líquidos y para hepatitis 14. Taraxacum officinale se ha demostrado que posee compuestos con una amplia variedad de actividad antimicrobiana frente a patógenos tanto Gram positivos como Gran nega tivos 15.
Esta investigación buscó establecer el efecto y la posible actividad antimicrobiana de los extractos obtenidos a partir de Bauhinia sp., Sambucus nigra, Eichhornia crassipes y Taraxacum officinale con po tencial antimicrobiano frente a siete bacterias y una levadura de importancia clínica en Colombia, me diante pruebas de susceptibilidad en placa y perfil fitoquímico.
Materiales y métodos
Material vegetal
Sambucus nigra, Taraxacum officinale, Bauhinia sp., se adquirieron por compra en Bogotá D.C., Colom bia y Eichhornia crassipes se obtuvo por donación del dueño de la finca "El Jardín" ubicada en la vereda de Chicaque, Municipio de San Antonio del Tequendama, departamento de Cundinamarca, Colombia. La identificación taxonómica de las cuatro plantas se realizó en el Herbario del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia.
La selección del material vegetal se hizo de acuerdo con lo recomendado por Brango y colaboradores 16 y se eliminó el que presentaba manchas, que maduras, daño de tejido por hongos o bacterias. Las partes utilizadas de cada planta fueron: tallos y hojas para Bauhinia sp., Eichhornia crassipes y Taraxacum officinale y para Sambucus nigra hojas, tallos, flores y bayas. Las partes de las plantas fueron tomadas según disponibilidad al momento de su compra y recolección respectivamente.
Secado y molienda
Las hojas, tallos y flores, según correspondió de cada planta, se secaron, separando cada parte, a una tem peratura promedio de 42°C por un período de 4 días. Una vez secas las partes de las plantas, se pro cedió al triturado 16. Para las bayas de S. nigra se procedió a extraer el zumo y realizar su respectiva extracción 16.
Extracción con solventes orgánicos
Para realizar la extracción etanólica de los tallos, hojas y flores se siguió el protocolo de Tello y cola boradores 17, las diferentes partes de las plantas trituradas (250g por cada parte de las plantas) se depositaron en recipientes de vidrio y se procedió a agregar 500ml de etanol en cada recipiente y se dejó en obscuridad y sellado por ocho días. Posterior a este periodo se procedió a filtrar todo el material mediante un sistema al vacío mediante embudo de Büchner, luego se concentró en el rotaevaporador (Eyela®) a 40°C y 175mbar 17.
La extracción del zumo de las bayas de Sambucus nigra se realizó con butanol debido a que los com puestos que se hallaban en esta parte de planta son en su mayoría polares y este solvente permite su ma yor recuperación en sustancias acuosas 16.
Análisis fitoquímico
Para realizar el análisis fitoquímico se partió del extracto etanólico concetrado y se evaluaron los si guientes componentes según el protocolo de Harborne y colaboradores 18.
Quinonas. 1mg de extracto se trató con HCl concentrado y se observó la formación de precipitado de color amarillo 18.
Flavonoides. Una pequeña cantidad de cada extracto se disolvió en H2SO4 y se observó co loración amarilla para flavonoides, naranja para flavonas y rojo-azuloso para chalconas 18.
Alcaloides. Prueba de Wagner: una fracción del extracto se trató con reactivo de ensayo de Wag ner [1,27g de yodo y 2g de yoduro de potasio en 100ml de agua] y se observó la formación de color rojizo precipitado marrón 18.
Saponinas. Una pequeña cantidad de cada ex tracto se agitó con agua y se observó la formación de espuma persistente por más de dos minutos 18.
Triterpenos. Prueba de Liebermann-Burchard: se mezcló 1mL de anhídrido acético y uno de cloroformo, se enfrió a 0° y se le añadió gota a gota H2SO4. Se interpretó como positivo si ocu rrió formación de colores azul, verde, rojo, ana ranjado 18.
Fenoles. Prueba de cloruro férrico: Una frac ción de cada extracto se trató con cloruro férrico al 5% y se observó la formación del color azul o negro profundo 18.
Como controles se utilizaron aceites esenciales de eucalipto y tomillo.
Separación y visualization de las fracciones por cromatografía en capa fina
Para realizar este proceso se utilizó el extracto con centrado etanólico y se procedió a realizar una cro matografía para alcaloides, flavonoides, saponinas y triterpenos siguiendo el protocolo de Wagner 19. Los controles de las pruebas fueron adquiridos en el departamento de química de la Universidad Na cional y fueron específicos para cada cromatografía. Para Alcaloides se usó Efedrina, para flavonoides se utilizó Flavones (Flavonol), para saponinas se utilizó Saponinas purificadas y para triterpenos se utilizó Lupeol. La lectura de las cromatografías se realizó a una longitud de onda 365nm (luz U.V).
Ensayo de la actividad antimicrobiana
Para valorar la actividad antimicrobiana de los ex tractos etanólicos de Bauhinia sp., Sambucus nigra,Eichhornia crassipes y Taraxacum officinale se siguió el protocolo de la CLSI de susceptibilidad antimi crobiana por difusión en agar 20, por duplicado de cada parte de las plantas frente a ocho bacterias y una levadura. Se utilizaron cuatro concentraciones de cada extracto. Las cepas bacterianas ensayadas fueron: Streptococcus pneumoniae, Enterococcus faecium resistente a vancomicina, Klebsiella pneumoniae con presencia de KPC, Providencia rettgeri con presencia de ESBL, Pseudomonas aeruginosa ATCC 9027, Enterobacter cloacae, Escherichia coli, Staphylo coccus aureus (3-lisina ATCC 29213 y la cepa del hongo Candida albicans.
Como diluyente se utilizó Dimetil Sulfóxido (DMSO) para realizar la suspensión de los extrac tos y sus respectivas diluciones siguiendo el proto colo de Tello y colaboradores 17. La suspensión en DMSO se realizó debido a las características que posee de conservar principios activos en los medi camentos y facilitar su difusión en medios polares.
Se realizaron controles de crecimiento, esterilidad y de susceptibilidad antimicrobiana con antibióticos comerciales específicos para cada microorganismos ensayado.
Resultados
Análisis Fitoquímico
La Tabla 1 muestra los resultados obtenidos del análisis fitoquímico. Las hojas y flores de Sambucus nigra y los tallos de Bauhinia sp., tenían todos los grupos de complejos buscados a excepción de fe noles, mientras que por el contrario el único extracto de las plantas que tenía fenoles fue el zumo de Sambucus nigra. Los extractos que menos compuestos presentaron fueron los de las hojas de Eichhornia crassipes y Bauhinia sp., los cuales solo presentaron triterpenos. Según los resultados obtenidos mediante el análisis fitoquímico, se evidenció que los componentes más frecuentes en las plantas en estudio son los triterpenos, con presencia en ocho de las diez partes de las plantas analizadas; seguidos de los flavonoides, con el mismo número de test positivos, pero en menor cantidad.
Tabla 1 Análisis fitoquímico obtenido de los extractos orgánicos.
| PLANTA / ENSAYO | Control con aceites escenciales | Sambucus nigra | Eichhornia crassipes | Bauhinia sp | Taraxacum officinale | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Control | Hojas | Tallos | Flores | Zumo | Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | |||||
| Quinonas +++ | ++ | ++ | +++ | - | - | + | - | + | +++ | +++ | |||||
| Flavonoides +++ | +++ | +++ | +++ | +++ | - | + | - | +++ | ++ | + | |||||
| Alcaloides +++ | +++ | - | +++ | ++ | - | - | - | ++ | - | - | |||||
| Saponinas +++ | ++ | - | + | + | - | + | - | ++ | - | + | |||||
| Trierpenos +++ | +++ | - | +++ | - | +++ | +++ | +++ | +++ | +++ | ||||||
| Fenoles +++ | - | - | - | +++ | - | - | - | - | - | - | |||||
| + Poca cantidad, ++ j | Moderada Cantidad, +++ | Abundante cantidad, - | No se | evidencia reacción | |||||||||||
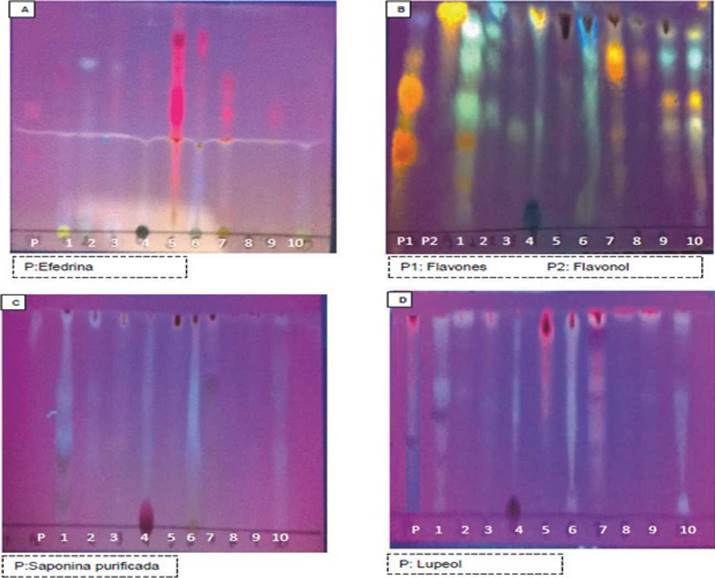
Figura 1 Cromatografías reveladas leídas en luz U.V. (365 nm) A. Alcaloides. B. Flavonoides. C. Saponinas. D. Triterpenos. P: Control 1: Sambucus nigra hojas, 2: Sambucus nigra tallos, 3: Sambucus nigra flores, 4: Sambucus nigra zumo, 5: Eichhornia crassipes hojas, 6: Eichhornia crassipes tallos, 7: Bauhinia sp. tallos, 8: Bauhinia sp. hojas, 9: Taraxacum officinale hojas, 10: Taraxacum officinale tallos.
Ensayos de actividad antimicrobiana por difusión en agar
El análisis por cromatografía de capa fina para alcaloides, Figura 1A, evidenció que los tallos de T. officinale (posición 10) fueron los únicos que no tenían ningún tipo de compuesto perteneciente al grupo de los alcaloides. Para flavonoides (Figura 1B), la única muestra en donde no se relevaron flavonoides fue la correspondiente a las hojas de E. crassipes (posición 5). En el análisis de saponinas (figura 1C), las hojas de E. crassipes (posición 5) y hojas de Bauhinia sp. (Posición 8), fueron las únicas muestras en las que no se identificaron compuestos del tipo saponinas. Para el análisis de triterpenos (figura 1D) la cromatografía evidenció que todas las muestras presentaban por lo menos un compuesto de este tipo.
Tabla 2 Lectura de halos de inhibición obtenidos como resultado del ensayo de actividad antimicrobiana por difusión en agar.
| PLANTA Y PARTE | CONCENTRACIÓN | MICROORGANISMOS UTILIZADOS EN LAS PRUEBAS DE ACTIVIDAD ANTIMICROBIANA HALOS DE INHIBICIÓN (mm) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| DE EXTRACTOS | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1000 ng/|J | 11,5 | 22 | 11 | 12 | 12 | 10,5 | 11 | 13 | 17 | |
| T. officinale | 500 ng/|J | 11 | 15 | 10 | 11 | 10,5 | 10,5 | 10 | 12 | 11,5 |
| tallos | 250 ng/nl | 10 | 6 | 9,5 | 9,5 | 9 | 7,5 | 8 | 10 | 9 |
| 125 ng/nl | 9 | 6 | 9 | 8,5 | 7 | 6 | 6 | 8,50 | 6 | |
| 1000 ng/|J | 14,5 | 10 | 8,5 | 10,5 | 10,5 | 8,5 | 8,5 | 8,5 | 25 | |
| T. officinale | 500 ng/|J | 10 | 9 | 9 | 9,5 | 8,5 | 7,5 | 7,5 | 7 | 12 |
| hojas | 250 ng/nl | 8 | 8 | 6 | 10,5 | 6 | 6 | 6 | 6 | 10,5 |
| 125 Mg/M | 6 | 6 | 6 | 9 | 6 | 6 | 6 | 6 | 9 | |
| 1000 Mg/il | 12 | 20,5 | 7,5 | 11,5 | 18 | 11,5 | 8 | 12 | 12 | |
| E. crassipes | 500 Mg/il | 12 | 15,5 | 8,5 | 8,5 | 10 | 10 | 8 | 10 | 10 |
| tallos | 250 Mg/il | 8 | 6 | 6 | 6 | 8 | 9 | 9 | 6 | 9 |
| 125 Mg/il | 6 | 6 | 6 | 6 | 6 | 8 | 6 | 6 | 6 | |
| 1000 Mg/Ml | 14 | 17,5 | 10 | 15 | 11,5 | 10 | 10,5 | 12,5 | 16,5 | |
| E. crassipes | 500 Mg/Ml | 11,5 | 12 | 9 | 10 | 10 | 9,5 | 9,5 | 10,5 | 15,5 |
| hojas | 250 Mg/Ml | 11 | 12 | 7 | 9 | 9 | 9 | 8 | 8 | 15 |
| 125 Mg/Ml | 10 | 6 | 6 | 9 | 8 | 6 | 7 | 6 | 11 | |
| 1000 Mg/Ml | 11 | 6 | 9 | 10,5 | 9 | 9,5 | 9,5 | 12,5 | 12,5 | |
| Bauhinia sp. | 500 Mg/Ml | 11 | 6 | 8 | 9 | 8,5 | 8,5 | 8,5 | 11,5 | 10 |
| Tallos | 250 Mg/Ml | 6 | 6 | 6 | 7 | 8 | 7,5 | 6 | 10 | 9 |
| 125 Mg/Ml | 6 | 6 | 6 | 7 | 8 | 7 | 6 | 9 | 8 | |
| 1000 Mg/Ml | 12 | 14 | 11,5 | 13,5 | 10 | 8 | 10 | 8 | 11,5 | |
| Bauhinia sp. | 500 Mg/Ml | 10 | 10 | 10 | 9 | 9 | 6 | 8 | 6 | 10 |
| hojas | 250 Mg/Ml | 6 | 6 | 8 | 7,5 | 7,5 | 6 | 8,5 | 6 | 6 |
| 125 Mg/Ml | 6 | 6 | 6 | 6 | 7 | 6 | 6 | 6 | 6 | |
| 1000 Mg/Ml | 10,5 | 13,5 | 7,5 | 12 | 6 | 10 | 8 | 16 | 15,5 | |
| S. nigra tallos | 500 Mg/Ml | 10 | 10 | 6 | 10,5 | 6 | 7,5 | 7,5 | 14,5 | 9,5 |
| 250 Mg/Ml | 8 | 9 | 6 | 9 | 6 | 8 | 7 | 13 | 9 | |
| 125 Mg/Ml | 6 | 6 | 6 | 8 | 6 | 6 | 6 | 12,5 | 8 | |
| 1000 Mg/Ml | 10 | 15 | 6 | 8 | 10 | 9 | 9 | 15 | 13,5 | |
| S. nigra hojas | 500 Mg/Ml | 8 | 6 | 6 | 7 | 8 | 7 | 8 | 13 | 12 |
| 250 Mg/Ml | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 10 | 10 | |
| 125 Mg/Ml | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9,5 | 8,5 | |
| 1000 Mg/Ml | 13 | 20,5 | 9 | 8 | 12 | 8 | 9,5 | 20 | 10,5 | |
| S. nigra flores | 500 Mg/Ml | 12 | 17 | 7 | 8 | 10 | 8 | 8 | 17 | 9 |
| 250 Mg/Ml | 9 | 11 | 7 | 8 | 10 | 7 | 8 | 15 | 6 | |
| 125 Mg/Ml | 8 | 6 | 6 | 6 | 10 | 7 | 6 | 14 | 6 | |
| 1000 Mg/Ml | 11 | 6 | 8 | 8 | 9 | 6 | 6 | 6 | 25 | |
| S. nigra | 500 Mg/Ml | 9 | 6 | 7 | 8 | 8 | 6 | 6 | 6 | 19 |
| zumo | 250 Mg/Ml | 8 | 6 | 6 | 7 | 8 | 6 | 6 | 6 | 14 |
| 125 Mg/Ml | 6 | 6 | 6 | 6 | 7 | 6 | 6 | 6 | 6 | |
1: Streptococcus pneumoniae. 2: Enterococcus faecium resistente a la vancomicina. 3: Klebsiella pneumoniae con KPC (productora de carbapenemasa). 4: Providencia rettgeri ESBL (Betalactamasas de espectro extendido). 5: Pseudomonas aeruginosa. 6: Enterobacter cloacae 7: Escherichia coli. 8: Staphylococcus aureus. 9: Candida albicans. Medición dada en milímetros (mm).
En los ensayos de susceptibilidad antimicrobiana por difusión en agar los resultados para S. pneumoniae se obtuvieron con el extracto de hojas de T. officinale a una concentración de 1000μg/μl con un halo de inhibición de 14.5mm. El mejor extracto frente E. faecium resistente a vancomicina fueron los tallos de T. officinale a una concen tración de 1000μg/μl con un halo de inhibición de 22mm de diámetro. Para K. pneumoniae con KPC se observó que el extracto hojas Bauhinia sp. fue el que presentó mayor efectividad en la concentración de 1000μg/μl con una inhibición de 11.5mm. En el caso de P. rettgeri con ESBLs el extracto de hojas de E. crassipes fue el más efectivo a una concentración de 1000μg/μl con un diá metro de inhibición de 15mm. P. aeruginosa pre sentó un halo de inhibición de 18mm a una con centración de 1000μg/μl del extracto de tallos de E. crassipes. E. cloacae fue inhibida con 11.5mm a 1000μg/μl con el extracto de tallos de E. crassipes. El extracto de tallos de T. officinale inhibió a E.coli con un halo de 11mm a una concentración de 1000μg/μl. Para S. aureus el extracto de lores S. nigra resultó ser el más efectivo a una concentra ción de 1000μg/μl inhibiéndolo con 20 mm de diámetro y fue efectivo hasta una concentración de 125 μg/μl con 14 mm de inhibición. C. albicans fue inhibida con un halo de 25 mm a una concertación de 1000 μg/μl del extracto zumo S. nigra efectivo hasta una concentración de 250 μg/μl con 14 mm de inhibición.
Discusión
La resistencia bacteriana demostrada por inves tigadores de todo el mundo es el motivo por el cual en forma permanente se estén investigando nuevos compuestos, particularmente y en consi deración a las investigaciones genéticas que han demostrado genes de resistencia en microorganis mos 19-21. En el siglo XXI hay un buen nú mero de estudios en donde la búsqueda se centra en diferentes recursos naturales, principalmente en las plantas, debido a la riqueza en compuestos con diferentes actividades, entre ellas la capaci dad de inhibir el crecimiento de microorganismos 22,23.
Los diversos mecanismos de acción antibacteriana de las plantas y los posibles metabolitos implicados han sido estudiados mediante ensayos de suscepti bilidad antimicrobiana y análisis fitoquímicos de bido a los potenciales usos contra las enfermedades infecciosas (24, 25). El presente estudio reveló la presencia de metabolitos secundarios como terpenoides, compuestos fenólicos, flavonoides, saponinas y alcaloides en los extractos de Bauhinia sp., S. nigra, T. officinale y E. crassipes (Tabla 1 y Figura 1). Algunos de los extractos derivados de las plan tas analizadas presentaron actividades antimicro bianas relevantes, Tabla 2.
Los estudios realizados demuestran que los metabolitos, en su mayoría secundarios, tales como alcaloides, flavonoides, taninos, y otros compues tos de naturaleza fenólica son responsables de las actividades antimicrobianas en plantas superiores 26,27.
Los flavonoides son hidroxilados de sustancias fenólicas que suelen ser sintetizados por las plantas en respuesta a las infecciones microbianas 28, la actividad antimicrobiana de los flavonoides puede deberse a su habilidad para formar interacciones proteicas con proteínas intracelulares y por la in teracción para la formación de complejos con las paredes celulares bacterianas que involucra la lisis celular 29.
Los terpenoides también han sido informados como antimicrobianos debido a la capacidad que poseen de causar una desestabilización en la inte gridad y permeabilidad de la membrana, al inter ferir con la disipación de la fuerza de los protones 30. Por lo tanto, la presencia de terpenoides y compuestos fenólicos podrían explicar la actividad antimicrobiana observada en el presente estudio.
Se ha demostrado la presencia de flavonoides, alcaloides, saponinas y triterpenos con actividad antimicrobiana en las plantas Fabáceas como Bauhinia sp., la cual ha sido comprobada frente a E. coli, S. aureus resistente a la meticilina y K. pneumoniae31. Estos resultados pueden comparase con los obtenidos en este estudio, en los cuales se encontró una alta concentración de triterpenos en hojas y tallos de Bauhinia sp. Además, en tallos se hallaron flavonoides, alcaloides y saponinas, los cuales previamente han sido reportados con una buena actividad antimicrobiana 32.
En el presente estudio, el extracto de Bauhinia sp. demostró ser efectivo a una concentración de 1000 μg/μl frente a S. pneumoniae, E. faecium y P. rettgeri con ESBL, S. aureus y C. albicans. Adicio nalmente, las hojas demostraron ser eficaces fren te a K. pneumoniae con KPC a una concentración de 1000 μg/μl con una inhibición de 11,5mm de inhibición, el más amplio reportado en el pre sente estudio para este patógeno de elevada re sistencia y responsable de fallas en el tratamiento antibiótico convencional, Tabla 2. En un estudio realizado por Dhale 33 se encontró que extrac tos a partir de solventes orgánicos de Bauhinia a concentraciones de 20mg/ml, lograron inhibir P. aeruginosa y E. coli reportando un halo de inhi bición de 10mm. Estos datos evidencian que los resultados obtenidos dependen de los métodos de extracción y solventes Por los cuales presentan afi nidad química debido al comportamiento polar o apolar del solvente Además, es necesario analizar los resultados con otros métodos de extracción y otros solventes como la hidrodestilación asistida por microondas 34, o la destilación con fluido supercrítico 35. Igualmente, es recomendable realizar estos ensayos con microdiluciones en tubo para observar si hay actividad con menores concentraciones o se mantienen los mismos resul tados a los obtenidos en difusión por agar.
En el caso de S. nigra se demostró que tiene varios de los compuestos analizados en cada una de las partes de la planta. En las hojas se observó un alto contenido de quinonas, flavonoides, saponinas y triterpenos, mientras que los tallos demostraron la presencia de quinonas y triterpenos; las flores presentaron quinonas, flavonoides, alcaloides y triterpenos y el zumo de bayas presentó flavonoides y fenoles, este último fue el más abundante en esta parte de la planta.
Dichos compuestos han sido descritos como los más probables agentes antimicrobianos en la fami lia Adoxaceae, de la cual hace parte S. nigra36. Dos estudios han demostrado efectividad de esta planta como antiviral 37,38; también ha sido ensayado como antibacteriano siendo muy eficaz frente a S. aureus resistente a la meticilina 39.
Los resultados obtenidos en esta investigación re ferente a S. nigra son similares a los hallazgos de Hearst y colaboradores 40, quienes demostraron la actividad antimicrobiana de las flores de S. nigra frente a S. aureus resistente a la meticilina. Según estos autores, la actividad de S. nigra podría ocu rrir por compuestos fenólicos. En el presente estu dio, se encontró que dependiendo de la parte de la planta analizada, esta presentaba una inhibición diferente frente a cada patógeno.
Los microorganismos que presentaron un mayor halo de inhibición con los extractos de S. nigra fue ron S. aureus, E. faecium resistente a la vancomicina, C. albicans y P. rettgeri con presencia de ESBL a una concentración de 1000 μg/μl. En la búsqueda realizada, no se encontraron reportes de actividad microbiana del zumo de las bayas de S. nigra, por lo tanto, el presente estudio sería uno de los prime ros reportes en los que se encontró que las bayas tienen actividad antimicrobiana.
En un estudio reciente se demostró la capacidad de S. nigra frente a S. aureus ATCC 6538 a una concentración de 15mg con la técnica de microdilución 41. Este resultado lleva a que se proyecte a futuro un estudio utilizando microdilución en tu bos para verificar la actividad con concentraciones bajas.
Con relación a la actividad antimicrobiana de E. crassipes, el trabajo realizado por Jayanthy y cola boradores 42 no encontró presencia de triterpenos, flavonoides, ni alcaloides, contrario a lo obtenido en este estudio, donde se demostró alta presencia de triterpenos y moderada de flavonoides y alcaloides. Al respecto, la investigación rea lizada por Kumar y colaboradores 43 demostró actividad antimicrobiana similar a la obtenida en este trabajo, pero con la diferencia de que los compuestos hallados en la planta fueron evalua dos por dos técnicas diferentes 44, análisis fitoquímicos y cromatografía en capa fina y en ambas se encuentra la presencia de estos compuestos.
La actividad antimicrobiana hallada en esta plan ta demostró ser efectiva frente a S. pneumoniae, E. faecium resistente a la vancomicina, P. aeruginosa, S. aureus y C. Albicans. Este dato es similar al hallado por Kumar y colaboradores 42, quie nes demostraron el efecto antimicrobiano de esta planta frente a Staphylococcus sp. Es importante el resultado obtenido del extracto de E. crassipes frente a E. cloacae porque se obtuvo un halo de inhibición de 10mm de diámetro.
Los resultados arrojados por T. officinale demos traron que posee terpenos y quinonas; además, en las hojas de esta planta se evidenciaron flavonoides, dato interesante si se compara con lo hallado por Lateer y colaboradores 45, quienes encon traron terpenos y quinonas, pero no flavonoides. Los extractos de esta planta demostraron con la mayoría de los microorganismos halos de inhibi ción a una concentración de 1000 μg/μl.
Con este resultado se puede afirmar que el extrac to de tallos de T. officinale a una concentración de 1000 μg/μl se consideró como el más efectivo porque presentó las mayores inhibiciones de todo el estudio.
En los estudios realizados por Lateef y colabora dores 45, lograron inhibir el crecimiento de E. coli y S. aureus con una concentración de 200mg/ml, concentración muy alta en comparación con los resultados en este estudio.
Se encontró actividad de los extractos orgánicos de diversas partes de las plantas Bauhinia sp., S. nigra, E. crassipes y T. officinale como agentes anti bacterianos frente a patógenos de importancia clí nica. A partir de estos resultados, se podría inferir que en estas plantas existen compuestos como terpenos, alcaloides, flavonoides, quinonas, saponinas y fenoles que podrían estar involucrados en la actividad antimicrobiana de estas plantas.
Los resultados obtenidos en el presente estudios corresponden a datos preliminares los cuales de ben ser confirmados por técnicas más sensibles y evaluar la Concentración Mínima Inhibitoria de cada extracto. Además es necesario establecer los posibles metabolitos de cada planta que estaría ejerciendo la actividad antimicrobiana y compro bar las posibles acciones que estarían ejerciendo sobre los microorganismos. En conclusión, los extractos orgánicos de las plantas que se utiliza ron en este estudio poseen propiedades antimi crobianas, las cuales podrían ser útiles a futuro en la búsqueda de nuevos agentes terapéuticos.














