Introducción
Los carotenoides tienen importantes funciones biológicas como precursores de vitamina A, estimulantes de la respuesta inmune, prevención del cáncer y poder antioxidante 1.
Los carotenoides son pigmentos naturales liposolubles, según su naturaleza química se dividen en dos grupos principales, carotenos y xantofilas. La astaxantina es un carotenoide de tipo xantofila que en los últimos años ha tomado gran importancia debido a su gran aplicabilidad en la industria alimenticia, farmacéutica y cosmética ya que aporta múltiples beneficios a la salud humana y animal por sus diversas propiedades, dentro de las que se destacan su efecto antiinflamatorio, anticancerígeno, preventivo contra los efectos de los rayos UV y su gran poder antioxidante, siendo 550 veces más potente que la vitamina E y 11 veces más que el betacaroteno. Además, en la industria alimenticia este metabolito secundario es utilizado para generar la pigmentación roja de algunos peces como salmón, trucha, camarón, y algunos peces ornamentales, crustáceos y aves 2. Los pigmentos carotenoides son de gran importancia para diferentes sectores, entre los que se destacan la acuicultura, la ornitología y la industria farmacéutica, desempeñando funciones vitales en la fisiología y la salud de diferentes especies biológicas 3.
La principal limitación en la comercialización de la astaxantina de origen natural radica en la dificultad y el elevado costo de su síntesis lo que genera baja rentabilidad en comparación con la síntesis de astaxantina de forma sintética 4; H. pluvialis es una microalga verde de agua dulce y es una de las fuentes naturales con mayor producción de astaxantina ya que es capaz de acumular hasta un 3% de astaxantina en peso seco 5. El cultivo y las extremadas condiciones de crecimiento de Haematococcus pluvialis dificulta la producción de astaxantina a nivel industrial ya que este presenta un crecimiento lento, baja concentración celular, alta susceptibilidad a daños hidrodinámicos y un ciclo de vida complejo con distintas formas celulares que varían de acuerdo con los factores del cultivo, ya que para lograr un adecuado crecimiento con una elevada producción de astaxantina es necesario que el cultivo se encuentre en condiciones de estrés adecuadas, como lo son la intensidad lumínica, temperatura, concentración de nitrógeno, fósforo, dióxido de carbono, minerales, entre otros 6. Por este motivo, el objetivo principal de esta investigación fue la determinación de un medio de cultivo óptimo.
Kobayashi en 1992 7 examinó el crecimiento de Haematococcus pluvialis en un medio basal de etilo que se encuentra constituido por sales, aminoácidos y acetato, sometiéndolo a condiciones heterotróficas y mixotróficas evaluando como factor principal la influencia de luz-oscuridad. El trabajo mostró que H. pluvialis es capaz de crecer y producir astaxantina tanto en condiciones mixotróficas (acetato-12h luz y 12h oscuridad) como en condiciones heterotróficas (acetato-oscuridad), razón por la cual se llegó a la conclusión que H. pluvialis puede crecer y producir astaxantina en condiciones de luz y oscuridad siempre y cuando se haya adicionado acetato.
Tripathi en 1999 8 evaluó cinco medios de cultivo en condición autotrófica, heterotrófica y mixotrófica con el fin de determinar el medio y la condición de crecimiento óptimas y que generen la máxima producción de astaxantina. Los medios de cultivos que se emplearon en condiciones autotróficas fueron el medio basal bold (BBM) y el medio Z8, en condiciones heterotróficas y el medio (KM1)) bajo una intensidad lumínica constante de 1.5 klux y a una temperatura de 25 +/-1°c, en condiciones mixotróficas. Los medios de cultivo se prepararon a partir de los medios de cultivo autótrofos (BBM) completándolo con acetato de sodio (MM1) y acetato de sodio con l-asparagina (MM2). Los resultados mostraron que de los medios sometidos a condición de autotrofía el medio BBM obtuvo la mayor tasa de crecimiento con un recuento de celular máximo de 1.5 x 105 células/ml en comparación con el medio Z8 el cual obtuvo un recuento celular de 0.8x105 células/ml, analizados a los 10 días. En condiciones heterotróficas el medio KM1 obtuvo un recuento considerablemente mayor a los 5 días con un recuento celular máximo de 4,35 x 105 células/ml, 20 veces más que el recuento celular en el medio de BBM que obtuvo un valor de 0.217x105 al mismo día. Se pudo determinar que el medio Z8 es adecuado para el mantenimiento de los cultivos y el medio MM1 es adecuado para el mantenimiento de las células vegetativas.
Salazar en 2001 9 estudio el efecto de la concentración de NaNO3 en el crecimiento de Haematococcus pluvialis para determinar condiciones óptimas del cultivo, utilizando tres cepas de H.pluvialis (J,A,G) cultivadas en medio Bristol con tres concentraciones de NaNO3 distintas (0.25, 0.75, y 1.25 g) y empleando condiciones de crecimiento específicas como agitación orbital, temperatura: 25°C, intensidad de luz: 4850 lx, en un fotoperiodo de 12h de luz y 12h de oscuridad; se logró demostrar que el mayor crecimiento de H.pluvialis se obtiene en los medios que contienen 1.25 g/l en el día 45 en dos de las tres cepas estudiadas.
Kobayashi en 2001 10 analizó las distribuciones del tamaño de las células quísticas y el contenido intracelular de astaxantina en H. Pluvialis, las cuales fueron aisladas por centrifugación de gradiente de densidad de sacarosa y se examinó la relación entre el tamaño de los quistes y el contenido de astaxantina, usando el diclorofluoresceno fluorescente (DCF). La formación de DCF en las células quísticas se redujo cuando había un mayor diámetro de la célula. Esta disminución también se correlacionó con el aumento en el contenido de astaxantina. Por lo tanto, el diámetro celular y el contenido fluorescente DCF de las células quísticas sería buen parámetro para seleccionar cepas astaxantina híper productivas de poblaciones nativas de H. pluvialis.
Fabregas en 2001 11 realizó un sistema de cultivo en dos etapas para la producción de astaxantina a partir de H. pluvialis, las cepas fueron cultivadas en medio OHM con un pH 7,2 y 7,8 con una intensidad lumínica de 40 fotones mol m-2 s-1que fue proporcionada por lámparas fluorescentes de luz blanca regido por un ciclo de 12 horas luz: 12 horas oscuridad, a 25 °C, aireación intermitentemente durante 10 segundos, cada 10 min. a una velocidad de 250 ml min., en la primera etapa se realizaron cultivos semi-continuos con tasas de renovación diaria entre 10 y 40% con el fin de lograr una obtención de biomasa significativa. En la segunda etapa, los cultivos fueron sometidos a altas intensidades de 240 fotones mol m-2 s-1 durante 15 días con el fin de estimular la transición a la etapa aplanospora y con esto conseguir la producción de astaxantina. Los resultados revelaron que todos los cultivos alcanzaron el estado estacionario de 2 a 5 días del cultivo semi-continuo obteniendo una densidad celular de 5,72x105 células/ml y una renovación diaria de 10%, además se detectó que los cultivos obtenidos a una tasa de renovación del 10% después de 3 días de ser sometidos a una alta intensidad lumínica se obtuvieron valores de hasta 49 μg ml-1 en el día 15; cuando las células se obtienen a una tasa de renovación del 40% se detectó que después de 9 días de ser sometida a intensidad lumínica el crecimiento celular cesa y el nitrógeno se agota y en ese momento se generan períodos de inducción de astaxantina; la productividad máxima se generó a los 15 días con un valor de 9,6 mg l-1 día-1 con una tasa de renovación del 40%. 10
Cifuentes en 2003 12 evaluó diferentes condiciones del cultivo para optimizar el crecimiento de biomasa de H. pluvialis y con esto lograr la producción de astaxantina en condiciones autótrofas con la adición de NaNO3, NH4 Cl y urea y en condiciones mixotróficas con 4, 8, 12mM de acetato de sodio sometidas a densidad de flujo de fotones (PFD). La carotenogénesis fue inducida por 3 mecanismos: la adición de NaCl (0,2 y 0,8%), privación de nitrógeno y la alta PFD. Para el crecimiento inicial de Haematococcus pluvialis se utilizó Medio Bristol al cual se le ajustó el pH a 6. Esta acidificación condujo a aumentar el crecimiento exponencial específico del alga, la densidad inicial de biomasa fue 2.0 x103 células/ml. Los resultados mostraron que la mejor fuente de nitrógeno fue el cloruro de amonio para la obtención de mayor cantidad de biomasa que produjo una densidad celular de 7.8 x 104 células/ml. La luz era el mejor factor inductivo de la caroteno-génesis y la mayor producción de carotenoides se observó en los cultivos que fueron pre-cultivados en nitrato, de los cuales con poca luz se obtuvieron (22 pg. por célula) y el contenido de astaxantina por peso seco fue de 10,3 mg. Así mismo se demostró que el NaCl causó un aumento en el contenido de carotenoides por célula pero indujo a la mortalidad celular.
Domínguez en 2004 13 determinó las condiciones ambientales como intensidad de luz, aireación en el crecimiento y producción de astaxantina por H. pluvialis. La cepa se inoculó en el medio de cultivo Bold Basal (BBM) conformado por sales (sulfatos, nitratos, fosfatos), elementos trazas y ácido bórico; en el medio de cultivo (BG-11) compuesto por sales nitratos, sulfatos, ácido cítrico, EDTA; en el medio (FAB) teniendo el mismo contenido del Bold Basal (BBM) sin elementos traza; en el medio (BAR) con los mismos componentes exceptuando los elementos traza, sin ácido cítrico y sin EDTA; el medio (BAR) compuesto por sales, EDTA, ácido cítrico, ácido bórico. El crecimiento de H.pluvialis, en los diferentes medios de cultivo y condiciones de cultivo dio como resultado la mayor tasa de crecimiento en el Medio Basal Bold (BBM) con iluminación continua y aireación, obteniendo un conteo de 34.67 x 104 cél/ ml con una diferencia significativa con respecto a los demás medios de cultivo evaluados; la mayor producción de astaxantina en los medios evaluados fue dada en el medio de cultivo (BAR) con 3.30x104 mg/g de biomasa. 12
Imamoğlu en 2007 14 investigó y comparó los efectos de dos medios de cultivo RM y BG11 y las condiciones de crecimiento para lograr maximizar la tasa de crecimiento de dos cepas de H. pluvialis (EGEMACC-35 y EGEMACC-36). Las cepas fueron cultivadas bajo condiciones auto-tróficas (presencia de luz y suministro de CO2.), mixotróficas (presencia de luz y suministro de acetato de sodio) y heterotróficas (presencia de oscuridad suministro de acetato de sodio) con una temperatura de 25 ° C, aireación continua y una intensidad de luz de 75 mol-fotones. Teniendo en cuenta el crecimiento de las dos cepas estudiadas se logró determinar que el crecimiento para la cepa EGEMACC-35 se incrementó en un 90% con respecto a la cepa EGEMACC-36 en el modelo de cultivo bajo condiciones autótrofas. Se considera que la luz es esencial para el ciclo de vida de H. pluvialis y estudios previos sobre la nutrición de H. pluvialis lograron demostrar que el acetato es una importante fuente de carbono que mejora tanto el crecimiento como la carotenogénesis.
González en 2009 15 planteó como objetivo de este estudio fue comparar el crecimiento y la producción de carotenoides totales entre cuatro cepas de H. pluvialis aisladas de diferentes micro hábitats en dos ubicaciones geográficas en Chile. El crecimiento se llevó a cabo en medio Bristol en condiciones autotróficas y mixotroficas (con adición de 2 y 10 mM de acetato de sodio) a una temperatura de 22 ± 1 °C. y a dos densidades de flujo fotónico (DFF) (20 y 85 μmol m-2s-1). El contenido de carotenoides totales se estimó el día 45.14. Los resultados mostraron que la mayoría de las cepas crecieron mejor en condiciones autotróficas y las más altas tasas de crecimiento exponencial se presentaron a la mayor DFF en todas las cepas la cual fluctuó entre 0,73 y 1,20 divisiones/día a excepción de una de las 4 cepas que mostró la misma tasa de crecimiento exponencial que fue de 0,73 divisiones/día a cualquier DFF, además se comprobó que la densidad celular en el día 14 de las cepas CCM-UDEC 022 y CCM-UDEC 023 fue mayor cuando las cepas eran expuestas a la menor DFF con valores de 4,4 x 105 y 8,9 x105 cel./ ml, respectivamente.
Hanan en 2013 16 realizó un diseño factorial para detectar parámetros que puedan afectar el crecimiento de H. pluvialis evaluando variables como pH, tamaño del inóculo, temperatura y presencia o ausencia de luz. El cultivo fue realizado en Medio BBM compuesto por 5 elementos con adición de acetato de sodio 0,25% como fuente de carbono ya que este mejora el crecimiento y la carotenogénesis. Los resultados mostraron que el crecimiento experimental fue mayor de lo esperado: el crecimiento esperado era de 1,08 células/ml y el crecimiento obtenido fue de 1.17 células/ml, por lo que se llegó a la conclusión que las condiciones para optimizar el crecimiento de H. pluvialis se obtienen utilizando un pH de 5, un tamaño del inóculo de 40%, temperatura de 30°C y este cultivo deberá estar en presencia de luz.
Nunes en 2013 17 evaluó la respuesta celular de H. pluvialis bajo condiciones de estrés nutricional y la influencia de la luz para la inducción de la carotenogénesis. Las cepas fueron cultivadas en medio WC con pH 7,0, solución de hierro y EDTA y solución de vitaminas durante 15 días, con aireación atmosférica a una velocidad de 100 ml/ min, fotoperiodo de 12 horas y temperatura de 23°C. Los cultivos se mantuvieron en una intensidad de luz de 50 micromoles de fotones tiempo necesario para que el cultivo llegara a la fase exponencial. En conclusión, con la adición de CO2 y el aumento de la iluminación se observó un aumento de la proporción de carotenoides/clorofila y biomasa celular optimizando la carotenogenesis en H. pluvialis y aumentando la producción de astaxantina.
Materiales y métodos
Este trabajo de investigación se basó en un estudio de tipo descriptivo y correlacional, en donde se logró comparar 3 medios de cultivo (RM, OHM y BBM), bajo condiciones de estrés para que se dé mayor cantidad de biomasa y por ende mayor producción de astaxantina a partir de la microalga Haematococcus pluvialis.
La población de este estudio fue la microalga Haematococcus pluvialis, obtenida a partir de una cepa suministrada por la Facultad de Ingeniería de la Universidad de la Sabana, la cual se trabajó por un tiempo de 4 meses y medio aproximadamente, con los medios de cultivo RM, BBM y OHM escogidos según el estudio bibliográfico con mejor producción de astaxantina.
El tipo de muestra a usar fue el inóculo de Haematococcus pluvialis. Se trabajó por triplicado en los 3 medios de cultivo RM, BBM y OHM bajo las condiciones propuestas. Se consideró como unidad de análisis el crecimiento celular y la producción de astaxantina.
Variables
Variable dependiente: Crecimiento celular y la producción de astaxantina.
Variable independiente: Medios de cultivo, que generan las condiciones óptimas para crecimiento celular por parte de Haematococcus pluvialis.
Técnicas y procedimientos
Revisión bibliográfica: para definir la metodología a utilizar se realizó una revisión bibliográfica teniendo en cuenta los medios de cultivo, condiciones de crecimiento como pH, temperatura, fotoperíodo, etc. (Datos no mostrados).
Microorganismo
La microalga Haematococcus pluvialis UTEX, cepa de referencia (colección de cultivos de algas, Universidad de Texas, Austin TX, USA) suministrada por la Facultad de Ingeniería de la Universidad de la Sabana.
Preparación del preinóculo
La preparación del preinóculo se realizó a partir de la cepa de referencia, la cual se transfirió a un Erlenmeyer de 3L con adición de 2L de medio de cultivo MES Volvox estéril con ajuste de pH de 6.7, fotoperiodo de 18 horas luz - 6 horas de oscuridad, CO2 5%, agitación manual 10 segundos una vez al día a 25°C por 21 días (Ver Figura 1).
Se realizó monitoreo del preinóculo mediante microscopia donde se evaluó el color, morfología y viabilidad celular; se hizo conteo celular mediante cámara de Neubauer obteniendo una concentración celular de 16x104 células/ml; a partir de esta concentración se procedió a determinar el volumen de inóculo a usar por birreactor para obtener una concentración inicial de 1x104 en un volumen de 350ml de medio de cultivo, mediante la siguiente fórmula: V1 C1 = V2 C2.
Evaluación de los medios de cultivo
Con el fin de obtener la mejor productividad tanto de biomasa como de astaxantina y basándose en la revisión bibliográfica (Tabla 1), se evaluaron 3 medios de cultivo: BBM, RM y OHM, los cuales mostraron los mejores resultados.
Tabla 1 Medios de cultivo.
| Medio RM1 | mg/l | Medio BBM2 | mg/l | Medio OHM3 | mg/l |
|---|---|---|---|---|---|
| NaNo3 | 300 | KH2PO4 | 175 | KNO3 | 410 |
| K2HPO4 | 80 | CaCl2 | 25 | Na2HPO4 | 30 |
| KH2PO4 | 20 | MgSO4 | 75 | MgSO4.7H2O | 246.5 |
| MgSO47H2O | 10 | NaNo3 | 250 | Cl2Ca.2H2O | 110.9 |
| CaCl2.2H2O | 58.5 | K2HPO4 | 75 | FeC6H5O7.5H2O | 2.62 |
| EDTA | 7.5 | NaCl | 25 | Cl2Co.6H2O | 0.011 |
| NaCl | 20 | H3BO3 | 11.42 | CuSO45H2O | 0.012 |
| H3BO3 | 0.3 | ZnSO4 | 8.82 g/L | Cr2O3 | 0.076 |
| MnSO4H2O | 1.5 | MnCl2 | 1.44 g/L | MnCl2.4H2O | 0.989 |
| ZnSO4.7H2O | 0.1 | MoO3 | 0.71 g/L | Na2MoO4.2H2O | 0.12 |
| (NH4)6MoO4.2H2O | 0.3 | CuSO4 | 1.57 g/L | Se | 0.025 |
| CuSO4.5H2O | 0.08 | Co (NO3)2 | 0.49 g/L | Biotina | 5ml |
| Co (No3)2. 6H2O | 0.26 | Na2EDTA | 50 g/L | Tiamina | 5ml |
| FeCl3.6H2O | 17 | KOH | 3.1 g/L | B12 | 5ml |
| 1. (13). - 2. (20). - 3. (11). |
Medios de cultivo
El cultivo de H. pluvialis se realizó en biorreactores de 500ml con adición de 350ml de cada uno de los medios a evaluar, RM, BBM, OHM (ver Tabla 1), por triplicado.
Para cumplir con los objetivos del ensayo, el estudio se centró en la obtención de la mayor concentración celular en donde se evaluaron tres medios de cultivo (BBM, OHM, RM) cada uno por triplicado para un total de 9 ensayos, utilizando un inóculo inicial de 1x104 células/ml en Erlenmeyer de 500ml con un volumen de cultivo de 350ml en forma aséptica y sellándolos para garantizar esterilidad.
Todos los ensayos se realizaron bajo las siguientes condiciones:
Ajuste de cada medio a un pH 6,7, fotoperiodo de 18h luz - 6 oscuridad, 70 microestein de irradianza con lámparas de luz fluorescentes blanca (Tlt20w/54RS, marca Philips) controlados a través de medidor de irradianza (biosphericalinstrumentsQSPL2101), temperatura 25°c, agitación manual una vez al día durante 10 segundos, CO2 5% a través de pipeta de CO2 suministrada con compresor para regular la cantidad de flujo.
Se tomó 1ml de muestra para evaluar crecimiento celular y morfología cada tercer día, realizando conteo celular en cámara de Neubauer, evaluación de morfología celular por microscopia y registro fotográfico.
Toma de muestra de 10ml para evolución de clorofila y astaxantina cada 6 días.
Se realizó control de temperatura, pH, agitación, fotoperiodo, irradianza y CO2.
Esta fase del estudio se evaluó durante 36 días.
Curva de crecimiento
Se realizó la curva de crecimiento a partir del número de células por ml cuantificados en cámara de Neubauer durante 21 días obteniendo un total de 7 datos obtenidos por cada medio de cultivo.
Cambios morfológicos celulares
Los cambios de morfológicos se determinaron durante las diferentes fases de crecimiento de H. pluvialis y se documentaron por microfotografía.
Resultados
Crecimiento celular
En esta etapa de la investigación se evaluó el efecto de tres medios de cultivo (OHM, BBM y RM), los cuales fueron previamente seleccionados al hacer una revisión bibliográfica sobre la efectividad de los medios en el crecimiento celular de H. Pluvialis.
Se desarrolló un seguimiento fotográfico durante la fase de crecimiento para observar cambio en la morfología celular en cada uno de los medios evaluados. En la Figura 2 se registran los cambios en los días 0, 18, 24 y 36 del estudio.
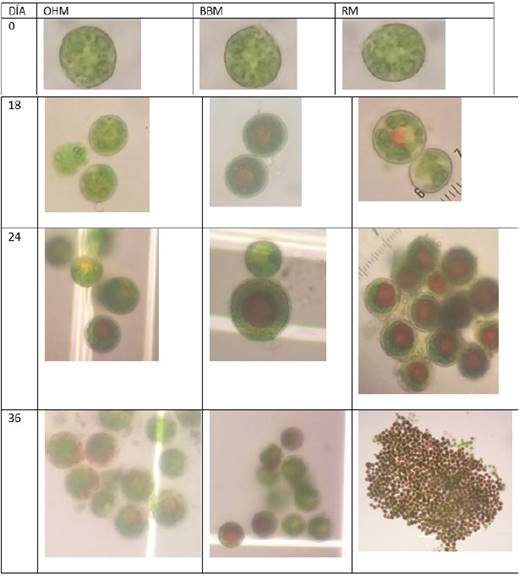
Figura 2 Cambios morfológicos en los medios de cultivo estudiados (OHM, BBM, RM). Fotos tomadas por las autoras de este proyecto.
A la vez se hizo registro fotográfico a los cambios macroscópicos celulares observables en los medios de cultivo (OHM, BBM, RM) en los biorreactores. En la Figura 3 se presentan los días 0, 15, 21 y 36 como los más representativos.

Figura 3 Cambios macroscópicos celulares en los medios de cultivo estudiados (OHM, BBM, RM). Fotos tomadas por las autoras de este proyecto.
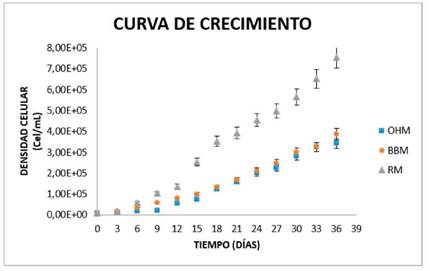
Los datos de crecimiento se obtuvieron mediante recuento celular por cámara de Neubauer, con los cuales se construyó una cinética de crecimiento. Se observó que el medio de cultivo con mayor tasa de crecimiento fue el medio de cultivo RM, con un recuento celular de 7.55x105 células/ml, seguido del medio de cultivo BBM con un recuento de 3.88x105 células/ml, y por último, el medio de cultivo OHM con un recuento de 3.43x105 células/ml (ver figura 4).
Las tendencias de crecimiento fueron ajustadas al modelo logístico mediante transformación de los valores de Y, a los cuales se les calculó su logaritmo en base 10 para obtener log vs t del crecimiento celular. La idea de realizar el ajuste fue la de determinar si existían diferencias significativas en la velocidad de crecimiento de los medios probados. El medio de cultivo con la mayor velocidad específica de crecimiento fue RM con una velocidad específica de crecimiento de 0,092 células/ día (ver Tabla 2).
Tabla 2 Matriz de coeficientes del modelo logístico ajustado para los diferentes medios de cultivo.
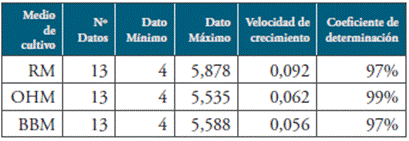
Fuente: Autoras.
Se realizó un análisis de varianza (ANOVA) de un factor (crecimiento celular) para los tres medios de cultivo (OHM, BBM, RM) del promedio de las réplicas, encontrando que para una confianza del 95% existe diferencias estadísticas significativas (p= 0,02) entre los diferentes medios de cultivo evaluados (ver Tabla 3).
Discusión
Las microalgas tienen un elevado valor industrial gracias a su gran aplicabilidad, debido a que son útiles en la producción de biodiesel, el tratamiento de aguas residuales y la producción de proteína para la alimentación animal y humana, entre muchas otras propiedades. Además de las aplicaciones anteriores, estos microorganismos, tienen una característica especial como lo es la capacidad de acumular metabolitos de interés biotecnológico como los ácidos grasos poli-insaturados de cadena larga y los carotenoides 19.
Varios autores han realizado experimentos con el fin de obtener las mayores tasas de crecimiento de Haematococcus pluvialis ensayando diversos métodos, como lo son evaluación de pH, temperatura óptima, agitación, CO2, exposición a una luz determinada por un tiempo, factores de estrés como adición de sales, aumento a la intensidad de luz (irradianza), entre otros más 20)(10)(13. Dentro de los requerimientos nutricionales para la producción de biomasa y astaxantina se encuentran los micronutrientes esenciales como el sodio, potasio, amonio, calcio, magnesio, hierro, cloro, azufre y los macronutrientes como carbono, hidrógeno, oxígeno y fósforo, que son de origen inorgánico y para los que se necesitan concentraciones entre 1-100mg/L, además se necesitan de elementos traza como magnesio, cobalto, níquel, vanadio, boro, cobre, zinc y molibdeno en concentraciones menores a 1mg/L, al igual que vitaminas y aminoácidos 21)(22)(23)(24.
El uso de diferentes medios de cultivo para optimizar el crecimiento de Haematococcus pluvialis ha sido uno de los grandes enfoques de la mayoría de los autores. En 13 se ensayó el Medio Basal Bold (BBM) obteniendo recuentos celulares de 3.5x105 células/ml. También en 7 se evaluó el crecimiento celular bajo condiciones normales en medio BBM obteniendo un bajo crecimiento celular 2x104 células/ml. Estos resultados se pueden comparar con los obtenidos en esta investigación con un crecimiento celular de 3.8x105 células/ml, los cuales presentan un aumento significativo con respecto a los obtenidos por Kobayashi 5, pero un crecimiento ligero comparado con el de Domínguez-Bocanegra 13. Asimismo, los datos de crecimiento celular obtenidos en el medio de cultivo OHM 3.43x105 células/ml son comparables por los reportados por 11 con un crecimiento de 3.77 x105 cel/ml, bajo condiciones de cultivo similares, como fueron pH entre 6.2 y 7.4, irradianza de 40 a 70 μEm-2s-1con lámparas de luz blanca.
El medio de cultivo RM en el presente trabajo obtuvo los mejores resultados alcanzando una concentración celular de 7.55x105 células/ml, lo que concuerda con lo reportado en la literatura y que lo considera como un medio de cultivo que alcanza concentraciones celulares más elevadas como las reportadas por 14 que alcanzó una concentración celular de 9.50 x 105 células/ml. Se debe tener en cuenta que los factores que pueden influir en el crecimiento celular como el pH, la intensidad de la luz 24-28, aireación temperatura, agitación, suplementos entre otras pudieron influir en obtener una concentración menor a la ya reportada.
Otro factor a discutir es el método de recuento celular usado para el presente trabajo que aunque es uno de los métodos más usados por la mayoría de autores no es el método más específico ni preciso. Por este motivo se hace necesario el uso de métodos más exactos como la utilización de cell counting como lo reporta 15.
El medio de cultivo RM además de ser el que obtuvo las mejores tasas de crecimiento celular también es el mejor medio para la aplicación de factores de estrés con una mayor producción de astaxantina, datos no relacionados en este trabajo.
Conclusiones
La influencia de diferentes factores como el pH, temperatura, agitación, aireación, CO2, e iluminación, favorecen el crecimiento celular de Haematococcus pluvialis, al darle un ambiente óptimo a la microalga en los medios de cultivo.
El medio de cultivo con mayor tasa de crecimiento, fue el medio de cultivo RM, con un recuento celular de 7.55x105 células/ml, seguido del medio de cultivo BBM con un recuento de 3.88x105 células/ml, y por último, el medio de cultivo OHM con un recuento de 3.43x105 células/ml.
El medio de cultivo RM por su composición nutricional favorece el crecimiento celular y que haya una mayor acumulación de astaxantina.