Introducción
El agua es un recurso natural indispensable del cual hacen uso constante los odontólogos en su práctica profesional diaria, con este recurso realizan tratamientos dentales y algunos tipos de cirugías maxilofaciales; sirviendo ésta como medio para el lavado bucal del paciente, para el lavado de manos del odontólogo ó para la preparación de instrumentos y materiales requeridos previamente al tratamiento.
El agua utilizada en la mayoría de las clínicas dentales es recopilada en grandes tanques de almacenamiento y circula mediante redes de distribución “tuberías” conectadas a cada unidad dental, las cuales cuentan con un sistema de distribución de agua constituido por mangueras de plástico flexibles que están directamente conectadas a las piezas dentales (jeringa triple y pieza de manos).
Por esta razón, es primordial designar un propicio proceso de lavado, desinfección y mantenimiento de las tuberías y de los instrumentos dentales que están en contacto directo con el agua; con el fin de evitar así la colonización de bacterias adheridas entre sí las cuales forman las denominadas biopelículas, reconocidas como altamente infecciosas. Éstas pueden llegar a separarse y desprenderse para buscar un nuevo lugar al cual incrustarse, sirviendo como nicho para otros microorganismos patógenos y pueden así afectar la inocuidad del agua. Cuando este recurso es utilizado en procedimientos odontológicos, sirve como transporte de este tipo de bacterias hacia la cavidad bucal del paciente, y si se presenta laceración en los tejidos, pueden viajar por el torrente sanguíneo hasta llegar a comprometer crónicamente la salud de la persona y, en casos agudos, llegar hasta una septicemia.
Por tal motivo, es muy importante contar con una adecuada calidad bacteriológica del agua en las unidades dentales. Esto con el fin de brindar un ambiente clínico seguro, que reduzca, o en el mejor de los casos, elimine por completo el riesgo de adquirir enfermedades e infecciones cruzadas entre el paciente y el agua utilizada en el momento en que se realizan los procedimientos dentales. La calidad bacteriológica del agua potable en Colombia se mide de acuerdo al hallazgo de microorganismos indicadores de contaminación como los Coliformes totales y Coliformes fecales. De acuerdo a la Resolución 2115 del 2007 se exige la ausencia de estas bacterias en el agua (0 UFC/100ml) y la ausencia de microorganismos altamente patógenos.
Estos parámetros son requerimientos mínimos que debe tener el agua manipulada en las clínicas odontológicas; ya que ésta tiene contacto directo con las piezas dentales, con la mucosa bucal de los diferentes pacientes. Tiene especial interés la población de niños, ancianos y personas inmuno comprometidas, quienes poseen una mayor predisposición de adquirir cualquier tipo de infección.
Biopelículas
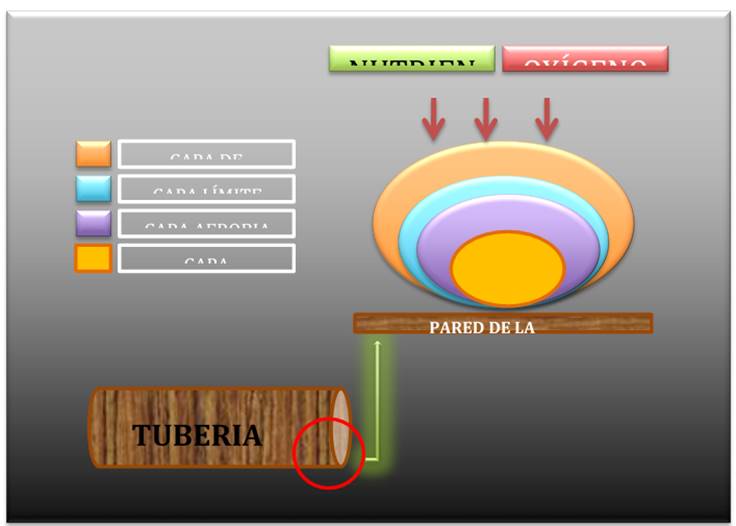
Las biopelículas son comunidades microbianas que se adhieren a las superficies sólidas donde hay suficiente humedad (incluidos los tejidos de plantas y animales). Los factores que influyen para su crecimiento son la luz, la temperatura, los nutrientes, la respiración (oxígeno) y el flujo de agua.
Se pueden formar en superficies bióticas y abióticas, debido a su respuesta a condiciones adversas del medio ambiente 1. Los microorganismos se unen a un entorno acuoso donde secretan una matriz protectora voluminosa y viscosa compuesta principalmente de polisacáridos complejos de forma tridimensional que adicionalmente puede incorporar sustancias inorgánicas de su entorno, albergando múltiples tipos de microorganismos como bacterias, hongos, protozoos, amebas y algas 2.
Proceso de formación y ciclo de las biopelículas en las mangueras de una unidad dental
La formación de biopelículas, la cual supera 105 y 107 células/cm2 en entornos acuosos, en una unidad dental (tuberías, tanques, lava manos y fregaderos), a menudo comienza con la formación de una película de aire de compuestos inorgánicos desde el medio ambiente, y se van adhiriendo microorganismos debido a las condiciones de estos lugares (las bacterias Gram negativas aerobias heterótrofas, son capaces de colonizar más rápido las tuberías plásticas que se manejan frecuentemente en las unidades dentales). Al estar adjuntos a la superficie se les facilita absorber nutrientes y se vuelven resistentes ante la escasez del alimento 3,4.
Uno de los requisitos que reúnen las unidades es el flujo de agua lento, accediendo a un pequeño estancamiento y proporcionando la acumulación pronta de bacterias ambientales, entre estas las patógenas, que se encuentran en los ductos de salida de agua, y son: Legionella spp., Pseudomonas spp., Staphylococcus spp. y Mycobacterium spp. (No tuberculosis). Sin embargo, la mayoría de estos organismos tienen un potencial patogénico mínimo en huéspedes inmunocompetentes 6,7.
Pseudomonas aeruginosa, un bacilo Gram negativo, a pesar de ser una bacteria que no puede unirse a una superficie en caso de existir calcio y sodio; al salir de los ductos de agua, por ejemplo las piezas de mano y jeringas triples generan aerosoles y gotas de agua, que se ha demostrado, causa infección oral en pacientes 6,7.
Los colonizadores iniciales se encargan entonces de ejecutar la primera fase del ciclo; la adhesión, que puede ser activa o pasiva 1, se fijan al área a través de fuerzas débiles y reversibles de Van Der Waals y posteriormente se unen de manera más permanente por otros métodos.
Una adhesión pasiva o por quimiotáxis es en el caso de las bacterias que poseen alguna sustancia de unión, como fimbrias (en el caso de las bacterias móviles), proteínas de adhesión (en el caso de algunas Gram positivas inmóviles), por las albúminas, lisozimas, glicoproteínas y lípidos que son algunos de los productos que ayudan a la unión directamente con la superficie.
La unión activa es cuando las bacterias requieren de una exposición prolongada al medio ambiente para la colonización 1,4. Esta capa proporciona sitios de conexiones iníciales más diversos para otros microorganismos, entonces comienza la fase del crecimiento; la cual se considera la segunda fase del ciclo. Se da cuando las bacterias se dividen y las células hijas se extienden a lo largo formando microcolonias, éstas pierden sus apéndices de motilidad (flagelos y otros) y van produciendo un complejo extracelular de polisacáridos adherentes. Después de varias capas, en los primeros microorganismos se va implantando un metabolismo anaerobio causando lentitud en su velocidad de multiplicación y comienza así la formación del glicocalix o matriz formada de polisacáridos 3,4. Allí también se encuentran inclusiones físicas de hongos, parásitos que pueden flotar lentamente en el agua 1,5.
En la tercera y última etapa, la matriz adquiere grosor y complejidad mostrando ser una organización tridimensional, comportándose como una barrera amortiguadora de cambios bruscos del ambiente exterior; con ello también se forman canales de aguas que separan las aerobias de las anaerobias y permiten el transporte de materias que se realiza de afuera hacia adentro. Es decir, desde las que están expuestas al flujo de agua hacia las que se encuentran adheridas y cohesionadas a la superficie del medio de distribución de agua o bacterias sésiles, aquí el pH se convierte en un factor que diferencia lo interno de lo externo, adentro el pH se vuelve más ácido que la capa cerca al flujo del agua 3,4.
La figura 1, muestra la distribución de una biopelícula por capas que simulan las colonias bacterianas.
Más adelante, las células del biofilm podrán aislarse o desprenderse para volver a su vida planctónica. Cuando hacen el aislamiento, se cree que es generado por cierta maduración de las bacterias y por la reducción de nutrientes lo cual permite que migren a otro lugar para colonizar. También puede suceder por el desprendimiento que se ocasiona por tres motivos, uno es el deslizamiento provocado por la remoción del mismo biofilm, igualmente por movimiento rápido y masivo o por la liberación y colisión de partículas, ayudando a la vez al mismo biofilm a alimentarse con los ácidos nucleicos que se adquieren 5.
La estructura en capas de biopelículas (difusión limitada) combinado con las condiciones de flujo de agua, hace que estas colonias microbianas sean intrínsecamente resistentes a muchos biocidas y esquemas de limpieza. Las biopelículas se convierten entonces en el reservorio principal de contaminación continua del sistema 3,4.
A pesar que los materiales de algunas tuberías, como las de plástico, no son tóxicas, se vuelven parte de la alimentación de las bacterias, en el caso de los ductos de hierro colado y acero fomenta el crecimiento debido a que los desinfectantes no se adhieren y siguen de corrido sin afectarlas. Por consiguiente, las biopelículas actúan como una fuente para la contaminación continua del agua, que operan como una infección cruzada y además generan un impacto físico en las válvulas de control y en la función de los instrumentos 6,7.
Microorganismos participantes en la formación del biofilm
Las bacterias, dependiendo de su estructura, son capaces de generar uniones resistentes y otras no tanto, y se hace alusión a las Gram positivas y Gram negativas 4,8-15.
Se habla de la E. Coli y la Pseudomonas spp. Estas necesitan de enzimas y proteínas capaces de generar señales y anclajes entre célula y célula que sean aptos para formar las biopelículas. En estos géneros se encuentran las proteínas de dominio (GGDEF) consideradas como trasmisor y sistema de comunicación o autoinducción, conocido como Quorum sensing4,8-15.
Para poder formar biofilm, las Pseudomonas necesitan de varias proteínas o péptidos señal, capaces de generar conexión tanto internamente como externamente, para ello necesita de un sistema de autoinducción conocido como Quorum sensing. Este sistema, como se dijo anteriormente, ayuda al microorganismo a reconocer la cantidad de bacterias cercanas, entre más se intensifica este signo, más rápido se inicia la concentración de señales y por ende la activación de genes pronunciándose así los sistemas de comunicación célula a célula 4,8-15.
La unión entonces comienza con la transcripción del gen lux, presente en las Pseudomonas y en la E. col conformado a su vez de luxl y luxR, capaces de activar otros genes. Al terminar el primer paso para la expresión génica, se forman proteínas conocidas como LasR activada por luxR y LasI activada por luxI. Por otra parte, se codifica la enzima AHL (acetil homoserina lactonasa) por medio del gen attM; esta se une a la proteína I (LasI), y juntas se ensamblan a la membrana interna de la bacteria, activando la bomba MexAB-OprM4,8-15.
MexAB-OprM es un canal que se divide en dos enzimas: MexAB (atraviesa la membrana citoplasmática) y OprM (se encuentra en la membrana externa). MexAB junto a OprM se encargan de darle resistencia antimicrobiana ante algunos antibióticos que ingresan al microorganismo y son expulsados por esta bomba, para esto necesitan de una proteína lipídica (PS) ligada al exterior de ella (figura 2). Al formarse un complejo octaédrico de estas enzimas es probable el traspaso del plásmido, esto es más fácil de realizar si la bacteria se encuentra en fase exponencial, de lo contrario el gen attJ, es un stop mientras el microorganismo está en fase estacionaria y para entonces ya debe terminar la transferencia del plásmido 4,8-15.
En la membrana también se une la proteína Lap A (leucina aminopeptidasa), conformada por LapE, LapC, LapB, con ello, y el complejo ya mencionado, se genera la adhesión de célula a célula.
Mientras tanto, en la membrana, las proteínas I (LasI) y las proteínas R (LasR) empiezan el control de otros activadores transcripcionales rhl. LasR regula la expresión de rhlR y LasI la de rhll4,8-15.
Otra molécula activadora de la formación de biofilm es el Diguanilato ciclasa que activa el mensajero secundario, el pili o fimbria también hacen parte de la asociación en la fase primaria y mientras se realiza el proceso de acoplamiento entre microorganismos las Pseudomonas producen un exopolisacárido de alginato que evitan que las fagociten o las eliminen, entre los exopolisacáridos existe un polisacárido enriquecido de glucosa llamado “Pellican”, actuando de refuerzo 4,8-15. Con la Escherichia coli es el mismo procedimiento, pero no se llama Las, sino CsrA.
Los Staphylococcus epidermidis son considerados cocos Gram positivos, coagulasa negativa, es decir, no poseen fibrina o factor de aglutinación que cubre a la bacteria de opsonización y fagocitosis. Son anaerobios facultativos, catalasa positiva que se encarga de inactivar la toxicidad del peróxido de hidrogeno y radicales libres de los macrófagos y son flora normal de la boca 16-19.
En las áreas dentales es frecuente encontrarlos en los equipos por la manipulación del personal (lavado de manos inadecuado). Estas bacterias se alimentan de la capa orgánica que se encuentra entre la interface y la superficie de la tubería, cambiando el estado de la superficie, con ello se mejora la fijación de los microorganismos 16-19.
En la formación de biofilm existen características que diferencian una bacteria Gram positiva de la Gram negativa, pero hay otras similares como lo es el dominio (Ggdef), en este caso necesitan de otro, el EAL. Las diferencias se notan al ver que en el caso de la Pseudomonas spp, poseen un flagelo; pero el Staphylococcus spp, al no ser móvil posee proteínas de superficie como AtlE, Bap, Esp, el exopolisacárido de galactosa-arabinosa y mientras que en las Gram negativas el autoinductor es la AHL, en estas son los péptidos señal 16-19.
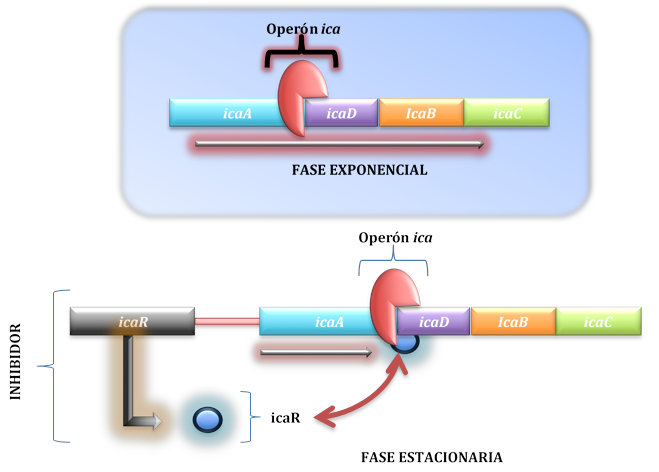
Para el Staphylococcus epidermidis la formación de biopelícula inicia con la codificación del operón ica, éste parte del gen icaADB; con el complejo de genes se da lugar al antígeno capsular PS/A polisacárido capsular/adhesina, conformado por galactosa-arabinosa 16-19.
PS/A permite, en primera instancia, la unión entre célula-superficie, icaA se encarga de codificar para PIA, un polisacárido de adhesión en tétradas trasmembranales, pero este gen necesita de la expresión de icaD para incrementar la expresión enzimática, con lo que icaA, icaD, icaB e icaC en la fase exponencial están en la producción de las proteínas de adhesión y con ello la acumulación de capas protectoras del biofilm. La expresión de PS/A, lleva a la unión célula-célula, junto al traspaso del plásmido que actualmente se conoce como pcN2716-19.
El proceso termina cuando icaR (gen icaR) entra a controlar la expresión de PIA, y a RIP como inhibidor de los péptidos señal, encargados de la autoinducción 16-19 (ver figura 3).
Objetivo
Recuperar y analizar la presencia de bacterias formadoras de biopelículas en las mangueras que distribuyen el agua a las unidades dentales de la Fundación Universitaria San Martin.
Materiales y métodos
En este trabajo se tomaron muestras de elementos de la clínica odontológica Prado Veraniego de la Fundación Universitaria San Martín, se ejecutó un estudio descriptivo de corte transversal con muestreo probabilístico.
La jeringa triple y la pieza de mano fueron seleccionadas al ser los instrumentos por los cuales transita el agua que entrará en contacto con el paciente. En primer lugar, se tomaron 6 muestras antes y 6 muestras después de la consulta, de la jeringa triple con solo agua, con agua-aire y la pieza de mano; se recolectaron 150 mL de agua en frascos schott con tiosulfato de sodio al 10 %.
Las muestras se transportaron inmediatamente al laboratorio de la UCMC (Universidad Colegio Mayor de Cundinamarca) en una nevera de refrigeración y se procesaron por medio de la técnica de filtración por membrana. Se utilizaron membranas de nitrocelulosa con un poro de 0.45 micras, y se procedió a filtrar 50 mL de cada agua, para después colocarla sobre medios Endo, cetrimide y sangre azida. Se incubaron los medios de 35º a 37º C de 24 a 48 horas con excepción del agar base sangre azida que se leyó hasta las 72 horas.

Fuente: elaboración propia
Imagen 1 Punto de conexión de las mangueras que enlazan la pieza de manos y la jeringa triple.
De otra parte, se tomaron doce muestras de las dos mangueras de los respectivos elementos escogiendo las unidades dentales al azar. Luego, se procedió a soltar las mangueras del punto de conexión conocido como bracket, el cual se bifurca hacia la derecha (pieza de mano) y hacia la izquierda (jeringa triple) (imagen 1); se desliza el escobillón en la boca del conducto y se introducen en tubos con BHI, con el fin de poder recuperar cualquier microorganismo presente. Las muestras fueron transportadas al laboratorio de la UCMC, en una nevera de refrigeración y se incubaron posteriormente a 37° C de 24 a 48 horas.
Pasadas las 48 horas se procede a realizar las siembras mediante estrías en Agar sangre y Agar Mac Conkey, y se incuba a 37° C de 18 a 24 horas. Culminadas las horas establecidas, se realiza repique a las colonias típicas en el Agar Sangre y MacConkey con el fin de obtener UFC puras.
A las 18 horas de incubación a 37° C, se procede a realizar coloración de Gram y lectura de las colonias que han crecido. A continuación, se realiza la identificación de cada colonia bacteriana mediante el sistema BBL Crystal para Gram negativos y Gram positivos.
Resultados y discusión
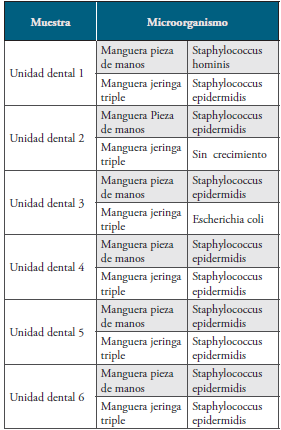
Los resultados del crecimiento de bacterias indicadoras de contaminación en el agua, se muestran en las gráficas 1 y 2 . Los resultados obtenidos de las muestras en las mangueras de la pieza de manos y jeringa triple de las seis unidades dentales se presentan en la tabla 1 y gráfica 3.
Fuente: elaboración propia
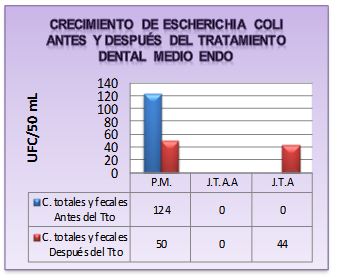
Gráfica 1 Resultados obtenidos de UFC/50mL de E. coli en medio ENDO antes y después del tratamiento
Fuente: elaboración propia
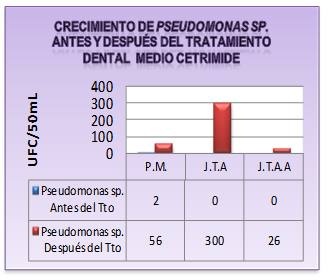
Gráfica 2 Resultados obtenidos de UFC/50mL de Pseudomonas sp. antes y después del tratamiento dental en medio cetrimide.

Fuente: elaboración propia
Gráfica 3 Resultados obtenidos de técnica de BBL Crystal. Comparación entre la presencia de Gram positivos y Gram negativos en el biofilm.
Según Arraigada y otros 20, la presencia de contaminación microbiana en el agua de las unidades dentales fue por primera vez reportada por Sciaky y Sulitzeanu en 1942, de ahí se empieza hablar de la implementación de una buena calidad bacteriológica del agua, cumpliendo así con los parámetros de aceptabilidad del agua potable para consumo humano. Igualmente, se reportan nuevas formas de contaminación en el área odontológica, se habla de microorganismos como bacterias aerobias, anaerobias, hongos, virus, protozoos; todos estos microorganismos formadores de biopelículas.
En este estudio, los resultados obtenidos demostraron el crecimiento de Escherichia coli en las mangueras de la pieza de manos y la jeringa triple, además de su presencia en el agua que es transita por estas dos piezas dentales.
Estas falencias pueden contribuir al inicio de enfermedades endodónticas en los pacientes.
El crecimiento de E. coli en la manguera y en el agua de la jeringa triple, después de la consulta dental, se debe al expulsar por segunda vez la salida del agua, lo que ocasionó el desprendimiento de bacterias agregadas anteriormente. Es decir, las biopelículas por parte de Escherichia coli. La presencia de este bacilo Gram negativo proporciona una fuente significativa de endotoxinas bacterianas, “lipopolisacáridos” (LPS) liberados de las paredes celulares de esta bacteria. Coleman y otros en Irlanda 6, indican que, al ser inhaladas, éstas pueden precipitar síntomas en las vías respiratorias. Además de que las concentraciones de las endotoxinas están directamente correlacionadas con la gravedad del asma. Resultados similares a esta investigación se encuentran en la investigación de Muñoz y otros en México 21, quienes evidenciaron en las mangueras e instrumentos de las unidades dentales crecimiento de Staphylococcus epidermidis y Escherichia coli.
La presencia de Pseudomonas ssp en la pieza de manos y en la jeringa triple puede tener varias probabilidades: la primera es debido a la contaminación por el medio ambiente, desde las redes de distribución que provee el agua potable hasta los tanques que almacenan y distribuyen el agua a todas las unidades dentales. La segunda, es debido al flujo lento de agua que genera “un estancamiento del agua” en las mangueras, propiciando la proliferación de este microorganismo; observándose más número de unidades formadoras de colonias en estos instrumentos dentales. La tercera es debido al deficiente mantenimiento periódico que debe realizarse en cuanto a la limpieza y desinfección del mismo como lo muestran Chacón y otros 22, quienes afirman que la factibilidad de recuperar este microorganismo se debe a que ella puede tener mecanismos de transmisión hídrica y tolerancia a condiciones nutricionales limitadas. Resultados similares se demostraron por Chacón 22, quienes demostraron la presencia de P. aeruginosa y P. fluorescens en el agua proveniente de la jeringa triple y el suministro externo.
Al no evidenciarse crecimiento de Pseudomonas aeruginosa en las mangueras de estos instrumentos dentales, no significa que no esté presente o que no forme biofilm. Puede deberse al insuficiente esquema intensificado de recuperación para este microorganismo en la presente investigación.
El crecimiento de Staphylococcus epidermidis en la manguera de la pieza de manos y de la jeringa triple, coincide con los resultados de Lancelloti y otros en Brasil 23-26, donde argumentan la formación de biopelículas por parte del género Staphylococcus aureus y Staphylococcus epidermidis en líneas de agua.
Como el reflujo constante del agua desde la boca del paciente hacia las mangueras y tuberías conlleva a la fijación de estos microorganismos en la jeringa triple y en la pieza de mano, contamina la superficie de estos instrumentos dentales; lo que posiblemente genera un riesgo de contaminación cruzada entre pacientes y el personal 27-28.
Estas bacterias pueden llegar a ser patógenos oportunistas en el momento de presentarse un desequilibrio sistémico en el paciente. Por lo tanto, hay probabilidad del aumento de bacterias patógenas sobre las superficies y sobre la biopelícula dental en individuos inmunosuprimidos. Coleman y otros en Irlanda 6) indicaron que este microorganismo pertenece a la flora normal en la piel del ser humano y por ser manipuladas contaminan fácilmente; propiciando la proliferación de este microorganismo en las mangueras y por ende en las piezas que se utilizan en la boca del paciente.
Conclusiones
La presencia de microorganismos formadores de biopelículas son potencialmente una fuente significativa de contaminación cruzada y de infección cruzada en el entorno de la clínica dental.
Es necesario desinfectar adecuadamente tanto la instrumentación dental, como el área de trabajo y debe efectuarse en el momento de culminar el tratamiento dental en cada paciente, garantizándole una total inocuidad.
La implementación del control de calidad del agua en las clínicas odontológicas, es esencial; ya que, conociendo la situación bacteriológica de esta, se pueden establecer medidas correctivas como: programas de monitoreo periódico y la aplicación de medidas higiénicas preventivas en el manejo de los elementos utilizados en los tratamientos dentales.