Introducción
Los suelos contaminados por derrame de petróleo crudo son un problema de gran trascendencia mundial. Particularmente, su impacto es negativo Colombia, por su potencial agrícola y forestal 1,2,3,4,5,6. La transformación en los últimos años hacia la producción petrolera, bajo el amparo de la “locomotora minero energética” emprendida por los últimos gobiernos nacionales, regionales y locales generaron que en la actualidad la industria petrolera tenga títulos para la producción o extracción de petróleo crudo para 26 millones de hectáreas, equivalente al 21% del total del territorio nacional 7,8. Las redes de transporte de este mineral, como son oleoductos y poliductos, poseen una longitud calculada en 5.467 kilómetros, cruzan el territorio colombiano de oriente a occidente hacia los principales puertos marítimos que a su vez son los lugares de extracción del crudo del país 9. Estas redes de transporte atraviesan diversos e invaluables ecosistemas en los cuales, ya sea por accidente o por motivaciones delictivas son destruidos, ocasionando un derrame de petróleo crudo y generando contaminación de suelos, agua y aire 4.
Benavides y colaboradores 10 estimaron que entre 1986 y 1998, según datos oficiales publicados en este campo, los atentados a oleoductos en Colombia generaron el derrame de dos millones de barriles de petróleo, los cuales afectaron cuerpos hídricos y suelos de uso tanto agro-industrial como forestal. Otros investigadores 7,11 aseguraron que se ha derramado 7.6 veces más que el petróleo que se derramó en el desastre del buque Exxon Valdés entre Alaska y Canadá el 24 de Marzo de 1989.
Según Wang 12, las características inherentes del petróleo crudo corresponden a una mezcla de varias sustancias de origen orgánico con variado tamaño y estructura, con la capacidad de afectar grandes extensiones de suelo y cuerpos hídricos tanto superficiales como subterráneos, los cuales en su mayoría pueden ser recuperados totalmente por la combinación de tecnologías desarrolladas para este fin. En un derrame de petróleo crudo en el suelo se afecta su estructura físico-química y biológica, como por ejemplo la relación carbono, nitrógeno y fósforo. Este último elemento es considerado escaso para los suelos colombianos, lo cual genera un impacto directo en los procesos fotosintéticos en plantas y altera la biota circundante 13,14. Además hay afectación severa sobre la germinación de semillas ya que inhiben dicho proceso, altera el crecimiento vegetal y produce necrosis foliar 15,16. Así, se reducen drásticamente las poblaciones macro y microbianas nativas, lo cual es perjudicial y trascendental para Colombia, pues al ser un país mega diverso, la ocurrencia de un derrame de petróleo crudo impacta su potencial biológico 2,3.
Dentro de las pocas especies que sobreviven a la contaminación con petróleo crudo, hacen parte los hongos filamentosos. Estos se caracterizan por ser aerobios, de amplia distribución geográfica, extremófilos (es decir, capaces de reproducirse en niveles de pH que oscilan entre 3 hasta 12), resistentes a temperaturas entre 2°C y 60°C; en su mayoría son simbióticos con las demás especies microbianas presentes en los suelos, y los hidrocarburolíticos poseen un mecanismo de supervivencia adaptativo para utilizar el carbono desde el petróleo crudo como fuente energética, lo cual permite utilizarles como organismos promisorios en procesos de biorremediación 12,17,18.
Al utilizar una técnica de biorremediación in situ, posterior a un derrame de petróleo crudo sobre suelo, los hongos filamentosos hidrocarburolíticos son útiles ya que al no generar metano como residuo final del proceso, son organismos que no contribuyen al efecto invernadero y al cambio climático 19. Una de las causas de estos problemas ambientales es la acumulación de gases tóxicos en el ambiente como son el anhídrido carbónico, óxido nitroso, ozono, amonio y metano; este último tiene una vida media en la atmósfera de 12 años y contribuye 25 veces más al calentamiento global que el anhídrido carbónico. El residuo final al utilizar hongos filamentosos hidrocarburolíticos son biomasa, agua y CO 12,20,21,22,23,24,25.
El mecanismo de acción de los hongos filamentosos está basado en la aerobiosis, se destaca por desencadenar un proceso totalmente oxidativo del sustrato para obtener su energía metabólica y el desarrollo de su cadena respiratoria, en donde el oxígeno actúa como aceptor final de electrones 26. En la presencia de oxígeno molecular es catalizado por enzimas presentes en el citoplasma celular, denominadas oxigenasas; las cuales pueden ser de tipo monooxigenasa (esto es, que incorporan un solo átomo al proceso y reducen el otro para generar agua) o dioxigenasa (es decir, las que adhieren ambos átomos de oxígeno al proceso) 27,28,29,30,31. Cabe resaltar que la actividad enzimática de los hongos filamentosos se presenta a partir de tres mecanismos enzimáticos, lignina oxidasas, lignina per oxidasas y lignina hidrolasas 28,32,33,34,35,36,37.
En el desarrollo de este proyecto se aislaron hongos filamentosos presentes en suelos contaminados por derrame de petróleo crudo en tres lugares correspondientes a tres regiones de Colombia, a saber, Antioquia, Meta y Nariño, con características ambientales diferentes. Se evaluó su capacidad biorremediadora in vitro sobre este sustrato en suelo contaminado con este, artificialmente por medio de la técnica landfarming modificada a diferentes concentraciones y se determinó el mecanismo de acción por el cual dichas especies degradan el contaminante mencionado.
Metodología
Muestreo del suelo: se recolectaron muestras de suelo en tres lugares geográficos diferentes en Colombia (figura 1), en los cuales hubo derrames de petróleo crudo desde oleoductos, con la finalidad de aislar especies de hongos filamentosos.
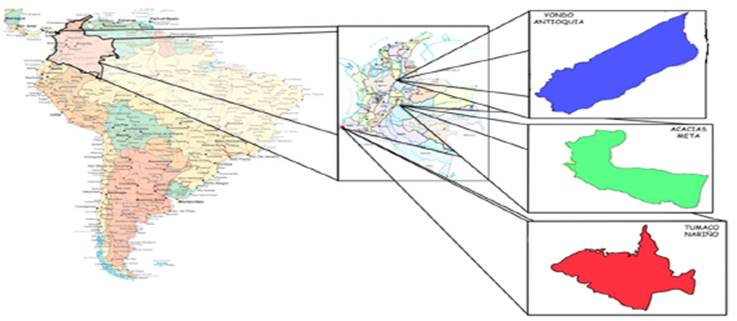
Fuente. (Tomado de: http://www.zonu.com/fullsize2/2009-11-18-11141/Mapa-Politico-de-America-del-Sur.html, http://histórico.presidencia.gov.co/asiescolombia/mapacol.htm. http://www.tumaconarino.gov.co/mapas_municipio.shtml?apc=bcxx-1-&x=1364266), modificada y diseñada por Daniela de Los Ángeles Cáceres Bedoya.
Figura 1 Localización de los sitios de muestreo.
En el cuadro 1 se indican las características de los sitios de muestreo y datos de su localización. La toma de muestras de suelo se realizó por medio de la elaboración de cajuelas de 20cm X 20cm X 10cm de las cuales se extrajeron 500g de muestra con barreno en el municipio de Yondó (Antioquia). En la recolección de las muestras de suelo en el municipio de Acacías (Meta) y Tumaco (Nariño) se utilizó cucharón de draga manual debido a que el suelo contaminado estaba cerca a los cuerpos de agua 41.
Cuadro 1 Características de los lugares donde se tomaron las muestras de suelo contaminadas con hidrocarburos.
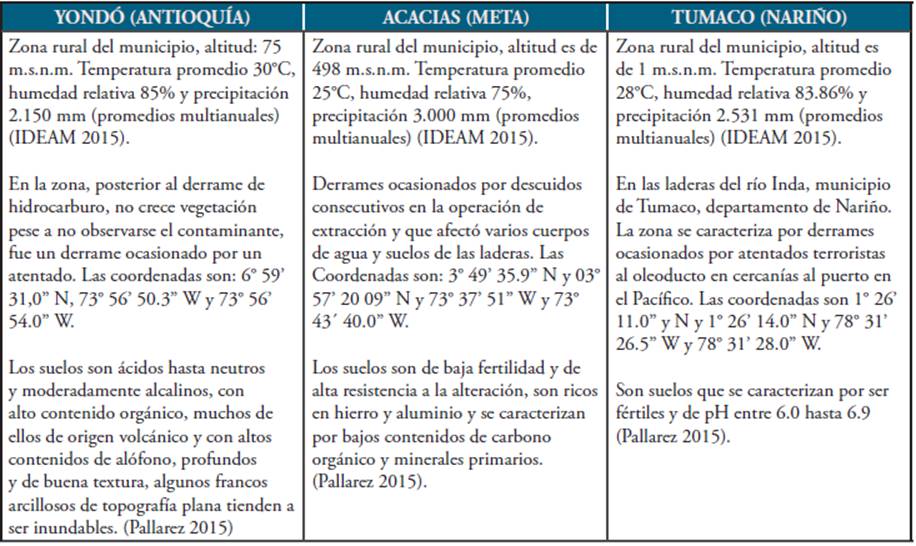
Fuente. Elaboración propia.
Se tomaron 10 muestras de suelo por sitio de muestreo en las áreas mencionadas, con el propósito de homogenizarlas 42. Además, se tomó una muestra de suelo control correspondiente a cada sitio muestreado, en lugares sin rastro o evidencia de afectación por contaminación con petróleo crudo, para realizar la comparación respectiva. El muestreo fue de tipo preferencial en el sentido que se localizaron las zonas de afectación por petróleo crudo para tomar las muestras y de allí fue recolectado el suelo, igualmente se hizo lo mismo para las muestras control. Se seleccionó este tipo de muestreo por las complicaciones existentes, de accesibilidad y seguridad, para acceder a los puntos de muestreo con suelos contaminados con petróleo crudo.
Condiciones de transporte de las muestras: las muestras fueron colocadas en bolsas de papel y de plástico previamente esterilizadas; se tomaron en total 33 muestras, las cuales fueron depositadas en una nevera de icopor con hielo con el fin de preservarlas en una temperatura de 4°C y transportadas inmediatamente a los laboratorios de la Universidad de Ciencias Aplicadas y Ambientales para su procesamiento basado en la norma 43.
Siembra primaria de las muestras de suelo: se sembraron las muestras de suelo contaminadas con petróleo crudo, recolectadas previamente en cada uno de los lugares donde se obtuvieron las muestras de suelo originalmente, por triplicado, para un total de noventa y nueve cajas de Petri, posterior a hacerse una dilución en 5ml de solución salina al 0.9%, con 1g de la muestra de suelo, directamente sobre el medio PDA + cloranfenicol por un periodo entre 2 a 7 días a 25°C. El protocolo fue modificado según la metodología 43.
Aislamiento e identificación de hongos filamentosos de las muestras de suelo: se seleccionaron cepas de hongos filamentosos que crecieron en el cultivo primario por zona de muestreo y cada una de ellas fue sembrada en una caja de Petri con el medio PDA + cloranfenicol, se incubó entre 2 y 7 días a 25°C, para su posterior identificación; al final del proceso, se seleccionaron los hongos con crecimiento en común en los tres suelos muestrea-dos y se identificaron a partir de las características macroscópicas y microscópicas utilizando claves taxonómicas 45,46,47.
Cuantificación del petróleo crudo en los suelos muestreados: después de realizar la extracción y/o fraccionamiento del petróleo crudo contenido en una muestra de suelo, estos se pueden cuantificar por varios métodos, en este caso se realizó la cuantificación por método gravimétrico 48.
Análisis físico-químico del suelo muestreado inicialmente y contaminado con petróleo crudo y las muestras control: las pruebas básicas que se realizaron a las muestras de suelo contaminadas con petróleo crudo fueron: pH, amonio, conductividad eléctrica, fosfatos, nitratos y nitritos basado en él 48,49.
Caracterización del petróleo crudo: se realizó una caracterización del petróleo crudo por medio de las pruebas BSW y el °API, para saber qué tipo de crudo se estaba empleando en la evaluación de la capacidad biorremediadora in vitro, teniendo en cuenta que el origen de éste es de un pozo petrolero de Puerto Gaitán (Meta) según lo establecido 50,51.
Método de agitación por centrifugación para la determinación de la capacidad biorremediadora de los hongos filamentosos: este método cuantitativo para la extracción de petróleo crudo de sustratos como el suelo, es utilizado por su economía, rapidez y sencillez en la técnica. En cuanto a la velocidad de agitación y volúmenes de solventes por utilizar, esta se basa en los métodos descritos en 48,52,53,54,55,56.
Método de evaluación in vitro de la capacidad biorremediadora de tres cepas de hongos filamentosos: el análisis de las muestras de suelo contaminadas con petróleo crudo se basó en diseñar un microcosmos, en el cual a 50g de suelo contaminado de manera artificial con diferentes concentraciones de petróleo crudo pesado (20.000 ppm, 30.000 ppm, 40.000 ppm, 60.000 ppm, 80.000 ppm, 100.000 ppm) se agregó 3ml de caldo nutricional/día, se aplicó aire continuo a cada tratamiento y se mantuvo la temperatura constante a 32°C, generando un ambiente artificial tratando de imitar las condiciones originales de los suelos. A estos montajes se adicionó conidios de hongos filamentosos por separado así como en consorcio. Cabe destacar que a partir de la caracterización morfológica y la correlación con las referencias bibliográficas se determinaron la capacidad biorremediadora de los hongos aislados en otros estudios, se escogieron tres cepas de las aisladas inicialmente, teniendo en cuenta el tiempo de crecimiento, el cual estuvo en el rango de 24-48 horas. Este inóculo se ajustó en una proporción de 300 conidios/ml en agua destilada, con ayuda de la cámara de Neubauer y como con-trol positivo se utilizó el hongo Penicillium janthinellum. Posterior a este procedimiento se analizó periódicamente la capacidad biorremediadora con un espectofotómetro UV-VIS 6405, JENWAY modelo 6405, hasta obtener cero de absorbancia 48,57,58,59.
Determinación preliminar in vitro de las enzimas utilizadas por los hongos filamentosos en el proceso de biorremediación: como parte del proceso, se evaluó cualitativamente el mecanismo de acción desarrollado por el hongo filamentoso in vitro para realizar la actividad biorremediadora del petróleo crudo mediante peroxidasa y oxidasa 21,36,37,60.
Determinación de la citotoxicidad de los hongos seleccionados en la biorremediación: se estableció la capacidad de citotoxicidad en plantas de Allium fistulosum, las cuales fueron inoculadas con las cepas seleccionadas para el proceso de biorremediación. Para este experimento se colocaron en un medio líquido con macro y micro nutrientes: CaNO3, 5g/L; KNO3, 5g/L; MgSO4, 2g/L; KH2PO4 1g/L quelato de Fe, 1g/L; agua destilada, 1L, cloranfenicol 0.5g/L. Se dejaron durante 14 días en el medio líquido con los nutrientes y las colonias de hongos utilizadas en el proceso de biorremediación.
Análisis de datos: se realizó por medio de análisis de varianza a partir de los resultados obtenidos de la cuantificación de la efectividad de los hongos filamentosos utilizados y las concentraciones de petróleo crudo a los cuales se sometieron los géneros micológicos, su capacidad biorremediadora en consorcio con relación al tiempo a partir de un ANOVA y la prueba de comparación usada fue la HSD (Diferencia Honesta Significativa) o prueba de Tukey, respectivamente. Se realizaron dos experimentos distintos, el primero se realizó bajo una estructura aleatoria con arreglo factorial del tipo 3 x 2 (Género x Concentración de petróleo), mientras que para el experimento 2 fue del tipo Diseño completamente al azar - DCA con 4 tratamientos, los cuales se describen a continuación:
Aplicación de las tres cepas (identificadas hasta género) de hongos a nivel individual: se realizó un diseño aleatorizado con dos (2) factores, el hongo filamentoso (que fue identificado a nivel de género) y la concentración del petróleo crudo. Estos factores tienen 3 y 2 niveles respectivamente, que son, por una parte, Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As- 3 y Rhizomucor sp. Cepa 1A/R-1; y por otra, las concentraciones de 20.000ppm y 30.000ppm, para evaluar nuevamente el tiempo en el cual los hongos desarrollaron el proceso de biorremediación en suelo a partir del nivel de absorbancia.
Aplicación de los cepas (identificadas a nivel de género) de hongos en consorcio: se utilizaron los hongos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As- 3 y Rhizomucor sp. Cepa 1A/R-1. En consorcio a 300 conidios, 100 de cada género aislado en diferentes concentraciones de petróleo crudo (40.000 ppm, 60.000 ppm, 80.000 ppm y 100.000 ppm), por triplicado, para evaluar el tiempo en el cual los hongos filamentosos generaron el proceso de biorremediación en suelo, lo cual se midió a partir del nivel de absorbancia.
Cada uno de los 125 resultados en el proyecto, se anexa a una tabla de tabulación de los datos utilizando el software MSExcel y el procesamiento de los mismos, con el lenguaje de programación 61,62. A través del diseño factorial múltiple, en este esquema se tuvo en cuenta las cuatro variables independientes que son: la concentración del petróleo crudo diluida en el sustrato, la cantidad de conidios de hongos filamentoso (identificados hasta nivel de género), el tiempo como variable dependiente y la capacidad biorremediadora.
Resultados
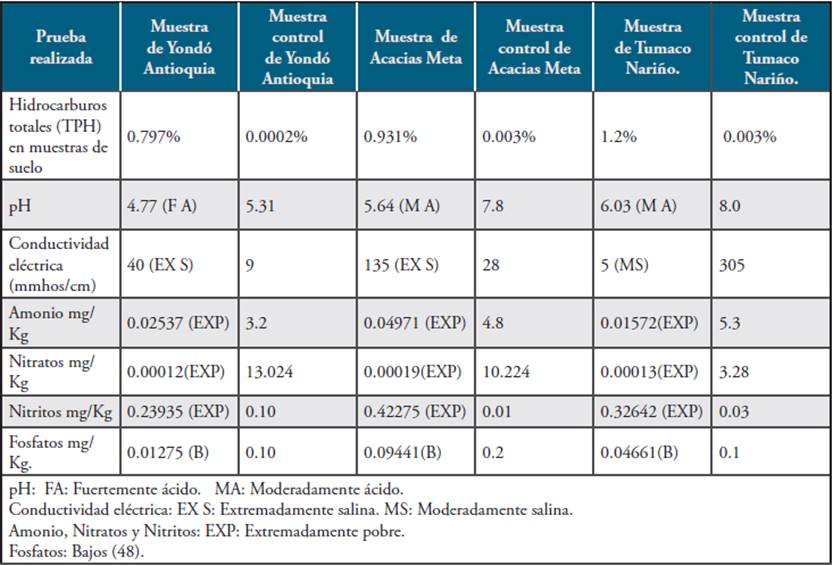
En la Tabla 1 se encuentran los resultados de los contenidos de hidrocarburos totales presentes en las muestras utilizadas para el proyecto, los cuales se obtuvieron por el método gravimétrico, y se corroboraron en un laboratorio certificado por el IDEAM (CHEBILAB). Además se realizaron otras pruebas como: pH, conductividad eléctrica, amonios, nitratos, nitritos y fosfatos.
Tabla 1 Resultado del análisis físico-químico de las muestras de suelo. Los análisis de Hidrocarburos totales se realizaron en el laboratorio Chemilab, acreditado por el IDEAM.
Fuente. Elaboración propia.
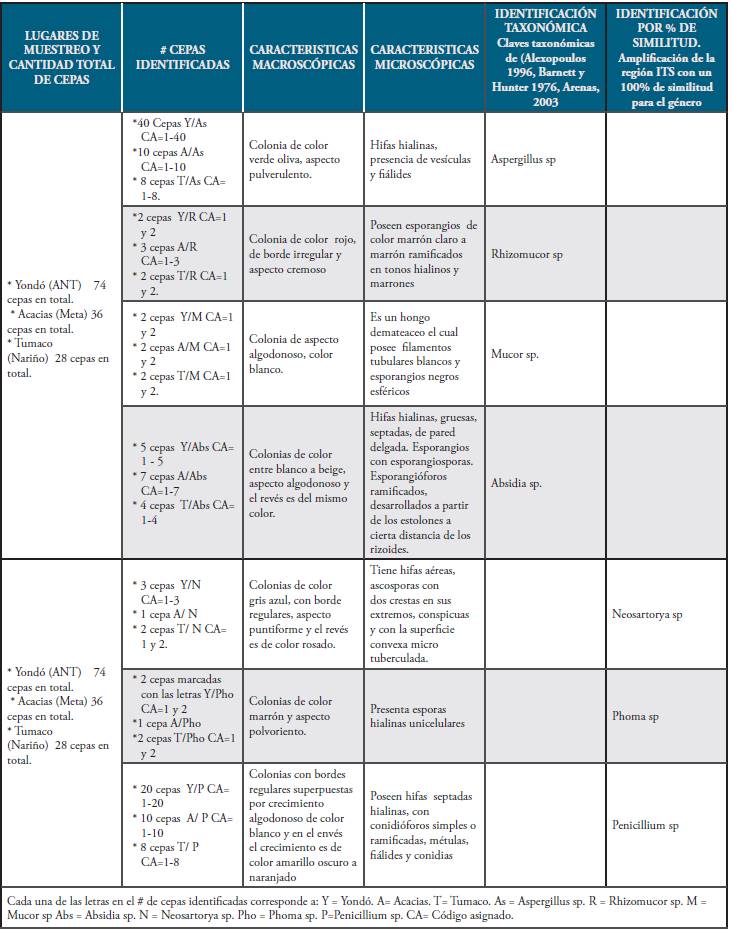
Identificación de hongos filamentosos obtenidos en las muestras de suelos contaminados con petróleo crudo: se aislaron 138 cepas a partir de 90 cultivos primarios de las muestras de suelo contaminado con petróleo crudo obtenidos en los municipios de Yondó (Antioquia), Acacías (Meta) y Tumaco (Nariño), teniendo en cuenta sus características macroscópicas y microscópicas, confirmadas con las claves taxonómicas de 45,46,47; así como la amplificación por PCR de la región ITS (Transcripción interna espaciador) ubicándose la totalidad de las cepas en siete géneros de hongos filamentosos. Como control del proceso de identificación de los hongos presentes en las muestras de suelo contaminado con petróleo crudo se tomaron muestras de suelos ubicados en cada uno de los lugares muestreados, es decir Yondó (Antioquia), Acacías (Meta) y Tumaco (Nariño) para un total de tres muestras, las cuales fueron obtenidas evidenciando por información de la comunidad aledaña y por análisis en el laboratorio que no estuvieran contaminadas con petróleo crudo, así como el análisis físico-químico de suelo. Este procedimiento se realizó con el objetivo de confirmar la presencia de los hongos filamentosos reportados en los suelos con petróleo crudo y descartar que las muestras se hubiesen contaminado en cualquiera de los procedimientos previos a la identificación de estas especies. Los resultados de la identificación de cada una de las muestras contaminadas con petróleo crudo se presentan en la Tabla 2.
Tabla 2 Cepas obtenidas en muestras de suelo contaminado con petróleo crudo obtenidas en los municipios de Yondó (Antioquia), Acacias (Meta) y Tumaco (Nariño) identificadas por claves taxonómicas o por PCR.
Fuente. Elaboración propia.
Caracterización del petróleo crudo utilizado en la biorremediación: la prueba BSW dio como resultado 0.924 g/cm3 = 21.6°API; según la clasificación internacional de hidrocarburos que es un petróleo crudo pesado 63; lo cual indica que es un componente cuya estructura química se caracteriza por tener cadenas dentro de su composición como son las resinas en un 30%, asfáltenos un 5.8% y aromáticos saturados en un porcentaje aproximado de 64% 64. En su estructura química el petróleo crudo presenta tanto en las resinas, los asfáltenos y los aromáticos saturados un alto peso molecular, poseen anillos bencénicos ligados con cadenas alquílicas y ciclo-alcanos los cuales se fusionan entre sí a partir de enlaces sencillos, dobles o triples. También contiene metales como el vanadio, níquel y el hierro y elementos como el azufre, el nitrógeno y el oxígeno los cuales componen los heteroátomos, estructuras que son características en estas sustancias 65,66,67.
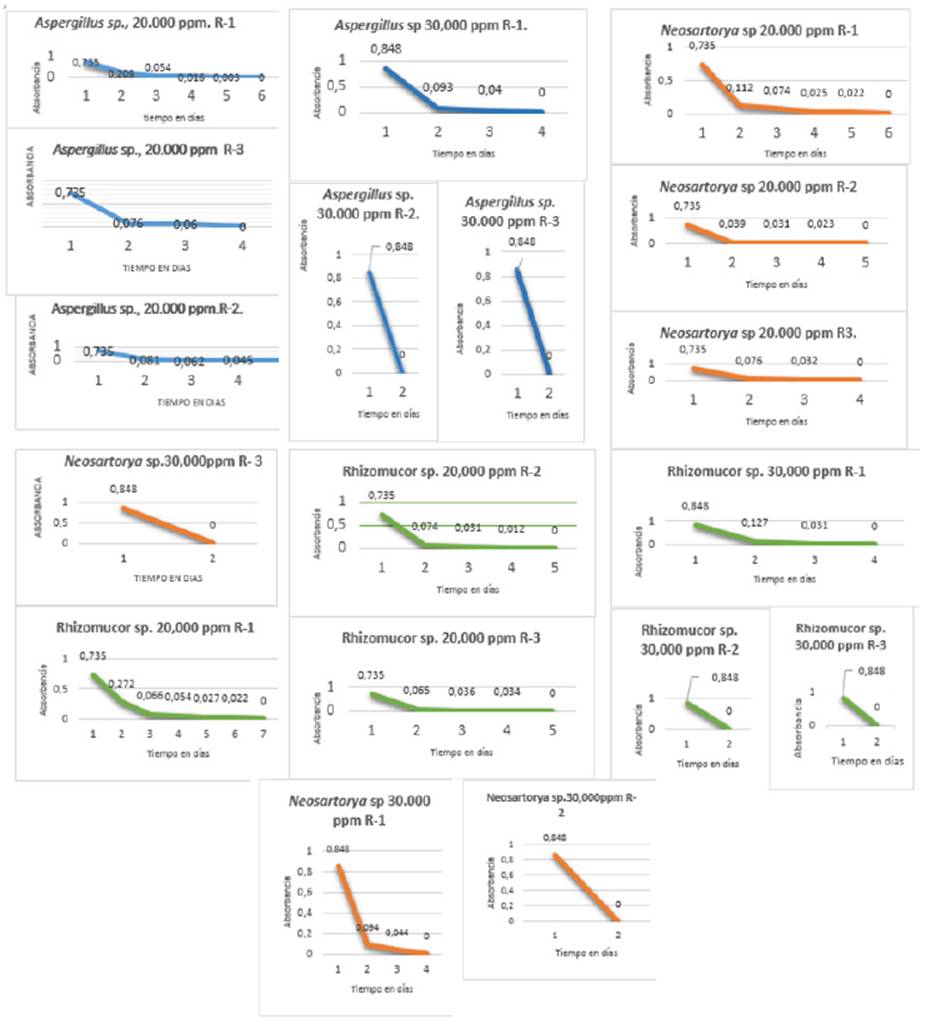
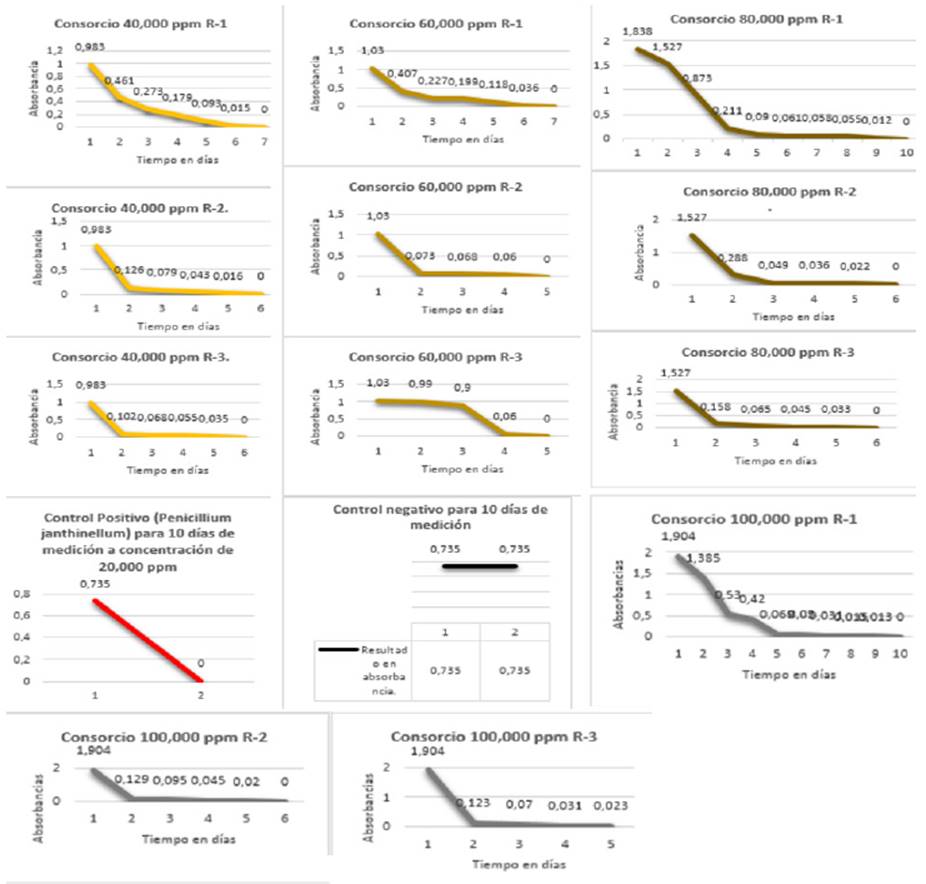
Evaluación de la capacidad biorremediadora de tres géneros de hongos filamentosos a diferentes concentraciones de petróleo crudo pesado: se realizó una medición por espectofotometría de la capacidad biorremediadora de los hongos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, individualmente en suelo contaminado con petróleo crudo pesado a concentraciones de 20.000 ppm y 30.000ppm y utilizando las tres cepas en consorcio en suelo contaminado con petróleo crudo pesado a concentraciones de 40.000ppm, 60.000ppm, 80.000ppm y 100.000ppm obteniendo como resultado 125 datos de absorbancia, los cuales se observan en las cinéticas correspondientes a las Figuras 2 y 3, respectivamente.
Fuente. Elaboración propia.
Figura 2 Cinética de los géneros de los hongos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1. Sobre suelo contaminado con petróleo crudo.
Fuente. Elaboración propia.
Figura 3 Cinética del consorcio: Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1. Sobre suelo contaminado con petróleo.
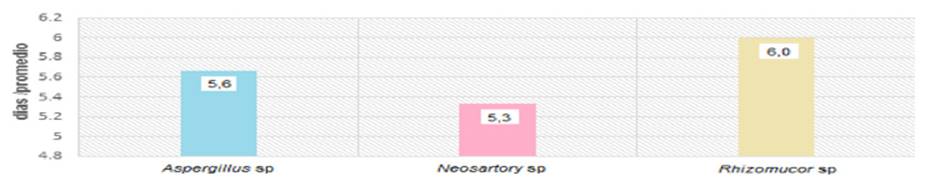
1: Aplicación de los tres géneros de hongos a nivel individual: los resultados obtenidos al evaluar la capacidad biorremediadora de los tres hongos filamentosos, se presenta en las siguientes figuras y tablas. En la Figura 4 se puede observar que no hay diferencia significativa entre los tres géneros utilizados, ya que su capacidad biorremediadora sobre suelo contaminado con petróleo crudo se llevó a cabo un periodo entre 5 a 6 días.
Fuente. Elaboración propia.
Figura 4 Efectividad biorremediadora de los hongos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, sobre suelo contaminado con petróleo crudo a 20.000 ppm.
En la Figura 5 se puede observar que no existe diferencia entre el tiempo que necesitan los géneros de hongos filamentosos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, para biorremediar el petróleo crudo del suelo contaminado artificialmente a 30.000 ppm.
Fuente. Elaboración propia.
Figura 5 Efectividad biorremediadora de los hongos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, sobre suelo contaminado con petróleo crudo a 30.000 ppm.
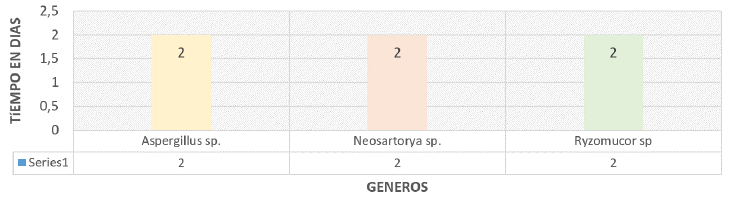
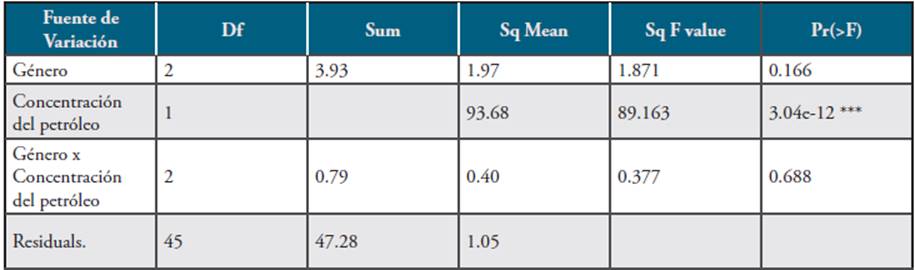
En la Tabla 3 se consolida la evidencia encontrada donde se puede verificar que no existe diferencia entre géneros frente a la capacidad biorremediadora de los mismos. Sin embargo, sí se verifica que hay una respuesta diferencial frente a la concentración de petróleo (p≤04e-12), la cual se reporta en la Tabla 10 (HSD para concentraciones).
Tabla 3 Resultados obtenidos en la ANOVAs para los análisis aplicados a los tres géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/ As-3 y Rhizomucor sp. Cepa 1A/R-1.
Fuente. Elaboración propia.
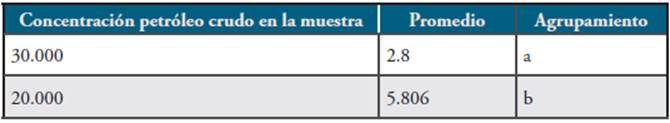
En la prueba de Diferencia Honesta Significativa o Tukey, agrupamiento a en la Tabla 4, se puede observar que con una concentración de 30.000ppm, el tiempo tuvo un promedio de digestión que disminuyó a la mitad, lo que equivale a 2.8 días. Esto indica que para los tres géneros de hongos utilizados en la biorremediación del petróleo crudo en suelo es más favorable su acción en una concentración de 30.000ppm.
Tabla 4 Diferencia Honesta Significativa o Tukey para los análisis aplicados a los tres géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1.
Fuente. Elaboración propia.
Así mismo se puede establecer que no hay diferencia significativa entre las absorbancia en función de la concentración ni del hongo, mientras que el tiempo de respuesta si evidenció diferencias como función de las concentraciones.
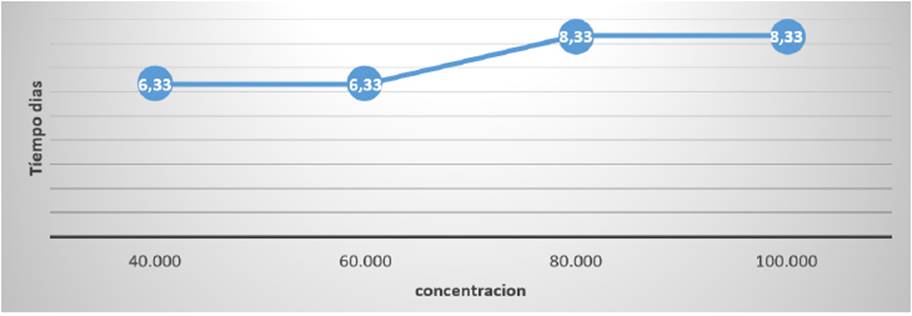
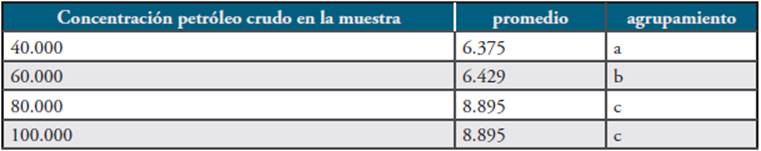
2: Aplicación de los tres géneros de hongos en consorcio: los resultados obtenidos en este proyecto y detallados en la Figura 6 permiten evidenciar que la evaluación de la capacidad biorremediadora en concentraciones de petróleo crudo de 40.000ppm y 60.000ppm, transcurre en un promedio de 6.4 días y en concentraciones de petróleo crudo de 80.000ppm y 100.000ppm se realiza en un promedio de 8.9 días, teniendo mejor respuesta los dos tratamientos iniciales con relación a los últimos.
Fuente. Elaboración propia.
Figura 6 Efectividad biorremediadora del consorcio comprendido por los géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1.
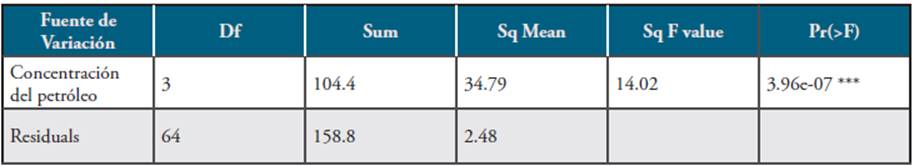
En la Tabla 5, la cual corresponde a la ANOVA para el consorcio conformado por los géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, se aporta evidencia de que el tiempo de actividad biorremediadora es diferente en función de la concentración de petróleo. Puede verificarse que en la medida en que la concentración es mayor, existe una actividad biorremediadora más rápida como se registra en la Tabla 6 (HSD).
Tabla 5 Resultados obtenidos en ANOVAs para el consorcio conformado por los géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1.
Fuente. Elaboración propia.
Tabla 6 Diferencia Honesta Significativa o Tukey para el consorcio conformado por los géneros Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1.
Fuente. Elaboración propia.
En la Tabla 6 también se evidencia que el uso de hongos filamentosos como Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. Cepa 1A/R-1, en consorcio, muestran un efecto sinérgico entre estos y que pueden degradar petróleo crudo de alta densidad (°API de 21.6) en concentraciones entre 40.000ppm hasta 100.000ppm, en un tiempo promedio de 6 a 8 días, en un porcentaje de 100%.
Resultado de la evaluación cualitativa in vitro del mecanismo de acción enzimático de los géneros de hongos filamentosos utilizados en la biorremediación de petróleo crudo pesado: en este proyecto se identificó cualitativamente el uso de peroxidasa (lignina peroxidasa) como mecanismo de acción de las tres especies evaluadas, lo cual indica que usaron enzimas peroxidasas en el metabolismo bioquímico empleado por las especies de hongos utilizados para evaluar la capacidad biorremediadora. Se puede corroborar que el metabolismo fúngico es de tipo aeróbico, garantizando al final del proceso la producción de biomasa, liberación de CO2 y agua.
Resultado de la prueba de citotoxicidad realizada a los hongos filamentosos seleccionados en el proyecto de biorremediación: no se encontró evidencia en el tejido vegetal de la planta Allium fistulosum, por lo que se considera que los hongos filamentosos utilizados en el proyecto carecen de citotoxicidad. Vale la pena resaltar que cuando la planta está en presencia de agua con alguna sustancia tóxica o en presencia de un microorganismo patógeno se inhibe la división celular de los meristemos, afectando parcial o totalmente el proceso de mitosis 68.
Discusión
A partir del desarrollo de esta investigación se pudo apreciar que hay diferencias en algunas de las características físico-químicas en los suelos analizados con respecto a los resultados obtenidos en las muestras control. Con respecto a los contenidos de hidrocarburos, se encontró que la muestra de Yondó presentó una concentración de 0,797 de hidrocarburos, la muestra de Acacías (Meta) el valor registrado fue de 0,931% y la muestra de Tumaco (Nariño) el valor fue de 1,02% de hidrocarburos. Es importante anotar que no existe una norma específica en Colombia que haga referencia a los valores máximos permisibles de hidrocarburos en suelo. La única resolución que trata este tema es la 631 del 17 de marzo de 2015, expedida por el Ministerio de Ambiente y Desarrollo Sostenible dirigida a vertimientos de aguas residuales. Por lo tanto, para este documento se toma como referencia el tratado de Luisiana, el cual señala a las muestras analizadas como contaminadas con hidrocarburos 69.
Las muestras control corresponden a suelos no contaminados con hidrocarburos, con concentración por debajo del 0,02%, lo cual según la técnica de gravimetría corresponde a valores por debajo de la sensibilidad de la técnica utilizada y por tanto los suelos control no presentan contaminación con hidrocarburos 69. En cuanto a la conductividad eléctrica en las muestras y controles permiten observar que son suelos extremadamente salinos o fuertemente salinos y por último los valores en amonio, fosfatos nitratos y nitritos en las muestras de suelo contaminadas y evaluadas son muy pobres y difieren de las muestras control 48.
Posterior a la siembra de los hongos encontrados y mencionados en la Tabla II, se puede observar que de 138 cepas aisladas en 90 cultivos primarios de las muestras de suelo contaminado con petróleo crudo localizados en los municipios de Yondó (Antioquia), Acacías (Meta) y Tumaco (Nariño); identificados a partir de sus características macroscópicas y microscópicas, con la ayuda de las claves taxonómicas de 45,46,47, así como la amplificación por PCR de la región ITS, se estableció que pertenecían a siete géneros de hongos filamentosos que son: Aspergillus sp., Penicillium sp., Neosartorya sp., Phoma sp., Rhizomucor sp., Mucor sp., y Absidia sp.
Godoy y colaboradores 70 aislaron de suelo contaminado con hidrocarburos 23 especies de hongos pertenecientes en su mayoría a la Phylum Ascomycota, Phylum Basidiomycota y la subfilo mucoromycotina, los cuales degradaron el anillo antraceno en 42 días por medio de enzimas extra-celulares oxidorreductasa. Varias de estas especies liberaron al contacto con el contaminante. Destaca la capacidad de la mayoría para degradar totalmente el hidrocarburo y solo unas pocas parcialmente, con porcentaje superior al 90%. La mayor parte de las cepas de hongos filamentosos encontradas en suelos contaminados con petróleo crudo en este proyecto pertenecen a los géneros Aspergillus sp. y Penicillium sp., las cuales, según la literatura, son las especies más utilizadas en el campo de la biorremediación ya que han sido obtenidas en muestras de suelo y agua contaminada con petróleo crudo y derivados de éste, en diversas partes del planeta como Indonesia 71; desierto de Kuwait, 72; el desierto de Arabia Saudita 73; Argentina 74; Guanaco, estado de Sucre en Venezuela 75; Nigeria 76; el Golfo de México 77 e Irán 28,78; lo cual indica su poder biorremediador de suelos, su carácter cosmopolita y una amplia capacidad de adaptarse a todos los climas, condiciones edáficas y atmosféricas 13,78,79,80.
Este proyecto respalda lo dicho por muchos investigadores como Sawulski y colaboradores 2, quienes analizaron la comunidad microbiana presente en suelos contaminados con diferentes tipos de hidrocarburo y su comportamiento a partir del contacto con este, destacando las pocas especies que sobreviven a este impacto y cómo las especies que se adaptan poseen capacidad hidrocarburolítica. Silva y colaboradores 32 utilizaron en su proyecto microorganismos aislados de un sustrato contaminado previamente con diésel y encontraron que las especies aisladas en dicho sustrato tienen capacidad para degradar en algún grado dicho contaminante. Aranda 81 destaca la importancia de utilizar especies de hongos por su potencial capacidad biorremediadora de petróleo crudo y derivados. Afirma, además, que su metabolismo intracelular es complejo y poco estudiado, pero que a partir del estudio del genoma de estos se podría aplicar su sistema enzimático, el cual está presente en casi todas las especies.
Así mismo se encontró en esta investigación el hongo filamentoso perteneciente al género Neosartorya, el cual se aisló inicialmente de suelos contaminados con petróleo crudo por lo que se considera una especie con capacidad biorremediadora 69,73,78,79,80,82. Y precisamente es en el estudio de Uribe y colaboradores 83 donde se comenta que hay evidencia de la capacidad que posee N. fischeri para mineralizar asfáltenos, catabolizando más del 15% del carbono presente en esta sustancia en un tiempo aproximado de 11 semanas; estudio que pudo ser la base de los proyectos de Hernández y colaboradores 84, quienes realizaron la transcripción de los perfiles utilizando un diseño propio de microarray, con el cual identificaron los genes que le permiten a esta especie utilizar los asfáltenos como única fuente de carbono. Ke y colaboradores 85 clonaron una endo y exo poligalacturonasa a partir de esta especie, para obtener dicha enzima in vitro ya que ésta se caracteriza por ser estable a una temperatura de 55°C y tolerar un amplio rango de pH; lo cual permite su uso en procesos de biorrefinería. Cabe destacar que este género de hongo filamentoso, no había sido reportado en suelos contaminados con petróleo crudo en Colombia hasta la presente investigación.
Otros géneros encontrados en el proyecto son: Phoma sp., Mucor sp., y Absidia sp., los cuales fueron reportados como biorremediadores de petróleo crudo en un estudio realizado por Yuan y colaboradores 86. Passarini 29 describieron como el género Mucor sp., posee una actividad enzimática como el mecanismo para degradar las cadenas lineales y ramificadas a sustancias como el CO2 y H2O. Resultado confirmado en la investigación liderada por Pernia y colaboradores 82) establecieron la capacidad biorremediadora en suelos contaminados con cadmio y petróleo crudo. En relación al género Rhizomucor, no se encontraron, al finalizar el año 2016, reportes como agente hidrocarburolítico, salvo lo encontrado en esta investigación.
Con base en lo obtenido por el ANOVA, se puede decir que en procesos de biorremediación con el método de Landfarming modificado, el uso de hongos filamentosos como son Neosartorya sp. cepa A/N-1, Aspergillus sp. cepa Y/As-3 y Rhizomucor sp. cepa 1A/R-1, cuando se utilizan por separado o en consorcio es una opción ecológica, económica y rápida para la recuperación de suelo contaminado, ya que se evidencia un efecto sinérgico entre estos y pueden degradar petróleo crudo de alta densidad (°API de 21.6) en concentraciones entre 20.000ppm hasta 100.000ppm, en un tiempo promedio de 6 a 8 días, dependiendo de la concentración del petróleo crudo en un porcentaje de 100%. Sarkar y colaboradores 87 realizaron una comparación entre dos métodos de biorremediación, Por una parte, la bioestimulación aplicando nitrógeno, fósforo inorgánico y biosólidos. Por otra, el método de atenuación natural, adicionando nitrógeno y fosforo inorgánicos, en un suelo de tipo arcilloso contaminado con diésel. En ambos casos el experimento se llevó a cabo in vitro. Después de 8 semanas de bioestimulación obtuvieron una degradación del contaminante de 96% para el método de bioestimulación y para el método de atenuación natural el resultado fue superior al 93% lo cual, concuerda con lo realizado por Naranjo y colaboradores 75, quienes utilizaron los géneros mencionados en este proyecto al sembrarlos en me-dio de cultivo con petróleo crudo como sustrato contaminante, con el fin de obtener enzimas extra-celulares capaces de degradar el hidrocarburo, en 21 días aproximadamente, en un porcentaje superior al 70%. Es importante destacar que varios estudios en este campo aseguran que es difícil biorremediar suelo o agua contaminados con petróleo crudo por su alto peso molecular y por los anillos bencílicos 89. Se necesita de una fuerte reacción por parte del hongo filamentoso con enzimas extracelulares para romper dichos anillos y mineralizar esta sustancia hasta hacerla inocua para cualquier ser vivo 84.
Posterior a dicha investigación, Taewoo y colaboradores 89 afirmaron que la Neosartorya sp. es un organismo de fácil recuperación en componentes naturales afectados por petróleo crudo y es un género que no posee una fase de latencia, capaz de metabolizar petróleo crudo de alta densidad, así como derivados de éste, aunque su capacidad biorremediadora se observa mejor en concentraciones del contaminante entre 5.000-20.000 mg/L. Además, comentaron que la capacidad de la Neosartorya sp. De adaptar su actividad metabólica, lo hace al utilizar diferentes tipos de hidrocarburos como un donador de electrones; lo cual concuerda con lo observado en este proyecto cuando se aplicó la cepa Neosartorya sp. Cepa A/N-1; observándose una rápida respuesta en la biorremediación del suelo contaminado.
Jia y colaboradores 94 aislaron de suelo contaminado con petróleo crudo catorce cepas de hongos filamentosos, las cuales se identificaron por medio del análisis de PCR amplificando la región ITS como géneros pertenecientes a Fusarium sp., Bionectria sp., Stachybotrys sp., Aspergillus sp., y Actinomucor sp. Para su estudio se dividieron las cepas en dos grupos y los resultados mostraron que las cepas podrían degradar diferentes componentes de petróleo crudo, lo cual fue evaluado por GC-MS. La capacidad biorremediadora se evaluó por 30 días en un medio líquido con el petróleo crudo y la tasa de biorremediación fue de 74,55% y 72,64%, respectivamente. Maddela y colaboradores 95 aislaron del suelo contaminado con petróleo crudo dos cepas de hongos filamentosos pertenecientes al género Geomyces sp., las cuales aplicaron a suelos en ambiente controlado como es un microcosmos contaminado con petróleo crudo en concentraciones de 1% y 1,5%; además, adicionaron N, P, K, para estimular el crecimiento del hongo inicialmente, por un periodo de 30 días, evaluando el proceso por cromatografía de gases y determinaron que el proceso de biorremediación se realizó en un porcentaje de 73,3% a 79,9% respectivamente. Los equipos de Fuad 13 y Benyahia 96 destacaron la efectividad de los hongos en biorremediación de diésel cuando se aplican en consorcio y Manli y colaboradores 97 obtuvieron resultados en el desarrollo de su investigación en la medición de la capacidad biorremediadora de hongos filamentosos para una efectividad en 70 días de 60% de degradación del contaminante y al cabo de 156 días de 77%.
En cuanto a la actividad enzimática de los hongos filamentosos, esta se basa en el estudio de los mecanismos de acción, tanto intracelular como extra-celular y aunque no se tiene bien identificada cada una de estas rutas, se sabe que son de tres tipos, lignino-oxidasas, lignino-peroxidasas y lignino-hidrolasas como han mostrado Johnsen y colaboradores 98. Mohsenzadeh y Chehregani 28 midieron la producción enzimática de hongos filamentosos para remediar diferentes concentraciones de petróleo crudo, para lo cual solo tuvo en cuenta enzimas como la catalasa, el fenol-oxidasa y la peroxidasa, determinando que a mayor concentración del petróleo crudo, hay mayor actividad peroxidasa. Ali y colaboradores 79 encontraron como mecanismo enzimático para el proceso de biorremediación de diésel las enzimas lignina-peroxidasas. Deshmukh y colaboradores 99 resaltaron la producción enzimática de los hongos filamentosos, la importancia de aquéllas y la futura aplicabilidad desde el campo de la biotecnología. Mohsenzadeh y Shirkhani 100 aislaron siete cepas de hongos filamentosos en la refinería de petróleo de Teherán, pertenecientes al género Aspergillus sp., en el medio de cultivo PDA con una concentración de petróleo crudo entre 0-15% (v/v). Posterior al crecimiento determinaron la producción de las enzimas extracelulares como son la peroxidasa y catalasa como mecanismo para la biorremediación. Estos resultados podrían confirmar los obtenidos en los estudios realizados por Fuad y colaboradores 13, quienes destacaron el uso de enzimas extracelulares como la lignina-peroxidasas así como la liberación de CO al final de proceso de remediación y la producción de una alta cantidad de biomasa en dicho proceso. Además, no se encontró evidencia en el tejido vegetal de la planta Allium fistulosum de alteraciones morfo-fisiológicas, por lo que se considera que los hongos filamentosos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. cepa 1A/R-1, no presentaron fitotoxicidad, de acuerdo con la prueba desarrollada en la investigación, por lo que son ade-cuadas en procesos de micorremediación, cuando la planta está en presencia de agua con alguna sustancia tóxica o en presencia de un microorganismo patógeno 68.
El uso de los carbonos presentes en el petróleo crudo como fuente de energía para algunas especies de hongos filamentosos permite la aplicación de estos en la biorremediación de suelos y aguas contaminados 90-93. Al finalizar esta investigación, se concluyó que de 138 cepas aisladas en 90 cultivos que corresponden a siete géneros de hongos filamentosos, con capacidad biorremediadora de suelo contaminado con petróleo crudo pesado o derivados de este, los hongos filamentosos Neosartorya sp. Cepa A/N-1, Aspergillus sp. Cepa Y/As-3 y Rhizomucor sp. cepa 1A/R-1 son capaces de biorremediar petróleo crudo pesado en un tiempo promedio entre 2 a 10 días, con una efectividad de 100% por medio de la enzima extracelular perteneciente al grupo de lignina-peroxidasa 101-103. Vale la pena destacar que en los tres sitios muestreados se aislaron ocho cepas pertenecientes al género Neosartorya sp., y esta especie no había sido reportada como biorremediador de petróleo crudo en Colombia. Además en el desarrollo de este proyecto se identificaron siete cepas correspondientes al género Rhizomucor sp. Este género no había sido reportado como agente biorremediador de petróleo crudo, en este proyecto se pudo comprobar su potencial uso en este campo.














