Introducción
Las Infecciones de Transmisión Sexual (ITS) son un problema de salud pública en el mundo, y su manejo eficaz refleja uno de los mayores trabajos multidisciplinarios en los últimos tiempos 1. Afectan a países industrializados y en vías de desarrollo, generando altos costos para los sistemas de salud debido a su tratamiento y pueden causar secuelas en el aparato reproductor, tanto de hombres como mujeres, a mediano y largo plazo e incluso pueden provocar la muerte 2. Las infecciones por CT son consideradas un problema de salud pública., Además, en Colombia no se conoce información epidemiológica completa de todas las ITS, considerando que solo el VIH, la hepatitis B y la sífilis gestacional y congénita son de reporte obligatorio 3.
A pesar de ser una infección presente en todo el mundo, es subnotificada por las entidades de Salud Pública debido a la ausencia de síntomas y manifestaciones clínicas, lo que contribuye a un desconocimiento generalizado sobre su verdadera prevalencia 3. La utilización de antibióticos tipo tetraciclinas (doxiciclina), macrólidos (azitromicina) y fluoroquinolonas se emplean como tratamiento convencional para CT 4, con alta tasa de eficacia 5., Sin embargo, cada vez son más recurrentes las infecciones por esta bacteria. Estudios han demostrado la aparición de cepas multirresistentes 6-7, que explicarían la persistencia de la infección como consecuencia de la resistencia a los antibióticos., También se ha reportado que el constante uso de antibióticos puede generar resistencia por parte de otros patógenos y también se puede presentar una disbiosis vaginal. En la actualidad no hay vacunas para prevenir la infección por CT y la respuesta inmunológica favorece la cronicidad de la enferme-dad 8-9.
A raíz de esta problemática surge la necesidad de realizar una revisión bibliográfica actualizada, comprendiendo como tema principal las investigaciones de tratamientos alternativos frente a esta infección.
Chlamydia trachomatis y su persistencia
CT es una bacteria intracelular obligada con un ciclo de desarrollo bifásico 10-11, Gram negativa, no móvil y aeróbica 12, es patógena en humanos, perteneciente a la familia Chlamydiaceae13 y considerada uno de los microorganismos de transmisión sexual más prevalentes en el mundo 14. Existen 15 serovariedades de CT clasificadas de acuerdo con la variabilidad antigénica de la proteína principal de la membrana externa (MOMP). Dentro de estas serovariedades están las causantes de tracoma (Serogrupos A-C), las causantes de infecciones urogenitales (Serogrupos D-K) y las que causan linfogranuloma venéreo “LGV” (L1-L2-L3) 15-18.
Al tener un desarrollo bimórfico, posee una forma metabólicamente inactiva conocida como cuerpo elemental (CE), el cual posee una membrana externa que le brinda estabilidad extracelular otorgándole la resistencia a factores ambientales adversos de forma semejante a una espora 19. Esta forma inactiva es capaz de entrar en contacto con las células epiteliales, a través de la interacción de receptores de la célula blanco (receptores de factor de crecimiento, proteoglicanos heparán sulfato) con proteínas bacterianas de la membrana externa (MOMP, OmcB, PmpD) 20. Después de entrar en contacto con las células epiteliales se transforma en cuerpo reticular (CR) que es la forma intracelular del microorganismo metabólicamente activo y se multiplican dentro de las vacuolas formadas por endocitosis (inclusiones) dentro de células del huésped, transcurridas 48 a 72 horas los CRs se transforman nuevamente en CEs infecciosos y se liberan por lisis celular para infectar células vecinas. Esta bacteria puede generar un estado de persistencia (formas aberrantes) en el área endocervical durante un tiempo prolongado. Por lo anterior, dicho microorganismo depende de la viabilidad y funcionalidad de la célula huésped para efectuar su ciclo de vida, siendo capaz de bloquear la apoptosis de la célula infectada y evadir el sistema inmune 10,21.
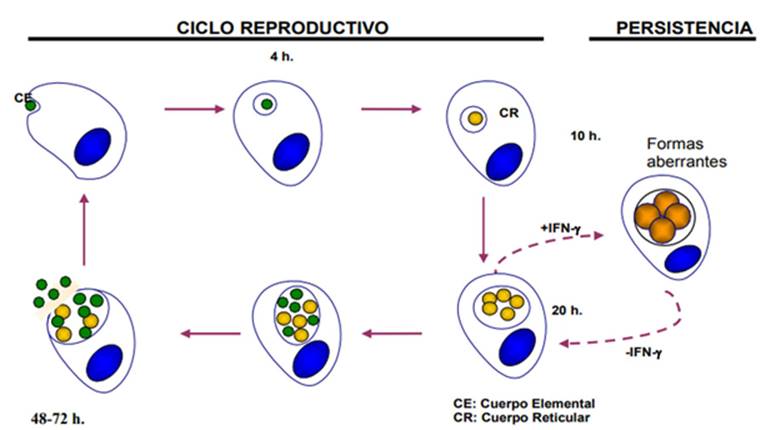
Fuente. Tomado de: https://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia44.pdf
Figura 1 Ciclo de vida de Chlamydia trachomatis.
Epidemiologia de la infección con CT
La bacteria CT es el microorganismo que causa la principal ITS bacteriana tanto en países desarrollados como países subdesarrollados 22. CT tiene una prevalencia creciente con casi 100 millones de nuevas infecciones cada año 14. Según un informe de la Organización Mundial de la Salud (OMS), en 2005 se registraron en el mundo 101 millones de casos nuevos de infección por CT. La mayor frecuencia de esta bacteria se presentó en la región de las Américas, con una prevalencia de 5,5 % en mujeres y 3,45 % en hombres 23.
En el 2008 y 2011 se reportaron cerca de 92 millones de casos de infección al año causados por CT, siendo esta una de las principales causas de infertilidad en hombres y mujeres 23-25. La clamidiasis tiene mayor prevalencia en adolescentes y adultos de un 5% a 10%, donde la población más afectada son mujeres menores de 24 años y hombres en edades de 15 a 24 años 22. Es importante resaltar que alrededor de un 70% de los casos en mujeres y de un 30% a un 50% de casos en hombres no son diagnosticados a tiempo debido a que es una enfermedad asintomática en un 80% de los casos 22,26.
Por otro lado, CT también causa el tracoma, la principal causa de ceguera prevenible alrededor del mundo. Éste tipo de manifestación clínica se presenta en áreas endémicas como Asia y Sudáfrica 18. En América Latina, se ha encontrado que Brasil, Guatemala y México presentan 1,1 millones de personas con tracoma 15. Sumado a lo anterior, las comunidades indígenas de Colombia muestran una prevalencia de tracoma en 18% de los casos 27.
En Colombia las ITS causadas por CT y Neisseria gonorrhoeae, constituyen un serio problema de salud pública. La Clamidiasis se ha detectado en gestantes (2% a 25%), en mujeres que acuden a clínicas de ITS (15% a 33%) y en población general (3% a 5 %) 28.
Un reporte emitido por el Ministerio de Salud y Protección Social de Colombia, en el que se analizaron los datos registrados en “El Sistema de Información de Prestadores de Salud (RIPS)”, permite evidenciar que sólo se diagnosticaron 1.538 personas con infección por clamidia en 2009, en el año 2010 se encontraron 1.525 casos y en el año 2011 se reportaron 1.313 casos. Como se puede evidenciar estos casos reportados son una muy pequeña parte del total de casos reales que deberían registrarse, pero debido a sus múltiples complicaciones se presentan boletines alejados de la realidad 29.
Patología de la infección por CT
La infección por CT cursa de manera asintomática en la mayoría de los casos, lo que favorece la propagación y reinfección 6,14,30-31. Desde el punto de vista fisiopatológico CT genera inflamación e infección persistente (originada por la entrada de los cuerpos elementales a las células) que puede durar meses o años en el área endocervical y/o perianal, por lo que factores como resistencia al tratamiento, infecciones repetidas, o un tratamiento antimicrobiano tardío favorecen la invasión a los órganos genitales femeninos superiores, como los ovarios o las trompas de Falopio 32, ocasionando daño en los tejidos cercanos, produciendo enfermedad pélvica inflamatoria, infertilidad y convirtiéndose en un cofactor de cáncer de ovario 33 y cáncer cervical, principalmente en células escamosas de cérvix 30., Esta inflamación crónica favorece la infección por Virus de Papiloma Humano (VPH) 31.
Las partículas infecciosas de CT invaden la superficie mucosa del tracto genital femenino y pueden persistir por un largo tiempo 34. En mujeres causa uretritis, salpingitis, endometriosis y cervicitis, cuyos síntomas iniciales incluyen flujo vaginal intermitente, intermenstrual y/o después de las relaciones sexuales puede estar acompañado de sangrado. Si no se trata a tiempo, la infección progresa hacia la parte superior del aparato reproductor ocasionando la enfermedad pélvica inflamatoria (4% a 12%), dolor pélvico crónico (18% a 24%) y otras secuelas reproductivas, que pueden ser asintomáticas y generan complicaciones severas como infertilidad del factor tubular (6% a 21%), embarazo ectópico (7% a 9%), muerte fetal o parto prematuro 35-38.
Además, se ha reportado que el neonato puede infectarse durante el parto natural al tener contacto con las membranas mucosas (ojos, orofaringe, tracto urogenital y recto), con el tejido cérvico y secreciones infectados., Igualmente, puede presentar conjuntivitis (tracoma) después de 5 a 12 días de nacimiento, y neumonía del 1 a 3 meses de edad con cuadro subagudo y afebril 39.
En hombres causa la uretritis no gonocócica y en más del 50% son asintomáticos. También pueden presentarse complicaciones como epididimitis o infección en los ductos espermáticos. Estas infecciones conllevan a complicaciones como la uretritis, prostatitis, epididimitis, estenosis de uretra y conductos deferentes con el riesgo de esterilidad por azoospermia. En hombres que tienen sexo con hombres, se presenta el LGV y estenosis rectal; además, dicha infección se ha relacionado con el síndrome de Reiter (uretritis, artritis reactiva y uveitis) 18,25.
Tratamiento convencional contra la infección de CT
De acuerdo con la OMS y el Centro de Prevención y Control de enfermedades (CDC) 18, el tratamiento para la clamidiasis no complicada incluye la utilización de doxiciclina (100 mg dos veces por día durante 7 días) y azitromicina (1 g en una dosis, indicado principalmente en mujeres embarazadas) como régimen convencional 18,40-41. Mientras que, amoxicilina, eritromicina, ofloxacina y tetraciclina se emplean como régimen alterno 42, estos tratamientos presentan una eficacia entre el 96% a 98%., Sin embargo, aunque en algunos casos se resuelve la infección, éstos no mejoran los daños ocasionados en el tejido 41-43.
Se han visto fallas en el tratamiento, complicándose el panorama con los casos asintomáticos, pues en infecciones cervicales pueden pasar desapercibidas hasta por 4 años. No obstante, la persistencia o la repetición de la infección ocurre entre 10% y 15% de las mujeres que han sido tratadas 18. Diversos estudios han demostrado que la persistencia de la infección puede ser ocasionada por fallas en el tratamiento 8,44-46., Uno de los factores que contribuyen al aumento de casos, es la persistencia de la infección inicial debido a la presencia constante de cuerpos elementales que pueden invadir una nueva célula y generar la reinfección, al encontrarse esta persistencia de la enfermedad, diversas investigaciones se han centrado en el bloqueo o inhibición de los cuerpos elementales su ingreso a la célula 47. Esta situación deja un mal pronóstico de este problema de salud pública, donde la fitoterapia proporciona nuevas alternativas terapéuticas.
Tratamientos alternativos de medicina tradicional contra CT
Existen al menos cuatro razones para realizar investigaciones sobre nuevas terapias antichlamydiales. En primer lugar, la persistencia de los cuerpos elementales de CT desde la infección inicial. La segunda razón es la resistencia a los antibióticos (tetraciclina, doxiciclina, azitromicina y ofloxacina). En tercer lugar, la aparición de resistencia a los antibióticos por parte de otros patógenos, debido al uso constante de estos. Por último, el daño a la microbiota por el uso prolongado de antibióticos de amplio espectro, lo cual puede producir disbiosis vaginal, lo que a su vez puede terminar en una vaginosis por Candida spp48. Dada la importancia de los cuerpos elementales para la reaparición de la enfermedad, diversas investigaciones se han centrado en el bloqueo o inhibición de su ingreso a la célula 49.
Con el fin de buscar terapias alternativas a los medicamentos antibacterianos para el tratamiento de infecciones causadas por CT, que sean eficaces y que no causen resistencia, investigaciones recientes se enfocan en el estudio de extractos de plantas y metabolitos secundarios aislados de plantas, reconociendo un amplio rango de compuestos que en diferentes estudios han demostrado actividad anti-microbiana, muchos de los cuales han exhibido actividad antichlamydial in vitro, encontrándose flavonoides, cumarinas, terpenoides y alcaloides. Los autores sugieren además el empleo de formulaciones “poliherbales” promisorias para la prevención y control del desarrollo de la resistencia al tratamiento 43. De acuerdo con lo anterior, la fitoterapia podría proporcionar nuevas alternativas de tratamiento mediante el descubrimiento de extractos y/o fracciones obtenidos de plantas medicinales que sean eficaces y seguros.
Actualmente la OMS reconoce que cerca del 80% de la población en países en vía de desarrollo depende de la Medicina Tradicional (MT) para satisfacer sus necesidades sanitarias y al menos el 70% de las fórmulas farmacéuticas utilizadas en la actualidad provienen de elementos naturales 50. En Latinoamérica las poblaciones emplean la MT como resultado de circunstancias históricas y creencias culturales 42. Colombia es reconocido como el segundo país a nivel mundial en diversidad de especies vegetales de las cuales cerca de 6000 cuentan con propiedades medicinales 51-52, lo que convierte a sus especies vegetales en una fuente de conocimiento con potencial terapéutico para el tratamiento de enfermedades en salud pública como la clamidiasis.
Los productos naturales abarcan una amplia variedad de compuestos bioquímicos, entre los cuales los metabolitos secundarios de plantas representan el grupo más amplio, siendo los polifenoles el grupo con más investigaciones relacionadas al tratamiento de Chlamydiaceae. También es importante mencionar los compuestos lipídicos y proteináceos que han demostrado una actividad antichlamydial, al igual que otros metabolitos celulares y los probióticos que han revelado un potencial efecto negativo contra las infecciones por clamidias 53. Otros metabolitos de interés son los taninos, cumarinas, terpenos, alcaloides, aceites esenciales, lectinas, polipéptidos, glicósidos y saponinas 54.
Se han realizado diversas investigaciones a lo largo de los años que han permitido encontrar compuestos útiles, la mayoría de los cuales se centran en la medicina tradicional de cada uno de los continentes 61-63. Una investigación realizada por Al-Marzooky en 1981 sobre medicina etnobotánica árabe, permitió corroborar la actividad antibacteriana de un extracto de trufa hervida de Terfezia claveryi, indicando que todos los extractos acuosos, polares y no polares de esta hierba mostraban una buena actividad antichlamydial 55. De igual manera un estudio realizado por Zaretzy y colaboradores en 1995 56, demostró el bloqueo de la infección empleando polianiones sulfatados en una línea de epitelio cervical.
De igual forma Vermani y colaboradores en 2002, proponen que prescripciones tópicas de berberina, el cual es un alcaloide de tipo isoquinolínico cuya eficacia y seguridad clínica ha mostrado ser comparable con la sulfacetamida, pueden ser efectivas para el tratamiento de la infección por Chlamydia57. Por otra parte, estudios etnobotánicos han permitido la identificación y el aislamiento de metabolitos con actividad antichlamydial entre los más reconocidos se encuentra la berberina 43,58-60, empleada en el tratamiento de tracoma ocular 58, infecciones vaginales 43,57 y en paciente con uretritis y cervicitis 64. En Colombia este compuesto ha sido identificado en Berberis aquifolium, Berberis vulgaris e Hydrastis canadensis idifolia colectada en cercanías a Bogotá 57. También se ha encontrado en Zanthoxylum monophyllum, una rutácea colectada en la Sierra Nevada de Santa Marta, con propiedades citotóxicas en líneas celulares de tumor de seno, colorrectal, laringe y gástrico 65.
De igual manera, Muschiol y colaboradores en 2006 66, demostraron que el empleo de INP0400, una molécula pequeña perteneciente a las hidrazonas, inhibe la replicación intracelular e infectividad de CT mediante microscopía de inmunofluorescencia. Investigaciones realizadas por Adedapo en 2008 y Korir en 2011 permitieron determinar actividad antichlamydial en Erythrina abyssinica y Calpurnia aurea respectivamente. Ese último año, Entrocassi evaluó una infusión al 10%, un extracto metanólico y un extracto de cloruro de metileno de Hydrocotyle bonariensis. Esta es una planta herbácea que crece en norte y centro de la Argentina, empleada en etnomedicina como antiséptica, diurética y estimulante., También fue estudiada frente a aislamientos clínicos de CT, el extracto de cloruro de metileno demostró una inhibición del 99% a 100% del ingreso de los cuerpos elementales a la célula. Por otro lado tanto la infusión al 10% como el extracto metanólico no demostraron actividad 67.
Una investigación realizada por Semenya en 2013, buscó analizar la medicina tradicional de los curanderos Bapedi de la provincia de Limpopo en Sudáfrica, y se pudieron identificar ocho especies de plantas antichlamydiales: Aloe marlothii subsp. marlothii, Eucomis pallidiflora subsp. Poleevansii, Gethyllis namaquensis (Schonland) Oberm, Hypoxis obtusa Burch. Ex Ker Gawl, Kleinia longiflora DC, Protea caffra subsp. caffra, Tribulus terrestris L, y Ziziphus mucronata Willd. Es importante resaltar que la mayoría de las terapias efectivas resultaban de la mezcla de varias plantas 68.
En una revisión reciente realizada por Protoz y Cho en 2015, sobre productos naturales para el tratamiento de tracoma e infecciones por CT, se evidencia la amplia gama de compuestos que en diferentes estudios han demostrado actividad antimicrobiana, muchos de los cuales han exhibido actividad antichlamydial in vitro. Dentro de estos compuestos se encuentran flavonoides, cumarinas, terpenoides, alcaloides y péptidos; los cuales han tenido una respuesta favorable como tratamiento de infecciones bacterianas 43. En esta misma revisión se resaltan los usos del “Praneem”, una crema en base acuosa para aplicación tópica que contiene tres principios activos: extracto purificado de semillas de Azadirachta indica (neem), hidrocloruro de quinina y extracto de saponinas del pericarpio de Sapindus mukorossi. La efectividad y confianza de este producto se confirman con estudios realizados en India, Brasil, Egipto y la República Dominicana 57,69. Finalmente, un estudio en el Hospital Safdarjung, Nueva Delhi, determinó que para el octavo día de aplicación, CT había sido eliminada de la región cervicovaginal 69. Esta preparación también ha demostrado actividad antibacteriana y antifúngica contra Gardnerella vaginalis y Candida albicans69.
Otros estudios realizados por Nardini y colaboradores en 2016 70, demostraron la importancia de metabolitos tipo ácidos orgánicos que representan una barrera de defensa importante frente a la infección por CT. Más adelante una investigación muy importante realizada por Zigangirova y colaboradores en 2017, evaluó la actividad antichlamydial del licopeno, uno de los principales carotenoides de la dieta que está presente en el tomate y algunas otras frutas 71. Esta investigación logró determinar la toxicidad del licopeno sobre clamidia con la prueba de MTT (BioVision, EE. UU.) 24 horas después de la adición al cultivo celular., Estos hallazgos confirmaron un efecto inhibidor del crecimiento de Chlamydia del 90%, los resultados se confirmaron por inmunofluorescencia y por microscopía electrónica 72. Los investigadores sugieren que el licopeno tiene antioxidantes que son capaces de bloquear la replicación de Chlamydia en las células del huésped, y recomiendan seguir realizando investigaciones sobre este efecto antioxidante 73.
Conclusiones
CT es un microorganismo de alta prevalencia mundial, por lo que se resalta la importancia de su estudio básico en Colombia, ya que como se mencionó, por su asintomatología, persistencia y por el desarrollo de infección crónica puede verse asociado al desarrollo de enfermedades ginecológicas como el cáncer de ovario 74-75.
Si bien es cierto que se ha ahondado en la búsqueda de nuevas terapias que han permitido el desarrollo de varios tratamientos alternativos de medicina tradicional contra CT, aún es necesario realizar investigaciones en este campo para poder encontrar un tratamiento óptimo y seguro contra la clamidiasis.














