Introducción
La inmunología es una disciplina biológica que ha tenido avances significativos en lo que va corrido del siglo XXI, evidencia de ello ha sido dejar de ser sólo una actividad médica relacionada con la vacunación y algunas reacciones serológicas, para convertirse en una ciencia interdisciplinaria sustentada por teorías y conceptos, lo cual le ha permitido generar sus propios planteamientos y estrategias para resolver las problemáticas de su campo de acción. De esta forma, la inmunología ahora desempeña un papel clave tanto en la investigación básica como en su aplicación clínica 1.
Los avances en esta ciencia han ayudado a comprender los procesos de generación de varias enfermedades y de esta forma encontrar tratamientos para mejorar la salud de muchas personas alrededor del mundo 2. De hecho, uno de sus aportes más notables ha sido el descubrimiento de los anticuerpos monoclonales, por lo cual recibe el premio Nobel de medicina en 1984 el químico argentino César Milstein. Desarrollos como estos han permitido dilucidar varios procesos inmunológicos, lo cual ha posibilitado, desde finales del siglo XX hasta ahora, el desarrollo de nuevas tecnologías, convirtiendo a la inmunología en una rama independiente de la microbiología y una de las especialidades médicas que más futuro tiene.
En este documento se presentarán algunos aspectos que se deben tener en cuenta para el estudio de la inmunología clínica en la actualidad, además de presentar un ejemplo de la forma como se desarrolla la investigación, particularizando en el papel de las citoquinas en el absceso hepático. De esta manera se pretende que este escrito suscite interrogantes y reflexiones para avanzar y seguir profundizando en esta importante disciplina científica.
Estado actual de la inmunología
Se comenzará por afirmar que la inmunología ha permitido no solamente desarrollar vacunas sino también tratar las distintas patologías que pueden afectar al sistema inmune 3. De hecho, al estudiar un sinnúmero de variables, esta ciencia se ha convertido en una especialidad tan compleja, que se la suele subdividir en ramas tales como inmunología clásica, clínica, diagnóstica, inmunoterapia e inmunología evolutiva. Ahora bien, resulta necesario aclarar que estas ramas no intervienen independientemente una de otra en la práctica clínica, sino que se encuentran en constante interacción.
Con respecto a la inmunología clínica, su principal procedimiento es el inmunodiagnóstico (metodología que utiliza la reacción antígeno-anticuerpo como su principal medio de detección) a partir de técnicas avanzadas y la investigación científica. No obstante, también estudia las enfermedades que se presentan como consecuencia de diversos trastornos en el sistema inmune, los cuales se pueden clasificar en inmunodeficiencias, enfermedades autoinmunes e hipersensibilidades.
Al respecto de las inmunodeficiencias, se trata de enfermedades que disminuyen la eficacia de los componentes inmunitarios, como por ejemplo el SIDA (Síndrome de Inmunodeficiencia Adquirida), la enfermedad más conocida que afecta al sistema inmunitario y caracterizada por la pérdida de linfocitos T CD4+ y macrófagos, que son destruidos por el VIH (Virus de Inmunodeficiencia Humana). Un segundo tipo de enfermedades son las que provocan que el sistema inmunitario reconozca a los propios tejidos como extraños y los ataque (enfermedades autoinmunes) 4; de estas, las más comunes son la diabetes tipo 1, el lupus eritematoso sistémico, la artritis reumatoidea, la anemia perniciosa, la esclerosis múltiple, la tiroiditis de Hashimoto y la esclerodermia, entre otras. Finalmente, están las enfermedades en las que la respuesta del sistema inmune es exagerada (hipersensibilidad), entre ellas encontramos las alergias y el asma.
Otro aspecto importante que estudian los inmunólogos clínicos es buscar la forma de prevenir el rechazo a trasplantes, puesto que el sistema inmunitario destruye antígenos extraños, mediante el reconocimiento del complejo mayor de histocompatibilidad 5. En este caso, el laboratorio clínico, con los avances recientes en tecnología, juega un papel importante en el cuidado del paciente al proporcionar resultados oportunos, precisos y confiables de la prueba. Tales resultados son utilizados por los miembros del equipo médico para hacer el diagnóstico, tratamiento y tomar las decisiones adecuadas de monitoreo.
Con respecto al desgaste de las funciones inmunológicas, la autoinmunidad y la infección, se ha determinado que son factores que subyacen a muchas enfermedades de la vejez, probablemente se lograría un control importante de dichas enfermedades mediante manipulaciones inmunológicas. Ejemplo de esto es alterando de forma activa el proceso inmune gracias al desarrollo de la inmunofarmacología, y así ser capaces de aliviar al paciente alérgico. En otras palabras, vislumbra la posibilidad de inmunizar contra la inmunidad no deseada.
El estudio de las citoquinas como ejemplo de investigación
El término "citoquina" define un numeroso grupo de proteínas pequeñas no estructurales que están involucradas en la señalización celular. Se incluyen en la familia de las citoquinas: interleucinas (IL), interferones (IFN), quimiocinas, linfoquinas y factores de necrosis tumoral (TNF). Las citoquinas se producen generalmente en cascadas y actúan en secuencia, como parte de una red coordinada compleja; aunque su producción se regula cuidadosamente, tanto intracelularmente como extracelularmente. Este proceso está dirigido a que las citoquinas actúen sobre las células diana uniéndose a receptores específicos y desencadenando así rutas de transducción de señales dentro de la célula, lo cual demuestra su importante papel en el sistema inmune al regular tanto la intensidad como la duración de la respuesta inmune.
Hasta ahora, se ha descrito varias citoquinas, entre ellas el grupo de IL-1 a IL-38, lo cual ha posibilitado que las citoquinas se puedan dividir en dos grupos, de acuerdo con su función: citoquinas pro y antiinflamatorias. Las citoquinas proinflamatorias son las que favorecen la inflamación, siendo las principales responsables de las respuestas tempranas IL-1α, IL-1β, IL-6 y TNF-α. Por el contrario, las citoquinas antiinflamatorias contrarrestan diversos aspectos de la inflamación, incluida la producción de citoquinas proinflamatorias; aunque, algunas citoquinas pueden tener actividades pro y antiinflamatorias, dependiendo de la situación. El equilibrio entre las citoquinas pro y antiinflamatorias determina el efecto neto de una respuesta inflamatoria, y una homeostasis alterada de las citoquinas deshabilita la función apropiada del sistema inmune. Esta dinámica hace posible que algunos parásitos puedan manipular la respuesta inmune para poder invadir y multiplicarse en el huésped, como es el caso del absceso hepático amebiano (AHA) en el cual los trofozoítos de E. histolytica pueden burlar la respuesta inmune e invadir el epitelio hepático. Estos procesos han sido objeto de investigación mediante estudios, tanto in vitro como in vivo, para analizar el papel de las citoquinas y otros componentes inmunes del huésped frente al parásito por medio de pruebas inmunodiagnósticas.
El absceso hepático amebiano (AHA) es una enfermedad mortal en la cual el parásito Entamoeba histolytica es capaz de diseminarse desde la pared intestinal a otros órganos como el hígado, donde produce citólisis de los hepatocitos y necrosis. Aunque se han desarrollado y probado varios modelos animales, ninguno de ellos ha proporcionado una explicación completa de los mecanismos inmunológicos que participan en la invasión y el establecimiento del parásito, aunque se ha obtenido bastante información sobre la complejidad de este microorganismo y la enfermedad que produce.
A pesar de que el ciclo de vida de la E. histolytica no se ha podido reproducir en modelos animales, se ha observado que hámsteres con AHA no tratados mueren 6. De hecho, se ha descrito que la inoculación con E. histolytica induce, en estos animales, un infiltrado inflamatorio rápido, principalmente compuesto por neutrófilos, los que rodean los trofozoítos y los aíslan del parénquima hepático; después, hay una lisis significativa de neutrófilos, responsable en parte del daño parenquimatoso durante la evolución de AHA. Como resultado, esta patogenia conduce a más del 90% de mortalidad en hámsteres 7,8. No obstante, en los seres humanos se ha observado una regeneración del hígado después de un tratamiento exitoso, probablemente por las características inflamatorias específicas 9.
Estudios in vitro previos con E. histolytica han demostrado que las moléculas amebianas inducen la secreción y expresión de citoquinas por leucocitos mononucleares y células epiteliales intestinales 9-14. La respuesta Th1 estaría implicada en la inmunidad protectora contra la amebiasis invasora 15. Por consiguiente, E. histolytica podría manipular la respuesta inmune hacia Th1 favoreciendo la invasión en el tejido 16. De igual manera, los estudios in vivo en el modelo de xenoinjerto de ratón-humano SCID intestinal indicaron que IL-1b e IL-8 se produjeron por el injerto en respuesta a la infección por E. histolytica17,18,19. En contraste, los niveles de expresión de IL-4, IL-10 y TGF-β son significativamente más altos en humanos con síntomas de amebiasis (intestinal o AHA) en comparación con controles sanos. Por otra parte, los pacientes que no presentan síntomas, pero que están infectados con Entamoeba sp. no mostraron diferencias en los niveles de citoquinas en comparación con el grupo control. Estas citoquinas (IL-4, IL-10 y TGF-β podrían suprimir las respuestas in-munitarias celulares, lo que daría lugar a una infección sintomática 20.
Se ha demostrado que los linfocitos aislados de pacientes tratados con AHA expuestos al antígeno de E. histolytica pueden producir IFN-c in vitro21. En modelos animales de AHA, las lesiones hepáticas pueden ser provocadas por la inoculación directa de trofozoítos en el hígado de conejos, hámsteres o jerbos 22. La lectina E. histolytica Gal/GalNAc puede estimular la producción de TNF-α en macrófagos de médula ósea murina preparada con IFN-c 23. Recientes estudios in vitro demostraron que el ADN genómico de E. histolytica estimula la línea celular de macrófagos de ratón RAW 264Æ7 y aumenta los niveles de ARNm de TNF-α y la producción de proteína 24. Además, se ha informado que las células cultivadas del epitelio intestinal humano HT29 pueden producir IL-8 al entrar en contacto con el parásito y la lectina 25.
Estudios inmunohistoquímicos mostraron que, durante la evolución de AHA en hámsteres, los trofozoítos fueron capaces de inducir una importante respuesta inflamatoria compuesta de PMN y leucocitos mononucleares. Este hallazgo implicó aumentar gradualmente la expresión de TNF-a, IFN-c, IL-8 e IL-1b durante las primeras etapas del desarrollo de AHA, que posteriormente disminuyó lentamente a niveles basales en la etapa crónica de la infección. Además, se observó que los hepatocitos en el parénquima hepático que rodeaban los focos inflamatorios se indujeron a expresar TNF-α e IL-8 durante el desarrollo de AHA 26. La expresión de la citoquina reguladora IL-10 se produjo muy temprano después de la infección y alteró su patrón de expresión en un período de tiempo muy estrecho. Esta rápida desactivación de la expresión de IL-10 es muy sugestiva de una posible supresión mediada por parásitos de la respuesta inmune reguladora a través de factores de virulencia amebiana 27,28,29,30.
Durante la amebiasis, la supresión de las respuestas linfoproliferativas (tanto las células T y B) como la producción de citoquinas parecen ser sistémicas. En gerbos, el día 20 de AHA (fase aguda), los niveles de IL-2 parecen disminuir significativamente cuando se estimulan las células del bazo con Con A, en comparación con los controles no infectados. Dado que la IL-2 desempeña un papel en la activación y proliferación de las células T, la supresión de esta producción de citoquinas puede contribuir al establecimiento de la infección 31. Además, linfocitos T humanos aislados de pacientes curados farmacológicamente de amebiasis liberan IL-2 e IFN-c cuando se expone a la lectina amibiana 32.
Aunque la inmunidad innata y adquirida se consideraba clásicamente entidades autónomas, los avances recientes en la comprensión de la señalización de los receptores Toll-like, identificaron la función de las citoquinas y la activación del complemento en una red de reguladores que dirigen el cambio de la inmunidad innata a la adquirida 33. Uno de esos factores es la citoquina inflamatoria IL-6, que a través del control diferencial del reclutamiento de leucocitos, la activación y la apoptosis, ha sido reconocida recientemente como un regulador de este interruptor inmunológico.
La generación de ratones 'knock-out' IL-6 (KO) en 1994 brindó una oportunidad única para probar directamente las funciones de IL-6 in vivo34. Los ratones con deficiencia de IL-6 se desarrollaron normalmente pero no controlaron las infecciones microbianas y fueron defectuosos en la producción de anticuerpos dependientes de células T 35,36. Los ratones con deficiencia de IL-6 también se vieron comprometidos en sus respuestas de fase aguda a la lesión tisular 37. Una serie de estudios in vivo indicó que la IL-6 influye en la polarización de las células T 38,39,40. Sin embargo, IL-6 no actúa universalmente para la inducción de una respuesta de tipo Th1 o Th2. La interleucina 6 puede favorecer la producción de IL-2 y promover el desarrollo de una colitis murina mediada por células Th1 41. Pero también se sabe que IL-6 suprime la polarización de las células T mediada por IL-12 y dirige la diferenciación de Th2 de las células T vírgenes en las células secretoras de IL-4 42.
A lo largo de los años, a la IL-6 se le han asignado características pro y antiinflamatorias 43,44. IL-6 podría definirse como un factor de resolución que equilibra las respuestas inmunológicas pro- y antiinflamatorias debido a su capacidad de orquestar la transición de la inmunidad innata a la adquirida. El control apropiado de este cambio inmunológico es esencial para la resolución exitosa de cualquier episodio inflamatorio, y la actividad de IL-6 parece ser crítica en el manejo efectivo de la inflamación aguda 45,46,47,48.
Se identificaron bajos niveles de IL-6 en fluidos sobrenadantes de linfocitos activados expuestos a lectina de adhesión a membrana de E. histolytica de 220 kDa de mestizos mexicanos adultos sanos que se habían recuperado mucho antes de AHA, en comparación con controles sanos. Además, los niveles de IL-5, IFN-γ y TNF-α también fueron más bajos en los pacientes, pero los niveles de IL-2, IL-4 e IL-10 fueron similares en ambos grupos 49. Por lo tanto, una producción de citoquina IL-6 regulada negativamente puede potenciar el desarrollo de AHA 50. Por otra parte, se ha observado el papel supresor de la IL-10 en la amebiasis, al estudiar células mononucleares periféricas aisladas de sujetos sintomáticos que expresaban altos niveles de IL-10 51.
Los hepatocitos también pueden contribuir a la producción de citoquinas quimiotácticas que reclutan células inflamatorias en los sitios de infección hepática, formando un entorno inflamatorio exacerbado que puede facilitar el daño al tejido hepático y el desarrollo de AHA, en lugar de eliminar los trofozoítos. Los resultados obtenidos por el grupo de Pacheco-Yépez 26 sugieren que existe una correlación in vivo entre la expresión de citoquinas inflamatorias y la progresión de la amebiasis invasiva y que la ausencia de expresión TH2 reguladora/supresora de citoquinas, un factor importante que inhibe las moléculas proinflamatorias, puede conducir a un estado inflamatorio persistente que a su vez produciría extenso daño tisular en el hígado.
El papel de estas citoquinas en el patógeno de los abscesos hepáticos amebianos necesita más investigación, particularmente para buscar otros factores de crecimiento, como TGF-b, HGF e IGF, y citoquinas reguladoras para elucidar sus roles durante las etapas crónicas del desarrollo de AHA. Varios estudios han demostrado la importancia de los neutrófilos en la respuesta innata contra la invasión de E. histolytica52. Los neutrófilos activados proporcionan señales para la activación y maduración de los macrófagos, que a su vez liberan IL-1b, TNF-a, G-CSF y GM-CSF, de tal forma que estas citoquinas extienden la vida útil de los neutrófilos en los sitios de inflamación.
La interacción de lipopéptido fosfoglicano (LPPG) con TLR-2 y TLR-4 da como resultado la activación de NF-kappa B y la liberación de IL-8, IL-10, IL-12p40 y TNF-a de macrófagos humanos. Los neutrófilos activados aumentan la producción de especies reactivas de oxígeno (ROS), activan NF-kB y aumentan degranulación de neutrófilos. Los gránulos primarios contienen mieloperoxidasa (MPO), defensinas, lisozima, proteína bactericida que incrementa la permeabilidad (BPI), neutrófilo elastasa (NE), proteinasa 3 (PR3) y catepsina G (CG). Los gránulos secundarios se caracterizan por la presencia de lactoferrina, neutrófilo lipocalina asociada a gelatinasa (NGAL), proteína antimicrobiana catiónica humana 18 o cathelin (hCAP-18) y lisozima. MPO puede unirse a monocitos, que pueden conducir a la producción de ROS y citoquinas proinflamatorias 53,54.
Estudios realizados por el grupo de Pacheco-Yepez han sugerido un papel importante de la MPO en la respuesta inmune contra trofozoítos de E. histolytica en modelos de AHA. Por un lado, en el modelo de resistencia (ratones Balb/c) se observó un aumento de actividad y expresión génica de MPO a diferencia del modelo de susceptibilidad (hámster) en el que se observa ausencia de la actividad y expresión génica de la enzima 55.
Tabla 1 Descripción de los modelos experimentales empleados en el estudio de las citoquinas en el absceso hepático amebiano.
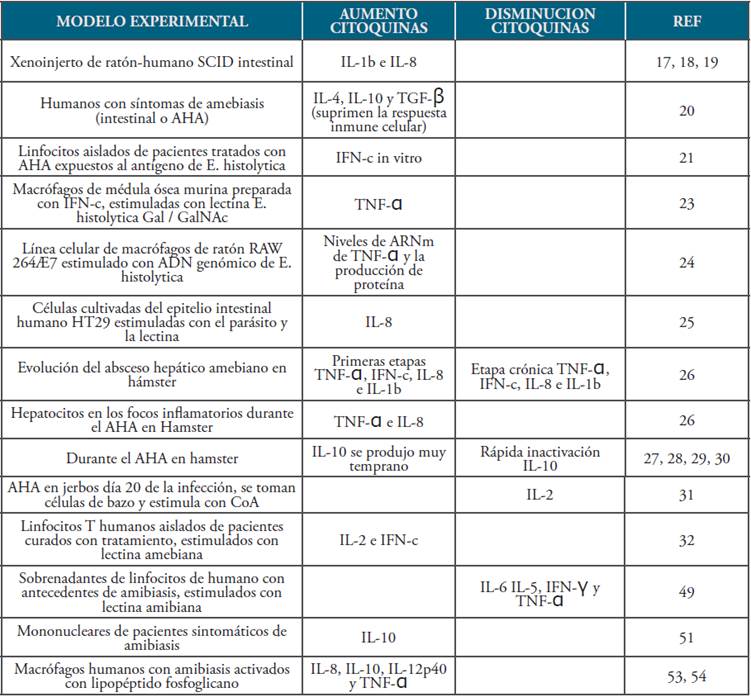
Fuente. Elaboración propia.
Como se puede evidenciar, se han realizado varios estudios para determinar el papel de las citoquinas en el AHA tanto in vitro como in vivo (modelos animales experimentales). Aunque no se ha dilucidado la forma en que la E. histolytica manipula la respuesta inmune, los experimentos realizados con pruebas inmunodiagnósticas han producido nuevos conocimientos que fortalecen los conocimientos de la inmunología como ciencia básica y permiten desarrollar nuevas e innovadoras investigaciones en este campo.
No es fácil predecir el futuro, pero el ritmo de avance y acumulación de conocimientos básicos de la inmunología garantiza el advenimiento de novedades casi increíbles, ante las cuales quedarán anticuadas muchas fases de la práctica clínica actual 56-58. Dentro de lo previsible, se supone que será posible trasplantar prácticamente cualquier órgano con un porcentaje elevado de éxitos, corregir la mayoría del tipo de inmunodeficiencias ya sean heredados o adquiridos. Estaremos en condiciones de potenciar la resistencia a la infección, así como de tratar y prevenir gran parte de las infecciones que son resistentes a la antibioterapia. Tendríamos en un futuro la certeza de diagnosticar el cáncer con más prontitud y precisión por métodos inmunológicos. Se llegará quizás a tratar con eficacia formas de cáncer utilizando varias clases de inmunoterapias, cirugía y quimioterapia, y se podrá manipular la respuesta inmune para prevenir algunas enfermedades 59.
Confiamos enormemente en que la mayoría de estas predicciones, si no la mayoría, se cumplirán en este nuevo siglo gracias a la aplicación de los nuevos hallazgos de la investigación básica y aplicada.














