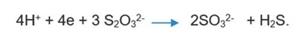Introducción
Los avances en microbiología se deben en gran medida a la observación de fenómenos macroscópicos como, por ejemplo, la transformación que ocurre en los alimentos (en la que se arruinan las condiciones organolépticas de los mismos); en los anteriores cambios se infiere que los microorganismos hacen parte del ambiente natural. Uno de los aportes más interesantes para descifrar estos fenómenos ha sido el descubrimiento y la optimización de las condiciones para el cultivo de los microorganismos. El primer medio de cultivo artificial líquido fue creado por Louis Pasteur en 1860, resaltando la importancia de las necesidades nutricionales de los microorganismos, los cuales debían ser proveídos en medios de cultivo para su aislamiento. El desarrollo del primer medio de cultivo sólido de Koch marcó el inicio, procesos infecciosos en humanos y animales de la evolución de los medios de cultivo bacteriano, en él se logró observar el crecimiento bacteriano en sustancias alimenticias preparadas en el laboratorio, lo cual permitió observar el crecimiento de las unidades formadoras de colonias (UFC) que se les denomina Cultivo, los cuales presentan variedad de características.
El principal agente gelificante utilizado en medios de cultivo sólidos es el agar. Sin embargo, se han observado algunos límites en el uso de este, debido, a que algunas bacterias extremadamente sensibles al oxígeno no crecen en medios de agar, por lo que se propusieron y probaron otras alternativas; luego, el descubrimiento de agentes antimicrobianos y sus objetivos específicos provocó la aparición de medios selectivos. 1
El medio de cultivo artificial debe reunir una serie de condiciones para que las bacterias se mantengan vivas y se desarrollen, factores como la naturaleza, el origen, las interacciones y el metabolismo bacteriano condicionan el tipo y composición del medio de cultivo. Sin embargo, son muchas las especies bacterianas que existen en la naturaleza que aún no son cultivables "in vitro", esto se debe a dificultades tales como: ser microorganismos parásitos de otros; imposibilidad de reproducir las condiciones de su ecoambiente natural; desconocimiento de los requerimientos específicos nutricionales, y, a la existencia de grupos de microorganismos que deben mantenerse en equilibrio para poder sobrevivir (casos de sintrofía). Se estima que sólo alrededor del 1% de las bacterias del suelo y del 0,01 al 0,1 % de las bacterias marinas son cultivables.
En la composición de los medios de cultivo se encuentran sustancias químicas que proporcionan enriquecimiento como carbohidratos, suero, sangre completa, bilis, aminoácidos y vitaminas, entre otros.
Como agente solidificante de los medios de cultivo se utiliza el agar, este se licúa completamente a la temperatura de la ebullición del agua y se solidifica por debajo de 40°C. En general, no tiene efecto sobre el crecimiento de las bacterias y no es utilizado dentro de su metabolismo; la gelatina es otro agente solidificante, sin embargo, se emplea mucho menos ya que algunas bacterias provocan su licuefacción y en este caso se utiliza más como prueba de identificación.
Fuente: Autores.
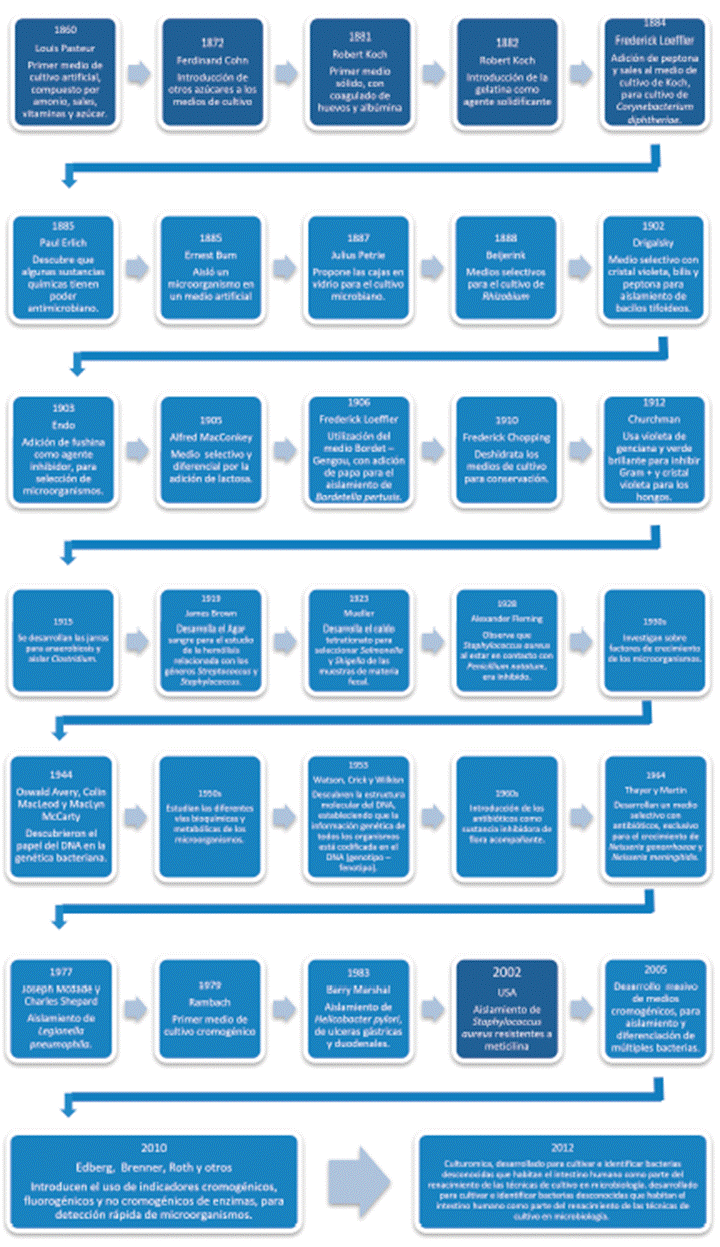
Figura 1 Evolución de los medios de cultivo: desde el primer cultivo bacteriano (1860) hasta la culturómica. en la Tatacoa (Colombia).
Después de la aparición de técnicas moleculares en la década de 1970, como la PCR, la secuenciación y más particularmente la metagenómica, los microbiólogos han favorecido estas técnicas innovadoras en detrimento de la cultura. Sin embargo, la metagenómica presenta ciertas desventajas y en particular, un sesgo de profundidad, debido a la falta de sensibilidad de los cebadores utilizados, ya que no detecta bacterias presentes en concentraciones <10 5 bacterias por gramo de heces 2. Hace unos años, se desarrolló una nueva técnica de cultivo que utiliza una cantidad de medios y condiciones para extender el repertorio de bacterias 2; esta técnica demuestra la complementariedad entre metagenómica y culturómica. Por lo tanto, la identificación metagenómica de especies bacterianas existentes en una microbiota dada, puede ser explotada por la culturómica a través de la optimización de nuevos medios de cultivo específicos para el aislamiento de estas especies. Esta complementariedad permite que el culturismo se convierta en una técnica dirigida 1.
Requerimientos nutricionales y medios de cultivo
Para crecer, las bacterias necesitan un mínimo de nutrientes: agua, una fuente de carbono, una fuente de nitrógeno y algunas sales minerales 3.
Se denomina cultivo puro o axénico al que contiene sólo un tipo de microorganismo, éstos se inician a partir de colonias aisladas, de manera que todos los individuos provengan del mismo linaje. Los cultivos puros son esenciales para estudiar las características metabólicas e identificarlos. 4
Nutrición bacteriana
Como nutrición se denomina al conjunto de procesos por los cuales los seres vivos toman del medio las sustancias que necesitan para su desarrollo (nutrientes) que requieren para su catabolismo (mantenimiento) y su anabolismo (crecimiento). De igual forma, las bacterias también realizan biosíntesis de nuevos compuestos celulares, que demandan energía procedente del medio ambiente. 4
De acuerdo con la forma como las bacterias obtienen la energía, se clasifican en: Quimiótrofas, cuando la obtienen de sustancias orgánicas y Fotótrofas, cuando la obtienen de la luz. 5, mientras que, dependiendo de la ganancia energética, se clasifican en: Litótrofas (del griego lithos = piedra), cuando requieren sustancias inorgánicas como ácido sulfhídrico (H2S), azufre elemental (S), amoniaco (NH3), ion nitrito (NO2-), Hierro (Fe), entre otros y Organótrofas, las que requieren compuestos orgánicos como carbohidratos, hidrocarburos, lípidos y proteínas, entre otros. 4,5
Los procesos biosintéticos, que le permiten suplir las necesidades de crecimiento (plásticas) a las bacterias se dividen en dos grupos:
1. Por la utilización del carbono se clasifican en:
Autótrofas: las que crecen sintetizando sus materiales orgánicos a partir de sustancias inorgánicas tales como el CO2 .
Heterótrofas: la fuente de carbono es orgánica, una de las más utilizadas, es el monosacárido Glucosa (C6H12 O6).
Mixótrofas: son aquellas que pueden pasar de estadios autotróficos a heterotróficos y viceversa de acuerdo, a las condiciones en que se encuentren.
2. Por los requerimientos nutricionales se clasifican en:
Auxótrofas, cuando se comportan de manera exigente frente a algún requerimiento nutricional exógeno, generalmente por mutación genética.
Protótrofas, cuando no son exigentes y se autoabastecen 4.
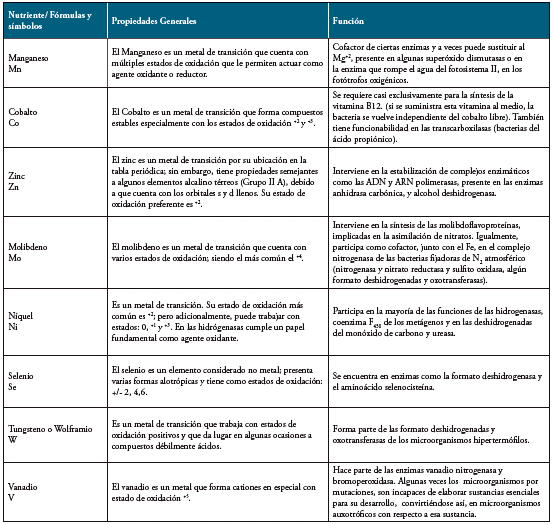
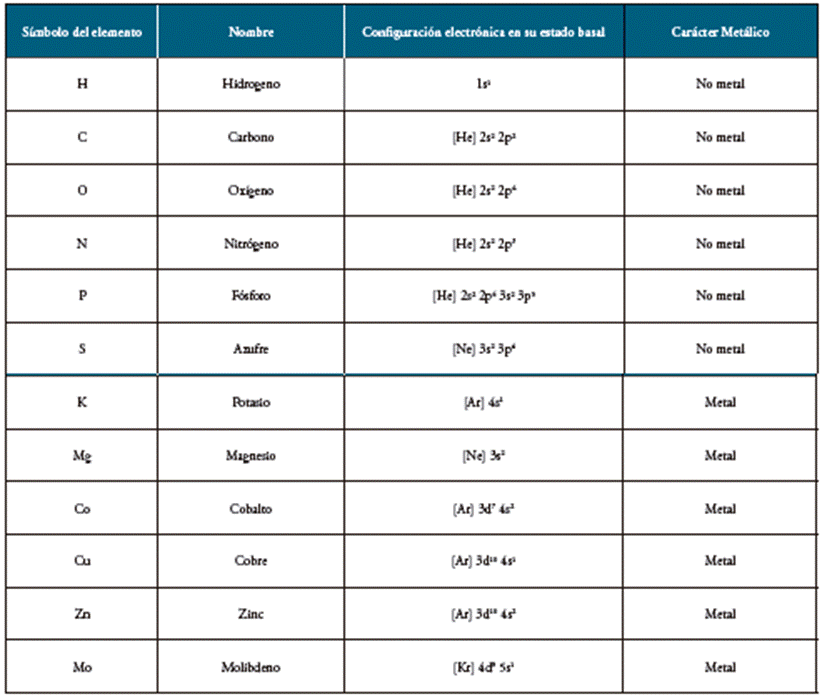
Las bacterias reaccionan con una serie de elementos químicos, y de acuerdo con las cantidades en que son requeridos se encuentran macronutrientes como C, H, O, N, P, S, K, Mg y micronutrientes como Co, Cu, Zn y Mo, los cuales se encuentran combinados en la naturaleza, formando parte de sustancias orgánicas y/o inorgánicas 3,6,7. En las diferentes reacciones en las que intervienen, los elementos anotados anteriormente, forman iones que les permiten aumentar su estabilidad química y transportar electrones. La formación de iones positivos (cationes) o negativos (aniones) depende directamente de la configuración electrónica del elemento en estado basal y del carácter metálico del mismo. 8
Tabla 1 Configuración electrónica y carácter metálico de algunos elementos implicados en la Nutrición Bacteriana.
Fuente: Autores.
Así mismo, algunos de los nutrientes son incorporados para construir macromoléculas y estructuras celulares; otros, sólo se utilizan para la producción de energía, y no se incorporan directamente como material celular; y finalmente, unos pocos, pueden ejercer ambos roles.
Las bacterias heterótrofas, aunque no usan el CO2 como fuente de Carbono ni como aceptor de electrones, necesitan pequeñas cantidades para realizar reacciones de carboxilación en procesos anabólicos y catabólicos. Las reacciones de carboxilación se caracterizan químicamente, por hacer uso de las moléculas de CO2 como reactivos para producir moléculas más complejas. 9
Como se estableció anteriormente, la principal fuente de carbono inorgánica (exógena), para las bacterias, es el dióxido de carbono (CO2); y las fuentes (endógenas) orgánicas pueden ser azúcares y alcoholes. 10,11. Así, el carbono es el elemento constituyente más abundante en las bacterias y, por tanto, dichos microorganismos producen, a su vez, biomoléculas como lípidos, carbohidratos, proteínas y ácidos nucleicos.
Normalmente, las bacterias crecen a la concentración de CO2 atmosférico (0.03%). De tal forma que, la composición del medio de cultivo puede influir sobre diferentes aspectos en la fisiología del microorganismo y por ende en la producción de metabolitos primarios y secundarios 12.
Tabla 2 Propiedades y Funciones de Macronutrientes.
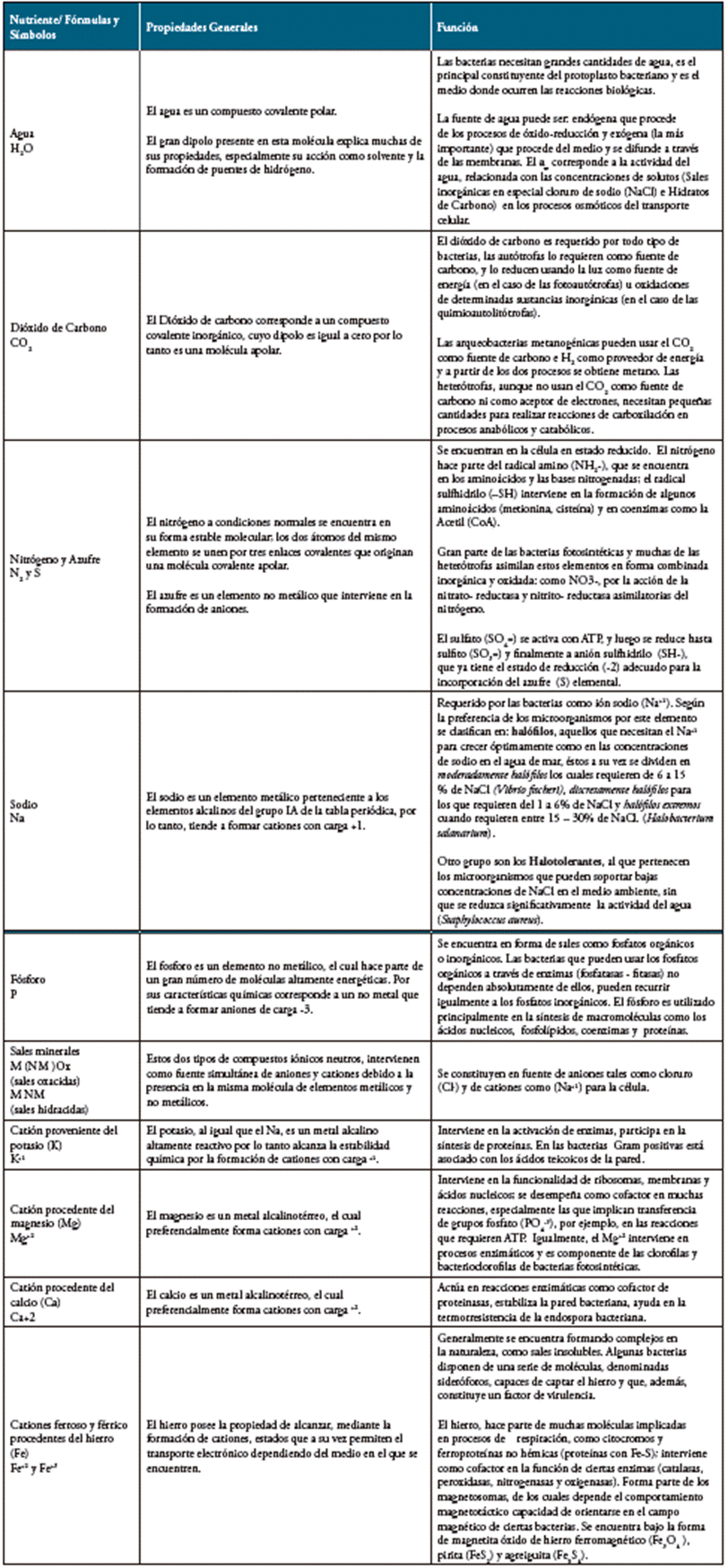
M: Elemento Metálico
NM: Elemento no metálico.
Fuente: Autores.
Las propiedades que tienen las bacterias de metabolizar elementos y compuestos les ha conferido el uso de ser inoculantes biológicos en sistemas agrícolas, en los cuales favorece el desarrollo de las plantas, mediante diferentes mecanismos, tales como la fijación de nitrógeno, inducción de resistencia frente a patógenos, promoción de rizogénesis y síntesis de fitohormonas estimuladoras del crecimiento vegetal, como el ácido indol acético (AIA); dentro de los géneros reportados como promotores del crecimiento vegetal (PGPR) se encuentran Pseudomonas fluorescens, Rhizobium sp. y Bradyrhizobim sp., entre otros 13. Otros tipos de actividades promotoras del crecimiento vegetal, asociadas a la disponibilidad de P en el suelo, son la solubilización ácida del P inorgánico y la mineralización del P orgánico. La solubilización de los compuestos inorgánicos insolubles como los fosfatos de calcio, se lleva a cabo por la producción de ácidos orgánicos (ácido glucónico, ácido 2-ceto-glucónico, ácido glicólico, oxálico, malónico y succínico), productos del catabolismo microbiano, y la consecuente sustitución del Ca++. 14,15.
Los micronutrientes o elementos traza, son aquellos que las bacterias necesitan en pequeñas cantidades, denominados también oligoelementos.
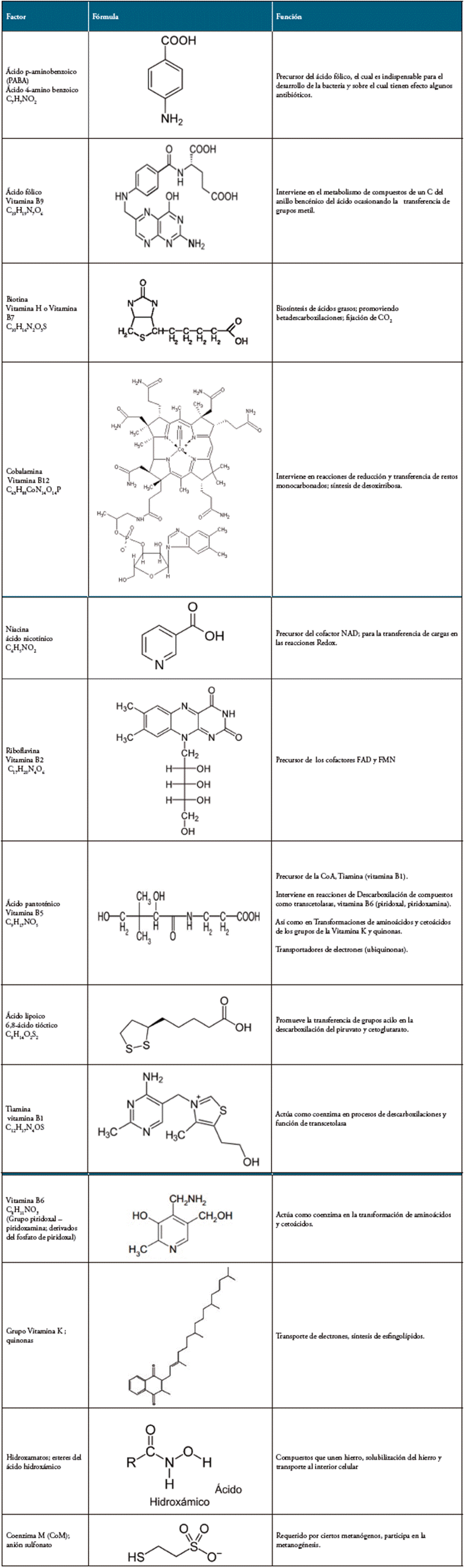
De otro lado, se encuentran los Factores de crecimiento, que se refieren a moléculas específicas que algunas bacterias requieren en muy pequeña cantidad para crecer. Suelen ser coenzimas o sus precursores, como vitaminas, que determinadas bacterias no pueden sintetizar por sí mismas, al carecer en parte o totalmente de una ruta biosintética. Igualmente, en este grupo se incluyen algunos aminoácidos y las bases nitrogenadas purinas y pirimidinas, como, por ejemplo, las bacterias del género Brucella que requieren como factores de crecimiento en sus medios de cultivo la biotina, niacina, tiamina y ácido pantoténico. Haemophilus necesita como suplementos nutricionales los grupos hemo y nicotinamida adenina dinucleótido (Factor X y Factor V) 16.
El Faecalibacterium prausnitzii, por ejemplo, requiere una gran cantidad de vitaminas para crecer, como biotina, ácido fólico, riboflavina o vitamina B12, que no puede sintetizar, así como otros factores de crecimiento como los ácidos grasos volátiles (ácido acético, ácido propiónico o ácido valérico) 17. Dunn y colaboradores, mostraron en 1946, que solo dos aminoácidos eran esenciales para el crecimiento de Leuconostoc mesenteroides, ácido glutámico y valina, mientras que para el crecimiento de Lactobacillus brevis, se requerían al menos 15 aminoácidos 18. Este alto requerimiento de aminoácidos puede explicarse por el hecho de que el medio base utilizado en ese momento no era rico en nutrientes comunes. De hecho, hoy en día, Lactobacillus brevis crece en un agar COS (Columbia Blood Agar) (Biomérieux, Marcy l'Étoile, Francia), no suplementado con aminoácidos, pero compuesto de hidrolizado de caseína y peptona proteosa, fuentes importantes de aminoácidos 19.
En los aminoácidos que conforman las proteínas, las cadenas laterales pueden estar ordenadas en sentido horario o antihorario - orientaciones que los químicos llaman "D" y "L" -, encontrándose casi siempre en la forma L. Al respecto, Matthew Waldor, y sus colegas encontraron que ciertas bacterias convierten aminoácidos específicos en formas D cuando necesitan retardar su crecimiento 20.
Las bases de purina y pirimidina, son necesarias para la síntesis de ácidos nucleicos, de hecho, algunas bacterias del ácido láctico necesitan adenina, guanina, timina o uracilo para crecer. Este es el caso en particular de Leuconostoc mesenteroides, para la cual la guanina es esencial en su desarrollo 21.
Crecimiento Bacteriano
Se define como crecimiento de cualquier sistema biológico al aumento de la masa celular que implica su multiplicación 22. En organismos unicelulares que se dividen por fisión o por gemación, lo que ocurre es un aumento de la población. El crecimiento bacteriano se puede observar desde dos puntos de vista: a escala individual y a escala poblacional.
A escala individual, incluye una serie de procesos que hacen referencia al ciclo celular, en los cuales se encuentran: inicio y transcurso de la replicación cromosómica y de los plásmidos; segregación del cromosoma y los plásmidos a las células hijas; síntesis de precursores de membranas y pared celular y señales que coordinan la replicación genómica con la división celular 23 Por su parte, el crecimiento a nivel poblacional incluye: la cinética de crecimiento; factores que afectan el tiempo de generación y los factores ambientales que limitan el crecimiento 24.
Métodos para la cuantificación del crecimiento bacteriano
1. Por la medida del consumo de nutrientes o de producción de algún metabolito en particular por unidad de tiempo. En este caso el consumo de oxígeno (QO2) y consumo de gas carbónico (QCO2), se determinan por el respirómetro de Warburg o mediante la producción de ácidos.
2. Por métodos turbidimétricos, el fundamento de estos métodos radica en la interacción de la luz con un cultivo bacteriano. Las suspensiones bacterianas dispersan la luz, al igual que cualquier partícula "relativamente" pequeña suspendida en agua, por lo tanto, dicha dispersión es proporcional a la masa del cultivo. Esta medición se puede realizar con dos tipos de equipos.
Espectrofotómetro: mide la densidad óptica (D.O.), es decir la absorbancia. En esta técnica hay que realizar una curva estándar para relacionar los valores de A (absorbancia) con la masa bacteriana en la muestra problema.
Nefelómetro: difiere del espectrofotómetro en cuanto a que su dispositivo sensor está situado en ángulo recto respecto de la dirección de la luz incidente y lo que mide es la luz dispersada directamente por la preparación, esto le otorga mayor sensibilidad que el espectrofotómetro.
Recuento directo: consiste en la observación al microscopio de volúmenes muy pequeños de suspensiones de bacterias. Se usan unos portaobjetos especiales denominados cámaras de Petroff-Hausser; para que la medida sea correcta, es necesario que la densidad de células sea del orden de 105 por ml.
Recuento de viables: se realiza sembrando un volumen determinado de cultivo o muestra sobre el medio de cultivo sólido adecuado para estimar el número de viables contando el número de colonias que se forman, ya que cada una de estas deriva de una célula aislada; para que la medida sea correcta desde el punto de vista estadístico, es necesario contar más de 300 UFC. En ciertas ocasiones, en las que la densidad de microorganismos es demasiado baja, éstos se pueden recolectar por filtración a través de una membrana (de 0.2 µm de tamaño de poro), la cual se coloca en un medio de cultivo adecuado para que se formen las colonias.
Medida del número de partículas: En este método se utilizan contadores electrónicos de partículas. Estos sistemas no indican si las partículas corresponden a células vivas o muertas; pero pueden dar una idea del tamaño de las partículas.
Medida de parámetros bioquímicos: en este caso pueden ser la cantidad de ADN, ARN, proteínas o peptidoglicano, entre otros por unidad de volumen de cultivo 25,26,27,28.
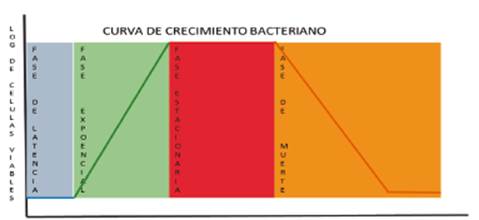
Ciclo de Crecimiento de Poblaciones.
En un medio líquido se pueden diferenciar cuatro fases en la evolución del crecimiento bacteriano:
Fase de adaptación: Las bacterias acomodan su metabolismo a las nuevas condiciones ambientales y de nutrientes para iniciar el crecimiento exponencial.
Fase exponencial o logarítmica: Tanto la velocidad de crecimiento como el consumo de nutrientes son máximos, las bacterias tienen un tiempo de generación mínimo y corresponde a la fase de infección y multiplicación del agente infeccioso dentro del organismo.
Fase estacionaria: No se incrementa el número de bacterias y estas presentan un metabolismo diferente al de la fase exponencial; se observa acumulación y liberación de metabolitos secundarios que tienen importancia en el curso de las infecciones o intoxicaciones. Esta fase sucede porque se agotan uno o varios nutrientes esenciales en el medio, bien ser porque, los productos de desecho liberados en la fase de crecimiento exponencial convierten el medio en inhóspito para el crecimiento microbiano o por la presencia de competidores que limitan su crecimiento.
Fase de muerte: se produce una reducción del número de bacterias viables del cultivo 29,30.
Factores condicionantes del desarrollo bacteriano
Las bacterias se encuentran en la naturaleza en constante interrelación con otros organismos vivos y de esta interacción incide en su desarrollo. Por ejemplo, las bacterias endofíticas, las cuales son, bacterias beneficiosas para las plantas que prosperan dentro de ellas y pueden mejorar su crecimiento; esto se puede relacionar con una mejor absorción de nutrientes que regula el crecimiento y la síntesis de fitohormonas relacionadas con el estrés 31.
Temperatura: Para cada microorganismo existe una temperatura de crecimiento adecuada; en este sentido, se observa una temperatura mínima por debajo de la cual no hay crecimiento, a temperaturas mayores se produce un incremento lineal de la velocidad de crecimiento hasta que se alcanza la temperatura óptima y por encima de esta, la velocidad de crecimiento decae bruscamente y se produce la muerte celular.
El incremento de la velocidad de crecimiento en relación con el aumento de la temperatura se debe al incremento de la velocidad de las reacciones enzimáticas; mientras que, el crecimiento escaso o nulo a temperaturas bajas en relación con la óptima, se debe a la reducción de la velocidad de reacción enzimática y al cambio de estado de los lípidos de la membrana celular que pasan de ser fluidos a cristalinos 32. Así mismo, la muerte ocurre a altas temperaturas debido a la desnaturalización de las proteínas y también a las alteraciones producidas en las membranas lipídicas.
Sin embargo, se debe tener en cuenta que, a temperaturas bajas, el metabolismo celular se enlentece y las células paran de crecer, pero no mueren y pueden recuperar su capacidad de división si aumenta posteriormente la temperatura; lo que no ocurre en el caso contrario de altas temperaturas donde los microrganismos mueren, lo que permite esterilizar por calor y no por frío.
Tabla 5 Clasificación Bacteriana de acuerdo con las temperaturas Cardinales para su desarrollo.
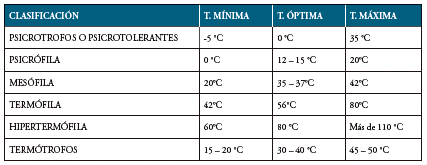
Fuente: Tomado de Conceptos Básicos de Microbiología.
Los microorganismos implicados en la generación de infecciones son los mesófilos y algunos psicrótrofos, sus temperaturas óptimas de crecimiento coinciden con las corporales; estas bacterias, pueden producir además toxinas que causan intoxicaciones alimentarias 33
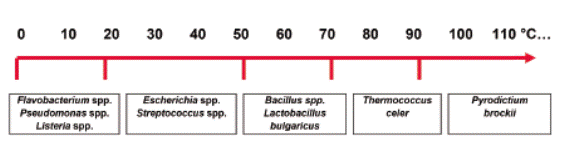
Fuente: Tomado de Conceptos básicos de microbiología. Corrales L y González A.
Figura 3 Rangos de temperatura en el crecimiento bacteriano.
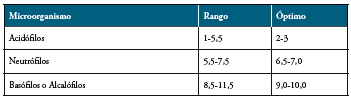
El pH: Las condiciones de pH del medio regulan, a su vez, el pH interno de la bacteria e influyen en el transporte de hidrogeniones a través de membrana citoplasmática. La mayoría de microorganismos que se desarrollan a pH 7 se denominan neutrófilos, los acidófilos se desarrollan a pH inferior a 5 y los que se desarrollan a pH mayores de 8 se denominan basófilos o alcalófilos. 33.
El pH intracelular es ligeramente superior al del medio que rodea las células ya que, en muchos casos, la obtención de energía metabólica depende de la existencia de un gradiente en la concentración de protones a ambos lados de la membrana citoplasmática.
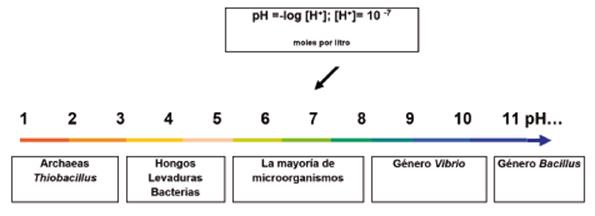
Fuente: Tomado de Conceptos básicos de microbiología. Corrales L y González A.
Figura 4 Rangos de pH en el crecimiento bacteriano.
El pH en los medios de cultivo suele bajar, lo cual confiere una ventaja selectiva frente a otros microorganismos competidores. Es así como, las bacterias lácticas, por ejemplo, producen grandes cantidades de ácido láctico (CH3CHOHCOOH) y como consecuencia de esto, el pH del medio de cultivo disminuye a valores inferiores a los soportables por otras bacterias.
Actividad del agua
El agua como compuesto químico, está constituido por moléculas que presentan una geometría molecular de la cual resulta un momento dipolar elevado. La polaridad de la molécula y, por tanto, el sinnúmero de interacciones que éste compuesto propicia, se explica por el ángulo de enlace de 104,9°, esta particularidad se constituye en un factor determinante en las atracciones intermoleculares, los puentes de hidrógeno, la solubilidad y la tensión superficial. 34
Las propiedades antes mencionadas influyen directamente en la "actividad de agua" (a w); la cual se define como la relación entre la presión de vapor de agua del substrato de cultivo (P) y la presión de vapor de agua pura (Po); por tanto, la actividad del agua incide en el curso de reacciones químicas y bioquímicas.
Si los microorganismos se encuentran en un substrato con una actividad de agua demasiado baja el crecimiento se detiene, esta detención no suele llevar a la muerte del microorganismo, sino que se mantiene en condiciones de resistencia durante un tiempo más o menos largo; en el caso de las esporas, la fase de resistencia puede ser considerada prácticamente ilimitada.
En relación con la actividad del agua se encuentran microorganismos osmotolerantes, cuando crecen en un rango amplio de a w, un ejemplo es el Staphylococcus aureus que crece a concentraciones de sal 3M; osmófilos son aquellos que crecen en ambientes con altas actividades y cuando crecen en ambientes muy secos o con bajas actividades reciben el nombre de xerófilos. 5,33,35
Potencial de óxido-reducción (REDOX)
Las reacciones de óxido reducción son aquellos que se caracterizan por la presencia simultánea de una sustancia oxidante (gana electrones) y un agente reductor (pierde electrones) 8. El potencial redox mide la tendencia a ganar o a perder electrones, lo que ocasiona un cambio en el estado de oxidación de cada especie, según sea el caso. Uno de los factores que intervienen en el potencial redox, aunque no el único, es la concentración de oxígeno (O2). Hay microorganismos que requieren ambientes oxidantes para crecer, mientras que otros necesitan ambientes reductores; cuando una bacteria requiere un ambiente oxidante, desarrolla un metabolismo oxidativo (respiratorio) en cambio cuando requiere ambientes reductores optan por un metabolismo fermentativo.
Una bacteria es aerobia cuando necesita del oxígeno para vivir y es anaerobia en dos casos, cuando no lo necesita, denominada "anaerobia tolerante" o cuando muere en presencia del oxígeno "anaerobias estrictas". Dentro de este grupo de bacterias se encuentran algunas que llevan a cabo un metabolismo oxidativo porque usan otro aceptor final de electrones que actúa como oxidante ambiental, ejemplo, de éstas son las que "respiran" nitratos (NO3-), sulfatos (SO4 2-) u otros compuestos capaces de aceptar electrones y funcionan como agentes oxidantes.
En el curso de ciertas reacciones metabólicas redox se forman compuestos altamente reactivos (radicales libres, formas superóxido) que pueden dañar las proteínas, membranas y ácidos nucleicos produciendo la muerte de las células. Las células se protegen de estos compuestos por la síntesis de enzimas como la superóxido dismutasa (SOD), peroxidasa y catalasa. Las bacterias anaerobias estrictas carecen éstas o las tienen en niveles muy bajos de forma que no pueden sobrevivir en presencia de oxígeno. 5,36
De otra parte, existen bacterias reductoras de metales como Geobacter sulfurreducens, las cuales transfieren electrones más allá de sus membranas externas a los óxidos de Fe (III) y Mn (IV); en este sentido, los óxidos metálicos insolubles en el medio ambiente representan un depósito común y vasto de energía para algunos microorganismos respiratorios capaces de transferir electrones a través de sus membranas aislantes a los aceptores externos, un proceso denominado transferencia de electrones extracelular 37.
Medios de cultivo
Caldos de Enriquecimiento: contienen agentes inhibidores a baja concentración, que retrasan el crecimiento de la microbiota contaminante y permiten el crecimiento del microorganismo que se quiere recuperar 29.
Caldo nutritivo con Extracto de Carne y NaCl (Cloruro de Sodio): es utilizado para la recuperación de microorganismos no exigentes; se puede suplementar con extracto de levadura, peptonas, glucosa, y otros componentes.
Caldo Tioglicolato: se suplementa con caseína, extracto de levadura, carne y tioglicolato. Para el aislamiento de anaerobios, se añaden además hemina y vitamina K.
El tioglicolato es un compuesto derivado del ácido tioglicolico, rico en átomos de azufre que facilita, el transporte de electrones.
Es el caldo más utilizado en microbiología clínica porque ofrece un bajo potencial redox, por lo cual permite el óptimo desarrollo de las bacterias anaerobias. Favorece también el crecimiento de aerobios, microaerófilos e incluso de microorganismos exigentes 38.
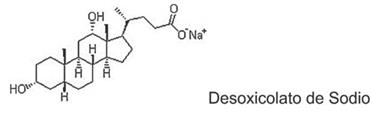
Caldo Gram negativos (GN): contiene agentes inhibidores a baja concentración como el citrato y desoxicolato (sal biliar), los cuales inhiben el desarrollo de las bacterias Gram positivas y retrasan el crecimiento de las coliformes; se utiliza como medio de enriquecimiento para el aislamiento de Salmonella y Shigella en muestras de heces e hisopados rectales.
Caldo selenito F: Contiene como agente inhibidor el selenito de sodio (Na2SeO3), el cual inhibe los enterococos y retrasa el crecimiento de las coliformes, se puede añadir cisteína que favorece el crecimiento de Salmonella.
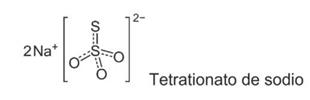
Caldo tetrationato: Contiene sales biliares y tetrationato sódico (se genera en la reacción de tiosulfato con yodo), los cuales inhiben las bacterias Gram positivas y las coliformes que no tienen la enzima tetrationato reductasa. Se utiliza como medio de enriquecimiento para el aislamiento de Salmonella.
El tetrationato de sodio es una sal proveniente del anión sulfito (SO3)=, enriquecido con otro átomo de azufre que incrementa la densidad electrónica y, por lo tanto, facilita el transporte de electrones.
Caldo peptona complementada: medio con pH 8,4 que se utiliza como enriquecimiento para el aislamiento de especies de Vibrio, antes de pasar a subcultivos en medios más selectivos.
Caldo tioglicolato Campy: es un medio semisólido por la adición de agar, similar en componentes al caldo tioglicolato suplementado con antibióticos. Se utiliza para el enriquecimiento de especies de Campylobacter antes de subcultivar en medios más selectivos.
Caldo Todd-Hewitt con sangre y antibióticos: compuesto por infusión cerebro corazón, peptona, glucosa C6H12O6, cloruro de sodio, NaCl, fosfato de sodio, Na3PO4 y carbonato de sodio, Na2CO3. Como inhibidores contiene ácido nalidixico (C12H12N2O3) y gentamicina (C21H43N5O7) o colistina (C52H98N16O13), se utiliza como medio de enriquecimiento para Streptococcus agalactiae de muestras genitales 16,39.
Caldo con carne picada: caldo nutritivo al cual se le añaden trozos de carne como fuente de proteínas, posee un bajo potencial redox, lo cual favorece la recuperación de anaerobios, mejor cuando se añade una capa de parafina liquida, la cual, se utiliza para aislar el cultivo bacteriano del O2 del ambiente.
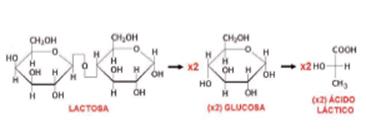
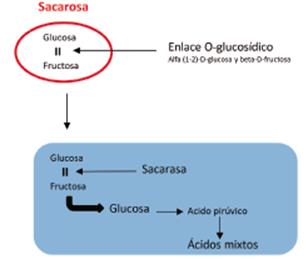
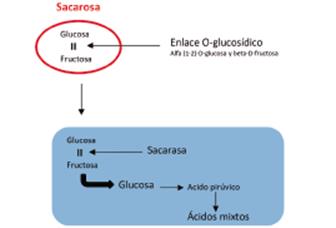
Leche con tornasol: caldo enriquecido al cual se le añade leche (descremada), su uso se fundamenta en la capacidad de ciertos microorganismos de producir determinadas reacciones metabólicas como fermentación de la lactosa, caseolisis (peptonización), y coagulación de la caseína C38H57N9O9. Estas reacciones se ponen de manifiesto mediante un indicador redox y de pH, como el tornasol.
La caseína es una proteína sobre la cual actúa la enzima caseinasa, rompiendo los enlaces peptídicos y la estructura cuaternaria, originando asociaciones más pequeñas que pueden aglutinarse cuando se alcanza el punto isoeléctrico. El crecimiento se interpreta de la siguiente manera:
Color rosado en el medio de cultivo: Fermentación de la lactosa y por lo tanto es una reacción ácida, en la cual, como producto de la reacción se obtiene el ácido láctico:
Cuando no hay cambio de color en el medio de cultivo, no se ha producido fermentación de la lactosa ni se han utilizado las sustancias nitrogenadas del medio. De otra parte, un color azul en el medio de cultivo, indica que el microorganismo ha utilizado las sustancias nitrogenadas del medio, produciendo reacción alcalina.
Un color blanco en el medio de cultivo, indica que se ha producido una peptonización de la proteína de la leche (digestión), y el tornasol se reduce a una leucobase. La producción de coágulo, indica coagulación de la leche, se alcanza el punto isoeléctrico de la proteína y la producción de gas, por la aparición de burbujas (CO2 y H2) en el medio.
Caldo verde brillante bilis al 2%: es un medio selectivo recomendado para la prueba confirmatoria en la detección del grupo coliforme en aguas, leche, derivados lácteos y otros productos de importancia sanitaria, mediante la determinación del NMP (número más probable). La bilis y el verde brillante inhiben el desarrollo indeseable de la flora acompañante de los coliformes e incluso suprimen el crecimiento de los anaerobios fermentadores de la lactosa como es el caso de Clostridium perfringens. La presencia de gas después de 24 - 48 horas a 35° C de incubación se considera como prueba positiva para la presencia del grupo Coli - Enterobacter40.
Medios de cultivo en placa de aislamiento primario de uso rutinario
No Selectivos: para cultivo de una amplia variedad de organismos difíciles de crecer "in vitro". A menudo están enriquecidos con nutrientes como: sangre, suero, hemoglobina, factores de crecimiento X, V, aminoácidos, y vitaminas entre otros.
Selectivos: de moderada o de alta selectividad, a los cuales se les añaden sustancias que inhiben el crecimiento de ciertos grupos bacterianos permitiendo a la vez el crecimiento de aquellas que se desean seleccionar. Algunas sustancias inhibidoras son el cristal violeta que inhibe las bacterias Gram positivas. Otra manera es modificar la fuente de carbono; si se sustituye la glucosa por maltosa, se seleccionan aquellos microorganismos capaces de metabolizarla.
Enriquecidos: algunos microorganismos no son capaces de desarrollarse en medios de cultivo normales, para cultivarlos se requiere añadir sustancias altamente nutritivas como sangre, suero, cofactores, vitaminas, extractos de tejidos animales y las bacterias que crecen en ellos se denominan exigentes o fastidiosas 41.
Los medios enriquecidos en los cuales se suprime el crecimiento de la flora competitiva normal se hacen mediante el uso de antibióticos específicos, como kanamicina (C18H36N4O11) y vancomicina (C66H75Cl2N9O24).
Agar Cled (cistina, lactosa, deficiente en electrolitos):
Es un medio no selectivo diferencial, recomendado para el análisis bacteriológico de orina ya que en él crecen la gran mayoría de las bacterias, tanto Gram negativas como Gram positivas, patógenas de vías urinarias. Debido a que en su composición tiene deficiencia en electrolitos (no contiene cloruro de sodio), impide que las colonias del género Proteus invadan la placa de cultivo (efecto swarming), por lo tanto, este medio facilita el recuento de las unidades formadoras de colonias (UFC).
El único carbohidrato que contiene es La lactosa; la cistina, facilita el crecimiento de las bacterias coliformes dependientes de ella y el azul de bromotimol funciona como indicador, el cual permite distinguir las colonias de bacterias fermentadoras de las que no lo son ya que vira a amarillo en pH ácido y se torna de un color azul más intenso en pH alcalino 42.
Agar Nutritivo
Es un medio de cultivo no selectivo, utilizado para el aislamiento y recuento de microorganismos que tienen requerimientos nutricionales escasos, su uso está descrito principalmente para procedimientos en el análisis de alimentos, aguas y otros materiales de importancia sanitaria. La pluripeptona y el extracto de carne aportan nutrientes para el desarrollo bacteriano; el cloruro de sodio (NaCl) mantiene el balance osmótico y el agar es el agente solidificante. Puede ser suplementado con sangre ovina desfibrinada estéril, para favorecer el crecimiento de microorganismos exigentes en sus requerimientos nutricionales y en este caso permite una clara visualización de las reacciones de hemólisis.
Agar BHI (infusión cerebro-corazón)
La infusión cerebro-corazón es una fórmula que contiene muchos nutrientes ya sea como caldo o medio sólido y opcionalmente con sangre adicional. Los componentes clave incluyen infusión de distintos tejidos animales con el agregado de peptona, tampón fosfato (HPO4-) y una pequeña concentración de glucosa que proporciona la fuente de energía accesible.
Este medio en presentación de caldo se emplea con frecuencia como medio para hemocultivo y como medio base para muchas pruebas metabólicas, en especial para la identificación del género Streptococcus. Cuando al medio se le adiciona 6.5% de cloruro de sodio, las sales activas actúan como agentes diferenciales y selectivos, los cuales interfieren en la permeabilidad y el equilibrio eléctrico y osmótico en microorganismos intolerables a esta sal 43.
Agar TSA (triptona-soja)
Medio rico de uso general para el crecimiento de una amplia variedad de microorganismos. Se produce por digestión enzimática de la soja y de la caseína, con frecuencia se utiliza como agar base para otros tipos de medios tales como agar sangre o chocolate. En este medio pueden crecer microorganismos exigentes como algunas especies de Brucella, Corynebacterium, Listeria, Neisseria y Vibrio16.
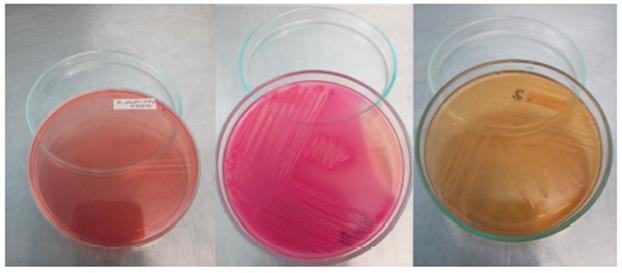
Agar Sangre
El agar sangre es un medio no selectivo, compuesto por un agar base que contiene una fuente proteica al cual se le agrega de 5% a 8% de sangre ovina; el agar sangre, permite el crecimiento de la mayoría de las bacterias (Gram positivas y Gram negativas), permite verificar capacidad hemolítica (medio diferencial), las hemólisis que se pueden evidenciar en este medio son: beta, alfa y gamma.
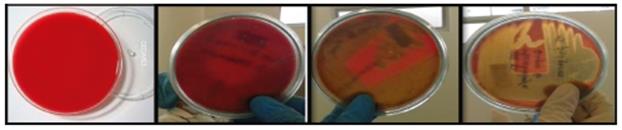
Fuente: L. Corrales.
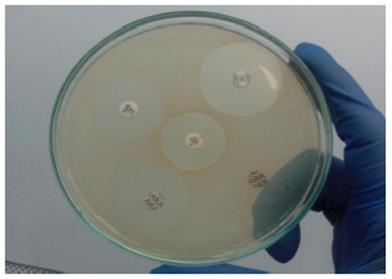
Foto 4 Hemolisis en agar sangre. De izquierda a derecha: agar sangre sin sembrar, producción de hemolisis gama, hemolisis alfa y hemolisis beta.
El agar sangre está preparado con un medio de cultivo deshidratado denominado agar base sangre, el cual está compuesto por agar-agar, infusión de músculo de corazón, peptona, cloruro de sodio; el color del medio es ámbar claro; cuando se agrega la sangre, su color cambia a rojo cereza. La sangre utilizada para preparar el medio generalmente es sangre de cordero, pero también puede ser sangre humana o de caballo, y, al respecto es importante considerar que algunas bacterias varían el tipo de hemolisis de acuerdo con la naturaleza de la sangre. El uso se fundamenta en que la infusión de músculo de corazón y la peptona, otorgan al medio un alto valor nutritivo, que permite el crecimiento de una gran variedad de bacterias y otros microorganismos, aún de aquellos nutricionalmente exigentes. El cloruro de sodio mantiene el balance osmótico.
Hemolisinas: cerca del 35% de las toxinas producidas por las bacterias son del tipo "Toxinas membranolíticas" (TM). La característica más importante de los efectos de estas toxinas es sobre la organización en la bicapa fosfolipídica de la membrana plasmática de células humanas y/o animales. La pérdida de la integridad de la membrana conlleva a un desbalance osmótico, reflejado por la hinchazón de la célula debido al ingreso de agua y desorden del gradiente electroquímico que conduce a la lisis y muerte celular, contribuyendo a la virulencia de la bacteria y jugando un rol importante en la patogenia bacteriana. Las TM fueron identificadas "in vitro" por su característica de lisar glóbulos rojos sensibles de humanos y otras especies animales, con la aparición de un halo de hemólisis alrededor de las colonias bacterianas en agar sangre. Sin embargo, actualmente se sabe con certeza que la mayoría de hemolisinas bacterianas actúan sobre células distintas a los glóbulos rojos, causando daño tisular o muerte de muchos de los animales de experimentación. Es por esta razón, que se propuso el término "citotoxina" o "toxina citolítica" para describir correctamente el rango de sus actividades biológicas 16,44.
Como se expuso anteriormente, en el agar sangre, se pueden diferenciar tres tipos de hemólisis:
Hemolisis alfa: Lisis parcial de los glóbulos rojos, con un halo de color verdoso alrededor de las colonias, debido a la oxidación de la hemoglobina a metahemoglobina, con la liberación de un producto de degradación llamado biliverdina por el peróxido de hidrógeno generado en el metabolismo de los microorganismos.
Hemolisis beta: Lisis total de los glóbulos rojos. Se observa un halo claro, traslúcido alrededor de la colonia, estas hemolisinas interactúan con el colesterol en la membrana celular, dando como resultado el deterioro de esta estructura celular protectora. La estreptolisina, una exotoxina que causa la lisis completa de los hematíes, (Estreptolisina O, citotoxina sensible al oxígeno. Estreptolisina S, citotoxina oxigeno estable.)
Hemolisis gamma: Ausencia de lisis de los glóbulos rojos. El medio de cultivo no presenta modificaciones de color y aspecto alrededor de las colonias 45.
Agar Chocolate
Este medio permite el crecimiento de microorganismos exigentes en sus requerimientos nutricionales, como es el caso de algunos Streptococcus, Haemophilus y Neis-serias patógenas; corresponde a la misma fórmula del medio agar sangre, en el cual, por calentamiento a 60°C se lisan los glóbulos rojos, éstos al ser lisados liberan la hemoglobina y otros nutrientes como factor X (hemina) y factor V (Nicotin Adenin Dinucleótido - NAD).
El dinucleótido de nicotinamida y adenina, más conocido como NAD+ en su forma oxidada y NADH en su forma reducida, corresponde a una coenzima que se encuentra en las células vivas; está compuesta por dos nucleótidos unidos por sus grupos fosfatos, uno de ellos una base de adenina y el otro de nicotinamida. Su función principal es intervenir en el intercambio de electrones e hidrogeniones en la producción de energía celular 46) (47. El factor X, denominado hemina y también protoporfirina es un pigmento que contiene hierro (Fe) y suministra los compuestos tetrapirrólicos necesarios para la síntesis de citocromos y enzimas. Este medio de cultivo, es muy nutritivo por la presencia de peptona, tripteína, extracto de levadura, extracto de corazón y almidón, se pueden agregar suplementos definidos que proporciona el factor V, vitaminas, aminoácidos, coenzimas, glucosa iones férricos (Fe+3) y otros factores que favorecen el crecimiento de especies exigentes 8,49.
Agar Mueller Hinton
Es un medio de cultivo rico, diseñado especialmente para hacer ensayos de sensibilidad frente a antimicrobianos y recomendado por el Comité de la Organización Mundial de la Salud para la estandarización de pruebas de susceptibilidad por no contener sustancias inhibidoras de los antimicrobianos, por ejemplo, el PABA (ácido p-amino benzoico), que anula la actividad de sulfamidas, así como por su reproductibilidad. Además, es útil con el agregado de sangre para el cultivo y aislamiento de microorganismos nutricionalmente exigentes. El agar Mueller-Hinton, se utiliza para la realización del ensayo de difusión en placa, en tanto que el caldo Mueller-Hinton se emplea para la determinación de la concentración mínima inhibidora en el ensayo de diluciones seriadas 50.
Solo bacterias aeróbicas o facultativas que crecen satisfactoriamente en agar Mueller Hinton, sin suplementar, podrían ser testeadas en este medio. Para los test con cepas que no crecen satisfactoriamente en Mueller Hinton no suplementado como S. pneumoniae, estreptococos β hemolíticos y del grupo Viridans, se requiere adicionar sangre de oveja desfibrinada al medio fundido y enfriado, en una concentración final de 5 % (V/V) 51.
Tabla 7 Variacion de la actividad de diferentes antimicrobianos con el cambio del pH del medio.
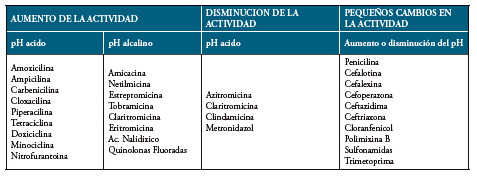
Fuente: Corrales L y González A.
Agar Gardnerella
Es un medio parcialmente selectivo y de diferenciación para el aislamiento de Gardnerella vaginalis a partir de muestras clínicas. El medio está suplementado con peptona de proteasa para mejorar el crecimiento de Gardnerella. Se añade anfotericina B para reducir el crecimiento de las levaduras como Candida spp. que también son frecuentes en las muestras vaginales, se añade sangre humana como nutriente y para detectar la beta-hemólisis difusa característica de este microorganismo 49. La detección del organismo en medios utilizados sistemáticamente es difícil dado que la Gardnerella y otras bacterias tales como lactobacilos y estreptococos pueden producir alfa hemólisis en medios con sangre de carnero, no obstante, en medios con sangre humana, produce la beta-hemólisis característica 52,53.
Agar Thayer Martin
Utilizado para el aislamiento del gonococo, este medio es un agar chocolate enriquecido al cual se ha añadido una mezcla de tres antibióticos específicos que inhiben el crecimiento del resto de la flora acompañante 51. Es selectivo para la recuperación de Neisseria gonorrhoeae y Neisseria meningitidis por la presencia de suplemento de antibióticos constituido por vancomicina, colistina, nistatina y trimetoprima que inhibe el desarrollo de microorganismos Gram positivos y Gram negativos y candidas, y sin efecto inhibitorio para neiserias. El medio de cultivo es altamente nutritivo ya que contiene agar base GC, hemoglobina y el suplemento de enriquecimiento Vitox o Isovitalex que contiene: vitamina B12, L-glutamina, CIH guanina, adenina, ac. p-aminobenzoico, L-cistina, NAD (coenzima I), cocarboxilasa, nitrato férrico Fe (NO3)3, CIH tiamina, CIH cisteína y glucosa 54,55.
Agar Mac Conkey
Es un medio selectivo porque contiene sales biliares y cristal violeta que inhiben el desarrollo de bacterias Gram positivas y de algunas Gram negativas exigentes y diferencial por la lactosa que proporciona la única fuente de carbono para el desarrollo bacteriano.
Este medio se utiliza para el aislamiento de bacilos Gram negativos de fácil desarrollo, aerobios y anaerobios facultativos a partir de muestras clínicas, aguas y alimentos; todas las especies de la familia Enterobacteriaceae se desarrollan con buen crecimiento. La bacteria requiere dos enzimas para degradar el azúcar, la lactosa permeasa (galactósido permeasa), que transporta el disacárido al interior de las células y la B-galactosidasa, que cataliza la hidrólisis de lactosa en sus dos monosacáridos glucosa y galactosa. Las bacterias que sintetizan las dos enzimas son fermentadoras rápidas y las bacterias que solo sintetizan la B-galactosidasa son fermentadoras lentas; el indicador es el rojo neutro, así que en medio ácido se observa de un color rosa intenso o fucsia en las colonias o alrededor de las mismas que corresponde a la reacción de fermentación positiva 16,50.
Se recomienda el uso de este medio en muestras clínicas con posible flora microbiana mixta, tales como procedentes de la orina, sistema respiratorio, heridas y otras, porque permite la agrupación preliminar de bacterias entéricas y otras bacterias Gram negativas en organismos fermentadores y no fermentadores de lactosa 56.
Agar Endo
Es un medio importante para el examen microbiológico del agua potable y residual, los productos lácteos y los alimentos. El medio se utiliza aún en microbiología clínica y en otros sectores para el aislamiento y la diferenciación de la familia Enterobacteriaceae. La selectividad del agar Endo, se debe a la combinación del sulfito de sodio (Na2SO3) con la fucsina básica, lo cual ocasiona la supresión parcial de los microorganismos Gram positivos 57. Los coliformes fermentan la lactosa, produciendo colonias color rosa oscuro a rojizo con un brillo metálico verdoso iridiscente y una coloración similar en el medio. Las colonias de microorganismos que no fermentan la lactosa son incoloras o de color rosa pálido en contraste con el fondo rosa claro del medio 58.

Fuente: L. Corrales.
Foto 8 Endo en microplacas deshidratadas para ser utilizado en la técnica de filtración por membrana, para análisis microbiológico del agua. (a la izquierda medio hidratado sin membrana de filtración, derecha medio con crecimiento bacteriano de coliformes totales después de incubación).
Agar Eosina Azul De Metileno (EMB)
Este medio de cultivo tiene como inhibidores los colorantes eosina y azul de metileno; como hidratos de carbono, lactosa y sacarosa y como indicador eosina y azul de metileno. Permite la diferenciación de colonias de organismos fermentadores de lactosa y aquellos que no la fermentan; el contenido de eosina y azul de metileno inhiben el desarrollo de microorganismos Gram positivos. La presencia de sacarosa permite, para algunos miembros del grupo coliforme, fermentarla con más facilidad que la lactosa. Las colonias lactosa positiva presentan un color azul o moradas con brillo metálico o poseen centros oscuros con periferias transparentes incoloras y las que son negativas se observan incoloras o rosa pálido transparentes 59.
Agar Xilosa Lisina Desoxicolato (XLD)
Contiene como inhibidor cloruro de sodio (NaCl), tres hidratos de carbono: xilosa (C5H10O5), sacarosa (C12H22O11) y lactosa (C12H22O11), el indicador es el rojo fenol y la fuente de azufre es el tiosulfato de sodio (Na2S2O3). La xilosa es una aldopentosa, un monosacárido que contiene cinco átomos de carbono y un grupo funcional aldehído (-CHO) que tiene un isómero funcional que es la xilulosa (C5H10O5) 50,60.
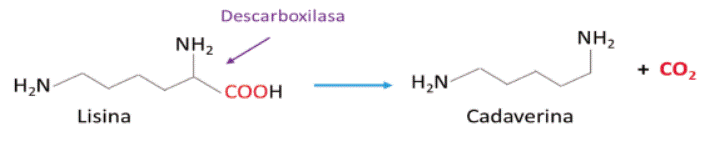
Es un medio selectivo para aislamiento y diferenciación de Enterobacterias enteropatógenas como Salmonella, Shigella y Escherichia. La fermentación de los azucares (xilosa, lactosa y sacarosa) producen cambio de color de rojo a amarillo por el indicador rojo de fenol, debido a la oxidación del grupo carbonilo. El Tiosulfato de sodio (Na2S2O3) y la sal férrica (Citrato férrico) revelan la formación de ácido sulfhídrico (H2S) por la precipitación de sulfuro de férrico (Fe2S3) de color negro presente en las colonias; los microorganismos productores de cadaverina, se evidencian por la formación de un color rojo púrpura alrededor de las colonias dado por el aumento del pH 16.
De otro lado, las proteólisis de las proteínas producen aminoácidos individuales; ciertas bacterias heterotróficas pueden liberar enzimáticamente el azufre de los diversos aminoácidos azufrados, produciendo H2S gaseoso, peptona, cisteína, cistina, metionina y tiosulfato (S2O3 2- ) los cuales son fuente de azufre. Las enzimas responsables de esta actividad son la cisteína desulfhidrasa y la tiosulfato reductasa.
El catabolismo anaerobio de la cisteína produce H2S, ácido pirúvico y amoniaco. El anión tiosulfato S2O3 2- reemplaza al grupo sulfato (SO4=) como aceptor de electrones y es la fuente de azufre del microorganismo, según la siguiente reacción:
El H2S es un gas incoloro, su producción se detecta cuando el gas reacciona con ciertos metales, como plomo (Pb), hierro (Fe) o bismuto (Bi) originando sulfuros 60,61. Por lo anterior, es necesario un segundo indicador, así que se propicia la reacción con una sal fuerte de hierro (citrato de amonio férrico), lo cual produce un precipitado negro insoluble de sulfuro ferroso metálico (FeS).
Agar Hacen Enterico
Este medio contiene como inhibidor sales biliares, como hidratos de carbono lactosa, sacarosa y salicina, posee dos indicadores: azul de bromotimol y fucsina ácida y como fuente de azufre tiosulfato de sodio (Na2S2O3). La salicina es un glucósido 3- alcohólico, conformada por glucosa y alcohol salicílico que están unidos por un puente éter acetálico, la presencia del alcohol ligado al azúcar aumenta la solubilidad debido a la formación de puentes de hidrógeno.
La presencia de los dos indicadores diferencia las colonias de bacterias fermentadoras de las no fermentadoras, las primeras toman un color amarillo-anaranjado y las segundas, azul-verdoso. La presencia de sacarosa evita la selección de patógenos falsamente positivos. Con el tiosulfato de sodio y el amonio férrico se detectan los productores de sulfuro de hidrógeno (H2S) por el precipitado negro en el centro de la colonia. Este es un medio ideal para el aislamiento selectivo de Salmonella, Escherichia y Shigella, a partir de heces y alimentos 16,62.
Agar Cetrimide
Este medio cuenta con tiosulfato citrato como inhibidor y azul de timol y de bromotimol como indicadores; es un medio selectivo y diferencial para aislamiento de Pseudomonas a partir de diversas muestras ya que permite evidenciar la formación de pigmentos. El cetrimide, reactivo está constituido por una mezcla de sales derivadas del Bromo (Br-1), de las cuales la mayor concentración corresponde a Bromuro de hexadeciltrimetilamonio (C19H42BrN) que constituye el componente que inhibe la flora acompañante 63,64.
Las colonias de Pseudomonas aeruginosa forman un pigmento de color verde-azulado llamado piocianina que es fluorescente a la luz UV, Esta reacción se observa gracias a su bioluminiscencia que requiere O2.
Agar Salado Manitol
Se emplea para el aislamiento selectivo y recuento de Staphylococcus aureus en productos alimenticios, productos farmacéuticos y cosméticos; es un medio altamente selectivo por su alta concentración salina; los estafilococos coagulasa positiva hidrolizan el manitol (edulcorante obtenido de la hidrogenación del azúcar manosa) acidificando el medio; las colonias aparecen rodeadas de una zona amarilla brillante, los estafilococos coagulasa negativos, presentan colonias rodeadas de una zona roja o púrpura.
En el medio de cultivo, el extracto de carne y la pluripeptona, constituyen la fuente de carbono, nitrógeno, vitaminas y minerales, el manitol es el hidrato de carbono fermentable, el cloruro de sodio (que se encuentra en alta concentración) es el agente selectivo que inhibe el desarrollo de la flora acompañante, y el rojo fenol es el indicador de pH 65
Las bacterias que crecen en un medio con alta concentración de sal y que además fermentan el manitol, producen ácidos, con lo que se modifica el pH del medio y por lo mismo vira el indicador de pH del color rojo a amarillo. Los estafilococos crecen en altas concentraciones de sal, y pueden o no fermentar el manitol.
Agar Baird-Parker
Medio de alta especificidad diagnóstica, selectivo y diferencial para el aislamiento y recuento de Staphylococcus coagulasa positiva. Es un medio altamente nutritivo que permite el crecimiento selectivo de Staphylococcus ya que el telurito de potasio (K2TeO3) y el cloruro de Litio (LiCl), inhiben el desarrollo de la flora acompañante presente en la muestra. Los Staphylococcus coagulasa positiva reducen el telurito a teluro y así se originan colonias de color negro. Las bacterias que tienen actividad lecitinasa, actúan sobre la yema de huevo produciendo un halo claro alrededor de la colonia 16.
La fosfatidilcolina conocida como lecitina, es un fosfolípido que, junto con las sales biliares, ayuda a la solubilización de los ácidos biliares en la bilis (65). Es el componente más abundante de la fracción fosfatídica que puede extraerse de la yema de huevo. La fosfatidilcolina es uno de los principales constituyentes de las bicapas lipídicas de las membranas celulares. La fosfolipasa D cataliza la hidrólisis de fosfatidilcolina a ácido fosfatídico, liberando la colina, soluble en el citosol, que puede usarse para sintetizar triacilgliceroles y otros lípidos de membrana 66.
Agar TCBS
El extracto de levadura, la peptona de carne y la tripteína aportan nutrientes para el desarrollo de las bacterias, este es el medio selectivo más adecuado para el aislamiento de las especies de Vibrio, e inhibidor para la mayoría de las enterobacterias.
La inhibición está dada por las altas concentraciones de tiosulfato y citrato, la presencia de bilis y el pH que es fuertemente alcalino. La degradación de la sacarosa es variable entre las especies de Vibrio; las colonias son verdes para las cepas que no la utilizan y amarillas para aquellas que producen ácido a partir de este azúcar. Los indicadores de pH son azul de timol y azul de bromotimol, que pasan de color azul al amarillo en medio ácido 50.
Es importante tener en cuenta, que en el medio la proporción de sacarosa está equilibrada de forma tal que no se inhiba el crecimiento bacteriano por exceso de ácido; el NaCl favorece el crecimiento de microorganismos halófilos y halotolerantes e inhibe el desarrollo de los no tolerantes 67. El tiosulfato de sodio (Na2S2O3) aporta azufre y junto con el citrato férrico (C6H5O7Fe) permiten la formación de ion es sulfato (SO4 -2), iones sulfuro (S-2) y la reducción a iones ferroso (Fe+2).
Medio Löwenstein-Jensen
Lõwenstein-Jensen es una base para la preparación de varios medios destinados al aislamiento, cultivo y diferenciación de micobacterias. La mezcla de huevos, constituidos en su clara por la proteína ovoalbúmina y en la yema por vitaminas A, E, D, ácido fólico, B12, B6, B2, B1 y minerales como hierro (Fe), fósforo (P), potasio (K) y magnesio (Mg), que constituyen soporte para el crecimiento de una gran variedad de micobacterias. El verde de malaquita inhibe a gran parte de la flora acompañante 68. Por su parte, el agregado de glicerina estimula el crecimiento de Mycobacterium tuberculosis, pero inhibe el desarrollo de gran parte de M. bovis., si se agrega un 5% de NaCl, se pueden seleccionar micobacterias tolerantes a la sal, como es el caso de M. smegmatis.
Para la siembra se recomienda, en procedimientos de rutina, inocular la muestra previamente descontaminada, sobre la superficie del medio de cultivo. Incubación 35-37°C; a los 7 días de incubación, se observa por primera vez si hubo crecimiento. Luego, se debe observar cada semana, hasta un total de 8 semanas, para establecer las características morfológicas y la presencia o ausencia de pigmento en las colonias 50.
Schaedler Kanamycina-Vancomicina Agar Con 5% Sangre De Cordero
Se utiliza para el aislamiento selectivo de Bacteroides, Prevotella y diversos anaerobios Gram negativos a partir de muestras clínicas. El medio base es el agar Schaedler, un medio altamente nutritivo, desarrollado específicamente para el crecimiento de anaerobios obligados. Cuando se le agrega vitamina K1 y hemina, se constituye en la base para varios medios selectivos, incluidos Schaedler-KV Agar con 5% de sangre de cordero.
La combinación de kanamicina y vancomicina se usa en el aislamiento selectivo de anaerobios Gram negativos; la adición de tres peptonas le proporcionan los nutrientes para el desarrollo bacteriano, y la glucosa es fuente de energía, contiene además un tampón Tris (hidroximetil-aminometano), de fórmula (HOCH2)3CNH2, para evitar la reducción excesiva del pH durante la fermentación de la glucosa. El extracto de levadura es una rica fuente de vitaminas; la hemina y la sangre de carnero suministran hemo o factor X, necesario para el metabolismo respiratorio de una variedad de anaerobios estrictos. Se considera que la vitamina K favorece el crecimiento de una variedad de anaerobios Gram negativos. El cloruro de sodio, proporciona los electrolitos esenciales; la kanamicina inhibe los bacilos anaerobios Gram negativos facultativos y muchas otras bacterias facultativas, mientras que, la vancomicina inhibe las bacterias Gram positivas. La adición de estos agentes antimicrobianos convierte al medio en selectivo para anaerobios Gram negativos estrictos, tales como Bacteroides y Prevotella69,70.
Agar Feniletanol (Agar Alcohol Fenil Etílico)
Es un medio selectivo para el aislamiento de Estafilococos y Estreptococos a partir de diversas muestras con flora mixta. La peptona, el extracto de levadura y el extracto de carne, proporcionan los nutrientes necesarios para el desarrollo de los microorganismos Gram positivos. La presencia del alcohol fenil etílico (feniletanol) inhibe el desarrollo de los microorganismos Gram negativos, ya que evita la síntesis de DNA. La adición de sangre de carnero al 5% no se recomienda para la determinación de reacciones hemolíticas, ya que se pueden presentar reacciones atípicas. También evita el crecimiento en velo de algunas especies de Clostridium como Clostridium septicum, facilitando de este modo su aislamiento. Se aconseja sembrar en este medio las muestras purulentas o cuando sea previsible una infección mixta 71.
Conclusiones
La nutrición bacteriana corresponde a un conjunto de reacciones químicas en las que intervienen la energía y diferentes sustancias en forma de elementos, iones y compuestos; bien sea, en procesos anabólicos o catabólicos.
Los cultivos bacterianos, constituyen uno de los aportes más importantes desde la microbiología en la comprensión y el diagnóstico de los procesos infecciosos; en su composición, se encuentran sustancias orgánicas e inorgánicas que determinan diferentes mecanismos de reacción.
La temperatura, el pH, la actividad del agua y el potencial Redox son propiedades fisicoquímicas que inciden directamente en el crecimiento bacteriano.
La selectividad y la especificidad de los medios de cultivo se explican por las sustancias utilizadas en la preparación de los mismos y por las propiedades fisicoquímicas de los azucares, las proteínas, y los indicadores que revelan el comportamiento bacteriano.
La comprensión de la nutrición y el crecimiento bacteriano implican el conocimiento de reacciones tales como fermentación, oxido-reducción y descarboxilación entre otras.
Los aportes de la metagenómica en la identificación de especies bacterianas se enriquecen con la culturómica y el uso de medios de cultivo específicos en el aislamiento de estas especies.