Introducción
La conjuntivitis es una de las enfermedades oculares más comúnmente consultadas, la cual consiste en la inflamación o infección de la conjuntiva cuyo origen puede ser de tipo infeccioso o no infeccioso 1. La conjuntivitis de tipo bacteriano es causada por estafilococos y estreptococos 2, entre los que se han reportado a S. epidermidis (43-48%), S. aureus (35-28%), Streptococcus pneumoniae (4%) y Corynebacterium sp. (2%), entre otros 3,4
Dentro de los protocolos establecidos para disminuir propagación de la infección, se recomienda el uso de tratamientos tópicos, acompañado de estrategias de educación al paciente sobre técnicas de limpieza 5. Este tipo de tratamientos preliminares, a pesar de tener una alta efectividad en casos no agudos tiene como desventaja el tiempo prolongado del tratamiento, si se compara con el uso de antibióticos comerciales 6,7. Sin embargo, por tratarse de una infección altamente contagiosa, en la práctica clínica si el problema no se ha resuelto en tres días, se opta por la medicación con antibióticos como penicilina, amoxicilina, gentamicina, ciprofloxacina, rifampicina, vancomicina y eritromicina sin un estudio microbiológico previo 8. Esta situación junto a la falta de valoración por un profesional de la salud y la automedicación ha llevado a problemas de resistencia de los microorganismos frente a los antibióticos comerciales 9.
El género Staphylococcus en especial las cepas de S. aureus tienen un amplio rango de resistencia a los antibióticos, considerándoseles como resistentes y multiresistentes, como respuesta a la presión selectiva dada por los tratamientos antimicrobianos 10. Además teniendo en cuenta los efectos adversos generados en el paciente como afectaciones al sistema nervioso central y periférico y complicaciones neurológicas durante el tratamiento con ciertos antibióticos 11, se ha propuesto la búsqueda de nuevas alternativas de tratamiento, donde el uso de las plantas medicinales ha permitido conocer de manera general sus propiedades benéficas para el ser humano 12. Sin embargo, la actividad antimicrobiana en general es reducida si se compara con el efecto directo de los antibióticos; por tal razón, se han postulado nuevas estrategias como las combinaciones entre extractos y antibióticos donde se potencializa la actividad del extracto y se reducen los efectos adversos de los antibióticos 13. Por todo lo anterior, es importante la realización de estudios basados en la evaluación del potencial antimicrobiano de extractos de plantas medicinales y sus mezclas frente a microorganismos asociados con conjuntivitis bacterianas como S. epidermidis y S. aureus
Materiales y métodos
Selección de plantas
Se realizó una búsqueda de las plantas que son utilizadas comúnmente en la medicina tradicional Latinoamericana, para el tratamiento de conjuntivitis o de infecciones oculares. 14,18. Para la selección de especies, se tuvieron en cuenta como criterios combinados a) frecuencia de citación mayor a tres en los documentos seleccionados, b) la no existencia de reportes de actividad antimicrobiana para extractos etanólicos de especies recolectadas en Colombia frente a S. aureus y S. epidermidis. Las plantas que cumplieron con estos criterios fueron adquiridas en las plazas de mercado de Bogotá-Colombia. Con un ejemplar completo de cada especie se realizó la identificación taxonómica a través de las claves del Gentry 19 y con la colaboración del personal científico del herbario del Museo de La Salle (Colombia).
Obtención de extractos
El material vegetal limpió se secó en un horno a 37°C por 3 días. Posteriormente, se procedió a moler aproximadamente 300 g del material y se sometió a maceración con etanol al 96% en una proporción 1:2 (peso-volumen), el solvente se removió por destilación a presión reducida y se determinó el rendimiento de extracción.
Evaluación de susceptibilidad de extractos y de tres antibióticos comerciales
Preparación del inóculo
Se usaron cepas de referencia S. epidermidis ATCC14990 y S. aureus ATCC 25923. El inóculo de cada bacteria se preparó tomando de 3 a 4 colonias de la cepa y se sembró con la técnica de estría en placas con Muller Hinton (MH) solidificado, incubando a 37°C por 24 h. Para cada uno de los ensayos, se partió de un inóculo con una absorbancia de 0,1 utilizando un espectrofotómetro Genesys a una longitud de onda de 600 nm 20.
Difusión en disco
El inóculo se sembró masivamente sobre medio MH solidificado. Posteriormente, sensidiscos de 6mm de diámetro fueron impregnados con 15uL de cada uno de los extractos a una concentración de 30 mg/mL disueltos en DMSO al 10%, y fueron distribuidos en las cajas de Petri 21. Los antibióticos empleados para evaluar la susceptibilidad fueron marca: Becton Dickinson col): Ciprofloxacina (5ug), Oxitetraciclina (30ug), Eritromicina (15ug). Después de 24 h de incubación se tomaron los diámetros de inhibición de crecimiento alrededor de los sensidiscos 22. Este procedimiento se realizó por triplicado y se tuvo en cuenta controles de medio y solvente.
Dilución en tubo
Para determinar la CMI de los extractos y de los dos antibióticos que presentaron mayor halo de inhibición en difusión en disco, se realizaron diluciones seriadas (60 - 1,8 mg/mL en DMSO al 10% para los extractos y 4 - 0,015 mg/mL de solución salina para los antibióticos). Para lo cual, se incubó por 24 h 500 µL de cada uno de los tratamientos con 500uL de inóculo en caldo MH. Posteriormente se agregó 50 µL de resarzurina a 2 mg/mL y después de 2 horas se realizó la lectura de susceptibilidad e inhibición. Todos los tratamientos se realizaron por triplicado y se emplearon controles del crecimiento bacteriano, medio y solvente (DMSO 10% y solución salina).
Evaluación de la interacción entre combinaciones
Para la evaluación se empleó la técnica del tablero para el extracto y el antibiótico con la menor CMI y 23. Para lo cual se realizó previamente la preparación de 36 mezclas en una microplaca, cuyas concentraciones tanto del extracto como del antibiótico varió desde el doble de la CMI a cuatro diluciones por debajo de esta cantidad. Así mismo se evaluó cada uno de los tratamientos por separado. Posteriormente, en cada uno de los pozos se adicionó 100 µL del inóculo en caldo MH y se incubó por 24 h a 37°C. Posteriormente, se usó 20 µL de una solución de resazurina a 2 mg/mL y se incubó por 24 h más. Adicionalmente, para corroborar los resultados, se realizó el método de García 24, en el cual 2 µL de cada uno de los tratamientos se incubó durante 24 h para determinar el crecimiento o no de colonias bacterianas. La interpretación de los resultados se realizó mediante isobologramas y el cálculo del índice de concentración fraccionaria inhibitoria (ΣCFI) 23.
Resultados
La Tabla 1 presenta los rendimientos de extracción para la obtención de los extractos, se observa un alto porcentaje en belladona seguido del extracto de caléndula.
Tabla 1 Porcentaje de rendimiento de extracción para las plantas seleccionadas.

Fuente. Elaboración propia.
En la actividad antimicrobiana evaluada por difusión en disco se encontró que los mayores halos de inhibición fueron para el extracto de hojas de achiote frente a S. aureus y los de frutos y hojas de achiote para S. epidermidis (Tabla 2). En cuanto a las CMIs de los extractos, la mayoría mostraron una acción inhibitoria a 30 mg/mL; sin embargo, se resalta que la CMI del extracto de hojas de achiote fue de 15 mg/mL para ambas cepas bacterianas. El extracto de romerillo no presentó actividad antimicrobiana frente a ninguna de las dos cepas evaluadas. Los resultados de los antibiogramas permitieron determinar que todos antibióticos presentaron efecto inhibitorio frente a S. aureus y S. epidermidis, siendo la ciprofloxacina el de mayor efectividad. Las CMIs de los antibióticos muestran valores más bajos frente a S. aureus que para S. epidermidis.
Tabla 2 Resultados de inhibición de los extractos y antibióticos frente a S. aureus y S. epidermidis.
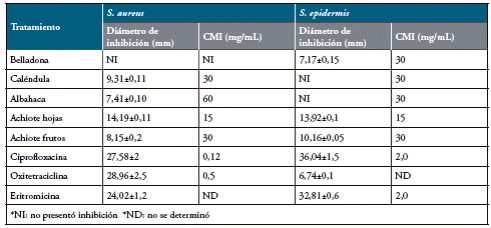
Fuente. Elaboración propia.
Evaluación del efecto sinérgico
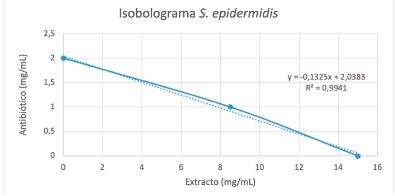
El diseño experimental permitió determinar que la mezcla ciprofloxacina y el extracto de hojas de achiote presentó un valor de CFI 0,83 frente a S. aureus correspondiente a un efecto de sinergismo parcial o bajo y un CFI de 1,24 frente a S. epidermidis cuyo efecto es aditivo. Esto fue corroborado mediante la elaboración de los isobologramas que se presentan en la figura 1 y 2, en los cuales se observa gráficamente el efecto sinérgico frente a S. aureus, mediante una línea cóncava que conecta los ejes X y Y, y un efecto indiferente para S. epidermidis representado por una línea casi recta.
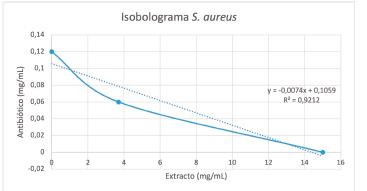
Figura 1 Isobolograma para la mezcla de ciprofloxacina con extracto de hojas de achiote frente a S. aureus.
Discusión
Este estudio parte de la revisión de 54 plantas empleadas la medicina tradicional empleadas en el tratamiento de infecciones oculares y que permitió la selección de cinco de ellas (caléndula, albahaca, achiote, sauco y llantén). Los porcentajes de rendimientos para la obtención de los extractos etanólicos en general fue entre 7,6 y 34,3%, los cuales están acordes con lo reportado por otros autores. Por ejemplo, para C. officinalis los resultados de este estudio son superiores a los reportados previamente de 19,8 25 y 19,5% 26 y cuyas diferencias pueden estar relacionadas con la época de recolección, ya que los cambios estacionales y las condiciones del suelo generan en la planta un estrés oxidativo que produce cambios en la producción de los metabolitos 27. Para albahaca, achiote, sauco y llantén no se ha realizado extracciones con etanol o es el primer reporte de estudios fitoquímicos, por lo que no pueden ser comparados al no emplear el mismo solvente.
Los resultados de actividad antimicrobiana permitieron establecer que los extractos con mayor potencial inhibitorio frente a las dos cepas seleccionadas fueron el extracto de hojas de achiote (13mm para S. aureus y 16,6mm frente a S. epidermidis), seguido por el del fruto de achiote (9,6mm frente a S. epidermidis), a 30 mg/mL como la máxima concentración evaluada, con el fin de evitar que su actividad no estuviera asociada a su toxicidad 28. Así mismo, se obtuvieron como CMIs de 30 mg/mL para casi todos los extractos, a excepción del extracto hojas de achiote con 15 mg/mL para las dos cepas bacterianas.
C. officinalis es la especie que presenta el mayor número de reportes de evaluación de actividad antimicrobiana frente a cepas del género Staphylococcus, variando los resultados de un estudio a otro. Para esta especie, se han reportado resultados previos de halos de inhibición de 28 mm 25 y 18 mm 29,30, para los extractos etanólico y metanólico respectivamente. Sin embargo, también hay reportes en los cuales esta especie no ha presentado actividad antimicrobiana frente a S. aureus26,31. La diferencia en los resultados, posiblemente se debe a la cantidad de extracto que fue utilizada para impregnar los discos, por el solvente de extracción, así como el lugar de procedencia del material vegetal 32. Las CMIs concuerda con el obtenido por Roopashree y colaboradores 26, que reporta un valor de CMI de 32mg/mL, siendo cercano al obtenido en esta investigación.
Para la especie O. basilicum sólo existe un reporte CMI, el valor fue superior a lo reportado previamente para el etanólico (CMI: 4mg/mL) 33. En el caso de B. orellana se reporta una inhibición parcial del extracto de etanol/diclorometano frente a la cepa S. aureus34. Adicionalmente, hay dos reportes, que coinciden entre ellos y en los cuales la CMI es de 1,28 mg/mL 33, pero inferiores con lo reportado en este estudio, lo que puede estar relacionado con el solvente de extracción utilizado (metanol), un solvente más polar que el empleado en el presente estudio. Para el extracto de A. belladona existe un reporte cuyo valor de halo de inhibición fue de 1,2mm frente a S. aureus35, resultado tan bajo que permitiría confirmar que esta especie no posee actividad frente a S. aureus, como se determinó en este estudio. Finalmente, para la especie D. rosmarinifolium no hay reportes de estudios de actividad antimicrobiana frente a las dos bacterias empleadas.
Se conoce ampliamente el potencial antimicrobiano frente a bacterias Gram positivas y Gram negativas 33 de especies de la familia Asteraceae, a la cual pertenece C. officinalis siendo consistente con los resultados previos reportados para otras especies como Artemisia absinthium36 y Baccharis dracunculifolia37, que han mostrado inhibición principalmente frente a S. aureus. El potencial de las especies de esta familia, ha sido asociado a la presencia de flavonoi-des, aceites volátiles y compuestos poliacetilénicos, diterpenos y acidos fenólicos 38. Aunque ya se ha reportado el aislamiento de algunos compuestos para C. officinalis26,30, O. Basilicum39,40 y B. orellana41, a ninguno en particular se ha atribuido los efectos antimicrobianos por lo que es importante continuar con la realización de estudios biodirigidos que permitan identificar cuáles son moléculas responsables de la actividad que presentaron las especies objeto de este estudio.
Los antibióticos seleccionados como controles para este estudio, mostraron sensibilidad frente a las cepas S. aureus y S. epidermidis de acuerdo a los patrones establecidas por CLSI (Clinical Laboratory Standard Institute) 42 y EUCAST (European Committee on Antimicrobial Susceptibility Testing) 43, y frente a la misma cepa de referencia S. aureus 25923, donde se reporta para la ciprofloxacina un halo de inhibición 32mm 44 acorde al obtenido con el de la presente investigación y uno de 42mm 25, que aunque es superior, esta diferencia puede estar relacionada con la cantidad del antibiótico en el sensidisco (4500µg). En cuanto a las CMIs para estos antibióticos frente a S. epidermidis se han reportado valores para la ciprofloxacina y la eritromicina de 0,25 mg/mL 45, y para el primer antibiótico otro reporte de 0,125 mg/mL 46. Para S. aureus, se reportan valores de CMI para la ciprofloxacina de 1,2 mg/mL 47, 0,024 mg/mL 48 y 0,5 µg/ mL 49, siendo el resultado obtenido en el presente estudio un valor intermedio a los estudios previos, y cuyas diferencias pueden ser explicadas debido a la concentración del inóculo empleados en los ensayos, a la marca del antibiótico empleado o incluso al tipo de procedencia de la cepa de referencia 50.
A pesar del potencial antibacteriano que presentan las plantas medicinales frente a algunas cepas bacterianas, estas no son frecuentemente utilizadas, debido a las altas concentraciones necesarias para la inhibición de los microorganismos, la susceptibilidad a la degradación y las reacciones adversas que pueden aparecer si se emplean en dosis inadecuadas o por períodos prolongados 51. Sin embargo, el uso de mezclas de extractos con antibióticos, ofrece como ventajas la conservación del efecto del antibiótico, pero a su vez la disminución de los efectos secundarios, costos y de los casos de resistencia que se presentan frente a los medicamentos comerciales. A partir de la evaluación de la mezcla de ciprofloxacina con extracto de hojas de achiote, se encontró un efecto de sinergismo parcial frente a S. aureus y un efecto aditivo frente a S. epidermidis, siendo este estudio el primer reporte del uso de esta mezcla en evaluaciones del tipo de interacciones que se presentan. Sin embargo, este tipo de estrategias también han sido evaluadas previamente para mezclas de otros extractos con ciprofloxacina, tales es el caso de Platycarpha glomerata que también presenta dos efectos diferentes, un efecto antagónico para el extracto de hojas frente a S. aureus 25925 (CFIs 2,5) y un efecto sinérgico al emplear el extracto de rizoma (CFIs 0,1) 44. Para la mezcla de Ansellia africana con este mismo antibiótico se obtuvo un efecto antagónico (CFI de 1,5) frente a S. aureus 14468.
Para otros antibióticos se ha establecido un efecto sinérgico al combinar el extracto etanólico de romero con cefuroxima frente a una cepa meticilino-resistente de S. aureus. (CFI de 0,62) 52, o el demostrado por ampicilina y Cuspidaria convoluta con valores de CFI entre 0.125 y 0.5 frente a una cepa de S. aureus y una multi-resistente 53. Sin embargo, también es posible encontrar efecto antagonista, como lo reportado para la mezcla entre vancomicina y el extracto de Boesenbergia rotunda para S. aureus 20651 cuya CFI fue de 1,02; mientras que se presentó un efecto aditivo frente a las cepas S. aureus 20652, S. aureus 29213 y S. epidermidis 14932, con un valor de CFI de 1 54.
Conclusión
La mayoría de los extractos mostraron actividad frente a S. aureus a excepción de Belladona. Por el contrario, para S. epidermidis el número de extractos con actividad fue menor, solo belladona y achiote mostraron inhibición. Finalmente, la mezcla de ciprofloxacina con extracto de hojas de achiote frente a S. aureus mostró un efecto de sinergismo parcial, mientras que la misma mezcla presento un efecto aditivo para S. epidermidis. En este sentido, el uso de los extractos de plantas como achiote podrían hacer parte de terapias alternativas para el tratamiento de infecciones oculares causadas por estas bacterias. Igualmente, la aplicación de evaluaciones sinérgicas entre sustancias es una alternativa que puede ser positiva de acuerdo a la interacción entre los tratamientos utilizados.