Introducción
El uso del receptor quimérico de antígeno (CAR por sus siglas en inglés) en células T, ha proporcionado al área de la inmunología un nuevo enfoque en el tratamiento contra el cáncer. Esto a partir de células T modificadas que son capaces de reconocer el antígeno CD-19 de las células B en linfomas malignos, o en neutralizar directamente otra célula cancerígena mediante otros estímulos 1,2. El uso de las células CAR-T ha obtenido exitosos resultados, sin embargo, los efectos negativos también son igual de importantes de destacar, siendo probablemente las células CAR-T más perjudiciales que beneficiosas. Esto es debido a capacidad de ocasionar el síndrome neurológico de efecto inmune asociado a células (ICANS, por sus siglas en inglés) y el síndrome del lanzamiento de citocinas o "tormenta de citocinas" (SLC) 1,2. La importancia inmunológica de las células CAR-NK (CAR-Natural Killer) radica en los beneficios de su uso terapéutico en el cáncer, debido a las ventajas sobre otros tipos de células CAR, como las células CAR-T. Las células CAR-NK retienen su habilidad citotóxica innata además de poder detectar células tumorales MHC-negativas (Complejo Principal de Histocompatibilidad negativas), contrario a las células CAR-T dependientes en mayor grado de la expresión de antígenos tumorales mediante el MHC 3. Por lo tanto, una desregulación en la expresión del MHC por parte de las células tumorales reducirá significativamente la eficacia de las CAR-T 4. Entre las capacidades de las células CAR-NK se encuentra que estas pueden atacar de manera espontánea a las células, ya que las células CAR-NK, además de producir citocinas, pueden producir INF-y (Interferón gamma), IL-3 (Interleucina 3) y factores de estimulación para poblaciones de granulocitos y macrófagos 5. Por último, las células CAR-NK pueden atacar y eliminar varias células blanco sin perder sus efectos, llegando a reducir posiblemente el número de células NK necesarias en este tipo de terapias 5,6. Habiéndose mencionado los beneficios de las células CAR-NK, el presente ensayo busca proporcionar información más a fondo de las características del receptor CAR, de las células CAR-NK y mostrar puntos clave de su uso en el campo de la inmunovigilancia oncológica.
Receptor CAR y sus características
El receptor quimérico de antígeno o chimeric antigen receptor (CAR) son un conjunto de receptores de antígeno en los cuales, una sola molécula puede redireccionar las funciones y especificidad de las células inmunes como lo son las células T o las células NK 4. El enfoque principal al que se ha dirigido el uso del receptor CAR es para la terapia contra el cáncer, generando en las células cancerígenas un blanco para su posterior ataque de células inmunes que expresan dicho receptor, modificando sus herramientas cinéticas y de inmunización activa. Una vez expresado el receptor CAR, las células inmunes adquieren funciones suprafisiológicas y actúan como una "droga viviente" que puede ejecutar efectos inmediatos o a largo plazo en la terapia 5,6.
El funcionamiento del receptor CAR en las células inmunes innatas (células NK) y en las células inmunes adaptativas (células T) requiere un control en la transducción para la correcta expresión del receptor y una capacidad de expansión clonal de la célula modificada para que la progenie de dicha célula pueda ejecutar las mismas funciones. La transducción se puede lograr mediante múltiples procedimientos, sin embargo, se necesita una transferencia genética estable para que las células modificadas puedan clonar y expresar el receptor CAR de una manera adecuada 3,5.
Contrario a los receptores que comúnmente podemos encontrar en las células inmunes los cuales solo pueden unirse a un ligando específico expresado en la célula blanco, las células CAR pueden unirse a una variedad de ligandos blanco, dándoles una capacidad quimérica. Por ejemplo, el receptor TCR de las células T (T-Cell Receptor) solo es capaz de unirse a péptidos que hayan sido expresados gracias a la molécula HLA del Complejo Principal de Histocompatibilidad en la membrana celular, lo que limita la actividad del receptor TCR a un espectro en el holotipo de cada paciente 5. No obstante, si observamos una célula CAR-T, esta será capaz de anclarse a moléculas que no necesariamente hayan sido procesadas por HLA y, además, no depende tanto de la cantidad de expresión de moléculas de HLA como lo hace el receptor TCR, ya que las CAR-T son capaces de reconocer una célula tumoral, aunque tenga una baja expresión de moléculas de HLA, lo cual es una forma conocida de evasión inmunológica por parte de las células cancerígenas 1,3.
La construcción de un receptor CAR tiene cuatro componentes indispensables, que a lo largo del tiempo han sido modificados. El primero es una cadena simple de fragmento variable (scFv) derivada de anticuerpos, le sigue una bisagra, un dominio transmembranal (TM) y finalmente, uno o varios dominios de señalización intracelular (Figura 1) 4,5.
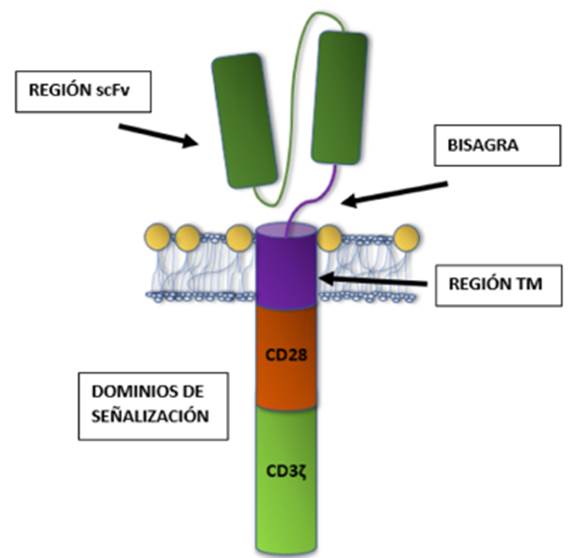
Fuente: Elaboración propia.
Figura 1 Componentes de un receptor CAR. Cada uno de los componentes ha sido estudiado y optimizado a lo largo del tiempo para maximizar la detección de tumores, la activación de la célula inmune y la eliminación cancerígena. La región scFv que le confiere al receptor CAR su especificidad consta de una cadena variable pesada (VH) y una ligera (VL) unidos con una liga flexible. El tamaño y el orden de las cadenas variables, junto con la distancia que los separa afecta la afinidad de la unión al antígeno. La bisagra es importante para la sinapsis inmunológica, una bisagra larga proporciona más flexibilidad para alcanzar antígenos cercanos a la membrana diana, mientras que una corta es suficiente para antígenos un poco más distales. El dominio transmembranal (TM) consiste en una alfa-hélice hidrofóbica la cual ancla el constructo a la célula. La optimización de las células CAR se enfoca un poco más en la modificación del último de los componentes del receptor CAR, los dominios de señalización intracelulares.
Los métodos utilizados para la unión del receptor CAR con el antígeno se engloban en 3 categorías principales: 1) La unión a través de la cadena scFv derivada de un anticuerpo; 2) Unión con fragmentos de la región Fab; y 3) La unión de ligandos hermanos. Las cadenas svFv derivadas de inmunoglobulinas de murinos son frecuentemente utilizadas, pero necesitan ser más específicas para cada paciente como lo son las regiones Fabs de la Ig humana ya que pueden ser reconocidas por el sistema inmune como extrañas 6.
Las secuencias de eventos en la unión del receptor con el antígeno aún no son del todo claras. Se piensa que la posición del epítopo y la distancia hacia la superficie de la célula afecta la unión con el antígeno. Observaciones empíricas indican que la región "espaciada" entre la cadena scFv y la membrana celular afectan la especificidad del receptor CAR. También es probable que la longitud del receptor CAR y la protrusión de la membrana del linfocito, también afecten la eficacia del receptor, sin embargo la evidencia que sustente estas ideas aún es poca 6,7.
Historia detrás del receptor quimérico de antígeno (CAR)
En 1986, Steven Rosenberg aprovechó el potencial del uso de células T en terapias con pacientes que presentaban melanomas, iniciando un nuevo capítulo en la historia del tratamiento contra el cáncer. Mientras que el proceso de aprovechamiento de la técnica de infiltración tumoral de linfocitos (TIL) tiene bastantes complicaciones, el uso de la ingeniería en los receptores de células T (TCR) confiere una especificidad entre el tipo de cáncer, lo que se denominan receptores CAR 5. Aunque anteriormente las terapias con receptores CAR eran específicas para cada paciente debido a la unión con HLA, la adición de dominios estimulatorios ha permitido la mejora en el potencial del receptor CAR, dando el salto hacia receptores CAR de segunda, tercera y cuarta generación, estos últimos son los que especialmente han sido modificados para ser más funcionales, aumentando la capacidad citotóxica y proliferativa de las células inmunes 4,5.
Otro nombre por el cual son conocidos algunos de los receptores CAR de cuarta generación son "armored CARs" o TRUCKS (T cells redirected for Universal Cytokine Killing), los cuales están mejorados para acentuar las capacidades antitumorales, la proliferación y persistencia de las células CAR-T, este constructo novedoso está diseñado para atacar tumores sólidos mediante una "carga útil" que facilita la proliferación y persistencia de la células CAR-T y modula el microambiente tumoral, expresando también otro producto, la IL-12, que facilita la liberación de la carga útil (Tabla 1) 8. Sin embargo, estas células CAR y demás de la cuarta generación por lo regular, generan toxicidad no anticipada debido a su excesiva capacidad citotóxica 9,10.
Tabla 1 Cambios generacionales en el receptor CAR y sus características: Las modificaciones realizadas en los receptores CAR hace que se dividan en 4 generaciones, cada una con características únicas. Démonos cuenta de que esto conduce al afán de continuar la investigación de este recurso novedoso y funcional.

Fuente: Elaboración propia.
La evolución de la construcción de receptores CAR se ha centrado principalmente en optimizar los dominios de señalización intracelular. Los receptores CAR de primera generación en células T contenían únicamente los dominios de activación CD3Z, mientras que los receptores de segunda y tercera generación cuentan con uno y dos dominios coestimuladores respectivamente. Los más utilizados a la fecha son los del dominio de la familia CD28 (observado en la Figura 1) como los de la familia del receptor TNF (4-1BB, OX40 y CD27) 11,12,13,14. La elección de estos dominios coestimuladores permite un ajuste más fino de la respuesta deseada de las células inmunes, por ejemplo, las CAR T con dominio CD28 exhiben una capacidad citolítica aumentada (ver Figura 2) y 4.
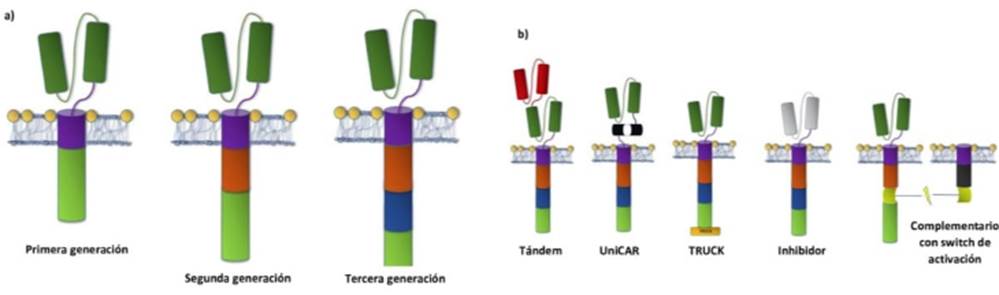
Fuente: Elaboración propia
Figura 2 a) Receptores CAR de primera, segunda y tercera. b) receptores de cuarta generación. La modificación de todas las regiones apunta a receptores CAR de cuarta generación más eficientes. Por ejemplo, el receptor tándem está diseñado para unirse a dos diferentes blancos, el cual está unido a un único dominio TM. El receptor UniCAR, está especializado en unirse distintos tipos de blancos tumorales, realizándose en él una breve modificación genética previa a la administración de la terapia de acuerdo con el cáncer del paciente, este tipo de receptor ya ha sido utilizado en células CAR-NK. El receptor TRUCK recibe el nombre debido a que posee una carga útil que facilita la eficacia de la célula CAR en general. De manera similar, el receptor inhibidor se enfoca en pasar de un estado inhibidor a uno activador a distintos blancos de los puntos de control inmunológico, como PD-1 o CTLA-4. Finalmente, el receptor con switch de activación efectúa su actividad únicamente cuando ha sido estimulado con algún medicamento.
Los tratamientos clínicos exitosos son los de las células CAR-T de segunda generación denominada CD19-targeted CAR-T resultaron en la aprobación de la FDA de los Estados Unidos (Food and Drug Administration) de dos productos denominados Kymriah® (Novartis) y Yescarta® (Kite/Gilead) respectivamente. Desafortunadamente, las desventajas del uso de células CAR-T superaban las ventajas que proporcionaban, entre los que se encuentran su tiempo y su costo de manufactura y su toxicidad severa que puede desencadenar neurotoxicidad con el síndrome neurológico de efecto inmune asociado a células (ICANS) y toxicidad en el organismo en general por el síndrome de lanzamiento de citocinas (CRS), donde se observan grandes niveles de citocinas como IL-6, INF-Y y el factor estimulante de colonias de monocitos-macrófagos (GM-CSF). Por lo regular, la toxicidad generada por las células CAR-T usualmente requiere que los pacientes sean hospitalizados por tres semanas (Tabla 2) 15,16,17.
Tabla 2 Efectos adversos en la salud y bienestar de los pacientes bajo las terapias de CAR-T. Estos efectos adversos conducen a la utilización de alternativas terapéuticas más rentables y seguras. Un claro ejemplo es la utilización de terapias con células CAR-NK.

Fuente: Elaboración propia.
Una estrategia alternativa para mitigar los efectos negativos en la terapia basada en células CAR-T es la utilización de células Natural Killer 3,4.
Receptor car en células NK (CAR-NK)
Las células NK son especialistas del sistema inmunológico innato y grandes protagonistas en la defensa contra infecciones virales y cáncer. La citotoxicidad natural de las células NK puede desencadenarse rápidamente con una estimulación adecuada y está regulada por un importante equilibrio de señales provenientes de receptores activadores e inhibidores de la superficie celular codificados en la línea germinal 1,4
A pesar de que las células cancerígenas son capaces de disminuir la expresión del complejo mayor de histocompatibilidad (MHC-I) haciéndolas invisibles para las células T, las células NK si pueden reconocer la falta de estas moléculas y actuar bajo una estimulación missing-self 2. La expresión disminuida de las moléculas HLA del MHC junto con la expresión de otros receptores activadores como Nkp30, Nkp44 y NKG2D sensibiliza a las células cancerígenas para ser un blanco más fácil de las células NK 3,4.
Cómo se mencionó con anterioridad, los receptores CAR de cuarta generación conducen a que la célula tenga actividades citotóxicas excesivas no deseadas. Una de las mejoras que se incluyen en las CAR-T es un switch de suicidio. No obstante, debido a la corta vida y seguridad de las CAR-NK, es probable que este tipo de switch no sea necesario en las CAR-NK, aunque sí ha sido utilizado. Estudios preclínicos demuestran gran eficiencia de células CAR-NK que pueden sacrificarse mediante la inducción de la Caspasa 9 (iCas9) mediante la inducción dimerativa química (CID) 11
En la mayoría de los casos donde se emplea una terapia con el receptor CAR en células NK se ha utilizado el subtipo NK-92, aunque también han sido utilizadas en menor medida células NK provenientes de a) Sangre cordal, de b) Sangre periférica y c) Células NK inducidas de células tallo pluri-potenciales o iPSC (ver Tabla 3) 4,5.
Tabla 3 Tipos de células NK empleadas en las terapia con células CAR-NK y sus características generales: La ingeniería genética apunta a superar la resistencia y problemas que presentan cada uno de los fenotipos de células NK y así, convertirlas en células mejor preparadas en las terapias con receptores CAR de acuerdo con las necesidades que se presenten para cada paciente.
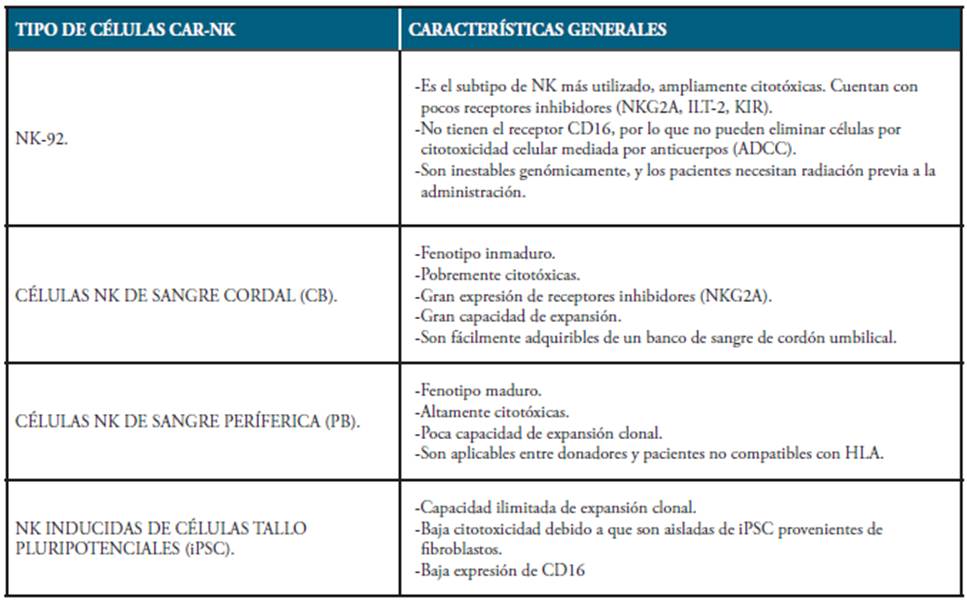
Fuente: Elaboración propia.
Las células NK-92 son muy parecidas fenotípicamente a sus hermanas NK CD56Bright, aunque a diferencia de estas, tienen un nivel de citotoxicidad bastante alto ya que cuentan con receptores estimuladores como lo son NKp30, NKp46 y NKG2D, y muy pocos receptores inhibidores como ILT-2, NKG2A y miembros de la familia KIR. Además, las células NK-92 carecen del receptor CD16, haciendo imposible la eliminación tumoral mediante la citotoxicidad celular dependiente de anticuerpos (ADCC), por lo que la ingeniería de las células CAR apunta a la expresión de este receptor, que junto con inducción de INF-y, la células NK-92 puedan ejercer una mejor eliminación de células tumorales 18. Desafortunadamente, las células NK-92 son positivas para el virus de Epstein-Barr, además de que son líneas celulares derivadas de linfomas, por lo que cargan con una gran inestabilidad genética que las hace un poco eficientes tras su aplicación, de hecho, es necesario aplicar radicación a los pacientes previo a la administración de las células CAR NK-92. Recientemente, las células CAR NK-92 han sido armadas con un receptor de cuarta generación que originalmente iba dirigido a las células CAR-T llamado UniCAR, este receptor puede ser modificado para ser específico en el ataque de cada tipo de tumor 3,19.
La sangre cordal tiene una gran cantidad de células NK (NK-CB), aunque son bastante malas en cuanto a su actividad citotóxica. La mayoría son del tipo CD56Bright, por lo que cuentan con fenotipo más inmaduro con una reducción en la expresión de receptores activadores, además, no cuentan con el receptor CD16 y sumado a esto, cuentan con elevada expresión del receptor inhibidor NKG2A que al unirse al ligando HLA-E sobreexpresado en las células tumorales, hace que la células NK-CB pierdan mucha eficacia 20. Pese a todas estas malas características, las células NK-CB representan el 15 al 30% de la población de linfocitos de la sangre cordal, además, los bancos de sangre proveniente del cordón umbilical hacen que este tipo de célula sea fácil y barata de adquirir. Las células NK-CB son muy sensibles a la estimulación con citocinas, y uno de los rasgos más importantes es que cuentan con una gran capacidad proliferativa que se desempeña mejor bajo la estimulación de ciertas citocinas como IL-2 o IL-15. La ingeniería con receptores CAR se dirige a la eliminación o reducción en la expresión del receptor NKG2A de este tipo de célula 3,10,21.
Las células NK provenientes de la sangre periférica son en 90% del tipo CD56Dim, teniendo una gran capacidad citotóxica y un fenotipo más maduro en comparación con las células NK-CB, aunque estas carecen de una buena habilidad proliferativa 22. Las células NK de sangre periférica que son utilizadas para la ingeniería con el receptor CAR, pueden ser del tipo "HLA-no coincidente" por lo que aumenta considerablemente el número de donadores de los que se pueden extraer. Este tipo de células NK están siendo utilizadas actualmente para tratar leucemia mieloide aguda, aunque el pronóstico es difícil de predecir 4.
Del último tipo de células NK que son candidatas para el receptor CAR, encontramos a las células NK inducidas de células tallo pluripotenciales. El hecho que sean derivadas de células tallo, le confiere a la célula NK, en teoría, la habilidad ilimitada de clonarse por sí sola. No obstante, el fenotipo obtenido es inmaduro, presentando también una baja expresión del receptor CD16 y una alta expresión del receptor NKG2A, esto se debe a que las células iPSC se obtienen a su vez de células que no son del linaje hematológico, como fibroblastos 23,24. La célula CAR-NK FT596 que expresa un constructo CD16 y un receptor para IL-15 está lista para ser probada en terapias experimentales junto anticuerpos monoclonales CD20, esto gracias a que algunas pruebas de linfomas CD19+ en 25.
Estudios con CAR-NK han sido efectuados contra linfomas de células B mediante células NK de una transfusión de sangre cordal. Estas fueron sometidas a la transducción con un vector retroviral para sintetizar una cadena scFV contra el antígeno CD19 y un switch de suicidio iCas9. Esta terapia mostró grandes resultados, especialmente cuando las células CAR-NK fueron estimuladas con IL-15 para su proliferación 4. Cabe destacar que una de las desventajas observadas en esta terapia con CAR-NK, es la carencia en la proliferación de estas a causa de una falta de estimulación proveniente de citocinas como IL-2 o IL-15, tal como se mencionó anteriormente 1,11
El combate de tumores sólidos con células CAR-NK resulta más complicado si lo comparamos con la eliminación de linfomas de linfomas. Las estrategias de escape tumoral engloban la secreción de citocinas inhibitorias, cómo el factor de crecimiento transformante beta (TGF3), la desregulación de ligandos en las células tumorales y la influencia del microambiente tumoral (TME). A pesar de estos mecanismos de evasión inmunológica, a la fecha se ha efectuado el uso de CAR-NK con el receptor HER-2 para cáncer de ovario 26, el receptor para el antígeno específico de membrana prostática en cáncer de próstata, y el receptor NKG2D para múltiples tumores sólidos. De manera similar, células CAR-NK estimuladas con EGFR (Epidermal growth factor receptor) mostraron resultados favorables en glioblastoma en modelos de ratones, 27.
Desde un principio, con la creación de receptores CAR de primera generación se mencionó la idea de que los receptores CAR serían funcionales en células NK. Hoy en día, las terapias con células CAR-NK están todavía en pleno desarrollo 28. Se identificaron alrededor del mundo 520 casos activos de terapias con células CAR, con un total de 64 células diferentes, no obstante, el 96.4% eran células CAR-T. Esto es debido principalmente a la complejidad de asimilar, activar, expandir y modificar las células NK 29,30.
Entre las herramientas utilizadas en favor de la mejora en los problemas presentados de la utilización de células CAR-NK, encontramos el uso de transducción viral, la utilización en desuso de la electroporación y el empleo de transposones con el fin de mitigar la resistencia que tienen las células NK a ser modificadas genéticamente. El Polybrene, junto con Retronectin, ambos polímeros sintéticos, están siendo utilizados con el fin de facilitar la entrada del virus a la célula 31,32. Un punto muy interesante es que los estudios realizados en la evaluación del nivel de expresión del receptor CAR en células NK que fueron sometidas a la ingeniería genética mediante electroporación, es que las células sólo retenían el receptor por 3 o 5 días, por lo que la electroporación está siendo descartada para modificar a las células NK 33,34. Finalmente el uso de transposones o genes saltarines es una herramienta muy prometedora por la habilidad de estos en insertar material genético estable en el DNA de las células blanco. Entre los transposones utilizados recientemente en CAR-NK encontramos a piggyBac y a sleeping beauty (SB) 35,36.
Conclusiones
De manera general, hemos dilucidado las características y estructura de los receptores CAR, donde pudimos observar la importancia que tiene cada uno de los componentes que contiene, y cómo estos han ido evolucionando a lo largo del tiempo dando paso a generaciones del receptor CAR más avanzadas y eficientes.
También, nos damos cuenta de los múltiples obstáculos que aún hoy en día dificultan el avance de las terapias con células CAR-NK y CAR-T, los cuales están en camino a ser superados con el fin de iniciar nuevas fases en varios ensayos clínicos.
Con todas las ventajas que presenta el uso de células CAR-NK sobre las células CAR-T, observamos que la innovación presente en esta herramienta promueve el ímpetu de la búsqueda de nuevas estrategias y tecnología para el combate contra el cáncer.















