Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.6 no.1 Caldas Jan./June 2009
Artículo original
Efecto de la osmolaridad, sobre el diámetro y la calidad de oocitos bovinos madurados in vitro*
Osmolarity effect on the diameter and the quality of in vitro matured bovine oocytes
Efeito da osmolaridad, sobre o diâmetro e a qualidade de oocitos bovinos madurados in vitro.
Yasser Yohan Lenis Sanin**, Luis Fernando Restrepo Betancur***,
Martha Olivera Angel****, Ariel Marcel Tarazona Morales*****
* Artículo derivado de la investigación del mismo nombre, realizada entre marzo y junio de 2008 y financiada por el laboratorio Singamia, Universidad de Antioquia.
** Médico Veterinario Zootecnista, Especialista en Reproducción Bovina Tropical y Transferencia de Embriones, MSc(c) Ciencias Animales. Universidad de Antioquia, Facultad de Ciencias Agrarias, Grupo Reproducción, Fisiología y Biotecnología Animal. Correo electrónico: yaserudea@gmail.com.
*** Estadístico, Especialista en biomatemáticas y estadística, Grupo GRICA, Facultad de Ciencias Agrarias Universidad de Antioquia.
**** Médico Veterinario, Dr. Sci. Agr. Universidad de Antioquia, Facultad de Ciencias Agrarias, Grupo Reproducción, Fisiología y Biotecnología Animal.
***** Zootecnista, MSc en Ciencias Básicas Biomédicas. DPA/FCA/BIOGEM Universidad Nacional de Colombia, Sede Medellín.
Resumen
Los oocitos son susceptibles a cambios osmolares, presentando fenómenos que afectan la membrana plasmática. Objetivo. Evaluar el efecto de la hipo y la hiperosmolaridad del medio de cultivo sobre el diámetro y la calidad de oocitos madurados in vitro. Materiales y métodos. Se utilizaron 75 oocitos de excelente y buena calidad, como medio de control se empleó el M 199 suplementado con suero fetal bovino, 10%, hormona folículo estimulante (30 μg ) y hormona luteinizante (30 μg), piruvato, cuya osmolaridad es 290 mOsm/l (T2). Los oocitos fueron sometidos a dos concentraciones osmolares: medio hiperosmótico 497mOsm/L (T1), y medio hiposmótico 150mOsm/L (T3), se midió el diámetro y calidad a las 0 y 24 horas. Resultados. El diámetro de los oocitos a las 24 horas fue mayor en el T3 (148,7±9.7) y menor en el T1 (134,6±1.2) con respecto al control (147.9±11.5) (p<0.05.). No se encontró diferencia entre el porcentaje de oocitos de excelente y buena calidad a las 24 horas del tratamiento T1 respecto al control (56% y 60%) (p>0.05.), pero la calidad en el T3 fue menor (36%). Conclusiones. El medio hiperosmótico presenta un mayor detrimento sobre los oocitos que el medio hiposmótico, posiblemente porque los oocitos presenten mas mecanismos para evitar la entrada de agua del medio extracelular, que para evitar la salida de solutos y agua intracelular. Se evidencia la necesidad de adoptar medidas rigurosas en el control de calidad de osmolaridad de los medios de cultivo empleados en los procesos de maduración in vitro de oocitos.
Palabras clave: Membrana celular, solutos, hipertónico, hipotónico, calidad y diámetro de oocitos, oocitos bovinos.
Abstract
Ooocytes are susceptible to osmolar changes, and show some phenomena that affect the plasma membrane. Objective. To evaluate the effect of hypo and hyperosmolarity from the culture's environment on the diameter and the quality of in vitro matured oocytes. Materials and methods. 75 oocytes of excellent and good quality were use in the study. As a control the M 199 was used, suplemented with 10 % of FCS, 30 μg of FSH and 30 μg of LH (290 mOsm/l T2). The oocytes were evaluated under two osmolar concentrations: Hyperosmotic media, 497mOsm/L (T1), and hyposmotic media 150mOsm/L (T3). The diameter and the quality were measured at 0 hours and after 24 hours. Results. The oocyte diameter at 24 hours was bigger in the T3 (148,7±9.7) and smaller in the T1 (134,6±1.2). Regarding the control (147.9±11.5) (p <0.05.), no difference was found between the percentage of excellent and good quality oocytes after 24 hours of treatment T1 in comparison to the control (56 % and 60 %) (p> 0.05.), but the quality in the T3 was lower (36 %). Conclusions. It was demonstrated that the hyperosmotic media had a bigger detrimental effect on the oocytes than the hyposmotic media. It is possible that the oocytes show more mechanisms to avoid the water flow into the cytoplasm than to avoid the exit of solutes and water flow towards the outside. The necessity to adopt rigorous measurements in the quality control of osmolarity for the culture mediums used in the processes of in vitro maturation for oocytes, is evident.
Key words: Cell membrane, solutes, hypertonic, hypotonic.
Resumo
Os oocitos são susceptíveis a mudanças osmolares, apresentando fenômenos que afetam a membrana plasmática. Objetivo. Avaliar o efeito da soluço e a hiperosmolaridad do meio de cultivo sobre o diâmetro e a qualidade de oocitos madurados in vitro. Materiais e métodos. Utilizaram-se 75 oocitos de excelente e boa qualidade, como médio controle se utilizou o M 199 suplementado com SFB 10%, FSH (30 μg ) e LH (30 μg), piruvato, cuja osmolaridad é 290 mOsm/l (T2). Os oocitos foram submetidos a duas concentrações osmolares: meio hiperosmótico 497mOsm/L (T1), e meio hiposmótico 150mOsm/L (T3), mediu-se o diâmetro e qualidade às 0 e 24 horas. Resultados. O diâmetro dos oocitos às 24 horas foi maior no T3 (148,7±9.7) e menor no T1 (134,6±1.2) com respeito ao controle (147.9±11.5) (p<0.05.) não se encontrou diferença entre a percentagem de oocitos de excelente e boa qualidade às 24 horas do tratamento T1 com respeito ao controle (56% e 60%) (p>0.05.), mas a qualidade no T3 foi menor (36%). Conclusões. Demonstra-se que o meio hiperosmótico apresenta maior efeito detrimental sobre os oocitos do que o meio hiposmótico, possivelmente os oocitos apresentem mas mecanismos para evitar a entrada de água do meio extracelular que para evitar a saída de solutos e água intracelular. Se evidência a necessidade de adotar medidas rigorosas no controle de qualidade de osmolaridad dos meios de cultivo empregados nos processos de maturação in vitro de oocitos.
Palavras chaves: Membrana celular, solutos, hipertónico, hipotónico.
Introducción
Desde sus inicios en los años 70 hasta la actualidad, los medios de cultivo empleados en la producción de embriones in vitro han presentado pocas variaciones. El M-199 ha sido el medio más utilizado en los protocolos de maduración de oocitos y en muchos laboratorios es rutinario preparar in situ estos medios, lo que puede aumentar el riesgo de variabilidad en la repetición de los ensayos experimentales realizados en esta área1. El parámetro convencionalmente evaluado en los medios preparados es el pH, omitiendo la medición de la osmolaridad, la cual afecta directamente la calidad de los procesos2. La célula es un sistema semi-abierto, delimitado por una membrana plasmática de carácter semipermeable, que regula el paso de agua y de moléculas químicamente definidas, los procesos fisiológicos y las interacciones de la célula con su entorno suceden en un medio acuoso. La membrana plasmática es una bicapa lipídica que mantiene las diferencias del espacio citosólico y el ambiente extracelular; el flujo de sustancias se da en mayor grado por canales y transportadores, que presentan especificidad y son regulados por múltiples vías3.
Las células eucariontes poseen diversos procesos de difusión simple para controlar cambios en la osmolaridad; en particular, la habilidad de la célula para adaptarse a cambios osmóticos en su ambiente, depende de la actividad de la membrana, la cual es capaz de intercambiar solutos, según las necesidades, para equilibrar concentraciones en sus respectivos espacios4.
Las partículas cargadas (iones) no atraviesan la bicapa fosfolipídica debido al carácter hidrófobo en su parte interna. Algunas moléculas polares, como el agua y la urea, son suficientemente pequeñas para atravesarla. Las moléculas de tamaño reducido, grandes o de tamaño moderado que son liposolubles, pasan fácilmente a través de la membrana. Moléculas como azúcares, (monosacáridos), amino-ácidos, nucleósidos y otros polímetros como las proteínas, polisacáridos, y ácidos nucleicos, tampoco son capaces de atravesar la membrana. Esta dinámica entre soluto y solvente celular genera respuestas filológicas compensatorias3.
La relación entre el número de osmoles (solutos en dilución) y el solvente se conoce como osmolaridad; ésta juega un papel fundamental en el mantenimiento de la homeostasis regulando el paso a través de la membrana entre el medio intra y extracelular5.
La alteración de la osmolaridad es un factor de estrés celular que afecta el balance iónico e hídrico. El modelo de lisis y crenación en el eritrón muestra que la célula responde de diferentes maneras a las variaciones de osmolaridad, dependiendo del carácter del cambio; en medios hiposmóticos, pierde solutos y acumula agua al tiempo que aumenta el volumen y provoca el cese de procesos metabólicos y muerte celular (lisis)6, mientras que, en medios hiperosmóticos se deshidrata, incrementando la concentración de sales intracelulares y reduciendo el volumen celular (crenación)7. Estos cambios generan alteraciones metabólicas y morfológicas de los oocitos8, aunque no hay reportes que demuestren la presentación de estos fenómenos ante el estrés osmótico.
Una propiedad importante de los medios de cultivo, empleados en modelos celulares in vitro, es la osmolaridad. En 1950 Morgan y colaboradores9 reportaron la necesidad de crear un medio nutricionalmente definido para el cultivo celular. En sus experimentos se realizaron diferentes combinaciones de vitaminas, amino-ácidos y otros factores de crecimiento, hasta desarrollar un medio denominado M-199, utilizado tradicionalmente en los protocolos convencionales, para la maduración de oocitos bovinos, dentro de los procesos de producción de embriones in vitro1. Estudios recientes han mostrado que la capacidad de desarrollo de los oocitos bovinos, puede estar afectada por el tamaño y calidad del folículo10,11, ya que el fluido folicular tiene una composición bioquímica altamente compleja, que aporta los nutrientes necesarios para que el oocito realice las modificaciones citoplasmáticas, nucleares y epigenéticas características de su proceso de maduración, que determina la competencia para alcanzar el estadío de blastocisto12.
El éxito en la producción de embriones in vitro depende, en gran medida, de la adopción de buenas prácticas de laboratorio, dentro de las cuales, el control de calidad de los medios de cultivo es un componente fundamental, al igual que la manipulación de los oocitos1. Procedimientos inadecuados en el transporte de ovarios, la aspiración folicular, el almacenamiento de los oocitos, la preparación de los medios de cultivo (incluyendo el control de osmolaridad), la regulación del tiempo para los procedimientos, entre otros, son factores determinantes en el éxito del proceso de la fertilización in vitro, el cual se refleja en la obtención de embriones viables1.
El objetivo de este estudio fue evaluar el efecto de las variaciones de osmolaridad del medio, sobre parámetros de calidad de oocitos bovinos madurados in vitro, comparándolo con el modelo de lisis y crenación del eritrón.
Materiales y métodos
Los oocitos fueron obtenidos de ovarios provenientes de la planta de beneficio local y el transporte, hasta el laboratorio, se realizó en solución salina fisiológica 0.9% Corpaul®, a una temperatura de 37.5°C.
La aspiración folicular se realizó con agujas calibre 18 y el líquido fue recolectado en un tubo cónico de 50 ml Falcom® a 37.5 ºC, posteriormente, el volumen folicular fue sometido a Vortex por 10 segundos, para remover las células del cumulus y se dejó decantar en incubadora a 37.5 °C, 5% CO2 en aire y humedad > de 90% por 20 minutos.
Se seleccionaron 75 oocitos calidad 1 (excelente) y 2 (bueno) (ooplasma homogéneo, zona pelúcida íntegra, homogénea y circular según los criterios de Nagano, 2007)12. Los oocitos fueron cultivados de forma independiente, en gotas de 10 μl de medio de maduración bajo aceite mineral, en cajas de petri de 35 mm (5 por cada caja y 25 por tratamiento). Posteriormente, las cajas se introdujeron en incubadora a 37.5 °C, 5% de CO2 en aire y humedad > de 90% durante 24 horas.
Diseño experimental. Se aplicaron tres tratamientos (T1, T2, T3), usando como medio base M-199. El medio de maduración estándar fue preparado suplementando el M-199, con 10% de Suero Fetal Bovino (SFB), 100 μl de solución comercial de Penicilina-Estreptomicina, 30 μg Hormona Folículo Estimulante (FSH) y 30 μg Hormona Luteinizante (LH).
Los medios (T1, T2 y T3) fueron preparados en cabina de flujo laminar, homogenizados y estabilizados en incubadora a 37.5 °C, 5% CO2 en aire y humedad > de 90% durante 3 horas, la osmolaridad fue medida utilizando un osmómetro (Micro osmometer type 5B/13-fusion point, Roebling, Germany).
Tratamiento 1: M 199 + 0.5 gr de glucosa 95% (8.38 mM final). Osmolaridad final 497 mOms/L (Hipertónico).
Tratamiento 2: (Control) M 199 estándar comercial. (5.6mM final de glucosa). Osmolaridad final 290 mOms/L (Isotónico).
Tratamiento 3: M 199 + agua destilada (Corpaúl). (2.8 mM final de glucosa). Osmolaridad final 150 mOms/L (Hipotónico).
Sé organizaron de forma aleatoria 15 cajas Petri (Falcom® 35x10mm) 5 gotas por caja, 10μl por gota inmersas en aceite mineral.
Las variables registradas fueron: 1) diámetro medido en micras (μm) y 2) calidad, clasificada por criterios morfológicos de 1 a 5 (1, excelente; 2, bueno; 3, aceptable; 4, regular; 5, malo) usando los criterios de Nagano 200712. Ambas variables se evaluaron a la hora 0 y a las 24 horas de cultivo por medio de un estereoscopio Nikon Sm 2800, acoplado a una cámara Moticam 2300 M Pixel USB 2.0.
Los medios y reactivos empleados fueron marca Gibco® excepto el aceite mineral y las gonadotropinas FSH y LH de Sigma®.
Para el análisis se empleó un diseño de clasificación experimental completamente aleatorizado, efecto fijo balanceado. Donde se aplicaron pruebas de comparación por el método de Tukey con base en un nivel de significancia del 5%. De igual forma, se hizo el análisis descriptivo exploratorio de tipo unidimensional; cuyo objetivo fue establecer el promedio aritmético, desviación típica y coeficiente de variación para cada periodo de evaluación por tratamiento. Se utilizó el programa SAS versión 9.1.
Resultados
Efecto de la osmolaridad sobre el diámetro de los oocitos.
Al evaluar la variable diámetro en la hora 0 no se encontró diferencia estadística entre tratamientos (p>0.05); debido a que todos los oocitos seleccionados para el experimento debían cumplir con características de calidad 1 y 2, con un diámetro promedio de 143μm. A las 24 horas, se encontró diferencia estadística en el efecto promedio de los tratamientos (p<0.05) con respeto al hiperosmótico siendo el diámetro de este menor que en los medios iso e hipotónico, con respecto a la solución hiposmótica, los oocitos sometidos a este tratamiento presentaron tendencia a un leve aumento en su diámetro, respecto a los oocitos en el control (isosmótico T2) (Tabla 1) (Figura 1).
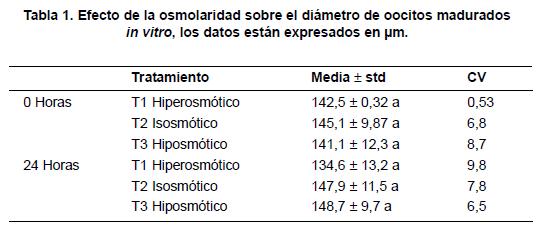
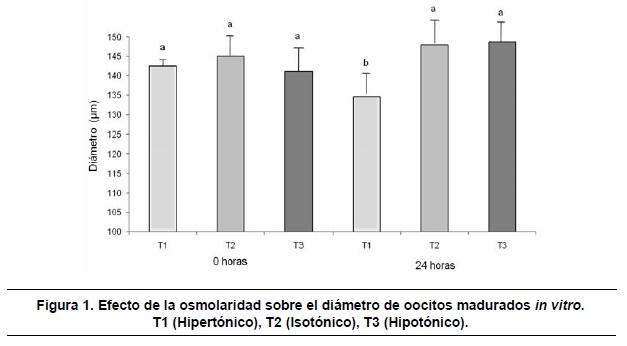
El análisis conjunto a través de la evaluación, permitió detectar la relación entre el periodo de evaluación y el efecto del tratamiento (p<0.05); de igual forma, se encontró diferencia entre los tratamientos, tal como se comentó, a la hora 24.
Efecto de la osmolaridad sobre la calidad de los oocitos.
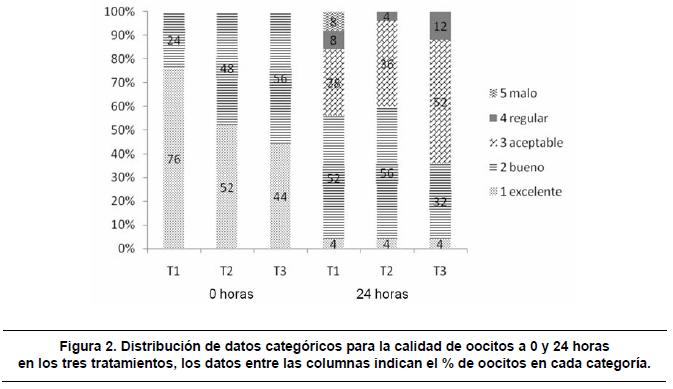
No se encontró efecto de la osmolaridad sobre la calidad a la hora cero, ni a las 24 horas. Aunque no se observó diferencia estadística significativa (p>0.05), se presentó una tendencia de los oocitos sometidos a T1, T2 y T3 de perder hasta dos grados de calidad. El análisis descriptivo de frecuencias a la hora veinticuatro, determinó que el porcentaje de oocitos que se calificó entre excelente y bueno fue el 56% para el T1, 60% para el T2 y 36% Para el T3. (Figura 2).
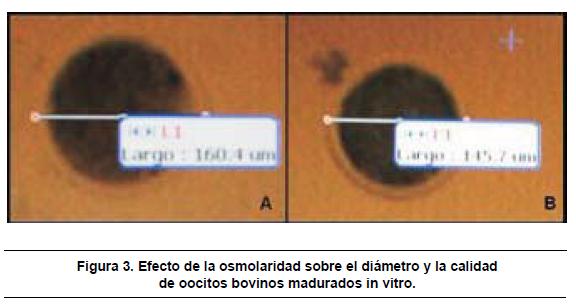
Las imágenes presentadas fueron tomadas directamente durante la medición con equipo Moticam 2300 M Pixel USB 2.0. A: oocito 24 horas T3, B: Oocito 24 horas T1. En ambos casos se observa ooplasma oscuro.
Discusión
Aún cuando el oocito cuenta con mecanismos moleculares propios y barreras externas como las células de la granulosa, que lo protegen ante cambios fuertes de osmolaridad1, estos pueden tener variaciones en tamaño y en calidad dependiendo de varios factores como: especie, raza, diámetro y tipo de folículo. Además se sabe que la maduración nuclear y citoplasmática en mamíferos es, en gran medida, dependiente de la osmolaridad del medio13.
El diámetro del oocito puede verse alterado por las variaciones de osmolaridad del líquido folicular, que es dependiente del diámetro folicular14, esto es acorde a nuestros resultados, ya que la variación de la osmolaridad del medio de maduración, afectó el diámetro a las 24 horas de cultivo. Desde el punto de vista fisiológico, esto se ha explicado por las variaciones en las concentraciones hormonales en el líquido folicular; la producción de estrógenos por parte del folículo es dependiente del tamaño del mismo, ya que cuando el tamaño folicular empieza a aumentar, se incrementa la tasa mitótica de las células de la teca interna, externa y de la granulosa; lo que se traduce en un aumento de los esteroides gonadales. Sin embargo, en nuestro experimento las concentraciones hormonales de los tratamientos fueron constantes y aun así ocurrieron cambios de diámetro, lo que señala que no son las hormonas las completas responsables de este fenómeno.
Cuando los oocitos son retirados del ambiente folicular, son puestos en condiciones distintas que inducen cambios en sus mecanismos biológicos de compensación11. Las células tienen un mecanismo por el cual son capaces de regular variaciones osmolares de su medio intra o extracelular; sin embargo presentan un límite de tolerancia osmótica tanto para hiper, como para hiposmolaridad, el cual una vez es superado, la célula detiene sus procesos metabólicos y no es capaz de realizar osmoregulación. En la hipótesis se planteó que los oocitos podrían tener la misma reacción de lisis o crenación que el eritrón, o podrían presentar cambios en el diámetro que pudieran interpretarse como entrada o salida de agua a través de membrana15, sin embargo, no hubo variaciones ni de calidad ni de diámetro a la hora cero, lo cual indica que la resistencia a los cambios osmóticos del oocito, es diferente a la del eritrón, el cual sufre los fenómenos de lisis y crenación pocos segundos después de ser sometidos a medios hipo o hiperosmóticos.
Una posible explicación para estos resultados, se relaciona con reportes previos donde se han estudiado dos canales de membrana relacionados con el balance hídrico: los transportadores sodio-glucosa (SGLT) y los transportadores específicos de glucosa (GLUT). En los primeros, los fenómenos de cotransporte son dependientes de sodio, el cual debe estar presente para permitir el ingreso conjunto con la glucosa; en los segundos, los fenómenos son independientes de sodio, ya que el canal trasportador presenta una afinidad específica por glucosa. Una vez activado el SGLT, el agua puede pasar de forma libre hacia el espacio intracelular o extracelular, obedeciendo a un gradiente específico el cual puede inducir la entrada o salida de agua del oocito16. El SGLT es capaz de mover más cantidad de agua entre el espacio intra y extracelular, ya que cuando el canal es activado, pasa un ion de sodio, una molécula de glucosa y 264 moléculas de agua17,18. Zeuthen y Stein proponen un modelo para el transportador GLUT2, el cual realiza un cotransporte específico con el agua. Como los medios utilizados en el presente estudio tuvieron variaciones en la concentración de glucosa, este principio podría explicar en gran medida la entrada y salida de agua del oocito16. Los cambios osmolares en los medios de maduración, pueden ser uno de los factores más críticos en este proceso, ya que los oocitos están sometidos a estrés físico, químico y molecular. Esto podría traducirse en una baja proporción de oocitos madurados y viables19. La dirección del movimiento del agua depende de factores como: numero de transportadores disponibles, número de transportadores activados, carga eléctrica generada por los iónes osmóticamente activos, osmolaridad y la presión ejercida sobre la membrana celular. Este conjunto de factores desencadena la respuesta celular, que regula el movimiento del agua, iónes y solutos en general, tratando de mantener en equilibrio la presión a nivel membranal. Cuando el estrés osmótico supera el umbral de tolerancia, el oocito activa la cascada de apoptosis6. La vía de MAP (proteína activada por mitógenos) se activa como respuesta a cambios osmolares en el medio y es un elemento clave para señales de transducción originadas en la superficie de la membrana nuclear6. Para la activación de MAP se requiere de las MAP Kinasas, que en el oocito cumplen funciones importantes como: proliferación celular, diferenciación y apoptosis. Los oocitos del T1 (hiperosmolar) presentaron una disminución del diámetro a la hora 24, pero la variable calidad no tuvo diferencia estadística (p>0.05). A pesar de esto, se vió una tendencia marcada de estos oocitos a tener un ooplasma oscuro a la hora 24 (Figura 4). En este grupo, la pérdida de agua del espacio intracelular (290mOsm/L) al extracelular, obedeció a una mayor osmolaridad externa (497 mOsm/L), este fenómeno fue posiblemente mediado por la activación del SGLT y GLT2, obedeciendo al exceso de glucosa del medio extracelular (8.38 mM), aumentando la actividad de estos transportadores y dirigiendo el flujo de agua hacia el espacio extracelular. Otra posible explicación, es la activación de la bomba sodio hidrogenión para contrarrestar la salida del agua, lo cual explicaría en parte la perdida de calidad de los oocitos por acidificación del microclima extracelular15-20. El cambio más drástico de calidad se evidenció en el T3 (hipotónico), posiblemente porque al realizar la dilución para lograr la hiposmolaridad, también se diluyeron los nutrientes necesarios para las funciones normales de los oocitos. Se sabe que medios pobres en solutos o glucosa, pueden disminuir la expresión de las proteínas transportadoras específicas en membrana SGLT y GLT2, disminuyendo la probabilidad del flujo agua en el oocito. Este mecanismo puede ser compensatorio ante un medio adverso, bajo en osmolaridad. Aunque el T2 era isosmolar, hubo un aumento del diámetro de los oocitos (2.8 μm), esto sugiere que durante el proceso de maduración los oocitos pueden crecer, ya que el medio brinda las concentraciones de solutos necesarios, para favorecer los procesos metabólicos.
Conclusiones
Las alteraciones del equilibrio osmótico, en los medios de maduración de oocitos destinados para la producción de embriones in-vitro, pueden generar cambios en el diámetro y la calidad. Los medios hipotónicos tienen el mayor efecto adverso sobre la calidad de los oocitos, no solo por su bajo contenido de nutrientes, sino también, porque la relación agua solutos es alta. Los medios hipertónicos con alta concentración de glucosa, causan amplias variaciones en el diámetro y la calidad de los oocitos, lo que podría sugerir eventualmente que la activación de estos canales (SGLT y GLT2), favorecen el flujo de agua sujeto a la alta concentración osmolar a nivel extracelular.
La osmolaridad final de los medios, es un parámetro que requiere rigurosidad en su control, ya que se podría inducir la incompetencia de los oocitos para su posterior uso en procesos de reproducción asistida.
Se sugiere, para posteriores investigaciones, evaluar la tasa de fertilización, clivaje y cinética de desarrollo embrionario temprano y estudiar las rutas mediadas por los canales (SGLT y GLT2).
Referencias
1. GORDON, Ian. Laboratory production of cattle embryos. 2 ed. Biotechnology and agricultural. Wallinford, UK: CABI publishing, 2003. 1-45 p. series, No 27. [ Links ]
2. FRESHNEY, Ian. Culture of animal cells a manual of basic technique. 4 ed. New York: Wiley- Liss Publications, 2000. p. 41-92. [ Links ]
3. GANONG, William. Fisiología médica. 16 ed. Mexico DF: Manual Moderno, 1998. p. 40-52. [ Links ]
4. BLANCO, Juan, et al. Osmotic tolerance of avian spermatozoa: Influence of time, temperature, cryoprotectant and membrane ion pump function on sperm viability. En: Journal of reproduction and development. February, 2008, vol. 1, no. 56, p. 8-14. [ Links ]
5. ALBERTS, Bruce, et al. Molecular biology of the cell. 3 ed. New York: Garland Publishing, 1991. 366-408. [ Links ]
6. VOLONTÉ, Daniela, et al. Cellular stress induces the tyrosine phosphorylation of caveolin-1 (Tyr14) via activation of p38 mitogen-activated protein kinase and c-src kinase. En: Journal of Biology. March, 2001.vol. 11, no. 276. p. 8094-8103. [ Links ]
7. LANG, Florian, et al. Functional significance of cell volume regulatory mechanisms. En: Revista Physiological, January, 1998. vol. 1, no. 78 p. 247-306. [ Links ]
8. AGCA, Yuksel, et al. Effect of osmotic stress on the development contents of germinal vesicle and metaphase II state bovine cumulus oocyte complexes and its relevance to cryopreservation. En: Molecular reproduction and development. February, 2000. vol. 2, no. 52, p. 212-219. [ Links ]
9. MORGAN, Joseph, et al. The nutrition of animal cells in tissue culture. I. Initial studies on a synthetic medium. En: Proceedings of the Society Experimental Biology and Medicine. January, 1950. vol. 73, no. 1, p. 1-8. [ Links ]
10. ARLOTTO, Theresa, et al. Aspects of follicle and oocyte stage that affect in vitro maturation and development of bovine oocytes. En: Theriogenology. April, 1996. vol. 45, no. 5, p. 943-956. [ Links ]
11. NAGAI, Hiroki, et al. The follicle size-depent changes in follicular fluid components and oocyte diameter in Antartic minkes whales. En: Journal of Reproduction and Development. December, 2007. vol. 53, no. 6, p. 1265-1272. [ Links ]
12. NAGANO, Masahi, et al. The relationship between oocyte morphologyc and ovarian status in cattle. En: Journal of Reproduction and Development. August, 2007. vol. 4, no. 53, p. 953-958. [ Links ]
13. COMIZZOLI, Pierre; WILDT, David E. and PUKAZHENTH, Budhan. Impact of anisosmotic conditions on structural and functional integrity of cumulus-oocyte complexes at the germinal vesicle stage in the domestic cat. En: Molecular Reproductor and Development. February, 2008. vol. 75, no. 2, p. 345-354. [ Links ]
14. VALDEZ, Delgado, et al. Water- and cryoprotectant-permeability of mature and immature oocytes in the medaka (Oryzias latipes). En: Cryobiology. February, 2005. vol. 50, no. 1, p. 93-102. [ Links ]
15. YANGJIAN, Liu, et al. Aquaporin 9 is the major pathway for glycerol uptake by mouse erythrocytes, with implications for malarial virulence. En: Proceedings of the National Academic of the Science of the United States of America. July, 2007. vol. 104, no. 30, p. 12560- 12564. [ Links ]
16. NAFTALIN, Richard. Osmotic water transport with glucose in GLUT2 and SGLT. En: Biophysical Journal. May, 2008. vol. 94, no 10, p. 3912-3923. [ Links ]
17. CHARRON, François; BLANCHARD, Maxime G. and LAPOINTE, Jean-Yves. Intracellular hypertonicity is responsible for water flux associated with Na+/glucose cotransport. En: Biophysical Journal. May, 2006. vol.90, no.10, p. 3546-3554. [ Links ]
18. DUQUETTE, Pierre Pascal; BISSONNETTE, Pierre and LAPOINTE, Jean-Yvesl. Local osmotic gradients drive the water flux associated with Na+/ glucose cotransport. En: Proceedings of the National Academic of the Science of the United States of America. March, 2001. vol. 98, no.7, p 3796-3801. [ Links ]
19. MULLEN, S.F.; ROSENBAUM, M. and CRITSER, J.K. The effect of osmotic stress on the cell volume, metaphase II spindle and developmental potential of in vitro matured porcine oocytes. En: Cryobiology. June, 2007. vol. 54, no. 3, p. 281-289. [ Links ]
20. LOO, Donald, et al. Passive water and ion transport by cotransporters. En: The Journal of Physiology. July, 1999. vol. 518, no. 1, p. 195-202. [ Links ]














