Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.7 no.1 Caldas Jan./June 2010
Artículo original
Efecto del etilenglicol sobre la morfología post-desvitrificación de oocitos bovinos inmaduros
Ethylene glycol's effect on the post-devitrification morphology of immature bovine oocytes
Efeito do etilenglicol sobre a morfologia pós-desvitrificar de ovócitos bovinos imaturos
* Médico Veterinario, docente de la Facultad de Ciencias Agrarias del Politécnico Colombiano Jaime Isaza Cadavid.
Correspondencia: e-mail: jegomez@elpoli.edu.co.
** Magíster en Biotecnología, docente de la Facultad de Ciencias Agrarias del Politécnico Colombiano Jaime Isaza Cadavid JIC.
*** Magíster en Reproducción, Facultad de Ciencias de la Universidad Nacional de Colombia Sede Medellín.
Artículo recibido: 06-04-2009, artículo aprobado: 05-04-2010
Resumen
Introducción. Almacenar oocitos bovinos inmaduros de forma eficiente permite contar con fuentes casi ilimitadas de recursos genéticos, valiosos para los procesos biotecnológicos de la reproducción y para la investigación. Diversos métodos se han empleado para la criopreservación de este tipo de células, entre de los cuales la vitrificación ha demostrado ser el más exitoso. Sin embargo, los resultados aún son limitados por las bajas tasas de sobrevivencia de los oocitos vitrificados. Objetivo. Determinar entre tres concentraciones del crioprotector etilenglicol cuál previene en mayor proporción las alteraciones sobre la morfología post-desvitrificación de oocitos bovinos inmaduros. Materiales y métodos. Para un protocolo de dos pasos de vitrificación en pajilla abierta estirada (OPS) de oocitos bovinos inmaduros, se evaluaron tres combinaciones en la concentración de etilenglicol: 1, (7.5% y 15%); 2, (10% y 20%) y 3, (20% y 40%). Resultados. Los resultados mostraron que un protocolo que utiliza 20% y 40% de etilenglicol en dos soluciones de vitrificación, produce menores alteraciones en la morfología posdesvitrificación de los oocitos bovinos inmaduros. Conclusiones: La utilización de las concentraciones de 20% y 40% de etilenglicol en un protocolo de vitrificación de dos pasos en OPS tiene un mayor efecto preventivo sobre los daños morfológicos asociados a la vitrificación de oocitos bovinos inmaduros.
Palabras clave: oocitos bovinos inmaduros, vitrificación, etilenglicol, pajilla abierta estirada, morfología de oocitos.
Abstract
Introduction. Efficient storage of immature bovine oocytes means to have an unlimited quantity of genetic resources, valuable for reproduction biotechnology processes and for research. Several methods have been used for the cryopreservation of these cells. Vitrification has demonstrated to be the most successful one, but its results are still limited due to the low survival rates of the vitrified oocytes. Objective. To determine which one, between three different concentrations of the ethylene glycol crioprotector, prevents in the highest proportion the alterations on post-devitrification morphology of immature bovine oocytes. Materials and methods. Three different concentrations of ethylene glycol were tested in order for a two step vitrification protocol in open pulled straw (OPS) of immature bovine oocytes: 1, (7.5% y 15%); 2, (10% y 20%) and 3, (20% y 40%). Results. A protocol that uses the combination of 20% and 40% of ethylene glycol on two vitrification solutions, produces less changes in the post-devitrification morphology of immature bovine oocytes. Conclusions. The use of 20% and 40% ethylene glycol concentrations, in a two step OPS vitrification protocol, has a better prevention effect on the morphologic damages associated to the vitrification of immature bovine oocytes.
Key words: Immature bovine oocytes, vitrification, ethylene glycol, open pulled straw (OPS), oocyte morphology.
Resumo
Introdução. Armazenar ovócitos bovinos imaturos de forma eficiente permite contar com fontes quase ilimitadas de recursos genéticos, valiosos para os processos biotecnológicos da reprodução e para a investigação. Diversos métodos se empregaram para a criopreservação deste tipo de células, entre dos quais a vitrificar demonstrou ser o mais exitoso. No entanto, os resultados ainda são limitados pelas baixas taxas de sobrevivência dos ovócitos vitrificados. Objetivo. Determinar entre três concentrações do crio - protetor etilenglicol qual previne em maior proporção as alterações sobre a morfologia pós-desvitrificação de ovócitos bovinos imaturos. Materiais e métodos. Para um protocolo de dois passos de vitrificar em palha aberta esticada (OPS) de ovócitos bovinos imaturos, avaliaram-se três combinações na concentração de etilenglicol: 1, (7.5% e 15%); 2, (10% e 20%) e 3, (20% e 40%). Resultados. Os resultados mostraram que um protocolo que utiliza 20% e 40% de etilenglicol em duas soluções de vitrificar, produz menores alterações na morfologia pos-desvitrificação dos ovócitos bovinos imaturos. Conclusões. A utilização das concentrações de 20% e 40% de etilenglicol num protocolo de vitrificar de dois passos em OPS tem um maior efeito preventivo sobre os danos morfológicos sócios à vitrificar de ovócitos bovinos imaturos.
Palavras importantes: Ovócitos bovinos imaturos, vitrificar, etilenglicol, palha aberta esticada, morfologia de ovócitos.
Introducción
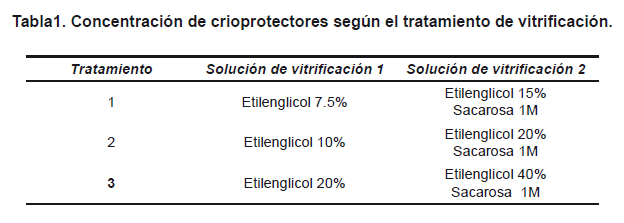
En el área de la biotecnología animal se han desarrollado procedimientos que mejoran de manera substancial la eficiencia reproductiva de las especies tradicionalmente destinadas a la producción pecuaria. La aspiración folicular transvaginal para la obtención de oocitos inmaduros, la maduración in vitro y la fertilización in vitro, generan una gran cantidad de células germinales y embriones. Sin embargo, en muchas ocasiones gran parte de este valioso recurso genético debe ser descartado por la falta de aplicación de procedimientos de conservación, o por el ineficiente almacenamiento derivado del uso de protocolos de criopreservación que resultan en altas tasas de deterioro y muerte celular1,2, por la formación incontrolada de cristales de hielo3. Esta situación ha conducido al desarrollo de técnicas y a la utilización de sustancias crioprotectoras que mitiguen tales consecuencias del proceso4,5,6,7. La vitrificación corresponde a una técnica de congelación ultrarrápida, basada en el contacto directo entre las células en una solución de vitrificación que contiene agentes crioprotectores entre 4-6 mol/L con el nitrógeno líquido, produciéndose una solidificación para formar un estado vítreo o similar a cristal, disminuyendo la formación de cristales de hielo8,9,10,11. La criopreservación por vitrificación con el uso de crioprotectores como el etilenglicol (EG) y el dimetilsulfóxido (DMSO), ha favorecido el mejoramiento de la eficiencia en la preservación de células germinales y embriones de varias especies12,13,14, dado que permite el aumento de la velocidad de enfriamiento, así como la disminución de los efectos osmóticos y tóxicos y las alteraciones a nivel celular15,16. Sin embargo, los índices de supervivencia de oocitos vitrificados en vesícula germinal son todavía muy bajos en el vacuno17. A pesar de que el etilenglicol ha sido el crioprotector más conveniente para la vitrificación de estas células18,19, se han utilizado diversas concentraciones del mismo y combinaciones con otros crioprotectores20,21, de manera que sigue siendo importante determinar cuáles son las concentraciones de etilenglicol que menos afectan la integridad de los oocitos. En este trabajo se evaluaron para un protocolo de dos pasos de vitrificación de oocitos bovinos inmaduros en pajilla abierta estirada (OPS), tres combinaciones en la concentración de etilenglicol: 1, (7.5% y 15%); 2, (10% y 20%) y 3, (20% y 40%).
El objetivo de este estudio fue determinar, entre las tres concentraciones del crioprotector etilenglicol, cuál previene en mayor proporción las alteraciones sobre la morfología post-desvitrificación de oocitos bovinos inmaduros.
Materiales y métodos
Sitio de estudio
La recolección de ovarios bovinos se llevó a cabo en la planta de faenado de la Central Ganadera del municipio de Medellín, departamento de Antioquia, Colombia, realizando una o dos recolecciones por semana. Los procedimientos de aspiración folicular, la selección de complejos oocito-cúmulus (COCs), la vitrificación y la evaluación morfológica post-desvitrificación, fueron desarrollados en el Laboratorio de Biotecnología Animal de la Universidad Nacional de Colombia, sede Medellín.
Recolección de oocitos
Los COCs bovinos fueron recolectados desde ovarios provenientes de la planta de faenado local, transportados en un medio tampón fosfato salino (PBS) estéril a 38°C, y procesados en el laboratorio dentro de las tres horas posteriores a la recolección. Los folículos entre 2 y 6mm fueron aspirados usando una jeringa de 5ml, con una aguja calibre 18. Los COCs y el fluido folicular recuperado fueron puestos en tubos cónicos plásticos de 15ml y se dejaron decantar en una incubadora a 38.5°C durante 10 minutos, para realizar la recuperación posterior de la fracción precipitada. La selección de los COCs se realizó con base en los criterios de capas múltiples y compactas de células de la granulosa y ooplasma homogéneo. Los COCs seleccionados fueron lavados en medio TL-Hepes suplementado con 0.2mM piruvato de sodio (Sigma P5280) y 3mg/ml de albúmina sérica bovina fracción V (Sigma A9647).
Vitrificación
Se elaboraron pajillas abiertas estiradas (OPS), a partir de pajillas convencionales de 0.25ml, apoyando el tercio central de cada pajilla sobre la esquina de una platina térmica a 90°C, durante 30 segundos, para reblandecerlas, estirarlas y cortarlas por la parte más angosta. Para el proceso de criopreservación, los COCs se pasaron por 200μl de una primera solución de vitrificación, (V1), por 45 segundos y por 20μl de una segunda solución de vitrificación, (V2), por 25 segundos. Estas soluciones estuvieron basadas en TCM-199, 10% de suero fetal bovino (SFB), y concentraciones de etilenglicol según el tratamiento (Tabla 1). Los COCs fueron empacados en las OPS en un volumen de 2μl de la segunda solución, para finalmente sumergirlas directamente en nitrógeno líquido.
Desvitrificación
Pasados 30 días, las pajillas fueron retiradas del termo de almacenamiento en nitrógeno líquido, expuestas al aire durante 5 segundos y luego sumergidas por 1.5 minutos en 1ml de una solución con 0.25M de sacarosa, en la que los COCs, fueron liberados y recuperados, para posteriormente ser transferidos a soluciones de 0.15M de sacarosa y medio Holding por 1.5 y 5 minutos, respectivamente. Estas soluciones estuvieron basadas en TCM-199 y 10% de suero fetal bovino (SFB).
Evaluación morfológica post-desvitrificación
Los COCs desvitrificados fueron evaluados en un microscopio invertido de contraste de fase (Axiolab HBO 50/AC) a 400X, según las características morfológicas descritas en la Tabla 2.

Diseño estadístico y análisis de resultados
El experimento se realizó bajo un diseño de bloques al azar. Los tres tratamientos fueron realizados por triplicado en unidades experimentales de 10 COCs cada una, y los resultados fueron agrupados con base en las categorías descritas en la tabla 2 y transformados a valores porcentuales. Los resultados fueron evaluados por análisis de varianza (ANOVA) y comparación de medias entre los tratamientos por una prueba Student-Newman-Keuls Múltiple. Para todos los análisis se utilizó el programa estadístico SAS, versión 8.0.
Resultados
Evaluación morfológica de oocitos postdesvitrificación
En los tres tratamientos estudiados de criopreservación por vitrificación se encontraron COCs desvitrificados en las tres categorías de evaluación morfológica previamente establecidas. La figura 1 muestra COCs clasificados en cada categoría. Los valores porcentuales por tratamiento para cada categoría morfológica se presentan en la Tabla 3.
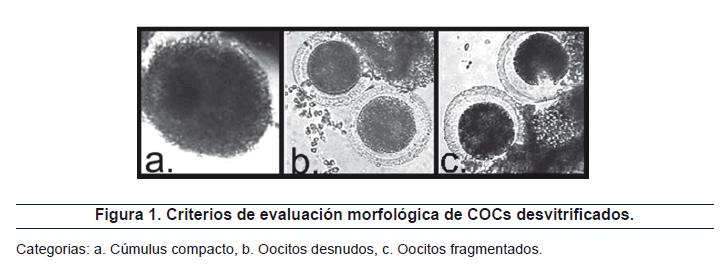
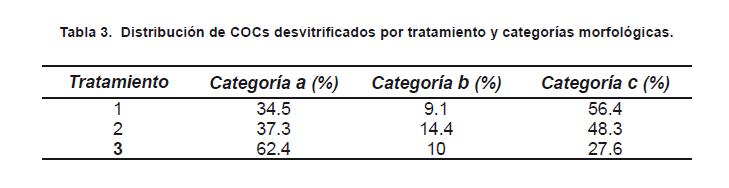
El análisis de varianza entre los tratamientos arrojó un valor altamente significativo de p (p<0.0001), y las comparaciones entre las medias por categorías morfológicas y tratamiento indicó superioridad estadística del tratamiento 3 de vitrificación, con el mayor porcentaje de COCs en la categoría a (cúmulus compacto) y el menor porcentaje de COCs en la categoría c (oocitos fragmentados).
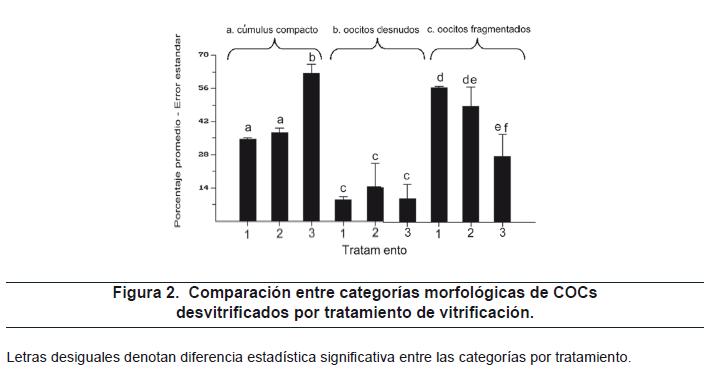
El porcentaje promedio de cada variable respuesta de cada tratamiento fueron graficados y las comparaciones que presentaron diferencia estadística significativa entre los diferentes protocolos de vitrificación dentro de cada variable respuesta están representadas con letra diferente (figura 2).
Discusión
Al comparar los resultados de la evaluación morfológica entre los tratamientos de vitrificación se encontró que el tratamiento 3 (20% y 40% EG) presentó un porcentaje estadísticamente mayor (p<0.05) de oocitos desvitrificados en la categoría de cúmulus compacto (62.4%), respecto a los tratamientos 1 (7.5% y 15% EG) y 2 (10% y 20% EG), con porcentajes de oocitos desvitrificados con cúmulus compacto de 34.5% y 37.3%, respectivamente (tabla 3). Souza y otros22, utilizando una combinación de etilenglicol, trehalosa y polivinilpirrolidona, reportaron un porcentaje de oocitos desvitrificados con cúmulus compacto del 79%.
Para el caso de la categoría morfológica de oocitos desnudos no se encontró diferencia estadística entre los tratamientos, mientras que para la categoría morfológica de oocitos fragmentados el tratamiento 3 presentó el menor porcentaje, con 27.6%, respecto a un 56.4% y 48.3% de oocitos fragmentados para los tratamientos 1 y 2, respectivamente (tabla 3).
Esto sugiere que entre las concentraciones de EG evaluadas para la vitrificación de oocitos inmaduros las utilizadas en el tratamiento 3 (20% y 40%) generan un mayor efecto preventivo sobre los daños estructurales derivados de este proceso de criopreservación, lo cual coincide con lo expresado por Martins et al23, quienes reportan que dichas concentraciones permiten la obtención de COCs que alcanzan las mejores tasas de maduración nuclear in vitro, sugiriendo una relación entre la morfología del complejo y su competencia meiótica o maduración nuclear.
Sin embargo, y a pesar de que la evaluación morfológica de los COCs es una de las herramientas útiles para evaluar los daños generados por la vitrificación, los índices de supervivencia de oocitos inmaduros vitrificados son todavía muy bajos en bovinos, lo que podría ser debido a daños de las membranas o de las comunicaciones intracelulares entre el oocito y las células del cúmulus24,25. Otros reportes han sugerido que la criopreservación afecta la membrana por ruptura o fusión, el citoesqueleto, por disolución de microtúbulos y daño de la actina26 y las proteínas y enzimas por la deshidratación y pérdida de la función, alterando la organización de los gránulos corticales y causando alteraciones y fracturas en las organelas intracelulares y la zona pelúcida27, de manera que tanto los daños morfológicamente perceptibles como otros daños de la estructura interna celular, incluso de orden molecular, pueden estar asociados a fallas en el clivaje y la distribución mitocondrial28,29, a la activación partenogenética, a alteraciones en la regulación de calcio intracelular, al choque osmótico y a la generación de radicales libres30.
Una alternativa para la criopreservación de oocitos bovinos es la vitrificación de oocitos inmaduros de folículos preantrales, los cuales poseen características que los hacen menos sensibles a los daños causados por la vitrificación, como son una baja tasa metabólica, un menor tamaño, un bajo número de células de la granulosa a su alrededor y la ausencia de zona pelúcida y gránulos corticales periféricos31.
Aun se requiere de un mayor estudio de las estrategias de criopreservación de oocitos inmaduros obtenidos de folículos antrales, para el desarrollo de procesos útiles para mejorar las tasas de recuperación de oocitos criopreservados óptimos para los procesos de maduración in vitro y producción de embriones, lo cual permitiría aumentar el potencial biotecnológico en la reproducción animal.
De acuerdo a los resultados de esta investigación se concluye que la utilización de las concentraciones de 20% y 40% de etilenglicol en un protocolo de vitrificación de dos pasos en OPS, tiene un mayor efecto preventivo sobre los daños morfológicos asociados a la vitrificación de oocitos bovinos inmaduros.
Referencias
1. CHEN, SU, et al. Effects of cryopreservation on meiotic spindles of oocytes and its dynamics after thawing: Clinical implications in oocyte freezing - A review article. En: Molecular and Cellular Endocrinology. April. 2003. vol. 202, no. 1-2, p. 101-107. [ Links ]
2. HAN, Bunnsoo and BISCHOF, John C. Direct cell injury associated with eutectic crystallization during freezing. En: Cryobiology. February, 2004. vol. 48, no. 1, p. 8-21. [ Links ]
3. ALBARRACIN MOMJE, José Luis. Vitrificación de ovocitos bovinos mediante la técnica open pulled straw: estudio estructural de cromosomas microtúbulos y microfilamentos y posterior desarrollo embrionario in vitro. Tesis doctoral. Bellaterra: Universidad Autónoma de Barcelona. Facultad de Veterinaria, 2005, p. 127. [ Links ]
4. VAJTA, G, et al. Open pulled straw vitrification: A new way to reduce cryoinjuries of bovine ova and embryos. En: Molecular Reproduction and Development. December, 1998. vol. 51, no. 1, p. 53-58. [ Links ]
5. MASSIP, Alban. Cryopreservation of bovine oocytes: current status and recent developments, minireview. En: Reproduction Nutrition Development. July-aug, 2003, vol. 43, no. 43, p. 325–330. [ Links ]
6. PAYNTER, SJ. Current status of the cryopreservation of human unfertilized oocytes. En: Human Reproduction Update. September-october, 2000, vol. 6, no. 5, p. 449-456. [ Links ]
7. SABRINA, Marie Luster. Cryopreservation of bovine and caprine oocytes by vitrification. Thesis of Master of Science. Louisiana: State University. Graduate Faculty. Agricultural and mechanical Collage, 2004, 93 p. [ Links ]
8. GUIGNOT, F. Cryoconservation des embryons des espèces domestiques. En: Productions Animales- Paris- Institute National de la Recherche Agronomique. 2005, vol. 18, no. 1, p. 27-36. [ Links ]
9. SHAW, JM. and JONES, G.M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. En: Human Reproduction Update. 2003, vol. 9, no. 6, p. 583-605. [ Links ]
10. MAVRIDES, Andreas and MORROLL, David. Cryopreservation of bovine oocytes; is cryoloop vitrification the future to preserving the female gamete?. En: Reproduction Nutrition Development. January-february, 2002, vol. 42, no. 1 p. 73–80. [ Links ]
11. MOLINA, I., et al. Criopreservación de ovocitos humanos. Vitrificación vs. Congelación. En: Revista Iberoamericana de Fertilidad. Mayo-junio, 2004, vol. 21, no. 3, p. 177-189. [ Links ]
12. Ibid., p. 177-189. [ Links ]
13. PICTON, Helen; GOSDEN, Roger and LEIBO, Stanley. Cryopreservation of oocytes and ovarian tissue [on line]. Geneva: WHO Headquarters, 17 September, 2001. [citado 20 noviembre 2008]. Disponible en: http://www.who.int/reproductive-health/infertility/report_content.htm [ Links ]
14. FUKU, Eiji; LIU, Jianmin and DOWNEY, Bruce R. In vitro viability and ultrastructural changes in bovine oocytes treated with a vitrification solution. En: Molecular Reproduction and Development. 1994. vol. 40, no. 2, p.177–185. [ Links ]
15. MASSIP. Op. cit., p. 325–330. [ Links ]
16. SILVA, M. and BERLAND, A. Vitrificación de blastocistos bovinos producidos in vitro con el método open pulled straw OPS: primer reporte. En: Archivos de Medicina Veterinaria. 2004. vol. 36, no. 1, p. 79-85. [ Links ]
17. ALBARRACIN MOMJE. Op. cit., p. 127. [ Links ]
18. PICTON. Op. cit., p. Disponible en: http://www.who.int/reproductive-health/infertility/report_content.htm [ Links ]
19. MARTINS, R.D. et al. Effects of vitrification of immature bovine oocytes on in vitro maturation. En: Animal Reproduction. April-June, 2005, vol. 2, no. 2, p.128-134. [ Links ]
20. Ibid., p. 128-134. [ Links ]
21. YAMADA, Claudia, et al. Immature bovine oocyte cryopreservation: Comparison of different associations with ethylene glycol, glycerol and dimethylsulfoxide. En: Animal Reproduction Science. June, 2007. vol. 99, no. 3-4, p. 384-388. [ Links ]
22. SOUZA, M. et al. Vitrificação de ovócitos imaturos de bovinos utilizando etilenoglicol associado à trehalose e polivinilpirrolidona. En: Arquivo Brasileiro de Medicina Veterinária e Zootecnia [on line]. Belo Horizonte: Oct, 2003. vol. 55, no. 5. [citado 15 septiembre 2008]. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-09352003000500011 [ Links ]
23. MARTINS. Op. cit., p. 128-134. [ Links ]
24. ALBARRACIN MOMJE. Op.cit., p.127. [ Links ]
25. MASSIP. Op. cit., p. 325–330. [ Links ]
26. ALBARRACIN MOMJE. Op.cit., p.127. [ Links ]
27. ABE, H., et al. Ultrastructure of bovine embryos developed form in vitro matured and fertilized oocytes: Comparative morphological evaluation of embryos cultured either in serum-free medium or in serum-supplemented medium. En: Molecular Reproduction and Development. 1999. vol. 53, p. 325-335. [ Links ]
28. AU, Heng, et al. Abnormal mitochondrial structure in human unfertilized oocytes and arrested embryos. En: Annals of the New York Academy of Sciences. May. 2005. no. 1042, p.177-185. [ Links ]
29. BAVISTER, B. and SQUIRRELL, J. Mitochondrial distribution and function in oocytes and early embryos. En: Human Reproduction. July, 2000. vol. 15, no. 2, p. 189-198. [ Links ]
30. BERNARD, A. and FULLER, B. Cryopreservation of human oocytes: a review of current problems and perspectives. En: Human Reproduction Update. May-june, 1996, vol. 2, no. 3, p. 193–207. [ Links ]
31. AMORIM, C.; GONÇALVES, P. and FIGUEIREDO, J. Cryopreservation of oocytes from preantral follicles. En: Human Reproduction Update. Mar-april, 2003, vol. 9, no. 2, p. 119-129. [ Links ]














