Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.7 no.1 Caldas Jan./June 2010
Artículo de Revisión
Transporte iónico en el epitelio branquial de peces de agua dulce*
Ionic transportation in the branchial epithelium of fresh water fish
Artigo de Revisão Transporte iônico no epitélio branquial de peixes de água doce
* Este trabajo hace parte de la revisión bibliográfica de la tesis de maestría en Acuicultura de Aguas Continentales titulada: "Cuantificación de los niveles de excreción de nitrógeno amoniacal en función del nivel de proteína en la dieta y la masa corporal en Cachama blanca (Piaractus Brachypomus) (Cuvier, 1818) bajo condiciones de laboratorio". Trabajo realizado durante el año 2008. Grupo de Investigación en Nutrición y Alimentación de Organismos Acuáticos "GRANAC" -UNILLANOS-.
** Biólogo. Especialista en Ecología, MSc. en Acuicultura de Aguas Continentales. Docente Corporación Universitaria Lasallista, Grupo de Investigación en Nutrición y Alimentación de Organismos Acuáticos "GRANAC" (UNILLANOS).
Correspondencia: e-mail: cadavid@lasallista.edu.co.
*** Msc, Ph. D. Profesor titular Universidad de los Llanos, Instituto de Acuicultura de los Llanos.
Artículo recibido: 06-08-2009, artículo aprobado: 05-04-2010
Resumen
Introducción. La branquia de los peces es el principal órgano de transporte y regulación de gradientes iónicos y osmóticos, así como también del balance ácido-base, excreción de desechos nitrogenados y metabolismo de hormonas circulantes, constituyendo el centro de las respuestas fisiológicas a los cambios internos y medioambientales. Objetivo. Documentar la estructura, la vascularización y las principales células constituyentes de este epitelio y su relación con los mecanismos de transporte iónico para el mantenimiento de su homeostasis, para argumentar el papel de la regulación iónica en la homeostasis del pez teniendo en cuenta que estos mecanismos fisiológicos suponen el éxito o fracaso de la actividad piscícola. Criterios de selección para la búsqueda bibliográfica. Se hizo revisión de autores clásicos de la fisiología en peces y de artículos científicos producto de investigación y revisiones en los últimos diez años, esencialmente los publicados en inglés y portugués. Resultados. Existe un campo inexplorado sobre los mecanismos que mantienen la homeostasis en los peces. Los trabajos para nuestras especies están aún por realizarse. Las nuevas herramientas moleculares podrían ayudar a elucidar la contribución de varios procesos de transporte de membrana a la regulación del balance ácido – base, al transporte iónico y a la excreción de metabolitos asociados a estos procesos. Retos. Integrar diferentes disciplinas para obtener una imagen clara de cómo funcionan las branquias de los peces y cómo tales procesos determinan su bienestar.
Palabras clave: Transporte iónico, epitelio branquial, homeostasis.
Abstract
Introduction. The gills are, for the fish, the most important organ for the transportation and regulation of ionic and osmotic gradients, and for the balance acid-base, the excretion of nitrogen wastes and the metabolism of circulating hormones, becoming the center of the physiological responses to internal and environmental changes. Objective. To make a document to register the structure, the vascularization and the main cells of this ephitelium, and its relation with ionic transportation for maintaining its homeostasis, in order to sustain the role of the ionic regulation in the homeostasis of fish, keeping in mind that these physiological mechanisms can be a reason to fail or to succeed in the fish breeding activities. Selection criteria for the bibliography. Classic authors on the fish physiology field were revised, plus many articles produced from research works and revisions from the last ten years. These materials were published especially in English and Portuguese. Results. There is an unexplored field concerning the mechanisms that maintain the homeostasis in fish. The work for our species is yet to be done. The new molecular tools could help to elucidate the contributions of many membrane transportation processes to the acid-base balance regulation, to the ionic transportation and to the excretion of metabolites associated with these processes. Challenges. To integrate different disciplines in order to obtain a clear image of how gills work and how the processes mentioned before determine the well being of fish.
Key words: Ionic transportation, branchial epithelium, homeostasis.
Resumo
Introdução. A brânquia dos peixes é o principal órgão de transporte e regulação de gradientes iônicos e osmóticos, bem como também do balanço ácidabase, excreção dos refugos nitrogenados e metabolismo de hormônios circulantes, constituindo o centro das respostas fisiológicas às mudanças internas e meio ambientais. Objetivo. Documentar a estrutura, a vascularização e as principais células constituintes deste epitélio e sua relação com os mecanismos de transporte iônico para a manutenção de sua homeostasis, para argumentar o papel da regulação iônica na homeostasis do peixe tendo em conta que estes mecanismos fisiológicos supõem o sucesso ou fracasso da atividade piscicultura. Critérios de seleção para a busca bibliográfica. Fez-se revisão de autores clássicos da fisiologia em peixes e de artigos científicos produto de investigação e revisões nos últimos dez anos, essencialmente os publicados em inglês e português Resultados. Existe um campo inexplorado sobre os mecanismos que mantêm a homeostasis nos peixes. Os trabalhos para nossas espécies estão ainda por realizar-se. As novas ferramentas moleculares poderiam ajudar a elucidar a contribuição de vários processos de transporte de membrana à regulação do balanço ácido – base, ao transporte iônico e à excreção de metabólitos associados a estes processos. Reptos. Integrar diferentes disciplinas para obter uma imagem clara de como funcionam as brânquias dos peixes e como tais processos determinam seu bem-estar.
Palavras importantes: Transporte iônico, epitélio branquial, homeostasis.
Introducción
Los peces son el grupo más numeroso y diverso de los vertebrados superiores que dominan el mundo acuático gracias a sus extraordinarias adaptaciones morfológicas, fisiológicas y comportamentales. Actualmente existen aproximadamente 25.000 especies de peces. Su diversidad y la gran variedad de hábitats, reflejan su larga historia evolutiva de al menos 500 millones de años. Este grupo ha evolucionado en tres grandes linajes: Agnatha (lampreas), Chondrichthyes o Elasmobranquios (tiburones) y Actinopterygii (peces óseos), con el grupo teleósteos, el más representativo1. Independientemente de su línea evolutiva, la mayoría de los peces usan las branquias como el sitio primario de respiración. Este órgano de intercambio gaseoso está esencialmente compuesto de un gran complejo vascularizado, rodeado por una extensa superficie epitelial que provee una delgada barrera entre la sangre y el ambiente acuático2. Varios autores coinciden en afirmar que el epitelio branquial es el sitio principal de los procesos de transporte y regulación de gradientes iónicos y osmóticos, así como también del balance ácido-base, de la excreción de desechos nitrogenados y del metabolismo de hormonas circulantes. Además juega un papel central en las respuestas fisiológicas a cambios internos y ambientales3,4,5,6
La presente revisión tiene por objeto argumentar el papel de la regulación iónica en la homeostasis del pez, teniendo en cuenta que estos mecanismos fisiológicos suponen el éxito o fracaso de la actividad piscícola.
Estructura Branquial
- Anatomía
Las branquias de los peces están localizadas en la región cefálica y están compuestas de varios pares de arcos ubicados en la faringe. Anclados a los arcos branquiales se encuentra un conjunto complejo de tejidos epiteliales, circulatorios y nerviosos. Los radios branquiales, constituidos por barras óseas o cartilaginosas, se localizan lateralmente proyectándose desde la base medial de cada arco branquial. Junto con el tejido conectivo presente entre éstos, forman el septo interbranquial7. Este septo sostiene muchas filas de filamentos branquiales carnosos que reciben la denominación de hemibranquias, que corren paralelamente a los radios branquiales, craneal y caudal. Los filamentos branquiales son la unidad funcional básica del tejido branquial. Un conjunto de hemibranquias craneales y caudales del mismo arco, son llamados también holobranquias8. En teleósteos, sólo están presentes cuatro pares de holobranquias y el septo interbranquial es mucho más reducido y únicamente se extiende hasta la base de los filamentos, permitiendo un mayor y más libre movimiento comparado con los elasmobranquios. No se distinguen aberturas branquiales externas en teleósteos, pero sí el opérculo, que protege la cámara branquial. En este grupo, el agua entra a la faringe desde la boca, pasando por los filamentos y la pared interior del opérculo, hasta salir vía caudal abriendo éste9.
- Anatomía y vascularización de los filamentos branquiales
En muchos peces los filamentos branquiales son largas y estrechas proyecciones laterales del arco branquial, que se alinean hacia el extremo de su parte distal. Los filamentos son planos aplanados dorso ventralmente y el área de su superficie se incrementa enormemente por pliegues secundarios denominados lamelas, las cuales tienen apariencia de placas delgadas con un centro vascular recubierto por un epitelio delgado. De esta característica resulta una pequeña distancia de difusión entre la sangre que inunda cada lamela y el agua para el intercambio. Esta distancia puede ser menor de una micra en peces activos y hasta 10 µm en peces menos activos10.
El filamento branquial es considerado como la unidad básica funcional de la branquia. Cada filamento es irrigado por sangre de la arteria filamental aferente (AFA), la cual se extiende a lo largo del filamento. La sangre en este vaso también viaja a lo ancho, a través de las lamelas. Esta sangre que fluye a través de la lamela drena en la arteria filamental eferente (AFE), que corre a lo largo del filamento y lleva sangre en dirección opuesta de la AFA11. Las lamelas están uniformemente distribuidas a lo largo del filamento y los espacios entre ellas son los canales por los cuales fluye el agua. Una mirada más cercana a una lamela individual revela que en esencia está compuesta de dos láminas epiteliales, sostenidas por una serie de células individuales llamadas células pilar. Olson12, indica que estas células son únicas en las branquias de los peces, formando el forro de la vasculatura respiratoria, soportando y definiendo los espacios sanguíneos lamelares, influyendo en la resistencia vascular y a su vez modulando los efectos metabólicos en las hormonas circulantes. Estudios en trucha arco iris permitieron evaluar el efecto de la acetilcolina sobre la resistencia branquial y su relación con los espacios entre este tipo celular13. Los espacios alrededor de las células pilar y entre las dos capas epiteliales, son inundadas con sangre, que fluye laminarmente a través de estos espacios (figura 1).
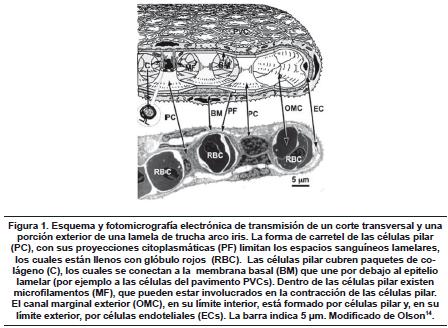
En todos los peces el flujo de agua a través de la branquia es "contra-corriente" al flujo sanguíneo. De esta manera la lamela está adaptada para el intercambio gaseoso, pero a su vez este es el medio para pérdidas o ganancias por difusión de iones y agua desde y hacia el ambiente15
- Sistema vascular
Existen dos vías de irrigación de la branquia: la vía arterio-arterial (respiratoria), donde la sangre viaja de la arteria branquial aferente (ABA), a una arteria filamental aferente (AFA), la cual corre a lo largo del filamento. La AFA distribuye la sangre a la lamela a través de las arteriolas lamelares aferentes (ALA) y la sangre lamelar es recibida por un conjunto de arteriolas lamelares eferentes (ALE), las cuales conducen a la arteria filamental eferente (AFE). La AFE retorna sangre del filamento a la arteria branquial eferente (ABE), la cual distribuye la sangre a la aorta dorsal para la circulación sistémica. La segunda vía de irrigación de la branquia se denomina vía arteriovenosa, en la que la sangre de la AFE puede ser distribuida a la circulación arteriovenosa, en este caso a los vasos interlamelares (VIL), por anastomosis postlamelar arteriovenosa o por arterias nutrientes (AN), las cuales vienen de AFE o ABE. Los VIL son presumiblemente drenados por venas branquiales (VB), las cuales retornan la sangre al corazón16. La figura 2 indica de manera general estas dos vías.

- El epitelio branquial, células branquiales y su papel en la regulación iónica
Perry18 indica que el epitelio que cubre el filamento branquial y la lamela, suministran un límite entre el ambiente externo del pez y los fluidos extracelulares, jugando un papel crítico en las funciones fisiológicas de la branquia. El epitelio branquial está compuesto por dos superficies epiteliales diferentes: el epitelio filamentoso y el epitelio lamelar (también llamados lamela primaria y secundaria, respectivamente), que a su vez están compuestos de tres diferentes tipos de células: células de moco o neuroepiteliales, células del pavimento (PVCs) o células epiteliales y células ricas en mitocondrias (MRCs.), o ionocitos o células de cloro. De estos tipos de células las más representativas son las PVCs y las MRCs, y comprenden respectivamente entre el 90% y el 15% del área de superficie epitelial19. Según Wilson y Laurent20, se definen las PVCs como células escamosas delgadas o de tipo cuboidal, que poseen una extensa superficie apical de tipo mucoso, aparato de Golgi desarrollado y retículo endoplasmático rugoso con numerosas vesículas, características que evidencian una alta actividad metabólica a pesar de tener muy pocas mitocondrias y son usualmente el primer tipo de célula que cubre los sitios de este tipo de intercambio en la lamela.
En las branquias de teleósteos de agua dulce, las PVCs pueden jugar un papel muy activo en la toma branquial de iones, principalmente de Na+ (asociado a bomba de protones) y en el transporte ácido-base. Los trabajos de Goss21, y Baylli, et al22, mencionan que en periodos de ácidosis respiratoria este tipo de células aumentan su área de superficie, permitiendo un mayor intercambio de Na+/H+. Goss, et al23, 24,25 reportan, por medio de estudios ultraestructurales del epitelio branquial del Catfish (Ictalurus nebulosus), la presencia de vesículas cerca de la membrana apical de las PVCs, las cuales se parecen a la ATPasa vacuolar rica en protones (V-ATPasa o bomba de protones). Este tipo de vesículas también se encuentran en otros epitelios iono reguladores26, como ejemplo en la vejiga urinaria de la tortuga y en los túbulos renales de los mamíferos. Un reporte de inmunolocalización en trucha arco iris (Onchorynchus mykiss), verifica la presencia de V-ATPasa en las PVCs27. Subsecuentes estudios de aproximación inmunológica realizados en tilapia (Oreochromis mossambicus) y en trucha arco iris (Onchorynchus mykiss), han verificado la presencia de V-ATPasa en PVCs28. Estudios más recientes de Galvez et al29. han aislado una subpoblación de PVCs ricas en mitocondrias (MR-PVCs) de la branquias de trucha arco iris que son ricas en V-ATPasa. Estas MR-PVCs, al parecer, también participan en el intercambio iónico y en la salida de protones (extrusión ácida).
Las MRCs, son consideradas como el sitio primario del influjo transepitelial de Cl- y Ca+2 y de la regulación ácido-base, por su relación con el antiporte Cl-/HCO3-. Son usualmente más comunes en el borde de salida del filamento branquial, así como también en las regiones entre la lamela individual, manteniendo su superficie basolateral en cercana proximidad con la circulación arteriovenosa. Por lo general, las MRCs son células de forma ovoide-alargada, alta polarización y con altas densidades de mitocondrias en su citoplasma30.
En las branquias de varias especies de teleósteos de agua dulce (Salmo salar; trucha café; Poecilia reticulata; Cobitis taenia; Gobio gobio y O. niloticus), se han detectado subtipos morfológicamente diferentes de MRC. Así se describen los subtipos α y β, basados en el grado de tinción con osmio (claro u oscuro) en el citoplasma31. Las funciones específicas de α y β –MRCs en teleósteos de agua dulce aún no han sido identificadas, pero no podría excluirse la posibilidad de que estas células representen diferentes actividades en la regulación ácido - base y/o sean estados de desarrollo de un solo tipo celular32. Galvez y colaboradores33 determinan los dos subtipos de células ricas en mitocondrias, que están asociadas con la reacción de aglutinación positiva o negativa a la lectina de Mani (PNA+(β)/PNA-(α)) y, junto a análisis de Western blotting, indican que ambos subtipos expresan altos niveles Na+-K+-ATPasa. Además PNA- muestra una mayor expresión (el doble) de V-ATPasa en relación a PNA+ y responde apropiadamente a estimulación por hipercapnia, incrementando la expresión de VATPasa. Estos resultados sugieren que el sitio de excreción de H+, está presente en el subtipo PNA-, que en unión con las PVCs, pueden ser los sitios de intercambio Na+/H+ (Influjo/Eflujo). Como resultado de este trabajo, Parks34 et al. proponen un nuevo modelo que implica que uno de los subtipos de células de cloro (PNA-) está involucrado en el intercambio Na+/H+, vía canal apical de Na+ en unión con una V-ATAPasa y que la salida del Na+ del interior de la célula de cloro está directamente acoplado a un cootransporte basolateral Na+/Base (NBC), en contraste con la teorá en la que se sostiene que la Na+-K+-ATPasa es la única ruta para la salida de Na+ al torrente sanguíneo.
Mecanismos de transporte iónico branquial
Para peces de agua dulce la consecuencia de vivir en un medio hiposmótico y de tener una gran área de superficie de intercambio (la branquia), sujeta a grandes gradientes externos como la pérdida continua de sales por difusión pasiva y una ganancia de agua por ósmosis, se ha convertido en un reto fisiológico al cual estos vertebrados han respondido de maneras muy particulares. Para el caso, los peces manejan la ganancia de agua mediante la producción de grandes cantidades de orina. Sin embargo esto supone una pérdida de iones, debido a que el riñón no es capaz de reabsorber todas las sales. Por esta razón, la toma branquial activa de Na+ y Cl- es crucial para mantener la homeostasis iónica35,35,36
Modelos para la entrada (influjo) de Na+
El modelo clásico para la toma de Na+, incorpora un cambiador electroneutral (antiporte) sensitivo a la amilorida Na+/H+ o Na+/NH4+ presente en la célula de cloro. Ambos representan un acoplamiento Na+/ácido38,39. Sin embrago otros reportes indican que los niveles de Na+ en el epitelio branquial son más elevados que los encontrados en el agua circundante (que usualmente son menores a 1mM). De esta manera, el gradiente electroquímico del Na+ a través de la membrana apical no podría favorecer un intercambio Na+/H+40,41. En consecuencia Avella y Bornancin42, trabajando con trucha arco iris (Salmo gairdneri), proponen un modelo alternativo para la toma de Na+, el cual implica su entrada a través de canales de Na+ presentes en la membrana apical, acompañada de un gradiente electroquímico creado por la salida activa de H+, mediada por un proteína de tipo vacuolar (V-ATPasa) o H+-ATPasa (bomba de protones) localizada apicalmente en las PVCs. Un trabajo posterior de Lin y Randall43, in vitro y de inmunolocalización de H+-ATPasa en branquias de trucha arco iris, da evidencia clara de la existencia de una bomba de protones activa (H+-ATPasa) en la membrana apical. Los autores concluyen que una bomba de protones indirectamente acoplada con un canal de Na+, en vez de los antiportes electroneutrales Na+/H+(NH4+), es la responsable para el influjo de Na+ y la excreción de H+ en peces de agua dulce, y que esta bomba está contenida tanto en las MRCs como en las PVCs. Por lo tanto, la toma del Na+ a través de las branquias probablemente tenga lugar en los dos tipos celulares.
Sin embargo, la pregunta de cuál de los dos tipos celulares es el responsable para la toma de Na+ en peces de agua dulce no está totalmente clara. Otras investigaciones sugieren evidencia clara de que las PVCs, más que las MRCs, son las responsables del influjo del Na+. Las investigaciones de Morgan et al44. en branquias de trucha café (Salmo trutta), revelan que los cambios en las concentraciones ambientales de Na+, tienen influencia directa sobre los niveles intracelulares de Na+ en las células del pavimento, sin afectar a las células de cloro. Para Sullivan43 y colaboradores, quienes trabajaron con trucha arco iris, la localización de V-ATPasa es exclusivamente las regiones apicales de las células del pavimento. Por otra parte, Goss y Perry46 afirman que durante periodos de ácidosis respiratoria (disturbios ácido-base) el área de superficie de exposición de las células de cloro se reduce y simultáneamente la tasa de entrada de Na+ y excreción ácida se incrementa, indicando que no existe una correlación entre la superficie de las células de cloro y los procesos mencionados.
En general, los modelos para la toma de Na+ han sido trabajados en salmónidos y tilapias de agua dulce, en los que la salida de protones a través de la V-ATPasa (v) genera el gradiente eléctrico necesario para conducir el Na+ a través de la superficie apical vía canal apical para el Na+ (ENaC). El paso de salida del Na+ a través de la membrana basolateral y del esperado rol de Na+-K+-ATPasa es aún poco claro, aunque también pueden estar presentes antiportes de la familia NHC147.
Modelo para la entrada (influjo) de Cl-
Según Marshall48, la naturaleza de la toma de Cl- a través del epitelio branquial no ha sido aún firmemente establecida. Sin embargo existe evidencia indirecta de que su absorción ocurriría vía cootransporte electroneutral apical de membrana (antiporte) Cl-/HCO3-. Este planteamiento ha sido apoyado por varios trabajos en los cuales, mediante adición de inhibidores de intercambiadores aniónicos al agua o mediante remoción del Cl-, se obtuvo una reducción en la tasa de influjo de Cl- y retención de HCO3-, desarrollando una alcalosis metabólica49,50. Para Perry y Laurent51, la proliferación de células de cloro en peces expuestos a ambientes pobres en iones parece ser una respuesta que incrementa la capacidad de transporte branquial para el Cl- y el Ca++. No obstante, pese a los trabajos desarrollados, se debe dilucidar el mecanismo a través del cual un intercambiador electroneutral para el Cl- podría operar bajo gradientes químicos desfavorables a través de la membrana apical. Una posible explicación podría ser que el antiporte esté conducido por un gradiente químico favorable para la base (HCO3-). Claro está que la concentración de Cl- intracelular es de 40 mmol L-1, y además la concentración intracelular de HCO3 -(2 mmolL-1) es insuficiente para superar el gradiente desfavorable del Cl-52. Es importante notar que la actividad intracelular del Cl- puede ser significativamente más baja que la concentración medida. Además, la concentración de Cl- en la capa límite de agua que está junto al epitelio no ha sido bien determinada.
Si se considera la concentración de Cl- y HCO3- tanto en el agua como en el interior de la célula, se pensaría en que un antiporte Cl-/HCO3- no sería operacional. Por esta razón Tresguerres et al53, proponen un nuevo modelo para la toma de Cl- que incluye un antiporte aniónico apical (AE), funcionalmente unido a la anhidrasa carbónica (AC) y al trabajo de una V-ATPasa en la membrana basolateral conectada al sistema tubular, la cual provee la suficiente fuerza conductora para vencer el gradiente desfavorable para el influjo de Cl-. Los autores han denominado a este arreglo como "metabolon", definido como un complejo de enzimas metabólicas o cualquier grupo proteico que actúan siempre efectuando una función metabólica particular. Su importancia metabólica, es debida a la unión estrecha entre enzimas que permite el rápido movimiento de metabolitos de un sitio activo a otro, lo que es conocido como canalización de sustratos. Las ventajas de este arreglo son limitar la pérdida de iones o metabolitos por difusión y crear un grupo específico de sustratos a altas concentraciones. Este modelo que resulta de la unión de AE, AC y V-ATPasa podría crear concentraciones de HCO3- lo suficientemente elevadas para conducir la toma de Cl- del agua vía AE.
Estudios de hibridización in situ demostraron la presencia de un ARN mensajero (mARN) específico para el antiporte Cl-/HCO3- en branquias de trucha. La señal de la hibridización fue más abundante en las regiones interlamelares. Estas regiones contienen la más alta densidad de células de cloro y, además, durante alcalosis metabólica la cantidad del mARN, incrementó marcadamente54, lo cual es consistente con lo reportado por Perry et al55, El modelo que indica la salida del Cl- del citosol al compartimiento extracelular puede ser presumiblemente a través de un canal basolateral de Cl-56; que implica además un antiporte electroneutral Cl-/HCO3- y el anión bicarbonato es suplido por la hidratación de CO2 en presencia de anhidrasa carbónica (CA), que pasa por difusión a través de la membrana basolateral al espacio intracelular57. Es preciso anotar que el transporte del Cl- del citosol hacia la sangre no está aún establecido, excepto para el modelo del metabolón.
La figura 3 resume los posibles caminos para el transporte de Na+, Cl- y Ca++ en un modelo de intercambio en una célula β de cloro (MRC) y en una célula del pavimento (PVC).
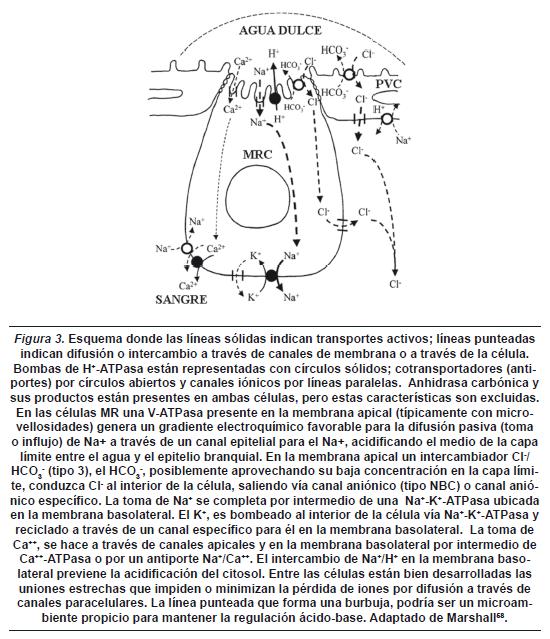
Por lo anterior el papel de los antiportes o de NHC no puede ser descartado, dados los vacios por dilucidar en los procesos de transporte o intercambio iónico.
Regulación ácido-base.
Al igual que en otros vertebrados, los peces pueden mantener su homeostasis del pH intra y extracelular. Como en mamíferos, los peces utilizan estrategias paralelas de excreción y sistemas buffer, que controlan las variaciones intra y extracelulares del pH59. Los procesos metabólicos celulares están constantemente generando compuestos ácidos, con la liberación de H+ e indirectamente la producción de CO2. Al mismo tiempo, el CO2 puede virar y ser convertido en H+ y HCO3-. Este proceso en la práctica se puede simplificar en la reacción de equilibrio CO2 + H2O ↔ H+ + HCO3-60. Bajo ciertas condiciones las branquias, el intestino y los riñones participan del intercambio ácido-base, pero es aceptado que el epitelio branquial es donde ocurre la mayoría de los movimientos ácido-base (90% o más)61.
Según Randall y Tsui62, la transferencia ácidobase a través del epitelio branquial es dominada por la excreción de gas carbónico (CO2) y amonio (NH3), pero especialmente por el primero, debido a que éste se excreta en mayores cantidades en comparación con el segundo. El amonio excretado por las branquias incrementa el pH y, por el contrario, el CO2 lo disminuye. Esta relación tiene una gran importancia en el aumento de la excreción de NH3, debido al atrapamiento de H+ por parte del NH3 para formar NH4+ (menos tóxico), pero la forma de excreción que predomina es la difusión de NH3 por su mayor permeabilidad. Sin embargo, es posible que la proporción de NH4+ excretado por difusión sea alrededor de un 2-3%. A su vez, el CO2 también puede ser excretado en forma de HCO3- a través de un intercambiador aniónico en la membrana apical de la branquia. Esta clase de excreción es considerada generalmente pequeña en relación al flujo de CO263. Según Goss y colaboradores64, existe una estrecha relación entre los mecanismos de regulación iónica y el balance ácido-base debido a que el Cl- es removido del agua en un intercambio por una base equivalente, el HCO3-, mientras que el Na+ es removido del agua en un intercambio por un ácido equivalente, el H+. Se puede indicar entonces que entender dichos mecanismos predice el comportamiento ácido-base.
En resumen, los mecanismos celulares y moleculares involucrados en el balance ácidobase son: 1, los antiportes (intercambiadores) de la familia NHE, principalmente los del tipo II y III que son típicos de la membrana apical y del tipo I en la membrana basolateral. Estos intercambiadores permiten la entrada de Na+ del agua y la salida de H+ del medio intracelular (II y III). Los del tipo I, permiten la entrada de Na+ al medio intracelular desde el plasma, acompañados con la salida de H+ del medio intracelular al plasma, según trabajos de inmunolocalización que soportan estos datos65. 2. Canales apicales (epiteliales) de Na+ en relación con una bomba de protones (H+-ATPasa/ENaC), concepción principalmente soportada por el trabajo de Avella y Bornancin, quienes indican que la salida de origen eléctrico de H+ por medio de una V-ATPasa en la membrana apical genera un potencial eléctrico negativo, el cual genera la fuerza conductora suficiente para el influjo de Na+ desde el exterior a pesar del bajo gradiente electroquímico, por medio de canales apicales de Na+. 3. Intercambiador o antiporte Cl-/HCO3-, responsable del intercambio aniónico en el epitelio branquial. Este modelo fue sugerido por Maetz, En el modelo propuesto por Wright et al66, se puede observar cómo el movimiento del CO2 a través del epitelio branquial puede modificar el pH del agua de la capa límite entre la membrana apical del epitelio y el agua del medio, todo mediado por la anhidrasa carbónica que actúa no sólo dentro de las célula epiteliales, sino también en la capa límite67.
Excreción de Nitrógeno.
Según Wood68, la desaminación del exceso de aminoácidos libera esqueletos de carbono que pueden ser conducidos dentro de rutas metabólicas como la gluconeogénesis y el ciclo del ácido cítrico, para la obtención de ácidos grasos, cuerpos cetónicos y carbohidratos, proceso que conlleva a una gran producción de amonio tóxico (NH3), que es excretado al medio principalmente por vía branquial. En los peces la mayor producción de amonio toma lugar en el hígado, aunque enzimas asociadas con la desaminación de aminoácidos pueden ser encontradas en otros tejidos tales como músculo, intestino y riñón69. En solución, el amonio está determinado por el equilibrio entre sus dos formas: no ionizado (NH3, tóxico) y ionizado (NH4+), siendo altamente dependiente de pH. La reacción indica esta relación: NH4+ + H2O ↔ NH3 + H3O+ 70. Además de la excreción, las concentraciones de amonio en el medio se pueden incrementar por la degradación de materia orgánica presente en los sedimentos y puede ser especialmente pronunciada cuando la nitrificación es impedida como resultado de bajas concentraciones de oxígeno. Otras condiciones que se suman a este aumento son las altas densidades de siembra y las actividades propias del hombre en sus procesos agroindustriales71,72. Estas concentraciones elevadas y/o crónicas de amonio causan daños en el epitelio branquial (hiperplasia, fusión lamelar, hipertrofia, necrosis y descamación), interfiriendo en los procesos de intercambio gaseoso, regulación iónica y regulación ácidobase, lo que conlleva a desbalances en la homeostasis, generando episodios de estrés que pueden conducir a la muerte73.
Existen varias razones que han influido para que los mecanismos de transporte de amonio a través del epitelio branquial aún permanezcan en controversia. Entre ellos está la dificultad para medir o controlar los gradientes transepiteliales del pH, presión parcial de NH3 y NH4+ y el potencial eléctrico que se genera en todo el pez o en el tejido que se esté estudiando. La mayoría de los datos experimentales soportan principalmente tres caminos para la excreción de amonio: 1, Difusión de NH3 y de NH4+; 2, Difusión de NH3 y atrapamiento y 3, Antiporte Na+/NH4+. No existe un mecanismo exclusivo, y su contribución cuantitativa está determinada por factores externos del agua como salinidad, pH y capacidad buffer.
1. Difusión de NH3
Como se describió anteriormente, la mayor parte del amonio total que cruza el epitelio branquial lo hace en forma de NH3, bajo un gradiente de difusión favorable entre la sangre y el agua. Este mecanismo está soportado por los siguientes argumentos: a) La disminución moderada del pH externo implica una caída en la concentración de NH3 vía protonación. Esto genera un incremento en la tasa de excreción de amonio total, lo cual es observado en trucha arco iris74, carpa75 y goldfish76. b) Según Cameron y Heisler77, en trucha arco iris el incremento en el pH externo del medio incrementa la concentración de NH3 en el exterior debido a la pobre disponibilidad de H+ en el medio para conjugarse y formar NH4+, lo cual influye en la disminución de la tasa de flujo de amonio total y c), el mismo autor, usando inyecciones con NH4Cl o (NH4)2SO4 (cloruro de amonio o sulfato de amonio) en trucha arco iris y en bagre del canal78 (chanel catfish), causan un incremento inicial en la excreción de amonio total, lo cual favorece la red de excreción ácida y sugiriendo que al menos algo de la infusión o solución inyectada de amonio ionizado se disocia y cruza las branquias como NH3. La difusión de NH4+ es probablemente mínima en peces de agua dulce, debido a su baja permeabilidad con respecto al epitelio branquial, pero Karnaky79, indica que factores hormonales podrían estar implicados modificando la permeabilidad de la membrana apical para que el NH4+ pase a través de las uniones estrechas entre las células epiteliales (caminos paracelulares). En este sentido se sabe que la acción de la prolactina reduce la permeabilidad del epitelio branquial a los iones y al agua, pero nada se sabe de su acción frente a la permeabilidad branquial para el NH4+ 80.
2. Difusión de NH3 y atrapamiento
Teóricamente, sostener la difusión de NH3 dependería de la remoción constante de NH3 de la capa límite debido a que la acumulación de NH3 en esta capa podría reducir la presión parcial del gradiente de difusión (pNH3). Para esto existen dos vías de remoción: una, físicamente a través de difusión continuada del flujo que viene de las branquias hacia la capa límite y luego al agua del medio y, la otra, por remoción química uniéndose (atrapamiento) con el ión H+ para formar NH4+ en la capa límite. Mantener los gradientes de difusión de NH3 a través de la branquia podría depender de la disponibilidad de iones H+ en la capa límite, lo cual facilitaría tal conversión o atrapamiento. Un posible papel de la anhidrasa carbónica sería servir de catalizador para la conversión de CO2 excretado como HCO3- + H+ en la capa límite, proceso que supliría los iones H+ para el atrapamiento81.
3. Antiporte Na+/NH4+.
En este modelo, el influjo de Na+ a través de la membrana apical en la branquia es unido a la salida de NH4+, el cual reemplaza el ión H+ en el antiporte electroneutral Na+/H+. Esta hipótesis fue formulada a partir de observaciones a través de la adición de amilorida con remoción del Na+ del agua externa e inyecciones de sales de amonio. La primera implica una reducción de la tasa de excreción de amonio y la segunda incrementa la absorción de Na+ 82. Wilson et al83, quienes trabajaron en trucha arco iris, no encontraron evidencia directa de un intercambiador Na+/NH4+ aplicando la misma metodología de Maetz. Ampliamente debatidos por varios autores, indican que el antiporte Na+/NH4+ necesitaría ser energizado para poder funcionar, debido a los gradientes bajos del Na+ en el exterior con respecto a su concentración interna, que imposibilitarían si influjo84,85,86. Estas afirmaciones reafirman el modelo presentado por Avella y Bornancin87 quienes descartan el antiporte (al menos para peces de agua dulce) y explican la entrada de Na+ a través de un canal epitelial en relación con una V-ATPasa. Wilkie88 indica que este modelo es casi específico para peces marinos y que, bajo ciertas circunstancias, en peces de agua dulce el NH4+ podría competir con el Na+ o con el K+ de la Na+-K+ ATPasa o con el antiporte Na+/2Cl-/K+ de la membrana basolateral. Aunque el reto para futuras investigaciones sería identificar una potencial Na+NH4+-ATPasa en la membrana basolateral.
Concluyendo, bajo condiciones normales, el CO2 excretado a través de las branquias es hidratado en la capa límite o en el citosol de la célula branquial (célula de cloro), para formar H+ y HCO3-; además, el H+ generado, tanto de la hidratación del CO2 y por medio de la VATPasa, acidifican la capa límite. Esta acidificación implica el atrapamiento del NH3 a NH4+, que permite la difusión pasiva de más NH3 a través de la membrana branquial (incremento de gradientes de presión parcial favorables para pNH3, entre el citosol y la capa límite). Estos gradientes son conservados aún bajo condiciones ambientales elevadas de pH y amonio. El amonio que entra por difusión pasiva a la branquia podría estar relacionado con un única Na+/NH4+-ATPasa desde el plasma a través de la membrana basolateral. El posible papel de poros acuosos (acuaporinas) y su participación en el transporte de iones y metabolitos en la membrana apical aún está por resolverse, pero ellos podrían estar implicados en la difusión pasiva del NH389 teniendo presente que en la generalidad que el NH3 es capaz de atravesar las membranas biológicas, debido a su apolaridad. La figura 4 resume las posibles vías de excreción de amonio a nivel del epitelio branquial.
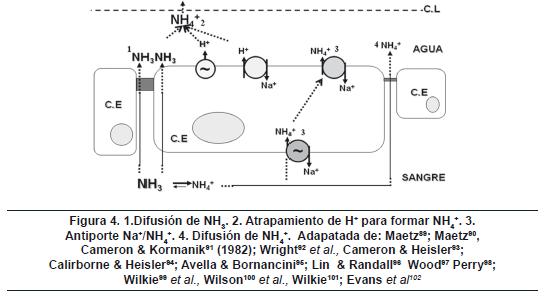
Excreción de amonio bajo condiciones anormales
Según varios autores, los peces tienen respuestas que están directamente asociadas con la concentración de amonio en el medio externo, a la cantidad y calidad de la dieta, a los periodos de ayuno y a factores fi sicoquímicos entre los cuales se destaca el pH. Los tipos de respuestas van desde la conversión de amonio a sustancias menos tóxicas, como glutamina103 y urea104; incremento de enzimas específicas para la disponibilidad de aminoácidos105 (GDH Glutamina deshidrogenasa y AAT alanina aminotransferasa) y la reducción en la producción de amonio; volatilización de amonio en la forma NH3106, excreción activa de iones de amonio y mantenimiento hasta donde les es posible de las condiciones de acidez en la capa límite107, además de modificar la morfología de las células que participan en los intercambios iónicos en el epitelio branquial108 (células de cloro y células del pavimento). Es de anotar que muchas de estas respuestas están ligadas con las variaciones ácido-base y con el intercambio iónico. Cuando estos mecanismos no funcionan, el pez se enfrenta a una serie de acontecimientos que pueden bloquear todos los transportadores asociados, crear un desbalance iónico y ácido-base, perder la homeostasis y conducirlo a la muerte.
Según Baldisserotto109, la influencia del pH ácido en los mecanismos de transporte iónico en el epitelio branquial se traduce posiblemente en bloqueo de la bomba de protones, impidiendo la entrada de Na+ ya sea por los canales apicales o por el antiporte Na+NH4+, causando acidosis metabólica al interior de la célula y acumulación de NH4+. Si estas condiciones se mantienen, el pez perdería su homeostasis y moriría. Por el contrario, si el pH es alcalino, el sistema de atrapamiento de NH3 se vería seriamente afectado y, en esta circunstancia, el amonio no podría ser excretado y sería acumulado en la célula. Otro sistema afectado sería el antiporte Cl-/HCO3-, causando alcalosis metabólica y potencializando la toxicidad del amonio al interior de la célula.
Se puede concluir que el epitelio branquial posee una serie de mecanismos para transportar los iones de Na+ y Cl-, los que a su vez están involucrados en la excreción de iones de amonio y equivalentes ácido – base. Desafortunadamente la compleja estructura de las branquias no ha permitido aclarar de manera contundente los diferentes modelos propuestos para el transporte iónico, teniendo en cuenta que el transporte iónico en peces de agua dulce involucra varios tipos celulares y que el medio dulceacuícola varía ampliamente en su composición (los sistemas de agua dulce son todos temporales), lo que hace que la confirmación científica en laboratorio sea más difícil. Desde hace tres décadas la combinación de estudios in vivo, combinados con aproximaciones integrales usando técnicas celulares, bioquímicas, inmunológicas y moleculares, han incrementado substancialmente el entendimiento de los mecanismos branquiales bajo los cuales se da la regulación ácido – base en peces.
Este panorama indica entonces que existe un campo totalmente inexplorado sobre los mecanismos que mantienen la homeostasis en los peces y que los trabajos para nuestras especies están aún por realizarse. Las nuevas herramientas moleculares podrían ayudar a elucidar la contribución de varios procesos de transporte de membrana a la regulación del balance ácido – base, al transporte iónico y a la excreción de metabolitos asociados con estos procesos. Entre los retos queda mantener la habilidad para integrar las diferentes disciplinas para obtener una imagen clara de cómo funcionan las branquias de los peces y cómo tales procesos determinan el bienestar de estos animales.
Referencias
1. MOYLE, Peter B. and CECH, Joseph J. Fishes an introduction to ichthyology. 5 ed. Estados Unidos: Pearson Education, 2004. 726. [ Links ]
2. EVANS, David Hudson; PIERMARINI, Peter M. and CHOE, Keith P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous Waste. En: Physiological Reviews. 2005. vol. 85, no. 1, p. 97-177. [ Links ]
3. OLSON, Kenneth R. Vasculature of the fish gill: anatomical correlates of physiological functions. En: Journal of Electron Microscopy Technique. December, 1991. vol. 19, no. 4, p. 389-405. [ Links ]
4. ROMBOUGH, Peter JR. The gill of fish larvae. Is it primarily a respiratory or an ionoregulatory structure?. En: Journal of Fish Biology. 1999. vol. 55, (Supplement A). p. 186-204. [ Links ]
5. SALAMA, A.; MORGAN, I.J. and WOOD, Chris M. The linkage between Na+ uptake and ammonia excretion in rainbow trout: kinetic analysis, the effects of (NH4)2SO4 and NH4HCO3 infusion and the influence of gill boundary layer pH. En: Journal of Experimental Biology. March, 1999. vol. 202, parte 6, p. 697-709. [ Links ]
6. CLAIRBORNE, James B.; EDWARS, S.L. and MORRISON-SHETLAR, A., I. acid–base regulation in fishes: cellular and molecular mechanisms. En: Journal of Experimental Zoology. August, 2002. vol. 293, no. 3, p. 302-319. [ Links ]
7. WILSON, JM. and LAURENT, Pierre. Fish gill morphology: Inside out. En: Journal of Experimental Zoology. August, 2002. vol. 293, no. 3, p. 192-213. [ Links ]
8. MOYLE. Op. cit., p. 38. [ Links ]
9. LAURENT, Pierre; HEBIBI, N. Gill morphology and fish osmoregulation. En: Canadian Journal of Zoology. 1989. vol. 67, p. 3055–3063. [ Links ]
10. EVANS, David Hudson. The fish gill: Site of action and model for toxic effects of environmental pollutants. En: Environmental Health Perspectives. 1987. vol. 71, p. 47-58. [ Links ]
11. WILSON. Op. cit., p. 194. [ Links ]
12. OLSON. Op. cit. p. 340. [ Links ]
13. BOOTH, John H. The effects of oxygen supply, epinephrine, and acethylcholine on the distribution of blood flow in trout gills. En: Journal of Experimental Biology. 1970. 83: 31–40. [ Links ]
14. OLSON, Kenneth R. Vascular anatomy of the fish gill. En: Journal of Experimental Zoology. August, 2002. vol. 293, no. 3, p. 214-231. [ Links ]
15. Ibid., p. 214-216. [ Links ]
16. OLSON, Kenneth R. Gill circulation: regulation of perfusion distribution and metabolism of regulatory molecules. En: Journal of Experimental Zoology. 2002. vol. 293, no. 3, p. 320-335. [ Links ]
17. OLSON. Op. cit., 214-216. [ Links ]
18. PERRY, Steve F. The chloride cell: Structure and function in the gills of freshwater fishes. En: Annual Review Physiology. October, 1997. vol. 59; p. 325-347. [ Links ]
19. EVANS. Op. cit., p. 101. [ Links ]
20. WILSON. Op. cit., p. 199. [ Links ]
21. GOSS, Greg G., et al. Morphological responses of the rainbow trout (Oncorhynchuis mykiss) gill to hiperoxia, base (NaHCO3) and acid (HCl) infusions. En: Fish Physiology Biochemestry. 1994 a. vol. 12, no. 6, p. 465-477. [ Links ]
22. BAILLY, Y.; DUNELER, S. and LAURENT, Pierre. The neuroepithelial cells of the fish gill filamentindolamine-immunocytochemistry and innervation. En: The Anatomical Record. May, 1992. vol. 233, no. 1, p. 143–161. [ Links ]
23. GOSS, Greg G.; LAURENT, Pierre and PERRY, Steve F. Gill morphology and acid-base regulation during hypercapnic ácidosis in the brown bullhead, Ictalurus nebulosus. En: Cell Tissue Research. 1992; 268: p. 539-552. [ Links ]
24. -, et al. Mechanisms of ion and acidbase regulation at the gills of freshwater fish. En: Journal of Experimental Zoology. August, 1992. vol. 263, no. 2, p. 143-159. [ Links ]
25. -; LAURENT, Pierre and PERRY, Steve F. Gill morphology during hypercapnia in brown bullhead (Ictalurus nebulosus): role of chloride cells and pavement cells in acid-base regulation. En: Journal of Fish Biology. 1994. vol. 45, no. 5, p. 705-718. [ Links ]
26. -; LAURENT Pierre and PERRY Steve F. Proton pumps in fish gill pavement cells? En: Archives Internationales de Physiologie de Biochemie et de Biophysique. January, 1994, vol. 102, no. 1, p. 77–79. [ Links ]
27. LIN, Hong, et al. Immunolocalization of H+-atpase in the gill epithelia of rainbow trout. En: The Journal of Experimental Biology. 1994. vol. 195, no. 1, p. 169-183. [ Links ]
28. WILSON, J.M., et al. NaCl uptake by the branchial epithelium in freshwater teleost fish: an immunological approach to ion-transport protein localization. En: The Journal of Experimental Biology. 2000. vol. 203, no. 15, p. 2279-2296. [ Links ]
29. GALVEZ, Fernando, et al. Isolation and characterization of mitochondria-rich cell types from the gill of freshwater rainbow trout. En: American Journal Physiological Regulatory Integrative and Comparative Physiology. March, 2002. vol. 282, no. 3, p. R658-R668. [ Links ]
30. EVANS, David Hudson; PIERMARINI, Peter M. and POTTS, W.T.W. Ionic transport in the fish gill epithelium. En: Journal of Experimental Zoology. 1999. vol. 283, no. 7, p. 641-652. [ Links ]
31. PISAM, MFG, et al. Ultrastructural features of mitochondria-rich cells in stenohaline freshwater and seawater fishes. En: The American Journal of Anatomy. January, 1990. vol. 187, no. 1, p. 21–31. [ Links ]
32. -, et al. Chronology of the appearance of beta, a, and alpha mitochondria-rich cells in the gill epithelium during ontogenesis of the brown trout (Salmo trutta). En: The Anatomical Record. July, 2000. vol. 259, no. 3, p. 301–311. [ Links ]
33. GALVEZ. Op. cit., p. R660. [ Links ]
34. PARKS, S.K.; TRESGUERRES, M. and GOSS, G.G. Interactions between Na+ channels and Na+-HCO3- cotransporters in the freshwater fish gill MR cell: a model for transepithelial Na+uptake. En: American Journal of Physiology. Cell Physiology. February, 2007. vol. 292, no. 2, p. C935-C944. [ Links ]
35. MOTAIS, R. and GARCIA-ROMEU, F. Transport mechanisms in the teleostean gill and amphibian skin. En: Annual Review of Physiology. March. 1972. vol. 34; p. 141-176. [ Links ]
36. EVANS, David Hudson. Osmotic and Ionic Regulation. En: The Physiology of Fishes. Maryland: Boca Raton: CRC Press, 1993. p. 315-341. [ Links ]
37. MARSHALL, William S. Na+, Cl-, Ca2+ and Zn2+ Transport by fish gills: retrospective review and prospective synthesis. En: Journal of Experimental Zoology. 2002. vol. 293, p. 264-283. [ Links ]
38. MAETZ, J. Fish gills: mechanisms of salt transfer in fresh water and sea water. A discussion on active transport of salts and water in living tissues. En: Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 1971. vol. 262, p. 209-249. [ Links ]
39. -. Na+/NH4 +, Na+/H+ exchanges and NH3 movement across the gill of Carassius auratus. En: The Journal of Experimental Biology. 1973. vol. 58, p. 255-275. [ Links ]
40. LIN, Hong and RANDALL, D.J. Proton pumps in fish gills. En: WOOD, Chris M. and SHUTTLEWORTH, T.J. (eds). Cellular and molecular approaches to fish ionic regulation. New York: Academic Press Inc., 1995. p. 229-255. [ Links ]
41. WILKIE, M.; LAURENT, Pierre and WOOD, Chris M. The physiological basis for altered Na1 and Cl2 movements across the gills of rainbow trout (Oncorhynchus mykiss) in alkaline (pH 5 9.5) water. En: Physiological and Biochemical Zoology. 1999. vol. 72, p. 360-368. [ Links ]
42. AVELLA, Martine and BORNANCIN, Michel. A new analysis of ammonia and sodium transport through the gills of the freshwater rainbow trout (Salmo Gairdneri). En: The Journal of Experimental Biology. 1989. vol. 142, p. 155-175. [ Links ]
43. LIN, Hong and RANDALL, D.J. H+-ATPase activity in crude homogenates of fish gill tissue: inhibitor sensitivity and environmental and hormonal regulation. En: The Journal of Experimental Biology. 1993. vol. 180, no. 1, p. 163-174. [ Links ]
44. MORGAN, I.J., POTTS, W.T.W. & OATES, K. Intracellular ion concentrations in branchial epithelial cells of brown trout (Salmo trutta) determined by x-ray microanalysis. En: The Journal of Experimental Biology. September, 1994. vol. 194, no. 1, p. 139-151. [ Links ]
45. SULLIVAN, Gary V.; FRYER, James N. and PERRY, Steve F. Immunolocalization of proton pumps (H+-atpase) in pavement cells of rainbow trout gill. En: The Journal of Experimental Biology. 1995. vol. 198, p. 2619-2629. [ Links ]
46. GOSS, Greg G. and PERRY, Steve F. Different mechanisms of acid-base regulation in rainbow trout (Oncorhynchuis mykiss) an American eel (Anguilla rostrata) during NaHCO3 infusion. En: Physiologycal Zoology. 1994. vol. 67, p. 381-406. [ Links ]
47. CLAIRBORNE; EDWARS and MORRISON A.I. Acid–base regulation in fishes: cellular and molecular mechanisms. Op. cit., 302-319. [ Links ]
48. MARSHALL, William. Transport processes in isolated teleost epithelia: opercular epithelium and urinary bladder. En: WOOD, Chris M. and SHUTTLEWORTH, T.J. (eds). Cellular and molecular approaches to fish ionic regulation. New York: Academic Press Inc., 1995. p. 1-23. [ Links ]
49. PERRY, Steve F., et al. Branchial ionic uptake and acid-base regulation in the rainbow trout, Salmo gairdneri. En: The Journal of Experimental Biology. 1981. vol. 92, p. 289-303. [ Links ]
50. MARSHALL, William S. Rapid regulation ofIon transport in mitochondrion-rich cells. En: KAPOOR, B.G.; BALDISSEROTTO, B. and MANCERA, J. (Eds.). Enfield, New Hampshire: Science Publishers Inc., pp. 395-426. [ Links ]
51. PERRY, Steve F. and LAURENT, Pierre. Adaptational responses of rainbow trout to lowered external NaCl concentration: contribution of the branchial chloride cell. En: The Journal of Experimental Biology.1989. vol. 147, p. 147-168. [ Links ]
52. MORGAN. Op. cit., p 141. [ Links ]
53. TRESGUERRES, M., et al. Chloride uptake and base secretion in freshwater fish: A transepithelial ion-transport metabolon? En: Physiological and Biochemical Zoology. November-December. 2006. vol. 79, no. 6, p. 981-996. [ Links ]
54. SULLIVAN, Gary V.; FRYER, J.N. and PERRY, Steve F. Localization of mRNA for proton pump (HC-ATPase) and Cl-/HCO-3 exchanger in rainbow trout gill. En: Canadian Journal of Zoology. 1996. vol. 74, p.2095-2103. [ Links ]
55. PERRY. Op. cit., p. 293. [ Links ]
56. EVANS. Op. cit., p. 649. [ Links ]
57. GOSS, Greg G., et al. Gill morphology and acid-base regulation in freshwater fishes. En: Comparative Biochemistry and Physiology Part A, Molecular and Integrative Physiology. January, 1998. vol. 119, no. 1, p. 107–115. [ Links ]
58. CLAIRBORNE, James B. and HEISLER, N. Acid-base regulation and ion transfers in the carp (Cyprinus carpio): ph compensation during graded long- and short-term environmental hypercapnia, and the effect of bicarbonate infusion. En: The Journal of Experimental Biology. 1986. vol. 126, p. 41-61. [ Links ]
59. GEORGALIS, T.; PERRY, S.F. and GILMOUR, K.M. The role of branchial carbonic anhydrase in acid–base regulation in rainbow trout (Oncorhynchus mykiss). En: The Journal of Experimental Biology. February, 2006. vol.209, (part 3), p. 518-530. [ Links ]
60. FERREIRA, F.W. and BALDISSEROTTO, B. Diet and osmoregulation. En: KAPOOR, B.G.; BALDISSEROTTO, B. and MANCERA, J. (Eds.). Enfield, New Hampshire: Science Publishers Inc., 2007. p. 67-83. [ Links ]
61. RANDALL, D.J. and TSUI, T.K.N. Acid–base transfer across fish gills. En: The Journal of Experimental Biology. April, 2006. vol. 209, (Pt.7), p. 1179-1184. [ Links ]
62. WEIHRAUCH, Dirk.; WILKIE, Michael P. and WALSH, Patrick J. Ammonia and urea transporters in gills of fish and aquatic crustaceans. En: The Journal of Experimental Biology. June, 2009. vol. 212, (Pt. 11), p. 1716-1730. [ Links ]
63. GOSS, Greg P. and LAURENT, Pierre. Ultraestructural and morphometric studies on Ion acid – base transport processes in freshwather fish. En: Fish Physiology. 1995. Vol. 14, p. 257-284. [ Links ]
64. WILSON, J.M. The use of immunochemistry in the study of branchial Ion transport mechanisms. En: KAPOOR, B.G.; BALDISSEROTTO, B. and MANCERA, J. (Eds.). Enfield, New Hampshire: Science Publishers Inc., 2007. p. 359-394. [ Links ]
65. WRIGHT, P.A.; RANDALL, D.J. and PERRY, S.F. Fish gill water boundary layer: a site of linkage between carbon dioxide and ammonia excretion. En: Journal Comparative Physiology B, Biochemical Systemic and Environmental Physiology. 1989. vol. 158, no. 6, p. 627-635. [ Links ]
66. NAWATA, C.M. and WOOD, Chris M. The effects of CO2 and external buffering on ammonia excretion and Rh glycoprotein mRNA expression in rainbow trout. En: The Journal of Experimental Biology. October, 2008. vol. 211, (Pt.20), p. 3226-3236. [ Links ]
67. WOOD, Chris M. Ammonia and urea metabolism and excretion En:. The Physiology of Fishes. Maryland: Boca Raton: CRC Press, 1993. p. 379–425. [ Links ]
68. WILKIE, M.P. Ammonia excretion and urea handling by fish gills: Present understanding and future research challenges. En: The Journal of Experimental Zoology. August, 2002. vol. 293, no. 3, p. 284-301. [ Links ]
69. UNITED STATES ENVIRONMENTAL PROTECTION AGENCY. Ambient water quality criteria for ammonia. Washington, D.C: EPA, Environmental, Protection, Agency, EPA, 1998; p. 1-160. [ Links ]
70. HARGREAVES, John A. Nitrogen biogeochemistry of aquaculture ponds. Review. En: Aquaculture. July, 1998. vol. 166, no. 3-4, p.181-212. [ Links ]
71. EVANS. Op. cit., p. 47-58. [ Links ]
72. SMART, Geoffrey. The effect of ammonia exposure on gill structure of the rainbow trout (Salmo gairdneri). En: Journal of Fish Biology. 1976. vol. 8, no. 6, p. 471-475. [ Links ]
73. AVELLA. Op. cit., p. 157. [ Links ]
74. CLAIRBORNE. Op. cit., p. 45. [ Links ]
75. MAETZ. Op. cit., p. 260. [ Links ]
76. CAMERON, James N. and HEISLER, N. Studies of ammonia in the rainbow trout: physicochemical parameters, acidbase behaviour and respiratory clearance. En: The Journal of Experimental Biology. 1983. vol. 105, p. 107-125. [ Links ]
77. - and KORMANIK, G.A. The acid-base responses of gill and kidneys to infused acid and base loads in the channel catfish, Ictalurus punctatus. En: The Journal of Experimental Biology. 1982. vol. 99, no. 1, p. 143-160. [ Links ]
78. KARNAKY, K.J. Osmotic and ionic regulation. En: The Physiology of Fishes. Maryland: Boca Raton: CRC Press, 1993. p. 157–176. [ Links ]
79. ZHOU B., et al. Effects of cortisol and prolactin on Na+ and Cl- transport in cultured branchial epithelia from fresh water rainbow trout. En: American Journal of Physiology Regulatory, Integrated and Comparative Physiology. December, 2003. vol. 285, no. 6, p. R1305–R1316. [ Links ]
80. WILKIE, Michael P. Mechanisms of ammonia excretion across fish gills. review. En: Comparative Biochemistry and Physiology Part A: Physiolog. September, 1997. vol. 118, no. 1, p. 39–50. [ Links ]
81. MAETZ. Op. cit., p. 240. [ Links ]
82. WILSON, R.W., et al. Ammonia excretion in freshwater trout (Onchorhynchus mykiss) and the importance of gill boundary layer acidification: lack of evidence for Na+/NH4+ exchange. En: The Journal of Experimental Biology. 1994. vol. 191, no. 1, p. 37–58. [ Links ]
83. KERSTETTER, Theodore H. and KEELER, Michael. On the interaction of NH4+ and Na+ fluxes in the isolated trout gill. En: The Journal of Experimental Biology. 1976. vol. 64, p. 517–527. [ Links ]
84. PAYAN, P.; MATTY, A.J. and MAETZ, J. A study of the sodium pump in the perfused head preparation of the trout Salmo gairdneri in freshwater. En: Journal Comparative Physiology. 1975. vol. 104, p. 33–48. [ Links ]
85. WILKIE. Op. cit., p. 44. [ Links ]
86. AVELLA. Op. cit., p. 170. [ Links ]
87. WILKIE. Op. cit., p. 46. [ Links ]
88. CUTLER, Christopher P., and CRAMB, Gordon. Branchial expression of an aquaporin 3 (AQP-3) homologue is downregulated in the European eel Anguilla anguilla following seawater acclimation. En: The Journal of Experimental Biology. 2002. vol. 205, p. 2643–2651. [ Links ]
89. ANDERSON, P.M., et al. Glutamine synthetase expression in liver, muscle, stomach and intestine of Bostrichthys sinensis in response to exposure to a high exogenous ammonia concentration. En: The Journal of Experimental Biology. 2002. vol. 205, p. 2053-2065. [ Links ]
90. SAHA, N., et al. Role of ureogenesis in tackling problems of ammonia toxicity during exposure to higher ambient ammonia in the air-breathing walking catfish Clarias batrachus. En: Journal of Biosciences. December, 2003. vol. 28, no. 6, p. 733-742. [ Links ]
91. IP, Y.K., et al. Chronic and acute ammonia toxicity in mudskippers, Periophthalmodon schlosseri and Boleophthalmus boddaerti: brain ammonia and glutamine contents, and effects of methionine sulfoximine and MK801. En: The Journal of Experimental Biology. May, 2005. vol. 208, (Pt 10) p. 1993-2004. [ Links ]
92. SANCHEZ-MUROS, M.J., et al. Long-term nutritional efects on the primary liver and kidney metabolism in rainbow trout. Adaptive response to starvation and a high-protein, carbohydratefree diet on glutamate dehydrogenase and alanine aminotransferase kinetics. En: The International Journal of Biochemistry & Cell Biology. January, 1998. vol. 30, no. 1, p. 55–63. [ Links ]
93. LIN, Hong L., and RANDALL, D.J. The effect of varying water pH on the acidification of expired water in rainbow trout. En: The Journal of Experimental Biology. 1990. vol. 149, p. 149–160. [ Links ]
94. GOSS, Greg G., et al. Mechanisms of ion and acid-base regulation at the gills of freshwater fish. En: The Journal of Experimental Zoology. August, 1992. vol. 263, no. 2, p. 143–59. [ Links ]
95. BALDISSEROTTO, B. Fisiologia de peixes aplicada à piscicultura. Santa Maria, Brasil: Editorial UFSM, 2002. 106 p. [ Links ]














