Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.8 no.1 Caldas Jan./June 2011
Artículo de revisión / Review article / Artigo de revisão
El calcio en el desarrollo de alimentos funcionales
Calcium in the development of functional food
O cálcio no desenvolvimento de alimentos funcionais
* Grupo de Investigación GIAS. Departamento de Alimentos. Facultad de Química Farmacéutica. Universidad de Antioquia.
** Departamento de Farmacia. Facultad de Química Farmacéutica. Universidad de Antioquia.
Correspondencia: Francia Elena Valencia García. e-mail: francia.valencia@gmail.com
Artículo recibido: 22/11/2010; Artículo aprobado: 25/04/2011
Resumen
Hábitos inadecuados en el consumo de alimentos que contienen calcio hace que se presenten desbalances en la dieta, que conducen a la aparición de trastornos en la salud, entre ellos, la osteoporosis. El calcio es un elemento vital para el organismo y la existencia de este en el organismo depende exclusivamente del consumo en la dieta. La sensibilización en los consumidores frente a los problemas de salud ha llevado a las empresas a desarrollar alimentos adicionados con calcio, que hagan parte de la rutina de la alimentación, innovando productos o mejorando los existentes con mayor valor agregado. Para estos desarrollos es importante conocer algunos parámetros que son tratados en este artículo.
Palabras clave: calcio, alimentos funcionales, estudio biológico.
Abstract
Inadequate habits in the consumption of food that contains calcium causes dietary misbalances which drive to health problems, such as osteoporosis. Calcium is a vital element for the body, and its existence in it depends exclusively on its consumption in the diet. Consumer awareness about health problems has driven companies to develop food with calcium additions, aiming to make them a part of the feeding routine, innovating products or improving the quality of those that already exist with a higher added value. For these developments it is important to get familiar with some parameters mentioned in this article.
Key words: calcium, functional food, biological study.
Resumo
Hábito inadequado no consumo de alimentos que contêm cálcio faz que se apresentem desbalances na dieta, que conduzem à aparição de transtornos na saúde, entre eles, a osteoporose. O cálcio é um elemento vital para o organismo e a existência deste no organismo depende exclusivamente do consumo na dieta. A sensibilização nos consumidores frente aos problemas de saúde levou às empresas a desenvolver alimentos adicionados com cálcio, que façam parte da rotina da alimentação, inovando produtos ou melhorando os existentes com maior valor agregado. Para estes desenvolvimentos é importante conhecer alguns parâmetros que são tratados neste artigo.
Palavras Importantes: cálcio, alimentos funcionais, estudo biológico.
Introducción
Actualmente se ha incrementado el interés por consumir alimentos que nutran y además mejoren las condiciones de salud1-4. Los alimentos adicionados con calcio se encuentran en este grupo, ya que varios estudios coinciden en afirmar que su consumo mejora la salud de los huesos 5. El cuerpo no produce minerales y su presencia en el organismo depende exclusivamente del consumo en la dieta6; por tal razón, una dieta variada que contenga fuentes de calcio como la leche y los productos lácteos aseguran el aporte de éste para una buena salud. Sin embargo, en muchos países se ha observado que el consumo de calcio y otros minerales decrece gradualmente. Con el fin de mejorar la ingesta de calcio de los consumidores, se ha incrementado el desarrollo de alimentos fortificados7-10.
Colombia no es ajena a esta problemática. Estudios realizados en la ciudad de Cartagena muestran que la ingesta promedio de calcio es baja, además de haber encontrado otros factores como el poco hábito de hacer ejercicio físico, hipertensión arterial y sobrepeso que pueden predisponer a la osteoporosis. Los anteriores factores hacen imprescindible el desarrollo y la aplicación de estrategias de tipo médico y nutricional, que incentiven la inclusión en la dieta de productos alimenticios adicionados o enriquecidos en calcio, en virtud del papel benéfico que este elemento tiene en la salud11.
Para el presente artículo se hizo una revisión de las bases de datos: Current Contents/ EBSCO/ SCIRUS/ MEDLINE/ para el período comprendido entre 1998- 2009.
Este artículo tiene como objetivo presentar el estado actual del conocimiento en lo relacionado con el desarrollo de alimentos adicionados o fortificados con calcio.
El calcio y la salud
Los minerales son sustancias orgánicas requeridas por el cuerpo para una variedad de funciones12-14. En el hombre los minerales se encuentran entre el 4 - 15% de su peso corporal. El 50% corresponde a calcio, el 25% a fósforo y la otra parte corresponde a minerales como magnesio, sodio, potasio y cobre, entre otros. El 98% del calcio que tiene nuestro organismo se encuentra haciendo parte de los huesos, el 0,5% de los dientes y el resto se encuentra en circulación sanguínea y puede estar ligado a proteínas, en forma iónica o formando complejos con ácidos15,16. El calcio específicamente tiene las siguientes funciones: constitución de fluidos y tejidos, regulación cardíaca, componente de los sistemas enzimáticos, conducción nerviosa, proliferación celular, estimulante de la secreción hormonal, contracción muscular, coagulación sanguínea y, la más importante, el mantenimiento de la estructura y calidad de la masa ósea17-19. Hay evidencias científicas de beneficios adicionales del calcio en la prevención de cáncer colonrectal20, la regulación de presión sanguínea21,22 y la concentración de lípidos en el suero23.
El calcio es considerado un macromineral, ya que necesitamos consumir más de 100mg/día. La concentración normal de calcio en la sangre es de 10mg/dl con un rango entre 8,8 y 10,6mg/dl. Los cambios en esta concentración pueden estar relacionados con alguna patología existente y no necesariamente con su bajo o alto consumo. Por ejemplo, la hipercalcemia puede presentarse en el hipoparatiroidismo, la hipomagnesemia o en la pancreatitis aguda. La hipocalcemia puede presentarse en hiperparatiroidismo, hipertiroidismo, sarcoidosis y prolongados períodos de inmovilización, ya que el músculo se atrofia y empieza a liberar calcio a los fluídos, lo que conlleva a trastornos neuronales y enzimáticos, y problemas relacionados con la contracción muscular y la coagulación sanguínea24,25.
La formación del hueso está relacionada con la estimulación de osteoclastos y osteoblastos que son el tejido activo para la formación de éstos y depende de factores endocrinológicos y nutricionales en los que intervienen la paratohormona (PTH) y la vitamina D, estimulando la resorción de calcio en el hueso cuando su concentración en sangre es baja. La PTH estimula la actividad de la enzima 1a-hidroxilasa, la cual interviene en la conversión de vitamina 25-hidroxi D3 inactiva a su forma activa 1,25-hidroxi vitamina D3. Esta última incrementa la absorción renal e intestinal del calcio, mediante la estimulación de la acción de proteínas relacionadas con el transporte de éste. La calcitonina tiene un efecto contrario, inhibiendo la resorción de calcio en hueso y disminuyendo el número de osteoclastos26-28.
El calcio es excretado diariamente a través del pelo, las uñas, la saliva, la orina y las heces, y en menor cantidad en el sudor, el semen, la menstruación y la leche29-32.
La osteoporosis es una enfermedad esquelética sistémica con disminución de la masa o densidad ósea, deterioro microarquitectónico del tejido óseo cortical y, sobre todo, trabecular, que aumenta la fragilidad del hueso y consecuentemente el riesgo de fracturas33-35. Es un problema de salud pública que se ha incrementado progresivamente en los últimos años y tiene amplia incidencia en el ámbito mundial; se presenta con mayor frecuencia en mujeres que en hombres, especialmente en mujeres premenopáusicas36. La osteoporosis causa discapacidad y deterioro de la calidad de vida. Además, genera altos costos para los sistemas de salud por el incremento de fracturas que se asocian con una mayor mortalidad, invalidez y pérdidas económicas por la atención médica multidisciplinaria requerida por los pacientes. La mortalidad posfractura es de 3 - 4% a los 50 años de edad, y de 28 - 30% a los 80 años37-39. El rompimiento de los huesos ocurre porque el cuerpo debe utilizar el calcio almacenado en éstos para mantener las otras funciones biológicas normales, generalmente, cuando hay insuficiente ingesta de calcio40. Para afrontar este problema de salud pública es preciso establecer estrategias para su prevención; algunas medidas preventivas son: aumentar el calcio en la dieta, promover los hábitos de ejercicio físico y evitar el tabaquismo41-45.
El calcio y los alimentos
Diferentes empresas farmacéuticas producen suplementos de calcio para que las personas cumplan los requerimientos diarios: tabletas, píldoras y productos en polvo, entre otros; sin embargo, muchos de estos productos son grandes y difíciles de ingerir y no se incorporan fácilmente dentro de la rutina diaria, y causan con frecuencia efectos secundarios como náuseas, indigestión, constipación y estreñimiento46. Debido a estas dificultades, son frecuentemente retirados del mercado. Para brindar opciones diferentes a los consumidores, se ha creado la necesidad de desarrollar alimentos adicionados con calcio, que hagan parte de la rutina de alimentación47-55.
El calcio ha sido ampliamente utilizado como un aditivo en alimentos para lograr múltiples propósitos entre los que se tienen: su capacidad de interactuar con las pectinas y otros componentes de las paredes celulares de las frutas y vegetales para obtener productos firmes después de calentar, congelar o almacenar56. Las sales de calcio han sido usadas para reducir el pardeamiento inducido por la enzima polifenasa y para reducir la esporulación causada por patógenos57,58, además, en la elaboración de queso para mejorar la estructura59
Entre los factores que debe cumplir la fuente de calcio seleccionada para el desarrollo de productos alimenticios con calcio son: debe ser estable al almacenamiento y manipulación, permitir la aplicación acorde con la tecnología y el proceso, ser de costo razonable para el consumidor, no debe interferir en el metabolismo de otro nutriente, ni producir efectos sensoriales indeseables, y deben existir métodos para evaluar los niveles de calcio añadidos60,61, la adición al alimento debe estar regulada por una normativa que especifique los niveles necesarios. En el caso de Colombia, los productos adicionados con calcio están reglamentados por el Ministerio de la Protección Social, mediante la resolución 288 del 31 de enero de 2008, por la cual se establece el Reglamento Técnico sobre requisitos de rotulado o etiquetado nutricional que deben cumplir los alimentos envasados para consumo humano62.
Fuentes y biodisponibilidad del calcio. El calcio en los alimentos, después de su ingestión, es ionizado en el medio ácido del estómago y absorbido en el intestino delgado (duodeno y yeyuno), donde interacciona con los demás componentes de la dieta, formando complejos, cuya solubilidad depende de muchos factores que afectan la tasa de absorción63-65. La biodisponibilidad de una fuente de calcio es una forma de indicar cuánto de éste se absorbe realmente durante la digestión66. Algunas patologías como la atrofia gástrica, la hipoclorhidria o aclorhidria que acompaña el envejecimiento, la mala absorción intestinal y la pérdida tubular renal afectan la absorción de calcio. La disminución en la producción de estrógenos, la obesidad y el alto consumo de alcohol, cafeína y sodio también afectan la absorción de calcio67,68.
Las fuentes de calcio que hay en el mercado tienen diferente contenido de calcio en mg/g de producto, y puede variar entre el 9 - 40% (véase tabla 1). El citrato del calcio contiene un 50% y el carbonato de calcio un 40% de calcio. Debido a que el tamaño de la molécula de citrato es grande, solo el 10.5% de éste es disponible como calcio, mientras que en el carbonato de calcio es disponible el 25%. Entre las sales de calcio, el citrato de calcio y el carbonato de calcio presentan valores de biodisponibilidad relativa significativamente mayores que las demás69. Sin embargo, algunos estudios han demostrado que no hay diferencias significativa en la biodisponibilidad relativa de carbonato de calcio, citrato de calcio y malato-citrato de calcio grado alimenticio y caparazón de caracol con relación al carbonato de calcio grado reactivo70.
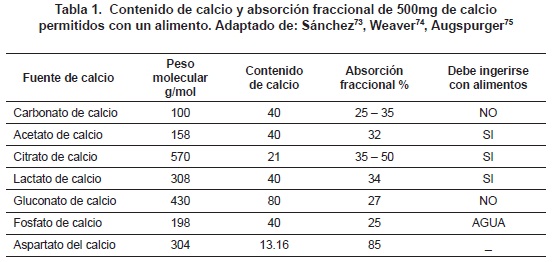
Los criterios conocidos para considerar un alimento como buena fuente de calcio son: que proporcione al menos 30 mg de calcio absorbible por una porción estándar o que por cada 418 kJ (100 kcal) de alimento, proporcione 30 mg de calcio absorbible71.
Factores que influyen en la absorción de calcio
Adecuado consumo. Las ingestas altas de calcio disminuyen su absorción y, por el contrario, una dieta con poca cantidad de éste incrementa su absorción, por esta razón es mejor no mantener las dosis diarias de consumo recomendadas72.
Componentes de la dieta. El calcio interacciona en el intestino con los demás componentes de la dieta; en consecuencia, algunos aminoácidos, péptidos, citratos, lactosa, fructooligosacaridos y otros glúcidos favorecen su absorción76,77, mientras que compuestos como fitatos (presentes en cereales, frijoles y semillas comestibles), oxalatos (presentes en hojas de vegetales), ácidos grasos de cadena larga, fluoruros, fosfatos y ciertas fibras pueden reducir la biodiponiblidad de calcio por la formación de complejos de calcio insolubles78-82. Se ha encontrado que el fosfato tricálcico adicionado a bebidas de soya muestra una absorción 25% menor que en la leche de vaca, pero es superior que cuando se utiliza la combinación fosfato tricalcico/ lactato de calcio en jugo de naranja.
La diferencia en el contenido de carbohidratos y ácidos orgánicos de los jugos de manzana y naranja adicionados con citrato de calcio hace que el primero presente mejor absorción de calcio. Esto sugiere que se pueden formular bebidas modificando su composición, para lograr una mejor absorción del calcio contenido en las mismas. Se ha reportado que más del 50% del calcio adicionado a algunos jugos de naranja sedimenta al centrifugarlos, indicando que existen en el jugo formas particuladas. Aun así, la frecuencia de calcio sedimentado interactúa pobremente con el calcio soluble en el sobrenadante indicando un tamaño de partícula grande y un débil movimiento de los iones de calcio entre los sólidos y las fases de solución del sistema83.
Proteínas. Se ha observado que las proteínas lácteas84,85, las proteínas de huevo y los aminoácidos quelados mejoran enormemente la biodisponibilidad del calcio. El aspartato del calcio es altamente soluble y es mucho más fácil de asimilar y de absorber que otras fuentes de calcio. Los productos lácteos usualmente contienen cantidades de calcio altamente biodisponible. Así que ellos pueden servir como un vehículo ideal para aportar cantidades extras de calcio que cubran las necesidades nutricionales en una sola porción. Para las personas con intolerancia a la lactosa, una buena fuente de calcio son los vegetales86,87.
Vitamina D. Necesita de la luz solar para ser activada; la cantidad producida de vitamina D varía de acuerdo con la hora, las estaciones, la latitud y la pigmentación de la piel. Generalmente 10-15 minutos de exposición solar en manos, brazos o cara de dos a tres veces por semana es suficiente para cubrir el requisito de vitamina D. En personas mayores de edad la capacidad de activación de la vitamina disminuye, se recomienda consumir aproximadamente 400 UI de Vitamina D88-91.
El aporte natural exógeno de vitamina D se obtiene de pocos alimentos como pescados, hongos y huevos. En épocas de poca radiación solar, el aporte alimentario suple la síntesis cutánea de vitamina D92. Estos factores contribuyen a la hipovitaminosis D. Por ello, algunos países han adoptado políticas sanitarias de obligatoriedad en la fortificación de sus alimentos con vitamina D93-95.
En el desarrollo de productos alimenticios con calcio, la solubilidad es un parámetro muy importante. La fuente de calcio adicionada debe conservar la buena imagen del alimento. En el caso de las bebidas no alcohólicas, es necesario evitar la separación de fases en el producto, que podría disminuir la disponibilidad del calcio debido a la precipitación de éste y el rechazo del consumidor por su apariencia inadecuada96,97. El sabor podría verse afectado por el empleo de algunas fuentes de calcio como el cloruro de calcio que puede aportar un sabor diferente en el producto (salado) y debido a que en solución su pH es de 9,9, se puede modificar el pH del alimento, afectando la estabilidad microbiológica y sensorial del producto (tabla 2).
Las interacciones que pueden presentarse entre la fuente de calcio adicionada, con otros ingredientes presentes en el alimento (polímeros: fibras, ácidos pépticos o proteínas), pueden afectar las propiedades reológicas del alimento y, a su vez, la disponibilidad del calcio98,99. En el desarrollo de productos lácteos funcionales adicionados de calcio, el empleo de iones de calcio puede causar coagulación de proteínas al someterlos a tratamientos térmicos. Las fuentes de calcio insolubles no causan coagulación, pero precipitan en los envases. Sales comerciales de calcio como carbonato de calcio, cloruro de calcio, fosfato de calcio, fosfato cálcico tribásico, malato citrato de calcio, lactato de calcio, gluconato de calcio, gluconato lactato de calcio y calcio lácteo natural, han sido usadas para enriquecer leches y bebidas100. Actualmente la industria alimentaria también está adicionando calcio a jugos de frutas, panes, cereales de desayuno, harina, productos lácteos, vegetales y cárnicos.
Por último, es importante mencionar que otro aspecto a tener en cuenta en la selección de la fuente de calcio y la concentración empleada de éste en el alimento, es el hecho de que el calcio puede formar incrustaciones en los equipos (figura 1).

Cuantificación de calcio y vitamina d
Para realizar la determinación de calcio y vitamina D, es importante tener en cuenta para la preparación de las muestras, que tanto el calcio como la vitamina D en un alimento pueden encontrarse unidos a otros compuestos como pectinas y otros componentes de las paredes celulares en el caso del calcio y lipoproteínas y complejos lipoproteínicos en el caso de la vitamina D101,102.
Para la determinación de calcio algunas metodologías realizan un secado de la muestra para eliminar el contenido de agua103,104; luego se hace una hidrólisis húmeda empleando ácido nítrico concentrado105 o una mezcla de ácido clorhídrico y ácido nítrico concentrados106,107 con calentamiento continuo, proceso que facilita la digestión de los otros compuestos; se filtra, se diluye y algunos autores recomiendan la adición de LaCl3 como modificador de la matriz alimentaria para evitar la interferencia de fosfatos. La determinación puede realizarse en espectrofotómetro de masas, de emisión atómica o de plasma secuencial108,109.
Para la determinación de la vitamina D, inicialmente se separa la fracción que contiene las vitaminas liposolubles. Esta etapa puede incluir hidrólisis alcalina para saponificar los lípidos, destruir las vitaminas A y E, pigmentos (carotenoides) y otras sustancias que pueden interferir en la determinación del analito; en muestras con alto contenido de almidón se puede realizar hidrólisis enzimática. Debido a que la vitamina D es un compuesto ligeramente polar es más eficiente extraerla con compuestos orgánicos como éter de petróleo, éter dietílico, dietil éter en hexano al 10% y hexano, proceso que debe realizarse varias veces. Algunas metodologías recomiendan secar el exceso de agua con sal de sulfato de sodio y posteriormente separar el solvente en un rotaevaporador. El residuo obtenido se suspende en un solvente apropiado para la determinación cromatográfica110,111.
Los estudios biológicos son empleados para establecer el efecto que produce un nutriente específico sobre una o varias acciones fisiológicas del organismo. Se emplean estudios biológicos en modelos animales y en humanos. En los estudios biológicos en modelos animales, se emplean ratas machos o hembras, con una edad entre 4-8 semanas. Estos animales responden rápidamente y las diferencias en la disponibilidad del calcio de diferentes fuentes pueden ser detectadas en períodos de tiempo tan cortos como 4 semanas. Las diferencias detectadas en estas pruebas pueden ser complementadas con estudios en humanos para documentar los efectos saludables del calcio.
Los estudios en humanos usando mediciones repetidas de la masa ósea son muy costosos, teniendo en cuenta la gran importancia de establecer el tamaño adecuado de la muestra y que generalmente, dichos estudios se realizan en 12 meses o más112.
Para determinar la eficiencia de la absorción del calcio se mide el efecto del calcio en la densidad ósea en el tiempo, es decir, se evalúa el proceso de remodelación ósea113-116. La medición de la densidad mineral ósea (DMO) permite identificar personas con mayor riesgo de osteoporosis117,118.
La Organización Mundial de la Salud (OMS) ha establecido los criterios para interpretar los resultados de la medición de la DMO. Normal: DMO no más de una desviación estándar (DE) abajo del promedio (score T). Osteopenia: DMO de más de una DE abajo del promedio pero no inferior a 2.4 DE. Osteoporosis: DMO de más de 2.5 DE por debajo del promedio. Osteoporosis severa: DMO de más de 2.5 DE por debajo del promedio y presencia de una o más fracturas por fragilidad; todas las mediciones, en adultos jóvenes. Para el diagnóstico de osteoporosis en hombres se propone el criterio de 3 DE por debajo del promedio del adulto joven, aunque no hay consenso internacional al respecto y muchos autores reportan los mismos criterios que para las mujeres.
En la actualidad, entre los métodos diagnósticos más utilizados para medir la DMO se encuentra la Absorciometría Dual de Rayos X (DEXA), de gran aceptación debido a su precisión, mínima radiación y rapidez del estudio; además, permite visualizar huesos y otros tejidos como músculo y grasa, y puede medir sitios relevantes de fractura por osteoporosis, pero es muy costoso. Este método mide sitios esqueléticos como cadera, antebrazo, espina o calcáneo. Otro método es el ultrasonido cuantitativo (QUS), usado como alternativa de medición no invasiva de la calidad ósea; se puede medir en el calcáneo, la columna o la rótula. Estudios retrospectivos y prospectivos para la medición de riesgo de fractura indican que el QUS es un buen predictor de fracturas, de bajo costo y libre de radiación.
Existen marcadores bioquímicos en sangre y orina que permiten correlacionar la remodelación ósea (balance de la formación de hueso y la pérdida de éste) y dan una idea del comportamiento óseo general del sistema esquelético. Son empleados para determinar de forma más rápida la respuesta a tratamientos específicos. Entre los marcadores bioquímicos de recambio óseo empleados para evaluar el proceso de formación o destrucción ósea, se encuentran: marcadores de formación como la fosfatasa alcalina específica de hueso, la osteocalcina, la determinación de propéptidos del colágeno tipo I carboxilo terminal y amino terminal. Marcadores de resorción como la relación calcio/creatinina en orina, la Hidroxiprolina, Piridinolinas totales y libres, Deoxipiridinolinas totales y libres, N-telopéptidos de los enlaces de colágeno en sangre, C-telopéptidos de los enlaces de colágeno en sangre u orina, y la fosfatasa ácida resistente a tartrato, la determinación de calcio, fósforo y magnesio en suero, entre otros119-124. La determinación de marcadores bioquímicos no predice la masa ósea ni el riesgo de fractura. Por tal motivo, tienen utilidad limitada en la evaluación clínica de los pacientes.
Después de iniciar el tratamiento con antirresortivos, se observan reducciones significativas entre 20 y 80% en los marcadores bioquímicos de resorción ósea entre 4 y 6 semanas después de iniciar el tratamiento (dependiendo del agente y el marcador) y en marcadores de formación ósea se observan cambios significativos en 2 a 3 meses. Si los marcadores de resorción se disminuyen, esto puede indicar que el tratamiento no funciona o es necesario cambiar la dosis o el tipo de medicamento125.
Dosis diarias de consumo recomendadas
Los valores de referencia para la población solo indican la probabilidad estadística de que una ingesta determinada, promediada en cierto período, es suficiente (o insuficiente) para satisfacer los requerimientos nutricionales de un individuo126. Los requerimientos diarios de calcio en diferentes países se presentan en la tabla 3.
Los nutricionistas y dietistas deberían reclamar a los productores de alimentos fortificados o adicionados con calcio mejorar la información en cuanto a la disponibilidad del calcio. Sin embargo, la sola adición de calcio a un producto alimenticio no garantiza la equivalencia nutricional con otros productos que contienen cantidades similares de calcio.
Conclusiones
Frente a la necesidad de mejorar la ingesta de calcio en la población, de manera agradable y económica, la adición y la fortificación de alimentos se convierten en estrategias útiles para mejorar la densidad nutricional de los alimentos en las dietas habituales. Por lo tanto, se requiere mejorar los sistemas de fortificación y asegurar la mejor calidad.
Para incorporar exitosamente las fuentes de calcio, es importante tener en cuenta las características fisicoquímicas de éstas y la interacción con los componentes de la matriz alimentaria, ya que son determinantes en la biodisponibilidad del calcio.
Referencias
1. VALENCIA GARCÍA, Francia Elena y ROMÁN MORALES, María Orfilia. La fibra dietaria como alimento funcional. En: Vitae. 2004. Vol. 11, no 2, p. 12-17. [ Links ]
2. CORTÉS, Misael; CHIRALT, Amparo y PUENTE, Luis. Alimentos funcionales: una historia con mucho presente y futuro. En: Vitae. 2005. Vol. 12, no1, p. 5-14. [ Links ]
3. ROMÁN MORALES, María Orfilia y VALENCIA GARCÍA, Francia Elena. Evaluación de galletas con fibra de cereales como alimento funcional. En: Vitae. 2006. Vol 13, no 2, p 36-43. [ Links ]
4. PRADO, Flávera; et al. Trends in non-dairy probiotic beverages. En: Food Research International. 2008. Vol. 41, no 2, p. 111-123. [ Links ]
5. CERKLEWSKI, Florian. Calcium fortification of food can add unneeded dietary phosphorus En: Journal of Food Composition and Analysis. 2005. Vol. 18, no 6, p. 595-598. [ Links ]
6. KESSENICH, Cathy. Alternative Choices For Calcium Supplementation. En: The Journal for Nurse Practitioners. January 2008. Vol. 4, no 1, p. 36-39. [ Links ]
7. CERKLEWSKI, Florian. Op. cit., p. 595-598. [ Links ]
8. BARRERA, C.; BETORET, N. and FITO, P. Ca2+ and Fe2+ influence on the osmotic dehydration kinetics of apple slices (var. Granny Smith). En: Journal of Food Engineering. (2004). Vol. 92, no 4, p. 9-14. [ Links ]
9. SCILINGO A. A. and AÑÓN M. C. Characterization of soybean protein isolates. The effect of calcium presence. En: JAOCS. 2004. Vol. 81, no 1, p 63-69. [ Links ]
10. JUNG Won-kyo; MOON, Sung and KIM, Sekwon. Effect of chitooligosaccharides on calcium bioavailability and bone strength in ovariectomized rats. En: Life Sciences. 2006. Vol. 78, no 9, p 970-976. [ Links ]
11. MONTERROSA, Álvaro; PEÑALOZA, Patricia y ARTEAGA, María. Cuantificación del calcio presente en la dieta que consumen mujeres entre 45 y 55 años de edad, residentes en Cartagena, Colombia. En: Revista de Menopausia. 2003. Vol. 9, no 3. [ Links ]
12. KESSENICH, Cathy. Op. Cit., p. 36-39. [ Links ]
13. GRADOS, Frank; et al. Effects on bone mineral density of calcium and vitamin D supplementation in elderly women with vitamin D deficiency. En: Joint Bone Spine. 2003. Vol. 70, no 3, p 203-208. [ Links ]
14. KAMCHAN, Achiraya; et al. In vitro calcium bioavailability of vegetables, legumes and sedes. En: Journal of Food Composition and Analysis. 2004. Vol. 17, no 1, p 311-320. [ Links ]
15. HEANEY, Robert. Calcium Nutriture: A Model System for Understanding Menopause-Nutrient Interactions. En: Menopause: biology and pathobiology. Elsevier science Technology books. April 2000. Capítulo 33. p. 481-494. [ Links ]
16. CACERES, E.; GARCIA, M.L. and SELGAS, M.D. Design of a new cooked meat sausage enriched with calcium. En: Meat Science. 2006. Vol. 73, no 2, p. 368-377. [ Links ]
17. KESSENICH, Cathy. Op. Cit., p. 36-39. [ Links ]
18. GRADOS, Frank; et al. Op. Cit., p 203-208. [ Links ]
19. KAMCHAN, Achiraya; et al. Op. Cit., p. 311-320. [ Links ]
20. BONITHON-KOPP, Claire; et al. Calcium and fibre supplementation in prevention of colorectal adenoma recurrence: a randomised intervention trial. En: The Lancet. Octubre 2000. Vol. 356, no 9238, p. 1300-1306. [ Links ]
21. SCILINGO A. A. and AÑÓN M. C. Op. Cit., p 63-69. [ Links ]
22. PATWARDHAN, Uma; PAHUJA, Deepak and SAMUEL A. M. Calcium bioavailability: an in vivo assessment. En: Nutrition Research. 2001. Vol 21 no 4, p. 667-675. [ Links ]
23. REID; Ian, et al. Effects of Calcium Supplementation on Serum Lipid Concentrations in Normal Older Women: A Randomized Controlled Trial. En: THE American Journal of Medicine. April 1, 2002. Vol. 112, no 5, p. 342-347. [ Links ]
24. HEANEY, Robert. Op. Cit., p. 481-494. [ Links ]
25. CACERES, E.; GARCIA, M.L. and SELGAS, M.D. Op. Cit., p. 368-377. [ Links ]
26. Ibíd.; p. 368-377. [ Links ]
27. FISHBEIN, Lawrence. Multiple sources of dietary calcium-some aspects of its essentiality. En: Regulatory Toxicology and Pharmacology. 2004. Vol. 39, no 2, p. 67-80. [ Links ]
28. SEGAL; Elena; et al. Daily supplementation with 800 IU of vitamin D3 insufficient for achievement of vitamin D adequacy in elderly hip fracture patients. En: International Congress Series. Marzo 2007. Vol. 1297, p. 120-125. [ Links ]
29. KESSENICH, Cathy. Op. Cit., p. 36-39. [ Links ]
30. FISHBEIN, Lawrence. Op. Cit., p. 67-80. [ Links ]
31. AGUILERA-BARREIRO, María de los Ángeles; et al. Efecto del calcio dietético vs el citrato de calcio sobre marcadores Bioquímicos convencionales en mujeres perimenopáusicas. En: Salud Pública de México. Julio-agosto de 2005. Vol. 47, no. 4, p. 259-267. [ Links ]
32. BINKLEY, Neil; et al. Alendronate/vitamina D3 70mg/2800IU with and without additional 2800 IU vitamina D3 for osteoporosis: Result from the 24 week extension of a 15 week randomized, controlled trial. En: Bone. 2009. Vol. 44, no 4, p. 639-647. [ Links ]
33. ANGEL-ARANGO, Luis A.; et al. Deficiencia de lactasa, intolerancia a la lactosa y pico de masa ósea en adultos jóvenes colombianos. En: Revista Colombiana de Reumatología. [online]. oct./dic. 2006, Vol.13, no. 4 [citado 07 Marzo 2008], p.271-286. Disponible en la World Wide Web: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0121-81232006000400004&lng=es&nrm=iso. ISSN 0121-8123. [ Links ]
34. TALBOT, J. C.; et al. Secondary prevention of osteoporosis: Calcium, Vitamin D and bisphosphonate prescribing following distal radial fracture. En: Injury, Int. J. Care Injured. 2007. Vol. 38, no 11, p. 1236-1240. [ Links ]
35. BESSETTE, L.; et al. Factors influencing the treatment of osteoporosis following fragility fracture. En: Osteoporos Int Published. Nov 2009. Vol. 20, no 11, p. 1911-1919. [ Links ]
36. KERSTETTER, Jane; et al. Dietary protein increases intestinal calcium absorption and improves bone balance: An hypothesis. En: International Congress Series. Marzo 2007. Vol. 1297, p. 204-216. [ Links ]
37. GRADOS, Frank; et al. Op. Cit., p 203-208. [ Links ]
38. AGUILERA-BARREIRO, María de los Ángeles; et al. Op. Cit., p. 259-267. [ Links ]
39. BINKLEY, Neil; et al. Op. Cit., p. 639-647. [ Links ]
40. SÁNCHEZ, Ariel; et al. Papel del calcio y de la vitamina D en la salud ósea (II). En: Revista Española de Enfermedades Metabólicas Óseas. 2003. Vol. 12, no , p. 14-29 (Módulo II). [ Links ]
41. GRADOS, Frank; et al. Op. Cit., p 203-208. [ Links ]
42. AGUILERA-BARREIRO, María de los Ángeles; et al. Op. Cit., p. 259-267. [ Links ]
43. BINKLEY, Neil; et al. Op. Cit., p. 639-647. [ Links ]
44. BESSETTE, L.; et al. Op. Cit., p. 1911-1919. [ Links ]
45. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
46. KESSENICH, Cathy. Op. Cit., p. 36-39. [ Links ]
47. CERKLEWSKI, Florian. Op. Cit., p. 595-598. [ Links ]
48. SCILINGO A. A. and AÑÓN M. C. Op. Cit., p 63-69. [ Links ]
49. CACERES, E.; GARCIA, M.L. and SELGAS, M.D. Op. Cit., p. 368-377. [ Links ]
50. TOBELMANN, Rosmary. Implementing Calcium Fortification: An Industry Case Study. En: Journal of Food Composition and Analysis. 2001. Vol. 14, no 3, p. 241-244. [ Links ]
51. HEANEY, Robert; et al. Calcium Fortification Systems Differ in Bioavailability. En: Journal of the American Dietetic Association. May 2005. Vol. 105, no 5, p. 807-809. [ Links ]
52. ALZAMORA, Stella; et al. Novel functional foods from vegetable matrices impregnated with biologically active compounds. En: Journal of Food Engineering. 2005. Vol. 67, no 1-2, p. 205-214. [ Links ]
53. ROMANCHIK-CERPOVICZ, Joelle and MCKEMIE, Rebecca. Fortification of All-Purpose Wheat-Flour Tortillas with Calcium Lactate, Calcium Carbonate, or Calcium Citrate Is Acceptable. En: Journal of the American Dietetic Association. 2007. Vol. 107, no 3, p. 506-509. [ Links ]
54. RODRÍGUEZ, Maria; et al. Chitosan influence on glucose and calcium availability from yogurt: In vitro comparative study with plants fibre. En: Carbohydrate Polymers. Nov 2008. Vol. 74, no 4, p. 797-801. [ Links ]
55. SINGH, Gurmeet and MUTHUKUMARAPPAN, Kasiviswanathan. Influence of calcium fortification on sensory, physical and rheological characteristics of fruit yogurt. En: LWT. Sept. 2008. Vol. 41, no 7, p. 1145-1152. [ Links ]
56. FENNEMA, Owen. Química de los alimentos. España: Acribia. 2000. 1090 p. [ Links ]
57. BARRERA, C.; BETORET, N. and FITO, P. Op. Cit.; p. 9-14. [ Links ]
58. JUNG Won-kyo; MOON, Sung and KIM, Se-kwon. Op. Cit.; p. 970-976. [ Links ]
59. WALSTRA, Pieter. Ciencia de la leche y Tecnología de productos lácteos. España: Acribia. 2001. 730 p. [ Links ]
60. CERKLEWSKI, Florian. Op. cit., p. 595-598. [ Links ]
61. ALVAREZ VIDAL, Laura. Enriquecimiento masivo de minerales y vitaminas en los alimentos. Bellaterra: UAB, 2003. [ Links ]
62. COLOMBIA. MINISTERIO DE LA PROTECCIÓN SOCIAL. Resolución 288 del 31 de enero de 2008 Por la cual se establece el reglamento técnico sobre requisitos de rotulado o etiquetado nutricional que deben cumplir los alimentos envasados para consumo humano. Bogotá: El Ministerio, 2008. 63 p. [ Links ]
63. SCILINGO A. A. and AÑÓN M. C. Op. Cit., p 63-69. [ Links ]
64. SINGH, Gurmeet and MUTHUKUMARAPPAN, Kasiviswanathan. Op. Cit., p. 1145-1152. [ Links ]
65. KRUGER, Marlena; et al. Effect of calcium fortified milk supplementation with or without vitamin K on biochemical markers of bone turnover in premenopausal women. En: Nutrition. Nov. 2006. Vol. 22, no 11, p. 1120-1128. [ Links ]
66. PATWARDHAN, Uma; PAHUJA, Deepak and SAMUEL A. M. Op. Cit., p. 667-675. [ Links ]
67. KERSTETTER, Jane; et al. Op. Cit., p. 204-216. [ Links ]
68. AUGSPURGER, Nathan and BAKER, David. Phytase improves dietary calcium utilization in chicks, and oyster shell, carbonate, citrate, and citrate-malate forms of calcium are equally bioavailable. En: Nutrition Research. Abr 2004. Vol. 24, no 4, p. 293-301. [ Links ]
69. TALBOT, J. C.; et al. Op. Cit., p. 1236-1240. [ Links ]
70. AUGSPURGER, Nathan and BAKER, David. Op. Cit., p. 293-301. [ Links ]
71. TITCHENAL, Alan and DOBBS, Jonnie. A system to assess the quality of food sources of calcium. En: Journal of Food Composition and Analysis. Dic 2007. Vol. 20, no 8, p. 717-724. [ Links ]
72. KAMCHAN, Achiraya; et al. Op. Cit., p 311-320. [ Links ]
73. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
74. WEAVER, Connie. Calcium in food fortification strategies. En: International Dairy Journal Nov. 1998. Vol. 8, no 5-6, p. 443-449. [ Links ]
75. AUGSPURGER, Nathan and BAKER, David. Op. Cit., p. 293-301. [ Links ]
76. RODRÍGUEZ, María; et al. Op. Cit., p. 797-801. [ Links ]
77. SINGH, Gurmeet and MUTHUKUMARAPPAN, Kasiviswanathan. Op. Cit., p. 1145-1152. [ Links ]
78. JUNG Won-kyo; MOON, Sung and KIM, Se-kwon. Op. Cit., p. 970-976. [ Links ]
79. KAMCHAN, Achiraya; et al. Op. Cit., p 311-320. [ Links ]
80. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
81. RODRÍGUEZ, María; et al. Op. Cit., p. 797-801. [ Links ]
82. SINGH, Gurmeet and MUTHUKUMARAPPAN, Kasiviswanathan. Op. Cit., p. 1145-1152. [ Links ]
83. HEANEY, Robert; et al. Op. Cit., p. 807-809. [ Links ]
84. SINGH, Gurmeet and MUTHUKUMARAPPAN, Kasiviswanathan. Op. Cit., p. 1145-1152. [ Links ]
85. KRUGER, Marlena; et al. Op. Cit., p. 1120-1128. [ Links ]
86. KAMCHAN, Achiraya; et al. Op. Cit., p 311-320. [ Links ]
87. TOBELMANN, Rosmary. Op. Cit., p. 241-244. [ Links ]
88. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
89. CACERES, E.; GARCIA, M.L. and SELGAS, M.D. Op. Cit., p. 368-377. [ Links ]
90. AGUILERA-BARREIRO, María de los Ángeles; et al. Op. Cit., p. 259-267. [ Links ]
91. MACDONALD, Helen; et al. Vitamin D status in postmenopausal women living at higher latitudes in the UK in relation to bone health, overweight, sunlight exposure and dietary vitamin D. En: Bone. Feb. 2008. Vol. 42, no 5, p. 996-1003. [ Links ]
92. HEANEY, Robert. Op. Cit., p. 481-494. [ Links ]
93. GRADOS, Frank; et al. Op. Cit., p 203-208. [ Links ]
94. BINKLEY, Neil; et al. Op. Cit., p. 639-647. [ Links ]
95. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
96. HEANEY, Robert; et al. Calcium. Op. Cit., p. 807-809. [ Links ]
97. WEAVER, Connie. Op. Cit., p. 443-449. [ Links ]
98. SCILINGO A. A. and AÑÓN M. C. Op. Cit., p 63-69. [ Links ]
99. RODRÍGUEZ, María; et al. Op. Cit., p. 797-801. [ Links ]
100. Ibíd.; p. 797-801. [ Links ]
101. BARRERA, C.; BETORET, N. and FITO, P. Op. Cit., p. 9-14. [ Links ]
102. JUNG, Won-kyo; MOON, Sung and KIM, Se-kwon. Op. Cit., p 970-976. [ Links ]
103. CERKLEWSKI, Florian. Op. Cit., p. 595-598. [ Links ]
104. YAMAWAKI, Namiko; et al. Macronutrient, mineral and trace element composition of breast milk from Japanese women. En: Journal of Trace Elements in Medicine and Biology. 2005. Vol. 19, no 2-3, p. 171-181. [ Links ]
105. Ibíd.; p. 171-181. [ Links ]
106. JODRAL-Segado, Antonio; et al. Magnesium and calcium contents in foods from SE Spain: influencing factors and estimation of daily dietary intakes. En: The Science of the Total Environment. Agos. 2003. Vol. 312, no 1-3, p. 47-58. [ Links ]
107. CORTÉS, Misael; GUARDIOLA, Luis y PACHECO, Roger. Aplicación de la ingeniería de matrices en la fortificación de mango (var. Tommy atkins) con calcio. En: Dyna, Nov. 2007. Vol. 74, no 153, p. 19-26. [ Links ]
108. KAMCHAN, Achiraya; et al. Op. Cit., p 311-320. [ Links ]
109. CHUMBIMUNI-Torres, Karin and KUBOTA, Lauro. Simultaneous determination of calcium and potassium in coconut water by a flow-injection method with tubular potentiometric sensors. En: Journal of Food Composition and Analysis. Mar-may 2006. Vol. 19, no 2-3, p. 225-230. [ Links ]
110. YAMAWAKI, Namiko; et al. Op. Cit., p. 171-181. [ Links ]
111. GARCÍA, Caridad; et al. Determinación por CLAR de las Vitaminas A y D en Aceite de Hígado de Tiburón. En: Latin American Journal of Pharmacy. 2008. Vol. 27, p. 419-24. [ Links ]
112. DAWSON-HUGHES, Bess. Protein intake and calcium absorption - Potential role of the calcium sensor receptor. En: International Congress Series. Mar 2007. Vol. 1297, p. 217-227. [ Links ]
113. BENHAMOU C., Laurent. Bone ultrastructure: evolution during osteoporosis and aging. En: Osteoporos Int Published on line 02 april 2009. DOI 10.1007/s00198-009-0867-4. [ Links ]
114. KRUGER, Marlena; GALLAHER, Brian and SCHOLLUM, Linda. Bioavailability of calcium is equivalent from milk fortified with either calcium carbonate or milk calcium in growing male rats. En: Nutrition Research. Sept 2003. Vol. 23, no 9, p. 1229-1237. [ Links ]
115. NESTLE. Boletín Informativo de Nestlé América Central. Nutrición y salud: El rol del calcio en el cuerpo. AÑO 5 No. 4. [ Links ]
116. REID, Ian. Effects of calcium supplementation on bone and other end-points in normal older women - The Auckland Calcium Study. En: International Congress Series. Mar 2007. Vol. 1297, p. 82-88. [ Links ]
117. Ibíd., p. 82-88. [ Links ]
118. DI DANIELE, Nicola; et al. Effect of supplementation of calcium and Vitamin D on bone mineral density and bone mineral content in peri- and post-menopause women A double-blind, randomized, controlled trial. En: Pharmacological Research. Dic 2004. Vol. 50, p. 637-641. [ Links ]
119. INSTITUTO COLOMBIANO DE BIENESTAR FAMILIAR - ICBF. Recomendaciones de consumo diario de calorías y nutrientes para la población Colombiana. [en línea] Bogotá: ICBF, 1988. Url disponible en: http://www.icbf.gov.co/espanol/planes/plan_nal_de_alimentacion/plan_nal_recomen_cons_2.html [ Links ]
120. GUEVARA, G. Controversias en el diagnóstico de Osteoporosis. Congreso Nacional e Internacional de Gerontología y Geriatría. Memorias Cartagena Agosto 16 al 19 de 2002. En: Revista de la asociación colombiana de gerontología y geriatría. Vol. 16, no 3. [ Links ]
121. CONS MOLINA, Fidencio. Marcadores Bioquímicos de Remodelado Óseo. En: Revista metabolismo óseo y mineral. 2003. Vol. 1, no 3, p. 91-98. [ Links ]
122. HORMAZA, M. P.; et al. Utilidad de la osteocalcina y los N-telopéptidos para la evaluación del recambio óseo en mujeres postmenopáusicas, con y sin Terapia de Reemplazo Hormonal (TRH). En: Revista de Menopausia. Clínica Universitaria de Menopausia. C. U. M. Facultad de Medicina de la Universidad Pontificia Bolivariana. mayo-ago. 2001. Vol. 7, no 2, p. 185-192. [ Links ]
123. SRIVASTAVA, Amitabh; et al. Development and Evaluation of C-telopeptide Enzyme-linked Immunoassay for Measurement of Bone Resorption in Mouse Serum. En: Bone. Oct. 2000. Vol. 27, no 4, p. 529-533. [ Links ]
124. ZENI, Susana; et al. Interrelationship between bone turnover markers and dietary calcium intake in pregnant women: a longitudinal study. En: Bone. 2003. Vol. 33, no 4, p. 606-613. [ Links ]
125. CONS MOLINA, Fidencio. Op. Cit., p. 91-98. [ Links ]
126. SÁNCHEZ, Ariel; et al. Op. Cit., p. 14-29. [ Links ]
127. Ibíd.; p. 14-29. [ Links ]
128. NESTLE. Op. Cit.; Boletín No. 4. [ Links ]
129. INSTITUTO COLOMBIANO DE BIENESTAR FAMILIAR - ICBF.; Op. Cit. [ Links ]














