Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.8 no.2 Caldas July/Dec. 2011
Artículo original / Original article / Artigo original
* Magíster en Biotecnología. Docente de la Facultad de Ciencias Agrarias del Politecnico Colombiano Jaime Isaza Cadavid.
** Médico veterinario, docente de la Facultad de Ciencias Agrarias del Politecnico Colombiano Jaime Isaza Cadavid.
*** Magíster en Ciencias Biomédicas, Facultad de Ciencias de la Universidad Nacional de Colombia, sede Medellín.
Correspondencia: Giovanni Restrepo Betancur. e-mail: grestrepo@elpoli.edu.co
Artículo recibido: 07/04/2011; Artículo aprobado: 12/12/2011
Resumen
Introducción. Diversos factores influyen sobre la capacidad fertilizante del semen canino criopreservado. Las alteraciones estructurales, y los efectos osmóticos y tóxicos sobre los espermatozoides, han centrado el interés en desarrollar nuevas técnicas de criopreservación y crioprotectores con mayor potencial para la conservación de la capacidad fertilizante del semen. Objetivo. Comparar el efecto de la congelación rápida con glicerol y dimetilformamida sobre la calidad post-descongelación del semen canino. Materiales y métodos. En un proceso de criopreservación por congelación rápida, fueron implementados cuatro tratamientos (glicerol al 3% y 5%, y dimetilformamida al 3% y 5%). Posterior a la descongelación, fueron evaluados para cada tratamiento, la movilidad individual, la morfología espermática y la integridad de membrana de los espermatozoides. La evaluación estadística se realizó mediante un análisis de varianza y una prueba de diferencia significativa mínima de Fisher. Resultados. Para la movilidad individual se encontró superioridad del glicerol 5% (58%±7.8) sobre DMF 5% (44.5%±17.7), glicerol 3% (18%±10.1), y DMF 3% (11.8%±10.5). Para la integridad de membrana, DMF 5% obtuvo el mayor promedio (33.4%±9.7), siendo superior a glicerol 3% (27.5%±4.3) y DMF 3% (24.2%±5.3), pero sin diferencia estadística sobre glicerol 5% (31.4%±3.8). Para la morfología espermática no se encontró diferencia estadística entre glicerol 5% (67%±11.9), glicerol 3% (65.6±12.5), y DMF 5% (60%±16.5), pero sí hubo diferencia entre estos y DMF 3% (50.1%±18.3). Conclusiones. El glicerol y la DMF en concentraciones del 5% proveen una protección similar del semen canino durante la criopreservación por congelación rápida.
Palabras clave: congelación rápida, crioprotectores, fertilidad potencial.
Abstract
Introduction. Several factors influence the fertilizing capacity of cryopreserved canine semen. Structural alterations and the osmotic and toxic effects on sperm have focused interest on developing new cryopreservation and cryoprotection techniques with a bigger potential for conserving the semen's fertilization capacity. Objective. To compare the effect of fast freezing with glycerol and dimethylformamide on the post-freezing quality of canine semen. Materials and methods. In a cryopreservation process by fast freezing, four treatments were implemented (glycerol at 3% and 5%, y dimethylformamide at 3% and 5%). After thawing, individual mobility, sperm morphology and the membrane's integrity of sperm were evaluated. The statistic evaluation was made by the use of a variance analysis and a Fisher's minimal significant difference test. Results. For the individual mobility, a superiority was found for the 5% glycerol (58%±7.8) over 5% DMF (44.5%±17.7), 3% glycerol (18%±10.1), and 3% DMF (11.8%±10.5). For the membrane's integrity, 5%DMF had the highest media value (33.4%±9.7), above 3% glycerol (27.5%±4.3) y 3% DMF (24.2%±5.3), but it had no statistic difference over 5% glycerol (31.4%±3.8). For the sperm morphology, no statistic difference was found between 5% glycerol (67%±11.9), 3% glycerol (65.6±12.5), and 5%DMF (60%±16.5), but there was a difference between these and 3% DMF (50.1%±18.3). Conclusions. Glycerol and DMF, in 5% concentrations, provide a similar protection to semen during fast freezing cryopreservation.
Key words: fast freezing, cryoprotectors, potential fertility.
Resumo
Introdução. Diversos fatores influem sobre a capacidade fertilizante do sêmen canino criopreservado. As alterações estruturais, e os efeitos osmóticos e tóxicos sobre os espermatozóides, centraram o interesse em desenvolver novas técnicas de criopreservação e crioprotetores com maior potencial para a conservação da capacidade fertilizante do sêmen. Objetivo. Comparar o efeito do congelamento rápido com glicerol e dimetilformamida sobre a qualidade pós-descongelamento do sêmen canino. Materiais e métodos. Num processo de criopreservação por congelamento rápido, foram implementados quatro tratamentos (glicerol ao 3% e 5%, e dimetilformamida ao 3% e 5%). Posterior ao descongelamento, foram avaliados para cada tratamento, a mobilidade individual, a morfologia espermática e a integridade de membrana dos espermatozóides. A avaliação estatística se realizou mediante uma análise de variância e uma prova de diferença significativa mínima de Fisher. Resultados. Para a mobilidade individual se encontrou superioridade do glicerol 5% (58%±7.8) sobre DMF 5% (44.5%±17.7), glicerol 3% (18%±10.1), e DMF 3% (11.8%±10.5). Para a integridade de membrana, DMF 5% obteve a maior média (33.4%±9.7), sendo superior a glicerol 3% (27.5%±4.3) e DMF 3% (24.2%±5.3), mas sem diferença estatística sobre glicerol 5% (31.4%±3.8). Para a morfologia espermática não se encontrou diferença estatística entre glicerol 5% (67%±11.9), glicerol 3% (65.6±12.5), e DMF 5% (60%±16.5), mas se teve diferença entre estes e DMF 3% (50.1%±18.3). Conclusões. O glicerol e a DMF em concentrações do 5% provêem uma proteção similar do sêmen canino durante a criopreservação por congelamento rápido.
Palavras Importantes: congelamento rápido, crioprotetores, fertilidade potencial.
Introducción
En los procesos de criopreservación de semen canino existen diversos factores que influyen en su capacidad fertilizante. Las células espermáticas son expuestas a soluciones que contienen agentes crioprotectores, los cuales evitan parcialmente la formación de hielo intracelular y el daño en las membranas1. Sin embargo, dichas sustancias, sumadas a los severos cambios térmicos y osmóticos propios de la técnica, pueden tener otros efectos adversos sobre los espermatozoides, como las alteraciones en el ADN2, el aparato genético3, la actividad mitocondrial4, el rompimiento de membranas por la peroxidación de los lípidos5, y en los acrosomas por daños como el hinchamiento, la distribución no uniforme de su contenido, y la vesiculación de la membrana externa acrosomal6. Dichas alteraciones han sido directamente relacionadas con la reducción en la fertilidad del semen canino criopreservado7, principalmente cuando involucran daños de la estructura y función de la membrana plasmática8.
Diversas alternativas han sido implementadas con el fin de mejorar los resultados de los procedimientos de criopreservación de semen canino, considerando aspectos como el método de congelación9, 10, la composición de los diluyentes con el uso de nuevas moléculas11-14 y la concentración y la naturaleza de los crioprotectores empleados15. El crioprotector tradicionalmente utilizado para la criopreservación de semen canino es el glicerol16, 17, que es un crioprotector permeable cuya función es evitar la formación de cristales intracelulares de hielo, dado que forma enlaces de hidrógeno fuertes con las moléculas de agua, compitiendo con los enlaces de hidrógeno agua-agua, de manera que interrumpe la formación de la red cristalina del hielo a medida que la temperatura se reduce significativamente. El glicerol posee como limitante su toxicidad parcial, debida al estrés osmótico que genera, dado que tiene una menor velocidad de difusión a través de la membrana plasmática respecto a otros crioprotectores18. De igual forma, se reporta que el glicerol causa la alteración de la unión del espermatozoide al oocito, lo cual disminuye la capacidad fertilizante del semen19 y, por lo tanto, reduce las tasas de concepción posteriores a la inseminación artificial. Otros crioprotectores utilizados para la criopreservación de semen canino son el polietilenglicol (PEG) y el dimetilsulfoxido (DMSO)20, 21. Este último ha demostrado tener una baja capacidad protectora en semen canino, mientras que el PEG, aunque presenta una similar movilidad, vigor y porcentaje de anormalidades morfológicas en los espermatozoides respecto al glicerol, se ha observado que aumenta el porcentaje de espermatozoides con velocidad curvilineal y desplazamiento lateral de la cabeza (posible capacitación), lo cual afecta la membrana y, por lo tanto, la longevidad del espermatozoide22.
Se han estudiado amidas tales como la dimetilformamida (DMF) y la dietilformamida (DEF) como posibles agentes crioprotectores, debido a sus propiedades físico-químicas que les permiten una alta difusión a través de la membrana celular, además no se comportan como sustancias tóxicas durante la criopreservación23, 24. La DMF ha sido evaluada en la criopreservación de semen equino, y es considerada como una buena opción que permite el mejoramiento del proceso25. En un reporte de investigación, donde se utilizó un diluyente a base de lactosa, yema de huevo y 5% de DMF, se encontraron porcentajes de movilidad del 45.5% ± 11.3, integridad de membrana del 49.2% ± 6.6, y de morfología normal del 65.3% ± 14.226. Mientras en un estudio más reciente se encontraron resultados equiparables de movilidad, vigor y morfología en semen canino criopreservado con glicerol y metilformamida (MF); ambos crioprotectores son superiores para los mismos parámetros respecto a los resultados obtenidos con DMF, con lo cual la investigación plantea el uso promisorio de la MF en dicho proceso27.
La técnica específica empleada para la criopreservación del semen, ya sea congelación lenta o rápida en vapores de nitrógeno28, es un aspecto altamente relevante en la conservación de su viabilidad y fertilidad, dado que incide en la magnitud de las alteraciones resultantes por fenómenos como el choque térmico y los efectos tóxicos previamente mencionados, y adicionalmente la presentación de otras alteraciones como la pérdida de la capacidad antioxidante del semen29. Procedimientos como la congelación rápida y ultrarrápida han sido relacionados con menores alteraciones estructurales y funcionales en las células espermáticas30, 31.
La disponibilidad de procedimientos que permitan conservar de manera más eficiente el semen canino es altamente relevante para la optimización de la biotecnología reproductiva aplicada a dicha especie. Esta investigación tuvo como objetivo comparar el efecto de diferentes concentraciones (3% y 5%) de los crioprotectores glicerol y dimetilformamida sobre varios parámetros de calidad espermática del semen canino criopreservado.
Materiales y métodos
Población en estudio. Cinco perros de la raza pastor alemán en edades entre los 2 y 5 años fueron empleados para el estudio. Los animales permanecieron bajo un plan de alimentación con concentrado comercial 2 veces al día y agua a voluntad, y fueron diagnosticados como negativos para Brucella canis.
Recolección de semen. El semen se recolectó por el método convencional de estimulación manual con mano enguantada, empleando un sistema de colección de semen canino por embudos (Minitube ®), mediante el cual se separó la fracción rica en espermatozoides del eyaculado. La recolección se hizo con una frecuencia semanal, durante cuatro semanas, para un total de 20 eyaculados.
Evaluación del semen canino. Para cada eyaculado de semen fresco fueron evaluados por métodos convencionales32, el volumen, el color, el pH, la concentración (conteo por cámara de neubouer), la movilidad masal (en una escala de 1 a 4), el porcentaje de espermatozoides con movilidad progresiva (400X), la funcionalidad de la membrana plasmática por el método de la prueba hiposmótica (Host), y el porcentaje de células con morfología normal (1000X) según criterios definidos por Oettle33. Para la prueba Host, en un tubo eppendorf con 100 µl de semen se adicionaron 500 µL de solución hipoosmótica (100 mOsmol/L), compuesta por fructosa y citrato de sodio en agua grado reactivo. Esta mezcla, se incubó a 38.5°C por 30 minutos34. El porcentaje de espermatozoides reaccionados (espermatozoides con colas enrolladas) se determinó por microscopia (400X), a partir del conteo de al menos 200 espermatozoides en mínimo 5 campos. Solo los eyaculados con un mínimo de 200 millones de espermatozoides totales, una movilidad progresiva superior al 70%, una movilidad masal superior o igual a 3, y un valor de morfología normal mayor al 80% fueron procesados.
Dilución del semen y tratamientos con crioprotectores. La fracción espermática de cada eyaculado fue diluida en una proporción de 1:1 en un diluyente base comercial (Dog Semen Diluent, Minitube ®) a 35°C. Esta solución fue equilibrada por una hora, y refrigerada a 4°C. El semen fue centrifugado a 700g por 5 minutos, el precipitado fue resuspendido en 1mL de diluyente base, y luego se ajustó su volumen para una concentración de 200 x 106 espermatozoides/mL. La solución fue dividida en cuatro alícuotas, y se adicionó a cada una de ellas un diluyente para criopreservación (tratamiento) en proporción de 1:1, para obtener una concentración final de 100 x 106 espermatozoides/ mL, y proporciones del 3% y 6%, tanto de glicerol, como de dimetilformamida, para un total de cuatro tratamientos. El diluyente para criopreservación estuvo adicionalmente compuesto por diluyente base, y 20% de yema de huevo.
Criopreservación de semen canino por congelación rápida. La congelación rápida del semen canino fue desarrollada según el procedimiento descrito por Rota; et al.35, donde cada muestra de semen en su respectivo tratamiento fue mantenida en refrigeración a 4°C durante 10 minutos, y fue empacada en pajillas para 0.5 mL de semen, las cuales fueron sometidas durante 10 minutos a vapores de nitrógeno (4 cm sobre la superficie del nitrógeno líquido), para finalmente ser sumergidas en este.
Descongelación y evaluación del semen. Después de un período de almacenamiento de tres semanas, las pajillas fueron descongeladas en agua a 37°C durante 30 segundos. Finalmente el contenido de cada pajilla fue evaluado según los métodos previamente descritos para porcentaje de espermatozoides con movilidad progresiva, porcentaje de células con morfología normal, y funcionalidad de la membrana plasmática.
Análisis estadístico. Los resultados fueron evaluados estadísticamente mediante análisis de varianza, y una prueba de diferencia significativa mínima de Fisher, empleando el programa Statgraphics Plus 5.1.
Resultados
Un total de 20 eyaculados fueron evaluados para los diferentes parámetros macroscópicos y microscópicos del semen fresco de los ejemplares caninos. Se descartaron las muestras contaminadas, con un escaso volumen de fracción espermática (<1mL), y con alteraciones en el color o el pH. Se encontró un volumen promedio de fracción espermática para los eyaculados de 2.8 ± 1.3mL, el color predominante fue blanco lechoso, el pH promedio fue de 6.5 ± 0.5, mientras la concentración promedio fue de 181.1 ± 82.9 millones de espermatozoides por mL. Los valores promedio encontrados para la movilidad progresiva, la morfología normal y la integridad de la membrana plasmática (% de espermatozoides reaccionados en la prueba Host -figura 1-) fueron de 78.4% ± 6.2, 88.8% ± 4.6 y 79.1% ± 6.5, respectivamente.
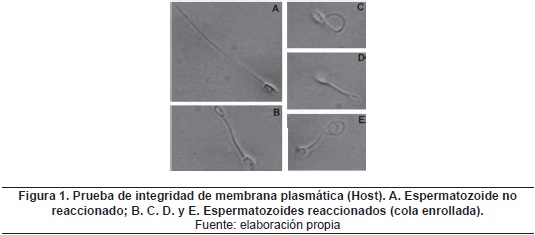
Un total de 50 pajillas de semen criopreservado por congelación rápida, empleando los cuatros tratamientos de criopreservación (glicerol 3%, glicerol 6%, DMF 3% y DMF 6%), fueron evaluadas para determinar los parámetros de movilidad progresiva, morfología normal e integridad de la membrana plasmática. La tabla 1 muestra los resultados obtenidos.
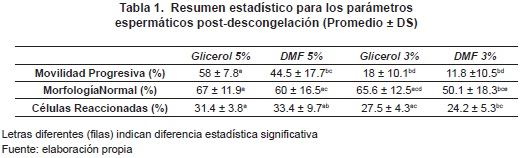
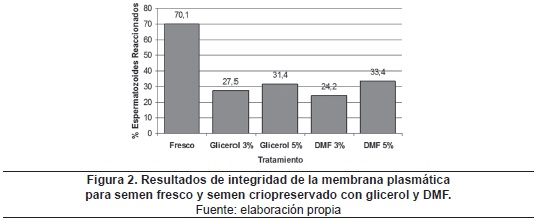
La figuras 2 y 3 muestran los resultados para la integridad de membrana plasmática (prueba Host) en función del porcentaje de espermatozoides reaccionados, y los resultados para el porcentaje de espermatozoides con morfología normal, respectivamente, tanto para semen fresco como para semen criopreservado con los cuatro tratamientos.
Discusión
El éxito de la recolección del semen canino está relacionado con factores como la raza, la edad, la agresividad, la presencia de una hembra en celo, y el método utilizado para la extracción de la muestra, ya sea por estimulación manual o por electroeyaculación. Es esta investigación todos los caninos respondieron de forma apropiada a la extracción seminal por estimulación manual, en uno o máximo dos intentos de colecta, siendo relativamente baja la variabilidad en el volumen de fracción espermática recuperado (2.8 ± 1.3mL). Dentro de los principales factores de fracaso en la obtención de la muestra seminal estuvieron el estrés del animal, la no presencia del propietario o entrenador, la dificultad en la diferenciación de las fracciones espermáticas en eyaculados de bajo volumen, y el descarte de eyaculados contaminados o de baja calidad.
Los resultados para los parámetros espermáticos del semen fresco fueron acordes con lo reportado por la literatura para volumen de fracción espermática36, pH37, color38, movilidad masal39, y concentración40. El valor de movilidad progresiva 78.4% ± 6.2 (tabla 1) fue cercano a lo reportado por Sánchez; et al.41 (83.8% ± 9.5), quienes incluyeron perros de la raza pastor alemán en el estudio, y por Oliveira; et al.42 (80%), quienes procesaron muestras de perros de diferentes razas; dichos valores fueron distantes de lo reportado por Sánchez; et al.43 (95.7% ± 3.6), lo cual sea probablemente explicado por la alta variabilidad de las características espermáticas entre las razas caninas, debido a la influencia de factores como la talla, el peso corporal de la raza, la edad, y la alimentación44.
Se encontró superioridad estadística (p<0.05) entre los valores para movilidad progresiva del semen fresco (78.4% ± 6.2), en comparación con el semen criopreservado para los diferentes tratamientos; de igual manera se presentó para los parámetros integridad de la membrana plasmática (figura 2) y morfología normal (figura 3). Este fenómeno fue igualmente observado en investigaciones de Silva; et al.45, y de Futino; et al.46, quienes implementaron un protocolo de congelación rápida similar al desarrollado en esta investigación. Este resultado es atribuido a los daños producidos por la criopreservación sobre las células, por efecto del estrés térmico, tóxico y osmótico originado por la exposición a los crioprotectores (hiperosmolaridad), y a la formación y disolución de cristales de hielo en el ambiente intracelular y extracelular47, 48.
Entre los tratamientos evaluados para el porcentaje de movilidad progresiva, se encontró superioridad estadística del glicerol 5% (58% ± 7.8) respecto a DMF 5% (44.5% ± 17.7), glicerol 3% (18% ± 10.1) y DMF 3% (11.8 %± 10.5) -tabla 1-. Ello coincide con lo reportado por Silva; et al.49 quienes, utilizando 5 diferentes razas de caninos, y una concentración final de glicerol del 6%, obtuvieron valores de movilidad de 54.6% ± 11.2. Para el caso de la criopreservación con DMF, en un reporte de Oliveira; et al.50, en el cual se utilizó un diluyente con base en lactosa y 5% DMF, encontraron un porcentaje de movilidad progresiva del 45.5% ± 11.3, lo cual es bastante cercano al valor hallado en esta investigación (44.5% ± 17.7), mientras Futino; et al.51 reportaron una tasa de movilidad progresiva post-descongelación de semen canino congelado con 3% de DMF del 37% ± 19.8.
El resultado obtenido para la integridad de membrana del semen fresco (79.1% ± 6.5), fue muy similar a lo reportado por Sánchez et al.52 (79.8% ± 6.6), y no muy distante de lo encontrado por Sánchez et al.53 (87,9% ± 8,1). Entre los tratamientos de criopreservación de semen, DMF 5% (33.4% ± 9.7), fue superior estadísticamente a glicerol 3% (27.5% ± 4.3) y DMF 3% (24.2% ± 5.3). Pero no se encontró diferencia respecto al tratamiento glicerol 5% (31.4% ± 3.8) -tabla 1-. Según lo anterior, aunque se plantea que el bajo peso molecular de la DMF respecto al glicerol (59 vs. 92), permite que dicha sustancia penetre la membrana plasmática de forma más rápida, produciendo una menor toxicidad osmótica54, esto no quedó en evidencia dado que la integridad de la membrana plasmática del espermatozoide fue mantenida de forma semejante entre los tratamientos. Oliveira et al.55 reportaron un porcentaje de 49.2% ± 6.6 en la integridad de membrana en semen de diferentes razas caninas, criopreservado con 5% de DMF.
El valor obtenido para la prueba de morfología normal del semen fresco (88.8% ± 4.6), fue similar a lo reportado por Sánchez et al.56 (87.7% ± 6.9), Fontecha57 (93.4% ± 0.6), Silva; et al.58 (79.2 ± 1.4) y Sánchez et al.59 (83.5% ± 20.3). Entre los tratamientos, no se encontró diferencia estadísticamente significativa entre glicerol 5% (67% ± 11.9), glicerol 3% (65.6% ± 12.5) y DMF 5% (60% ± 16.5). Sin embargo, el tratamiento DMF 3% (50.1% ± 18.3) fue estadísticamente inferior a los demás (tabla 1). Resultados similares para esta característica, utilizando glicerol al 6%, fueron reportados por Silva et al.60 (74.3%± 6.9). Mientras para la criopreservación con DMF, Oliveira; et al.61 encontraron un 65.3% ± 14.2 de morfología normal, Futino; et al.62 reportaron tasas de morfología normal para semen criopreservado con 3% de glicerol del 57.1% ± 5.0, y con 3% de DMF del 61.1% ± 5.5.
Conclusiones
La dimetilformamida puede ser considerada una alternativa viable para la congelación rápida de semen canino, dado que en concentraciones del 5% permite alcanzar valores de movilidad progresiva superiores al 40%, y se comporta de manera equivalente al glicerol (5%), en la protección de la integridad de la membrana plasmática y de la morfología normal de los espermatozoides. La congelación rápida del semen canino con 5% de glicerol permite alcanzar tasas de movilidad progresiva superiores a las obtenidas con 3% de glicerol, y con 3% y 5% de DMF.
Referencias
1. EILTS, B. Theoretical aspects of canine semen cryopreservation. En: Theriogenology. 2005. Vol. 64, No. 3. p. 692-697. [ Links ]
2. BAUMBER, J.; et al. Reactive oxygen species and cryopreservation promote DNA fragmentation in equine spermatozoa. En: J. Androl. 2003. Vol. 24, No. 4. p. 621-628. [ Links ]
3. ISACHENKO, V.; et al. DNA integrity and motility of human spermatozoa after standard slow freezing versus cryoprotectant-free vitrification. En: Biol. Reprod. 2004. Vol. 19, No. 4. p. 932-939. [ Links ]
4. MANOSALVA, L.; et al. Efecto de la refrigeración sobre la motilidad, integridad de membrana acrosomal y reacción acrosomal en espermatozoides caninos. En: Rev. Inv. Vet. Perú. [ Links ]
5. WATSON, P. The causes of reduced fertility with cryopreserved semen. En: Anim. Reprod. Sci. 2000. Vol. 60-61, No. 2. p. 481-492. [ Links ]
6. EILTS, Op. Cit., p. 4. [ Links ]
7. SILVA, A.; et al. Prognostic value of canine frozen-thawed semen parameters on in vitro sperm-oocyte interactions. En: Theriogenology. 2006. Vol. 66, No. 2. p. 456-462. [ Links ]
8. STORNELLI, M. A. and DE LA SOTA, R. L. Fertilidad y supervivencia del semen canino criopreservado. En: Analecta Veterinaria. 2006. Vol. 25, No. 2. p. 29-38. [ Links ]
9. STORNELLI, M. A.; STORNELLI, M. C. and DE LA SOTA R. L. Inseminación artificial con semen fresco, refrigerado y congelado aplicación y desarrollo en caninos. En: Analecta Veterinaria. 2001. Vol. 21, No. 1. p. 58-66. [ Links ]
10. ÁLAMO, D.; et al. Cryopreservation of semen in the dog: use of ultra-freezers of -152°C as a viable alternative to liquid nitrogen. En: Theriogenology. 2005. Vol. 63, No. 1. p. 72-82. [ Links ]
11. CARDOSO, R.; et al. Cryopreservation of canine semen using a coconut water extender with egg yolk and three different glycerol concentrations. En: Theriogenology. 2003. Vol. 59. No. 3-4. p.743-751. [ Links ]
12. PONGLOWHAPAN, S; ESSE'N-GUSTAVSSON, B. and LINDE FORSBERG, C. Influence of glucose and fructose in the extender during long-term storage of chilled canine semen. En: Theriogenology. 2004. Vol. 62, No. 8. p. 1498- 1517. [ Links ]
13. SCHÂFER-SOMI, S.; et al. Effects of semen extender and semen processing on motility and viability of frozen-thawed dog spermatozoa. En: Theriogenology. 2006. Vol. 66. p. 173-182. [ Links ]
14. STORNELLI, M. A.; et al. Estudios microscópicos y ultramicroscópicos de semen canino fresco y congelado-descongelado con un diluyente tris base con el agregado de trealosa. En: Acta Microscópica. 2007. Vol. 16, No. 2. p. 194-195. [ Links ]
15. HAY, M.; et al. Effects of cooling, freezing and glycerol on penetration of oocytes by spermatozoa in dogs. En: J. Reprod. Fertil. Suppl. 1997. Vol. 51. p. 99-108. [ Links ]
16. SILVA, A.; CARDOSO, R. and SILVA, L. Comparison between different dilution rates on canine semen freezing using tris-buffer with the addition of egg-yolk and glycerol. En: Arq. Bras. Med. Vet. Zootec. 2005. Vol. 57, No.6. p. 764-771. [ Links ]
17. ROTA, A.; et al. Comparison between glycerol and ethylene glycol for dog semen cryopreservation. En: Theriogenology. 2006. Vol. 65, No. 9. p. 1848-1858. [ Links ]
18. GILMORE, J.; et al. Effect of cryoprotectant solutes on water permeability of human spermatozoa. En: Biol. Reprod. 1995. Vol. 53. p. 985-995. [ Links ]
19. HAY Op. Cit., p. 4. [ Links ]
20. ROHLOFF, D.; LAIBLIN, C. and HEIDRICH, S. Cryoprotective ability of glycerin and DMSO in the deep freezing of dog sperm. En: Berl Munch Tierarztl Wochenschr. 1978. Vol. 91, No. 2. p. 31-33. [ Links ]
21. ROTA, A.; et al. Evaluation of dog semen quality after slow (biological freezer) or rapid (nitrogen vapours) freezing. En: Reprod. Nutr. Dev. 2005. Vol. 45. p. 29-37. [ Links ]
22. ROTA Op. Cit., p. 4. [ Links ]
23. BAUDOT, A. and BOUTRON, P. Glass-Forming tendency and stability of aqueous solutions of diethylformamide and dimethylformamide. En: Cryobiology. 1998. Vol. 37, No. 3. p. 187-199. [ Links ]
24. ALVARENGA, M.; et al. Amides as cryoprotectans for freezing stallion semen: A review. En: Anim. Reprod. Sci. 2005. Vol. 89, No. 1-4. p. 105-113. [ Links ]
25. Ibid., p. 5. [ Links ]
26. OLIVEIRA, E.; et al. In vitro evaluation of canine spermatozoa cryopreserved in different extenders. En: Escola de Veterinária UFMG. Belo Horizonte. 2006. Vol. 58. p. 1116-1122. [ Links ]
27. FUTINO, D.; et al. Glycerol, methyl-formamide and dimethyl-formamide in canine semen cryopreservation. En: Reprod. Dom. Anim. 2010. Vol. 45. p. 214-220. [ Links ]
28. ROTA Op. Cit., p. 4. [ Links ]
29. ISACHENKO Op. Cit., p. 4. [ Links ]
30. BAILEY, J.; BILODEAU, J. And CORMIER, N. Semen cryopreservation in minireview domestic animals: a damaging and capacitating phenomenon. En: J. Androl. 2000. Vol. 21, No. 1. p. 1-7. [ Links ]
31. ORIEF, Y.; et al. Vitrification: will it replace the conventional gamete cryopreservation techniques? En: Middle East Fertility Society Journal. 2005. Vol. 10, No. 3. p. 171-184. [ Links ]
32. ROMAGNOLI, S. Canine artificial insemination with fresh, refrigerated and frozen semen. [On line]. Oeiras: 10-12 Octubre, 2002. [Citado el 30 de Enero de 2011] Url disponible en: http://horta.0catch.com/congressospcv/18.pdf [ Links ]
33. OETTLE, E. Sperm morphology and fertility in the dog. En: J. Reprod. Fertil. Suppl. 1993. Vol. 47. p. 257-260. [ Links ]
34. ROTA, Comparison between glycerol and ethylene glycol for dog semen cryopreservation, Op. Cit., p. 4. [ Links ]
35. ROTA, Evaluation of dog semen quality after slow (biological freezer) or rapid (nitrogen vapours) freezing, Op. Cit., p. 4. [ Links ]
36. SÁNCHEZ, A.; RUBILAR, J. y GATICA R. Congelación de semen canino y evaluación de la fertilidad potencial. [En línea]. Chile: Instituto de Reproducción Animal - Facultad de Ciencias Veterinarias - Universidad Austral de Chile, 2007. [Citado el 30 de febrero de 2011]. Url disponible en: asancher@smtp.uach.cl. [ Links ]
37. FONTECHA, E. Estandarización de un Protocolo para la Crioconservación de Semen Canino con Congelador Programable (Cl-8800). Villavicencio, 2006. p. 42. Trabajo de Grado (Médico Veterinario Zootecnista). Universidad de los Llanos. Facultad de Ciencias Agropecuarias y Recursos Naturales. Escuela de Medicina Veterinaria y Zootecnia. [ Links ]
38. GOBELLO, C. y OLIVERA, M. El libro latinoamericano de reproducción canina y felina. Medellín, Colombia: Biogénesis; 2005. 338 p. [ Links ]
39. FONTECHA, Op. cit., p. 10. [ Links ]
40. SÁNCHEZ, Op. cit., p. 10. [ Links ]
41. Ibid., p. 10. [ Links ]
42. OLIVEIRA, Op. cit., p. 5. [ Links ]
43. SÁNCHEZ, R.; CARTAGENA, P. y BERLAND, 0. Comparación del efecto de dos diluyentes sobre la fertilidad potencial de semen canino refrigerado. En: Rev. Inv. Vet. Perú. Vol. 17, No. 1. 2006. p. 1-7. [ Links ]
44. MEDINA, V.; et al. Evaluación de las características seminales en cinco razas caninas a través de un sistema de análisis espermático asistido por computador (CASA). En: Rev. Col. Cienc. Pec. 2007. Vol. 20. No. 4. p. 671-672. [ Links ]
45. SILVA, Op. cit., p. 4. [ Links ]
46. FUTINO, Op. cit., p. 5. [ Links ]
47. WATSON, Op. cit., p. 4. [ Links ]
48. FUTINO, Op. cit., p. 5. [ Links ]
49. SILVA, Op. cit., p. 4. [ Links ]
50. OLIVEIRA, Op. cit., p. 5. [ Links ]
51. FUTINO, Op. cit., p. 5. [ Links ]
52. SÁNCHEZ, Comparación del efecto de dos diluyentes sobre la Fertilidad potencial de semen canino refrigerado, Op. cit., p. 10. [ Links ]
53. SÁNCHEZ, Congelación de semen canino y evaluación de la fertilidad potencial, Op. cit., p. 10. [ Links ]
54. SQUIRES, E.; KEITH, S. and GRAHAM, J. Evaluation of alternative cryoprotectants for preserving stallion spermatozoa. En: Theriogenology. 2004. Vol. 62, No. 6. p. 1056-1065. [ Links ]
55. OLIVEIRA, Op. cit., p. 5. [ Links ]
56. SÁNCHEZ, Comparación del efecto de dos diluyentes sobre la Fertilidad potencial de semen canino refrigerado, Op. cit., p. 10. [ Links ]
57. FONTECHA, Op. cit., p. 10. [ Links ]
58. SILVA, A.; et al. Effect to tris-buffer, egg yolk and glycerol on canine semen freezing. En: Vet. J. 2002. Vol. 164, No. 3. p. 244-246. [ Links ]
59. SÁNCHEZ, Congelación de semen canino y evaluación de la fertilidad potencial, Op. cit., p. 10. [ Links ]
60. SILVA, Op. cit., p. 4. [ Links ]
61. OLIVEIRA, Op. cit., p. 5. [ Links ]
62. FUTINO, Op. cit., p. 5. [ Links ]














