Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.8 no.2 Caldas July/Dec. 2011
* Artículo derivado del proyecto "Remoción de productos de aseo y cuidado personal de aguas del rio Medellín a la altura del Municipio de Caldas: estudio de humedal piloto" aprobado en la convocatoria de mediana cuantía de 2011, financiado por el fondo para el Desarrollo de la Investigación de la Corporación Universitaria Lasallista.
** Grupo de Investigación Aplicada al Medio Ambiente (GAMA). facultad de Ingeniería. Corporación Universitaria Lasallista. Caldas-Antioquia-Colombia.
Correspondencia: Claudio Jiménez Cartagena e-mail: clajimenez@lasallistadocentes.edu.co
Artículo recibido: 02/02/2011; Artículo aprobado: 12/12/2011
Resumen
Los residuos de productos farmacéuticos representan un riesgo ambiental debido a su persistencia y distribución en el agua, en el suelo, en el aire y en los alimentos. Su amplio uso hospitalario, veterinario y doméstico aumenta sus descargas y la de sus productos de transformación en el ambiente, y su toxicidad se manifiesta en los componentes vivos de los ecosistemas. El desarrollo de metodologicas de tratamiento de muestra y de técnicas instrumentales de análisis ha permitido monitorear sus a bajas concentraciones a lo largo de los componentes de los ecosistemas acuáticos, del suelo y su biomagnificación en las cadenas tróficas. Asimismo, se desarrollan ensayos in vitro e in vivo para determinar su ecotoxicidad, clasificándolos como contaminantes emergentes, cuyas descargas no son cuantificables, pero su impacto sobre los ecosistemas es crónico y de graves repercusiones para la salud pública mundial. Esta revisión compila investigaciones de los últimos diez (10) años acerca de la presencia de algunos fármacos en los cuerpos de agua, al igual que llama la atención del impacto de la actividad farmacéutica sobre el ambiente.
Palabras clave: productos farmacéuticos, ecotoxicidad, contaminantes orgánicos emergentes.
Abstract
Waste materials from pharmaceutical products are an environmental problem due to their persistence and distribution in water, soil, air and food. The use of those products in hospitals, veterinarian clinics and homes, increase their discharges and also those of their transformation products into the environment and their toxicity affects life in ecosystems. The development of sample treatment methods and instrumental analysis techniques have allowed their low concentrations monitoring throughout all of the components of aquatic, ecosystems, the soil and their biomagnifications in food chains. Likewise, in vitro and in vivo tests are made to determine their ecotoxicity, classifying them as emerging pollutants which discharges are not accountable, but which impact on ecosystems is chronic and highly harmful for health worldwide. This revision gathers research works made during the last 10 years concerning the presence of some pharmaceutical products in water bodies and also warns about the impact of pharmaceutical activities on environment.
Key words: Pharmaceutical products, ecotoxicity, emerging organic pollutants.
Resumo
Os resíduos de produtos farmacêuticos, representam um problema ambiental nos últimos anos devido a sua persistência e distribuição no água, no solo, no ar e nos alimentos. Seu uso hospitalar, veterinário e doméstico aumenta suas descargas e a de seus produtos de transformação no ambiente e sua toxicidade se manifiesta nos componentes vivos dos ecossistemas. O desenvolvimento de métodos de tratamentos de mostra e de técnicas instrumentais de análises permitiu sua monitoração a baixas concentrações ao longo de todos os componentes dos ecossistemas aquáticos, o solo e seu bio-magnificação nas correntes tróficas. Assim mesmo, desenvolvem-se ensaios in vitro e in vivo para determinar seu eco-toxicidade, classificando-os como contaminantes emergentes, cujas descargas não são quantificáveis, mas seu impacto sobre os ecossistemas é crônico e de graves repercussões para a saúde pública mundial. Esta revisão copila investigações dos últimos dez (10) anos a cerca da presença de alguns fármacos nos corpos de água; ao igual que chama o atendimento do impacto da atividade farmacêutica sobre o ambiente.
Palavras Importantes: Produtos farmacêuticos, eco-toxicidade, contaminantes orgânicos emergentes.
Introducción
Los principios activos farmacéuticos (fármacos, fitoterapéuticos y productos biotecnológicos) constituyen una variedad de compuestos, con propiedades diversas, ionizables en la mayoría de los casos e incorporados en matrices complejas para garantizar su estabilidad y preservar su actividad biológica1. En general, son obtenidos por síntesis orgánica y su paso a través de los sistemas biológicos no garantiza su total biotransformación. Cabe destacar que muchos de estos son transformados en su totalidad en el higado y algunos otros son eliminados casi en su totalidad, provocando alteraciones ambientales o bioacumulación en algunos de los niveles de la cadena trófica. Cabe destacar que los productos farmacéuticos son formulaciones complejas y que sus coayudantes tambien genera productos de transformación, que interactuan con la materia orgánica y bajo las condiciones propias del ecosistema, pueden ser potencialmente más tóxicos, más recalcitrantes e incluso más bioacumulables.
Los contaminantes convencionales como los agroquímicos, policloradosbifenílicos (PCB), fitalatos, dioxinas (PCDD), furanonas (PCDF), hidrocarburos poliaromáticos (PAH) e ignífugos, entre otros, han orientado los estudios en temas analíticos y de mitigación; pero en los años 90, algunos efluentes de sistemas de tratamiento de aguas residuales empezaron a mostrar concentraciones considerables de productos farmacéuticos y se orientaron múltiples investigaciones hacia su identificación y a su cuantificación2.
El primer reporte de la presencia de fármacos en aguas residuales tratadas y de sus efectos adversos sobre la fauna y la fora fue realizado en 1976 en Kansas, Estados Unidos, y que permitió a la Administración de Drogas y Alimentos-FDA de los Estados Unidos y a la Unión Europea (EU) a orientar muchos de sus estudios hacia la evaluación de sus impactos ambientales y al desarrollo de estrategias de tratamiento, estudio de metabolitos, toxicidad, remoción, biorremediación y técnicas instrumentales para su identificación y cuantificación3-6.
Entre los mecanismos de incorporanción de los productos farmacéuticos en los cuerpos de agua estan los procesos de eliminación de animales y humanos, los vertidos de la industria farmacéutica, los residuos hospitalarios, la disposición inadecuada de fármacos vencidos o no utilizados, y los vertidos de instituciones de investigación y desarrollo de fármacos, entre otros.
Por lo anterior, este escrito pretende mostrar de forma fácil y asimilable el desarrollo investigativo de los últimos diez años acerca de la presencia de principios activos farmacéuticos en los cuerpos de agua, con el objetivo de alertar a las instituciones de control ambiental en Colombia.
Productos farmamacéuticos en el agua
Los productos farmacéuticos no eran considerados contaminantes ambientales dado que se desconocía su acumulación o la de sus productos de transformación en suelos, aguas, aire, tejidos vegetales y tejidos animales. Por lo anterior, la concentración de estos en matrices ambientales y en especial en los cuerpos de agua es indeterminada, y solo a partir de los años noventa (90) se empezaron a cuantificar en aguas, concentraciones entre partes por billón (ppb) y partes por trillón (ppt). En publicaciones recientes, se reporta que en países como España, Italia, Alemania, Canadá, Brasil, Grecia y francia hay descargas al agua de aproximadamente 500 toneladas de analgésicos por año, en donde el ácido salicílico y el diclofenaco han alcanzado concentraciones de 0,22µg/L y 3,02µg/L, respectivamente7.
Factores como la demanda, la frecuencia de administración, la automedicación, el consumo ilícito de drogas y los procesos fisiológicos determinan la carga y la persistencia de principios activos en aguas8; un caso particular se reporta en Alemania donde cientos de toneladas de principios activos farmacéuticos de alta demanda son incorporados al ambiente9. De igual forma, los sistemas hospitalarios incorporan antimicrobianos al agua, promoviendo la generación de microorganismos resistentes y alteraciones en la actividad enzimática de la microbiota, lo cual interrumpe los procesos de biodegradación propia de materia orgánica en los cuerpos de agua10. Sin embargo, poco se conoce de los efectos crónicos de fármacos en el ambiente, aunque algunos ensayos ecotoxicológicos alertan del gran problema.
Moléculas como la carbamazepina, el atenolol, el metoprolol, el trimetoprim y el diclofenaco solo han sido removidas en un 10% por las plantas de tratamiento de aguas residuales, mientras que compuestos como la carbamazepina se removió solo el 7% y el propranolol en 96% en agua11. Finalmente, en Alemania hay reportes de concentraciones de clofibrato mayores a 70 ng/L en agua12, aunque en otros casos hay evaluaciones que muestran toxicidad de carbamazepina, de gemfibrozilo y de fluoxetina, y reportan concentraciones efectivas 50 (EC50) inferiores a 81µg/mL, 1.18µg/mL y 24µg/mL, respectivamente13-15.
En esta revisión, se abordan fármacos como analgésicos, antihipertensivos y antimicrobianos, ampliamente prescriptos.
Analgésicos
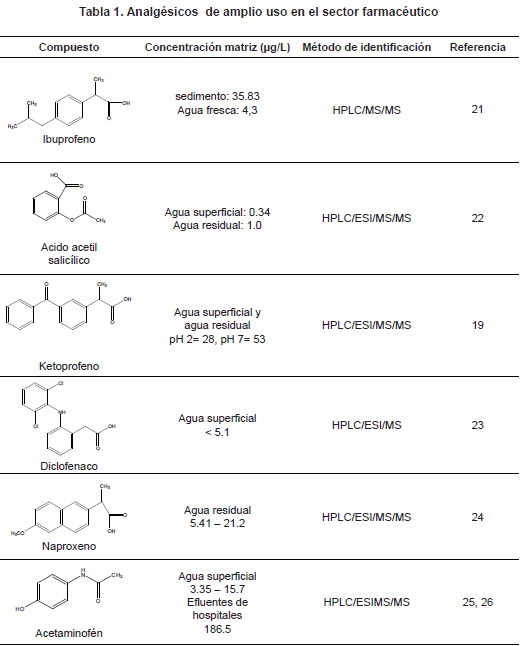
Constituyen uno de los fármacos de mayor consumo mundial y son considerados los de mayor automedicación16; el diclofenaco y el ASA se reportaron presentes en aguas residuales17; por su parte, el naproxeno, el ibuprofeno y el acetaminofén se reportaron en aguas residuales hospitalarias18. Autores como farré M y colaboradores reportaron concentraciones de analgésicos en aguas superficiales y evaluaron sus concentraciones tóxicas in vivo19. De igual forma, se ha reportado la presencia de metabolitos del ibuprofeno20; lo anterior es indicador importante de la necesidad de conocer las rutas metabólicas de cada uno de los compuesto, para determinar o descartar el origen de su toxicidad. En la tabla 1, se reportan algunos analgésicos antiinfamatorios no esteroideos-AINES, de amplia dispensación.
Antihipertensivos
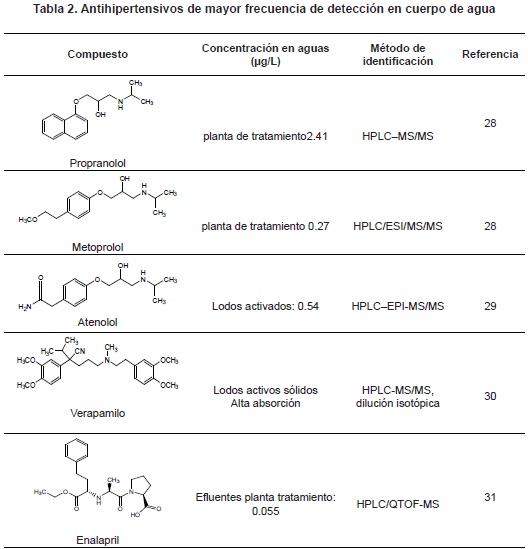
La hipertensión arterial es la enfermedad cardiovascular más común en el mundo; solo en Estados Unidos se reportan 43 millones de pacientes con valores de presión arterial sistólica igual o mayor de 140 mmHg y de presión diastólica igual o mayor de 90 mm Hg27. Lo anterior conlleva un aumento de la prescripción de estos. Constituyen un grupo muy amplio dentro de los cuales se destacan el calcio-antagonista, los inhibidores de la enzima convertidora de angiotensina (IECA) y los beta bloqueadores, entre otros. Algunos β-bloqueadores como el atenolol, el metoprolol y el propranolol han alcanzado niveles superiores a los 0.017µg/L en efluentes de aguas municipales11. En la tabla 2, se muestran algunos antihipertensivos de mayor número de reportes en cuerpos de agua.
Antibióticos
Los antibióticos son fármacos de amplio uso en el mundo; su efecto contra microorganismos patógenos en animales y humanos, así como su uso para la preservación de alimentos y piensos, ha incrementado su producción y consumo, permitiendo grandes descargas sobre los cuerpos de agua con manifestaciones de resistencia microbiana en las zonas de estudio.
La resistencia microbiana está determinada por la expresión de genes que codifican proteínas facultadas de la expulsión del antibiótico hacia el exterior celular32, síntesis enzimática33 y alteraciones de su blanco terapéutico34. De igual forma, hay evidencia de la presencia de residuos de antibióticos en el ambiente y su implicación en los mecanismos de defensa propios de los organismos vivos. Entre los antibióticos mayor reporte en los cuerpos de agua están las tetraciclinas35, los aminoglicósidos36, los macrólidos, los betalactámicos y la vancomicina37, entre otros38. (tabla 3).
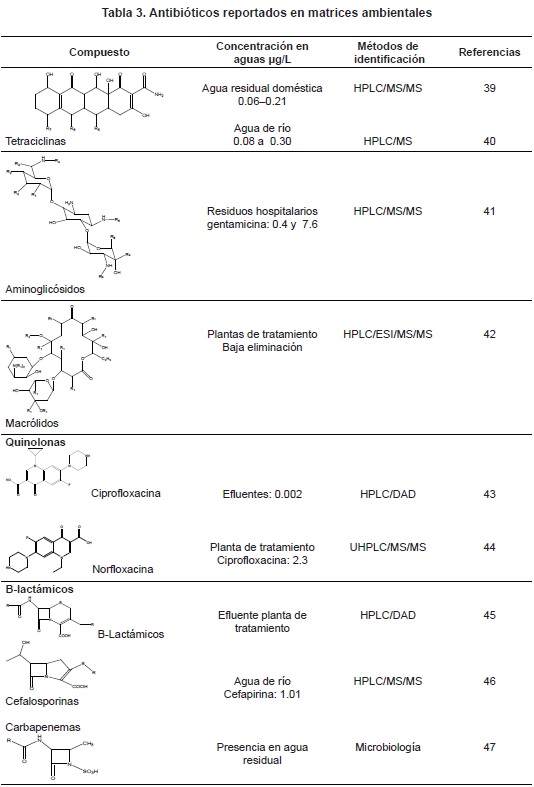
Las principales fuentes de estos en el agua son residuos hospitalarios y residuos domésticos o agrícolas. Entre los microorganismos que reportan resistencia se destacan: Staphylococcus, Aeromonas, Pseudomonas, Salmonellas y Escherichia, entre otros10. Efectivamente, la presencia de microorganismos resistentes en cuerpos de agua es un tema de gran importancia para la salud pública y para los sistemas de tratamiento en la definición de políticas legales y de operatividad.
Otros fármacos de importancia ambiental
En los últimos años, se han encontrado en las aguas residuales y en algunos casos en aguas de consumo humano, fármacos asociados a interrupción o alteración de funciones endocrinas. En general, todos los compuestos que afecten el sistema endocrino son definidos como disruptores endocrinos (DE), y están implicados en causar cambios hormonales en especies ícticas y en algunos anfibios48, 49; algunos están asociados a la secreción de hormonas como la hormona estimulante de la glándula tiroides (TSH), la luteinizante (LH) y la estimulante del folículo (FSH). Otros fármacos como el clofibrato, la carbamazepina y la fluoxetina modifican la actividad endocrina. De otro lado, fármacos DE no se remueven con facilidad en las plantas de tratamiento de agua residuales, y terminan en aguas superficiales y aguas para el consumo humano, exponiendo de forma crónica a la especie humana y sus efectos tóxicos11, 50.
Metabolismo de fármacos
La transformación de los xenobióticos (farmacos y otros) en subproductos de eliminación a través de los sistemas enzimáticos, estos son expuestos a reacciones de oxidorredución e hidrólisis, y posteriormente son conjugados para aumentar la solubilidad y facilitar su excreción. Estos subproductos de eliminación son de difícil identificación analítica, debido a escasez de patrones primarios o de técnicas de identificación, lo que hace necesario disponer de protocolos de tamizaje que permitan su identificación y determinar su ecofarmacotoxicidad51.
Propiedades fisicoquímicas de los fármacos y su distribución en el ambiente
A diferencia de otros contaminantes en el agua, los fármacos son moléculas con actividad biológica sobre diferentes organismos, y sus propiedades fisicoquímicas determinan su persistencia en el ambiente y facilitan su bioacumulación. La complejidad y Heterogeneidad molecular de estos permite que sus propiedades dependan del ambiente. Parámetros fisicoquímicos como el coeficiente de distribución octanol /agua (Dow), constante de Henry y la constante de disociación permiten describir su equilibrio químico y dinámico, y proporcionan información sobre el procedimiento analítico ideal para su identificación.
La gran mayoría de fármacos son ácidos y bases débiles, por lo que su distribución depende del pH del medio y la constante de acidez (Ka). Lo anterior indica que la bilis de algunos peces, por su naturaleza lipofílica, constituye una buena matriz para el análisis y biomagnificación de fármacos en ecosistemas acuáticos52; asimismo, evidencia que las propiedades fisicoquímicas de los fármacos condicionan su distribución, su bioacumulación y su biomagnificación.
Efectos tóxicos de los fármacos en el ambiente
Los efectos aún no son comprendidos en su totalidad, sin embargo, muchos de estos modulan el sistema endocrino y el sistema inmune, indicando su potencialidad sobre la homeostasis de los organismos acuáticos53. Los modelos ecotoxicológicos utilizan microorganismos, especies ícticas, crustáceos, entre otros, pero estos no logran describir el efecto de los fármacos sobre las comunidades acuáticas.
Los ensayos de ecotoxicidad, aprobados por la Agencia de Protección Ambiental de los Estados Unidos (EPA), son pruebas de toxicidad aguda; sin embargo, no se conocen los efectos crónicos de sub-trazas sobre la biota acuática. Inicialmente estas pruebas fueron implementados en Alemania en la guía de la Unión Europea 92/18 EWG para fármacos veterinarios54, y otras fueron propuestas por la Sociedad Escandinava de Toxicología Celular con el objetivo de describir potenciación y/o sinergia tóxica de fármacos. Por ejemplo, el verapamilo aumenta la susceptibilidad a otros fármacos, debido a que, se fija directamente al sitio activo de la proteína Pgp, por su parte la quinidina, las ciclosporinas y la progesterona inhiben la resistencia a multixenobióticos55.
Las pruebas de ecotoxicidad son de gran importancia para la descripción de los efectos tóxicos, expresados como concentración efectiva 50 (EC50), y clasifican las sustancias como muy tóxicas para organismos acuáticos (<1 mg/L, evaluadas en Dagnia magna), tóxicas con valores cercanos a 10 mg/L, y nocivas para los organismos acuáticos con valores que oscilan entre 10-100 mg/L del principio activo56. De igual forma, el Multicentro de Evaluación de Citotoxicidad In Vitro (MEIC) es un referente en estudios toxicológicos debido a que cuenta con una lista de efectos causados por fármacos en organismos acuáticos. Reportan toxicidad de varios fármacos en Daphnia magna. Otras guías como la de la Organización para la Cooperación Económica y el Desarrollo (OECD) 202 parte II (Reproducción en Daphnia magna) se fundamenta en la concentración con el efecto no observable (NOEC)
Una gran dificultad para los humanos es la exposición a sub-trazas de contaminantes emergentes en agua potable cuyas concentraciones sub-terapéuticas pueden traer efectos catastróficos para el ser humano y los diferentes sistemas biológicos y en especial para los neonatos, pediátricos y adultos mayores, con la dificultad de que las pruebas toxicológicas no evalúan el riesgo a través de agua potable, ni mucho menos los efectos carcinogénicos, mutágenos o endocrinos.
Conclusión
Los contaminantes emergentes se convierten en un riesgo ambiental para la salud pública en el mundo. Entre estos se destacan los principios activos farmaceuticos y los productos para el cuidado personal, que se encuentran en cuerpos de agua para el consumo humano y de reserva. Ensayos de ecotoxicidad in vitro e in vivo han demostrado el efecto tóxico de estos sobre las cadenas tróficas, y su identificación y cuantificación constituyen la primera etapa dentro de la toma de decisiones para la preservación del recurso, la cual es posible, gracias al desarrollo de técnicas de tratamiento de muestra y de sistemas cromatográficos que permiten alcanzar niveles de partes por billón e, incluso, partes por trillón. Ante esta situación, es necesario que las entidades encargadas de la vigilancia, el cuidado del medioambiente y la preservación de la salud pública, intervengan en los procesos de manejo y disposición final de los contaminantes emergentes.
Por último, se recomienda el uso de técnicas complementarias de tratamiento de afluentes y efluentes como las tecnologías avanzados de oxidación (TAO), lodos activados y otras técnicas para la reducción de contaminantes. Es necesario que Colombia incursione en los procesos de mineralización de contaminantes para la disminución de los niveles tóxicos de residuos de origen antropogénico en el agua y para optimizar el aprovechamiento de este recurso natural cada vez más escaso en el planeta Tierra.
Referencias
1. CUNNINGHAM, V. L. Special Characteristics of Pharmaceuticals Related to Environmental Fate. En: Pharmaceuticals in the Environment. 2008. p. 23-34. [ Links ]
2. CALIMAN, F.A. and GAVRILESCU, M. Pharmaceuticals, Personal Care Products and Endocrine Disrupting Agents in the Environment - A Review. En: CLEAN - Soil, Air, Water. 2009. Vol. 37, No. 4-5. p. 277-303. [ Links ]
3. KÜMMERER, K. The presence of pharmaceuticals in the environment due to human use -present knowledge and future challenges. En: Journal of Environmental Management. 2009. Vol. 90, No. 8. p. 2354-2366. [ Links ]
4. CELIZ, M. D.; TSO, J. and Aga, D. S. Pharmaceutical metabolites in the environment: Analytical challenges and ecological risks. En: Environmental Toxicology and Chemistry. 2009. Vol. 28, No. 12. p. 2473-2484. [ Links ]
5. FENT, K.; WESTON, A. A. and CAMINADA, D. Ecotoxicology of human pharmaceuticals. En: Aquatic Toxicology. 2006. Vol. 76, No. 2. p. 122-159. [ Links ]
6. ONESIOS, K.; YU, J. and BOUWER, E. Biodegradation and removal of pharmaceuticals and personal care products in treatment systems: a review. En: Biodegradation. 2009. Vol. 20, No. 4. p. 441-466. [ Links ]
7. HEBERER, T. Tracking persistent pharmaceutical residues from municipal sewage to drinking water. En: Journal of Hydrology. 2002. Vol. 266, No. 3-4. p. 175-189. [ Links ]
8. HALLING-SORENSEN, B.; et al. Occurrence, fate and effects of pharmaceutical substances in the environment-a review. En: Chemosphere. 1998. Vol. 36, No. 2. p. 357-393. [ Links ]
9. ELLIS, J. Pharmaceutical and personal care products (PPCPs) in urban receiving waters. En: Environmental Pollution. 2006. Vol. 144, No. 1. p. 184-189. [ Links ]
10. BAQUERO, F.; MARTINEZ, J. and CANTÓN, R. Antibiotics and antibiotic resistance in water environments. En: Current opinion in biotechnology. 2008. Vol. 19, No. 3. p. 260-265. [ Links ]
11. TERNES, T. Occurrence of drugs in German sewage treatment plants and rivers. En: Water research. 1998. Vol. 32, No. 11. p. 3245-3260. [ Links ]
12. STUMPF, M. Determination of drugs in sewage treatment plants and river water. En: Vom Wasser. 1996. Vol. 86. p. 291-303. [ Links ]
13. FERRARI, B.; et al. Ecotoxicological impact of pharmaceuticals found in treated wastewaters: study of carbamazepine, clofibric acid and diclofenac. En: Ecotoxicology and Environmental Safety. 2003. Vol. 55, No. 3. p. 359-370. [ Links ]
14. QUINN, B.; GAGNÉ, F. and BLAISE; C. An investigation into the acute and chronic toxicity of eleven pharmaceuticals (and their solvents) found in wastewater effluent on the cnidarian, Hydra attenuata. En: Science of the Total Environment. 2008. Vol. 389, No. 2-3. p. 306-314. [ Links ]
15. BROOKS, B.; et al. Aquatic ecotoxicology of fluoxetine. En: Toxicology letters. 2003. Vol. 142, No. 3. p. 169-183. [ Links ]
16. ASHP Therapeutic Position Statement on the Safe Use of Oral Nonprescription Analgesics. En: Am J Health Syst Pharm. 1999. Vol. 56, No. 11. p. 1126-1131. [ Links ]
17. RICHARDSON, S. Water analysis: emerging contaminants and current issues. En: Anal. Chem. 2009. Vol. 81, No. 12. p. 4645-4677. [ Links ]
18. GÓMEZ, M.; et al. Determination of pharmaceuticals of various therapeutic classes by solid-phase extraction and liquid chromatography-tandem mass spectrometry analysis in hospital effluent wastewaters. En: Journal of Chromatography. A. 2006. Vol. 1114, No. 2. p. 224-233. [ Links ]
19. FARRÉ, M. Determination of drugs in surface water and wastewater samples by liquid chromatography-mass spectrometry: methods and preliminary results including toxicity studies with Vibrio fischeri. En: J. Chromatogr. A. 2001. Vol. 938, No. 1-2. p. 187-197. [ Links ]
20. BUSER, H.; POIGER, T. and MÜLLER, M. Occurrence and environmental behavior of the chiral pharmaceutical drug ibuprofen in surface waters and in wastewater. En: Environ. Sci. Technol. 1999. Vol. 33, No. 15. p. 2529-2535. [ Links ]
21. VAZQUEZ-ROIG, P.; et al. Assessment of the occurrence and distribution of pharmaceuticals in a Mediterranean wetland (L'Albufera, Valencia, Spain) by LC-MS/MS. En: Analytical and Bioanalytical Chemistry. 2011. Vol. 400, No. 5. p. 1287-1301. [ Links ]
22. RICHARDSON, M. and BOWRON, J. The fate of pharmaceutical chemicals in the aquatic environment. En: Journal of Pharmacy and Pharmacology. 1985. Vol. 37, No. 1. p. 1-12. [ Links ]
23. STÜLTEN, D.; et al. Occurrence of diclofenac and selected metabolites in sewage effluents. En: Science of the Total Environment. 2008. Vol. 405, No. 1-3. p. 310-316. [ Links ]
24. SANTOS, J.; et al. Occurrence of pharmaceutically active compounds during 1-year period in wastewaters from four wastewater treatment plants in Seville (Spain). En: Journal of hazardous materials. 2009. Vol. 164, No. 2-3. p. 1509-1516. [ Links ]
25. HAN, G.; HUR, H. and KIM, S. Ecotoxicological risk of pharmaceuticals from wastewater treatment plants in Korea: Occurrence and toxicity to Daphnia magna. En: Environmental Toxicology and Chemistry. 2006. Vol. 25, No. 1. p. 265-271. [ Links ]
26. LIN, A. and TSAI, Y. Occurrence of pharmaceuticals in Taiwan's surface waters: Impact of waste streams from hospitals and pharmaceutical production facilities. En: Science of the Total Environment. 2009. Vol. 407, No. 12. p. 3793-3802. [ Links ]
27. HE, J. and WHELTON, P. Epidemiology and prevention of hypertension. En: Medical Clinics of North America. 1997. Vol. 81, No. 5. p. 1077-1098. [ Links ]
28. GABET-GIRAUD, V.; et al. Occurrence and removal of estrogens and beta blockers by various processes in wastewater treatment plants. En: Science of The Total Environment. 2010. Vol. 408, No. 19 p. 4257-4269. [ Links ]
29. WICK, A.; et al. Fate of beta blockers and psycho-active drugs in conventional wastewater treatment. En: Water Research. 2009. Vol. 43, No. 4. p. 1060-1074. [ Links ]
30. STEVENS-GARMON, J.; et al. Sorption of emerging trace organic compounds onto wastewater sludge solids. En: Water Research. 2011. Vol. 45, No. 11. p. 3417-3426. [ Links ]
31. LAVÉN, M.; et al. Serial mixed-mode cation and anion-exchange solid-phase extraction for separation of basic, neutral and acidic pharmaceuticals in wastewater and analysis by high-performance liquid chromatography-quadrupole time-of-fight mass spectrometry. En: Journal of Chromatography A. 2009. Vol. 1216, No 1. p. 49-62. [ Links ]
32. KUMAR, A. and Schweizer, H. Bacterial resistance to antibiotics: active efflux and reduced uptake. En: Advanced drug delivery reviews. 2005. Vol. 57, No. 10. p. 1486-1513. [ Links ]
33. WRIGHT, G. Bacterial resistance to antibiotics: enzymatic degradation and modification. En: Advanced drug delivery reviews. 2005. Vol. 57, No. 10. p. 1451-1470. [ Links ]
34. LAMBERT, P. Bacterial resistance to antibiotics: modified target sites. En: Advanced drug delivery reviews. 2005. Vol. 57, No. 10. p. 1471-1485. [ Links ]
35. DANG, H.; et al. Molecular determination of oxytetracycline-resistant bacteria and their resistance genes from mariculture environments of China. En: Journal of applied microbiology. 2007. Vol. 103, No. 6. p. 2580-2592. [ Links ]
36. SHAKIL, S.; et al. Aminoglycosides versus bacteria-a description of the action, resistance mechanism, and nosocomial battleground. En: Journal of biomedical science. 2008. Vol. 15, No. 1. p. 5-14. [ Links ]
37. ROBERTS, M.; et al. Nomenclature for macrolide and macrolide-lincosamide-streptogramin B resistance determinants. En: Antimicrobial Agents and Chemotherapy. 1999. Vol. 43, No. 12. p. 2823. [ Links ]
38. AKINBOWALE, O.; PENG, H. and BARTON, M. P514 Class 1 integron mediates antibiotic resistance in Aeromonas spp. from rainbow trout farms in Australia. En: International Journal of Antimicrobial Agents. 2007. Vol. 29. p. S113. [ Links ]
39. YANG, S., CHA, J. and CARLSON, K. Simultaneous extraction and analysis of 11 tetracycline and sulfonamide antibiotics in influent and effluent domestic wastewater by solid-phase extraction and liquid chromatography-electrospray ionization tandem mass spectrometry. En: Journal of Chromatography A. 2005. Vol. 1097, No. 1-2. p. 40-53. [ Links ]
40. YANG, S. and CARLSON, K. Evolution of antibiotic occurrence in a river through pristine, urban and agricultural landscapes. Water Research. 2003. Vol. 37, No. 19. p. 4645-4656. [ Links ]
41. LÖFFLER, D. and TERNES, T. A. Analytical method for the determination of the aminoglycoside gentamicin in hospital wastewater via liquid chromatography-electrospray-tandem mass spectrometry. En: Journal of Chromatography A. 2003. Vol. 1000, No. 1-2. p. 583-588. [ Links ]
42. GÖBEL, A.; et al. fate of sulfonamides, macrolides, and trimethoprim in different wastewater treatment technologies. En: Science of The Total Environment. 2007. Vol. 372, No. 2-3. p. 361-371. [ Links ]
43. HUANG, X.; et al. Preparation of a mixed stir bar for sorptive extraction based on monolithic material for the extraction of quinolones from wastewater. En: Journal of Chromatography A. 2010. Vol. 1217, No. 16. p. 2667-2673. [ Links ]
44. GRACIA-LOR, E.; SANCHO, J. V. and HERNÁNDEZ, F. Multi-class determination of around 50 pharmaceuticals, including 26 antibiotics, in environmental and wastewater samples by ultra-high performance liquid chromatography-tandem mass spectrometry. En: Journal of Chromatography A. 2011. Vol. 1218, No. 16. p. 2264-2275. [ Links ]
45. BENITO-PEÑA, E.; et al. Evaluation of mixed mode solid phase extraction cartridges for the preconcentration of beta-lactam antibiotics in wastewater using liquid chromatography with UV-DAD detection. En: Analytica Chimica Acta. 2006. Vol. 556, No. 2. p. 415-422. [ Links ]
46. CHA, J. M.; YANG, S. and Carlson, K. H. Trace determination of [beta]-lactam antibiotics in surface water and urban wastewater using liquid chromatography combined with electrospray tandem mass spectrometry. En: Journal of Chromatography A. 2006. Vol. 1115, No. 1-2. p. 46-57. [ Links ]
47. LUCZKIEWICZ, A.; et al. Antimicrobial resistance of fecal indicators in municipal wastewater treatment plant. En: Water Research. 2010. Vol. 44, No. 17. p. 5089-5097. [ Links ]
48. BJÖRKBLOM, C.; et al. Estrogen-and androgen-sensitive bioassays based on primary cell and tissue slice cultures from three-spined stickleback (Gasterosteus aculeatus). Comparative Biochemistry and Physiology Part C. En: Toxicology & Pharmacology. 2007. Vol. 146, No. 3. p. 431-442. [ Links ]
49. HUTCHINSON, T.; et al. Screening and testing for endocrine disruption in fish-biomarkers as "signposts," not "traffic lights," in risk assessment. En: Environmental Health Perspectives. 2006. Vol. 114, No. 1 p. 106. [ Links ]
50. TERNES, T.; BONERZ, M. and SCHMIDT, T. Determination of neutral pharmaceuticals in wastewater and rivers by liquid chromatography-electrospray tandem mass spectrometry. Journal of Chromatography A. 2001. Vol. 938, No. 1-2. p. 175-185. [ Links ]
51. RAHMAN, S.; et al., Pharmacoenvironmentology - a component of pharmacovigilance. En: Environmental Health. 2007. Vol. 6, Suppl 1. p. 20. [ Links ]
52. GUARINO, A. and LECH, J. Metabolism, disposition, and toxicity of drugs and other xenobiotics in aquatic species. En: Veterinary and human toxicology. 1986. Vol. 28. p. 38. [ Links ]
53. FENT, K.; WESTON, A. and CAMINADA, D. Ecotoxicology of human pharmaceuticals. En: Aquatic Toxicology. 2006. Vol. 76, No. 2. p. 122-159. [ Links ]
54. BOUDOU, A. and RIBEYRE, F. Aquatic ecotoxicology: from the ecosystem to the cellular and molecular levels. En: Environmental Health Perspectives. 1997. Vol. 105, Suppl 1. p. 21. [ Links ]
55. KURELEC, B. The multixenobiotic resistance mechanism in aquatic organisms. En: CRC Critical Reviews in Toxicology. 1992. Vol. 22, No. 1. p. 23-43. [ Links ]
56. COMMISSION OF THE EUROPEAN COMMUNITIES. Methods for determination of ecotoxicity; Annex V, C.20, Daphnia magna reproduction test. EEC Directive 92/69/EEC. 1992. [ Links ]














