Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.9 no.1 Caldas Jan./June 2012
Artículo original / Original article / Artigo original
* Artículo derivado de la tesis de maestría "Efecto del crioprotector Dimetilformamida sobre la viabilidad de embriones bovinos producidos in vitro" realizada desde junio de 2010 a julio de 2011, financiada por el Politécnico Colombiano Jaime Isaza Cadavid y la Universidad Nacional de Colombia Sede Medellín.
** Zootecnista, especialista en Reproducción Bovina, magíster en Ciencias - Biotecnología Animal. Profesor asistente, Facultad de Ciencias Administrativas y Agropecuarias. Corporación Universitaria Lasallista.
*** Médico veterinario. Profesor titular, Facultad de Ciencias Agrarias. Politécnico Colombiano Jaime Isaza Cadavid.
**** Biólogo, magíster en Ciencias Básicas Biomédicas, Candidato a Doctor en Ciencias - Biotecnología Animal. Profesor Asociado, Facultad de Ciencias. Universidad Nacional de Colombia Sede Medellín.
Correspondencia: John Jairo Giraldo Giraldo, email: jogiraldo@lasallistadocentes.edu.co.
Artículo recibido: 15/02/2012; Artículo aprobado: 01/08/2012
Resumen
Introducción. Grandes esfuerzos se han centrado en el perfeccionamiento de la criopreservación de embriones, no obstante, uno de los principales problemas es la alta sensibilidad a la criopreservación, debido a los efectos nocivos de las bajas temperaturas y a la concentración de crioprotectores, por lo que se ha planteado el uso de combinaciones de crioprotectores con el fin de reducir el daño causado por la criopreservación. Objetivo. Evaluar el efecto de la Dimetilformamida (DMF) sobre la viabilidad posdevitrificación de embriones bovinos producidos in vitro. Materiales y métodos. Fueron distribuidos al azar 123 embriones producidos in vitro y vitrificados en pajillas abiertas y estiradas (OPS, open pulled straw), de acuerdo con los grupos de estudio (T1: DMSO + DMF 15%, T2: DMSO + DMF 20% y control: EG + DMSO 20%). Luego de la devitrificación, los embriones fueron cultivados y se determinó el porcentaje de reexpansión a las 6 horas, y el mantenimiento de la misma a las 18 horas de cultivo como parámetro de viabilidad embrionaria. Resultados. Al determinar los porcentajes de reexpansión de embriones vitrificados en los tratamientos T1, T2 y control, a las 6 horas (61,9%, 91,6% y 63,8%) y a las 18 horas (83,3%, 91,6% y 63,8%), se encontraron los porcentajes más altos de reexpansión en las combinaciones con DMF Conclusión. La combinación de los crioprotectores 20% DMSO + 20% DMF durante la vitrificación de embriones bovinos, producidos in vitro, mantiene la morfología y la capacidad de reexpandir o recuperar el blastocele, después de la descongelación.
Palabras clave: criopreservación, embriones bovinos, reexpansión, vitrificación.
Abstract
Introduction. Great efforts have been made in order to improve the cryopreservation of embryos. Nevertheless, one of the main problems is the sensible they are to cryopreservation, due to the bad effects of low temperatures and the concentration of cryoprotectors. Given this, the use of combinations of cryoprotectors has been proposed in order to reduce the harm produced by cryopreservation. Objective. To evaluate the effect of dymethylformamide (DMF) on the post-vitrification feasibility of in vitro bovine embryos. Materials and methods. 123 in vitro produced and vitrified in open pulled straws (OPS) embryos were randomly distributed according to the study groups (T1: DMSO + DMF 15%, T2: DMSO + DMF 20% and control: EG + DMSO 20%). After the devitrification, the embryos were cultivated and the re-expansion percentage was determined at 6 hours and its maintenance, at 18 hours of cultivation as a parameter of embryonic feasibility. Results. When the re-expansion of vitrified embryos in the T1, T2 and control were determined at 6 hours (61,9%, 91,6% and 63,8%) and at 18 hours (83,3%, 91,6% and 63,8%), the highest re-expansion percentages were found in the combinations with DMF. Conclusion. The combination of the 20% DMSO cryoprotectors +20% DMF during the vitrification of in vitro produced bovine embryos + 20% DMF during the vitrification of the bovine embryos produced, keeps the morphology and the capacity to re-expand or recover the blastocoel, after the thawing.
Key words: Cryopreservation, bovine embryos, re-expansion, vitrification.
Resumo
Introduçáo. Grandes esforços se centraram no aperfeiçoamento da crio preservação de embriões, não obstante, um dos principais problemas é a alta sensibilidade à crio preservação, devido aos efeitos nocivos das baixas temperaturas e à concentração de crio protetores, pelo que se propôs o uso de combinações de crio protetores com o fim de reduzir o dano causado pela crio preservação. Objetivo. Avaliar o efeito da Dimetilformamida (DMF) sobre a viabilidade pôs-devitrificação de embriões bovinos produzidos in vitro. Materiais e métodos. Foram distribuídos a esmo 123 embriões produzidos in vitro e vitrificados em semem abertas e esticadas (OPS, open pulled straw), de acordo com os grupos de estudo (T1: DMSO + DMF 15%, T2: DMSO + DMF 20% e controle: EG + DMSO 20%). Depois da devitrificación, os embriões foram cultivados e se determinou a percentagem de reexpansión às 6 horas, e a manutenção da mesma às 18 horas de cultivo como parâmetro de viabilidade embrionária. Resultados. Ao determinar as percentagens de re-expansão de embriões vitrificados nos tratamentos T1, T2 e controle, às 6 horas (61,9%, 91,6% e 63,8%) e às 18 horas (83,3%, 91,6% e 63,8%), encontraramse as percentagens mais altas de re-expansão nas combinações com DMF. Conclusão. A combinação dos crio protetores 20% DMSO + 20% DMF durante a vitrificação de embriões bovinos, produzidos in vitro, mantém a morfologia e a capacidade de re-expandir ou recuperar o blastocele, depois do descongelamento.
Palavras importante: crio preservação, embriões bovinos, re-expansão, vitrificação.
Introducción
La criopreservación de embriones bovinos producidos in vitro facilita el uso de programas de transferencia de embriones, el establecimiento de bancos de germoplasma con acceso permanente a material genético de un determinado individuo o raza, e igualmente facilita las biotecnologías asociadas como clonación y transgénesis1. En materia de criopreservación, el desarrollo de tecnologías en la última década ha sido significativo. Una muestra de tales avances la constituye el campo de la reproducción en donde se ha hecho rutinario abordar el proceso de criopreservación de semen, oocitos, embriones o tejido gonadal con el fin de satisfacer la demanda cada vez más creciente por los métodos y servicios de la reproducción asistida2. El valor de la criopreservación en la reproducción asistida en bovinos queda claramente ilustrado por el gran número de gametos y embriones que son congelados y transferidos cada año3. No obstante, es necesaria la búsqueda de protocolos de vitrificación en los que se evalúen combinaciones de crioprotectores que permitan mejorar la viabilidad embrionaria4.
El tipo de crioprotector usado, sus posibles combinaciones y su concentración son variables del proceso de vitrificación, que influyen directamente sobre las tasas de supervivencia de los embriones. La dimetilformamida (DMF) es un crioprotector permeable perteneciente al grupo de las aminas, y se considera que por su bajo peso molecular este crioprotector5 puede ser más fácilmente absorbido por los embriones y menos tóxico en el proceso de vitrificación6. Estas características proponen a la DMF como alternativa de ser usada como crioprotector intracelular en la vitrificación de embriones bovinos y evaluar su efecto sobre la viabilidad, determinada a través de la reexpansión del blastocele.
Materiales y métodos
Localización. La investigación se realizó en las instalaciones del laboratorio de Biotecnología Animal de la Universidad Nacional de Colombia, Sede Medellín, y el material biológico para la obtención de los complejos cúmulo oocito (CCO) fue suministrado por la planta de faenado de la Central Ganadera de Medellín y la planta de sacrificio del municipio de Girardota.
Obtención de CCO de bovino. Los ovarios bovinos recolectados se depositaron en solución de tampón fosfato salino (PBS) estéril a 37°C y transportados al Laboratorio de Biotecnología Animal. Con aguja hipodérmica 18G y jeringa de 5 ml, se procedió a la aspiración de los folículos con un diámetro de 3 a 6 mm y el aspirado fue recolectado en tubos cónicos de 15 mL a 37°C. El líquido folicular obtenido de los ovarios fue centrifugado a 1500 rpm, por 5 minutos, y el precipitado se resuspendió en 1 ml de medio de lavado TCM-199 con sales de Hank's (Sigma M2520, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO), suplementado con 275 µg/mL de ácido pirúvico (Sigma P2506, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO), 29.2 µg/mL de glutamina (Sigma G9003, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO), 100 UI/mL de penicilina, 100 µg/mL de estreptomicina, 0.25 µg/mL de anfotericina B (Sigma A5955, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO). En caja de petri estéril de 60 x 15 mm, bajo visión con este-reomicroscopio, se seleccionaron los complejos CCO de buena calidad, según los criterios previamente establecidos (tabla 1)7. Los CCO seleccionados fueron lavados en medio TCM 199 y en grupos de diez CCO se cultivaron a 38.5 °C en gotas de 50 µl de medio de maduración, cubiertas con aceite mineral en cajas de petri medianas 60 x 10 mm.

Maduración y fertilización in vitro de oocitos. Los CCO fueron incubados por 24 horas en grupos de 10 por gota de 50 µl de medio de maduración (Gibco 11150-067, Life Technologies Corporation; USA, Grand Island, NY) suplementado con 0.33 mM de piruvato de sodio, 1µg/mL de Estradiol, 3% de suero fetal bovino SFB, 6 mg/ml de albúmina sérica bovina libre de ácidos grasos (BSA FAF, Sigma A6003), solución antibiótica (penicilina 100 UI/ ml; estreptomicina 100 mg/ml; anfotericina B 0.25 mg/ml) (Sigma A5955, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO) y gonadotropinas (rhLH 5 µg/ml (Luveris, Merck Serono S.A, Germany, Darmstadt), pFSH 1 µg /ml (Sigma F2293, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO). Las gotas fueron cubiertas con aceite mineral (Sigma M8410 Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO) e incubadas a 38.5°C, 5% CO2 en aire con 100% de humedad por 24 horas. Posteriormente, al terminar el tiempo de incubación, los CCO fueron sometidos a fertilización, para lo cual, los oocitos fueron transferidos a gotas de 50 ml de medio FERT-talp (Sigma® A331, Sigma® P4562, GIBCO® 11140-050, Químicos JM®) suplementado con 10 µl/ml de solución antibiótica (Sigma® A5955, Sigma-Aldrich Inc., USA, Spruce St. St. Louis, MO), 10 mM de hipotaurina (Sigma® H1384), 1 mM de epinefrina (Sigma® E4642), 2 U/mL de heparina (Sigma® H0519) y una concentración espermática de 2 x 106 espermatozoides/ml. Las condiciones de fertilización fueron de 38.5°C, 5% de CO2 y 90% de humedad relativa durante 18 horas8.
Desarrollo in vitro. A las 18 horas post-inseminación (hpi), los presuntos cigotos fueron desnudados de las células del cúmulo y cultivados durante 72 horas en gotas de 50 μl de medio de desarrollo KSOM-Evolve (ZenithBiotech, USA, Guilford, CT) suplementado con 3% de SFB, 6 mg/ml de BSA FAF, 0.33mM de piruvato de sodio y 10 µl/ml de solución antibiótica. Las condiciones de cultivo fueron 38.5°C, 5% de CO2 y 90% de humedad relativa. Después de las 72 horas de cultivo, se realizó un recambio del medio del 50% y se continuó el cultivo por 96 horas adicionales9. Al finalizar este tiempo, los blastocistos obtenidos fueron clasificados con base en los criterios de la sociedad de transferencia de embriones IETS (tabla 2)10, y sometidos al proceso de vitrificación de acuerdo a los grupos de estudio.

Vitrificación de embriones. Los embriones en estadio de blastocisto (BL) fueron vitrificados de acuerdo con los siguientes grupos de estudio: Grupo control (C), los blastocistos fueron incubados por 30 segundos en la solución V1 (C) compuesta de 10% etilenglicol (EG) + 10% de dimetilsulfoxido (DMSO), en medio TCM-199 HEPES (Sigma M7528) suplementado con 20% de SFB, a una temperatura de 38.5°C. Luego fueron transferidos durante 25 segundos a una solución V2 (C) compuesta de 20% de EG + 20% de DMSO y 0.5 M de sucrosa, en medio TCM 199 HEPES suplementado con 20% de SFB6.
Los grupos experimentales fueron: Tratamiento 1 (T1), los blastocistos fueron incubados por 30 segundos en la solución V1 (T1) compuesta de 7,5% DMF + 7,5% de DMSO, en medio TCM-199 HEPES suplementado con 20% de SFB), a una temperatura de 38.5°C. Luego fueron transferidos durante 25 segundos a una solución V2 (T1) compuesta de 15% de DMF + 15% de DMSO y 0.5M de sucrosa, en medio TCM 199 HEPES suplementado con 20% de SFB. Tratamiento 2 (T2), los blastocistos fueron incubados por 30 segundos en la solución V1 (T2) compuesta de 10% DMF + 10% de DMSO, en medio TCM-199 HEPES suplementado con 20% de SFB), a una temperatura de 38.5°C. Luego fueron transferidos durante 25 segundos a una solución V2 (T2) compuesta de 20% de DMF + 20% de DMSO y 0.5M de sucrosa, en medio TCM 199 HEPES suplementado con 20% de SFB.
Los embriones fueron vitrificados en pajillas abiertas y estiradas (OPS, open pulled straw), en 2 µl de la solución crioprotectora V2 de cada grupo experimental, correspondiente al volumen de la gota desde la cual dos o tres embriones fueron cargados por capilaridad, en cada OPS11, e inmediatamente fueron sumergidas en nitrógeno líquido dentro de los siguientes 25 segundos, para ser mantenidas allí hasta su devitrificación12.
Devitrificación de embriones. Para la devitrificación de los embriones, cada OPS fue retirada del nitrógeno líquido y sumergida en medio TCM-199 HEPES (Sigma M2520, Sigma-Al-drich Inc., USA, Spruce St. St. Louis, MO) con 20% de SFB y 0.25 M de sucrosa a 38.5°C, por 5 minutos y se verificó que los embriones fueron expelidos en el medio. Luego, los embriones fueron transferidos a gotas de medio TCM-199 HEPES con 20% de SFB y 0.15 M de sucrosa por 5 minutos13,14. Finalmente, los embriones fueron transferidos a medio de desarrollo a 38.5°C.
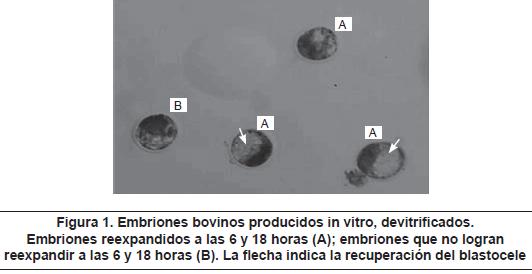
Determinación de la criotolerancia. Para determinar la viabilidad embrionaria se tuvieron los siguientes parámetros morfológicos: la integridad de la zona pelúcida (sin presencia de fracturas), el porcentaje de reexpansión completo, en donde se observa un blastocele que reexpande alrededor de un 50% del embrión y que ocupa casi todo el espacio paravitelino a las 6 horas, y el mantenimiento de esta condición en su morfología a las 18 horas posdevitrificación15,16. Estos parámetros fueron evaluados en cada embrión devitrificado, utilizando un estereomicroscopio (Nikon Instruments Inc., USA, Melville, NY).
Análisis estadístico. El diseño experimental fue definido como un diseño de bloques completos al azar. Los grupos de trabajo tuvieron seis a siete réplicas para un total de 37 a 45 embriones por tratamiento, y 123 embriones totales. Los porcentajes de reexpansión a las 6 y 18 horas de los embriones devitrificados de cada réplica fueron sometidos a un ANOVA, seguido de una comparación de medias utilizando el test de Tukey del programa Statistica versión 10.0 (StatSoft, USA, Tulsa Oklahoma). Las comparaciones de las medias con un p<0.05 fueron consideradas significativas.
Resultados
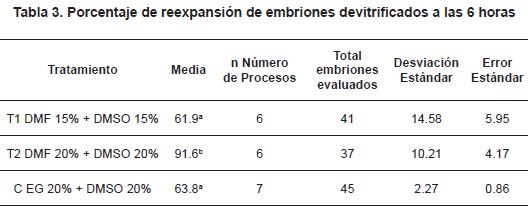
Un total de 123 embriones producidos in vitro fueron distribuidos al azar y sometidos a vitrificación, de acuerdo con los grupos de estudio (T1, T2 y C). Luego de la devitrificación, los embriones fueron cultivados y se determinó el porcentaje de reexpansión a las 6 horas de cultivo como parámetro indicativo de la sobrevivencia embrionaria17,18 (figura 1), en donde se observó un porcentaje de reexpansión del 61.9% en el T1, 91.6% en el T2 y 63.8% para el grupo C (tabla 3). El porcentaje promedio de reexpansión obtenido en el T2 fue mayor estadísticamente significativo (p<0,05) que el encontrado en los tratamientos T1 y C, en los cuales se encontró un respuesta similar (p>0,05).
La comparación de medias se realizó mediante el test de Tukey; letras diferentes indican diferencia estadísticamente significativa (p<0,05).
Evaluación del mantenimiento de reexpansión a las 18 horas, de embriones devitrificados
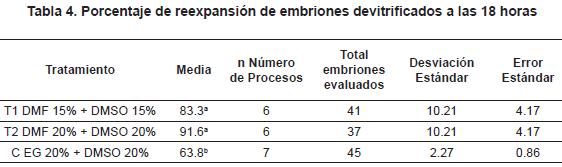
El mantenimiento de la reexpansión es uno de los parámetros más utilizados para validar la sobrevivencia embrionaria19, por lo cual se determinó el porcentaje de reexpansión a las 18 horas de cultivo, posteriores a la devitrificación. Al comparar los porcentajes de reexpansión de los embriones bovinos producidos in vitro devitrificados, se encontró que los tratamientos con DMF (T1 y T2) presentaron los porcentajes más altos de reexpansión (83.33 y 91.66%, respectivamente), con diferencia estadísticamente significativa (p<0.05) con el grupo C (63.85%)(tabla 4). A pesar de que el porcentaje de reexpansión obtenido en el tratamiento 2 (91.66) fue mayor que el tratamiento 1 (83.33%), no se encontró diferencia estadística (p>0.05).
La comparación de medias se realizó mediante el test de Tukey; letras diferentes indican diferencia estadísticamente significativa (p<0,05).
Discusión
Grandes esfuerzos se han centrado en el desarrollo o perfeccionamiento de la criopreservación de embriones producidos tanto in vivo como in vitro, generando aportes significativos para masificar el uso de la técnica de transferencia de embriones a gran escala20. Sin embargo, la supervivencia de los embriones bovinos producidos in vitro devitrificados puede ser afectada por diversos factores, como la suplementación y las condiciones de cultivo; entre los suplementos más utilizados está el suero fetal bovino (SFB)21, en donde los embriones producidos con este suplemento tienen una acumulación intracelular de lípidos anormales22, menor supervivencia23,19, y disminución en la tasa de eclosión de los embriones después de su descongelación19,15. Debido a lo anterior, para este trabajo se suplementó el medio de cultivo con 3% de SFB (7% menos SFB que en las concentraciones habituales) y 6 mg/ml de BSA FAF, donde el efecto de la disminución del suero se ha asociado con un bajo índice de apoptosis24, mayor criotolerancia y un patrón de expresión génica relacionado con calidad embrionaria19.
Adicional a las condiciones de cultivo, otro factor crucial es la alta sensibilidad de los embriones a la criopreservación, debido a los efectos nocivos de las bajas temperaturas y la concentración de crioprotectores, por lo que se han planteado estudios con el objetivo de reducir el daño causado por la criopreservación, mediante el uso de combinaciones de crioprotectores2,25, y tiempos de exposición19. Por lo tanto, en este trabajo se evaluó la dimetilformamida (DMF) en dos diferentes concentraciones (15% y 20%): en combinación con DMSO (15% y 20%), y como grupo control EG 20% + DMSO 20%, en embriones bovinos producidos in vitro. Al evaluar la morfología de los embriones devitrificados a las 6 horas de cultivo, se encontró un porcentaje de reexpansión en el grupo control (EG 20% + DMSO 20%) del 63,8%, el cual es mayor que el descrito por Carvalho en 20066 (54,3%), y menor que el reportado por Camargo et al., en el 200426 (79%). Sin embargo, los porcentajes de reexpansión obtenidos al utilizar las concentraciones de 15% y 20% de DMF en combinación con el DMSO fueron de 61,9% y 91,6%, respectivamente (tabla 3). Adicionalmente, el mantenimiento de la reexpansión de los embriones devitrificados, utilizado como uno de los parámetros para evaluar la sobrevivencia de los embriones sometidos a la criopreservación19, determinó el porcentaje de reexpansión a 18 horas, en donde los grupos que presentaron los porcentaje más altos fueron aquellos que tenían las concentraciones DMSO + DMF 15% y DMSO + DMF 20% (83,3% y 91,6%, respectivamente) (tabla 4), similares a los reportados por Laparatova y colaboradores27, Kuwayama et al.28 con 87%, Dinnyes et al. 29 con 81%, Mahmoudzadeh et al.30 con un 69-89% y Vajta et al.31 con un 84%. Mientras que el control presentó un 63,8% de reexpansión, similar a los obtenidos por Donnay et al.32 con un 67%, y Camargo et al.26 con 67%, pero superior a las reportadas por Varago et al.33 con un 33-44% de reexpansión y Guerra et al.25 con un 40% de reexpansión.
Estos resultados benéficos obtenidos con el uso de la dimetilformamida (DMF) como agente crioprotector pueden ser debidos a la disminución en la tendencia de formación de cristales de hielo durante el enfriamiento, y al aumento de la estabilidad del estado amorfo durante la descongelación, características que son comparables al DMSO, pero más eficientes que el glicerol y el etilen glicol34. Además, su toxicidad ha sido evaluada en cultivo de embriones de diferentes especies, tales como, crustáceos35, peces36, roedores37, por último en bovinos se ha evaluado como agente crioprotector en combinación con EG o DMSO en oocitos y embriones6.
Conclusiones
La dimetilformamida puede ser considerada una alternativa viable para la vitrificación de embriones bovinos producidos in vitro, dado que en concentraciones del 20% y en combinación con otros crioprotectores, demuestra ejercer una protección sobre la integridad de la membrana celular y la morfología normal de los embriones bovinos.
Referencias bibliográficas
1. ALBARRACÍN MONJE, J. Vitrificación de ovocitos bovinos mediante la técnica open pulled straw: Estudio estructural de cromosomas, microtúbulos, y microflamentos y posterior desarrollo embrionario in vitro. Tesis Doctoral. Universidad Autónoma de Barcelona, 2005. [ Links ]
2. RODRÍGUEZ, P. Vitrificación de embriones bovinos producidos in vitro. VIII Simposio Internacional de Reproducción Animal. Instituto de Reproducción Animal de Córdoba IRAC, 2009. [ Links ]
3. THIBIER, M. International Embryo Transfer Society. Data Retrieval Committee Statistics of Embryo Transfer, Year 2007. IETS Embryo Transfer Newsletter 2008. [ Links ]
4. CABRERA, P.; et al. Vitrificación: una alternativa para la criopreservación de embriones. En: Rev. Fac. Cienc. Vet. Maracay. 2006. Vol. 47, N°1. [ Links ]
5. KENNEDY, Jr. Biological effects of acetamide, formamide, and their monomethyl and dimethyl derivatives. En: Crit. Rev. Toxicol. 1986. Vol 9, p. 129-182. [ Links ]
6. CARVALHO, E. Vitrificação de ovócitos e embriões bovinos utilizandose etilenoglicol, dimetilsulfóxido e dimetilformamida como agentes crioprotetores. (tese apresentada junto ao programa de pós-graduação em medicina veterinária para obtenção do título de doutora). Faculdade de Medicina Veterinária e Zootecnia. Universidade Estadual Paulista. 2006. 121 p. [ Links ]
7. DE WIT, C.; WURTH, Y. and KRUIP, Th. Effect of ovarian phase and follicle quality on morphology and developmental capacity of the bovine cumulusoocyte complex. En: J. Anim. Sci. 2000. Vol. 78, p. 1277-1283. [ Links ]
8. DODE, A.; PEREIRA, D. and RUMPF, R. Evaluation of different culture systems on the in vitro production of bovine embryos. En: Theriogenology. 2005. Vol. 63, N°4, p. 1131-1141. [ Links ]
9. GANDHI, A. P, et al. A single medium supports development of bovine embryos throughout maturation, fertilization and culture. En: Hum Reprod. 2000. Vol. 15, N° 2, p. 395-401. [ Links ]
10. DE COSIO, M. A. Morfología y evaluación de embriones. En: Simposio Regional de Reproducción Bovina. 2008. p. 5. [ Links ]
11. GUIGNOT, F. Cryoconservation des embryons des espèces domestiques. En: INRA Prod Anim. 2005. Vol. 18, N°1, p. 27-35. [ Links ]
12. VAJTA, G. Oocyte and embryo vitrification. En: Reprod. Domest Anim. Suppl 2000c. p. 45-48. [ Links ]
13. DODE, A.; PEREIRA, D. and RUMPF, R.; Op. cit., p. 1131-1141. [ Links ]
14. VAJTA, G.; et al. Open Pulled Straw (OPS) vitrification of cattle oocytes. En: Theriogenology. 1998b. Vol. 49, p. 176. [ Links ]
15. MUCCI, N.; et al. Effect of estrous cow serum during bovine embryo culture on blastocyst development and cryotolerance after slow freezing or vitrification. En: Theriogenology. 2006. Vol. 65, p. 1551-1562. [ Links ]
16. MOORE, K.; et al. In vitro production of bovine embryos in medium supplemented with a serum replacer: Effects on blastocyst development. Cryotolerance and survival to term. En: Theriogenology. 2007. Vol. 68, p. 1316-1325. [ Links ]
17. SILVA, M. y BERLAND, A. Vitrificación de blastocístos bovinos producidos in vitro con el método Open Pulled Straw (OPS): Primer reporte. En: Arch. Med. Vet. 2004. Vol. 36, N°1. [ Links ]
18. CAMARGO, L. S. Producción in vitro de embriones. EMBRAPA. Primer Encuentro Internacional de Biotecnología. Medellín: Universidad Nacional de Colombia, 2008. [ Links ]
19. RIZOS, A; et al. Bovine embryo culture in the presence or absence of serum: Implications for blastocyst development, cryotolerance, and messenger RNA expression. En: Biol Reprod. 2003. Vol. 68, p. 236-243. [ Links ]
20. DINNYES, A.; et al. Criopreservação de embriões mamíferos. En: Acta Sci Vet. 2006. Vol. 1, p. 171-190. [ Links ]
21. SEIDEL, G. Jr. Modifying oocytes and embryos to improve their cryopreservation. En: Theriogenology. 2006. Vol. 65, p. 228-235. [ Links ]
22. ABE, H.; HOSHI, H. Evaluation of bovine embryos produced in high perfonmance serum free media. En: Journal of Reproducción and Development. 2003. Vol. 49, N°3, p. 193-202. [ Links ]
23. ABE, H.; et al. Ultrastructure of bovine embryos developed form in vitro-matured and fertilized oocytes: comparative morphological evaluation of embryos cultured either in serum-free medium or in serumsupplemented medium. En: Mol Reprod Dev. 1999. Vol. 5, p. 325-335. [ Links ]
24. SUDANO, M. J. Lipid content and apoptosis of in vitro-produced bovine embryos as determinants of susceptibility to vitrification. En: Theriogenology. 2011. Vol. 75 N°7: 1211-1220. [ Links ]
25. GUERRA, A.; et al. Evaluación de tres protocolos de criopreservación de embriones bovinos obtenidos in vitro e in vivo. En: IX Simposio Internacional de Reproducción Animal. Instituto de Reproducción Animal de Córdoba IRAC, 2011. p. 309. [ Links ]
26. CAMARGO, L.; et al. Comparisión of two vitrification protocols for croscbred Bos taurus x Bos indicus in vitro produced embryos. En: Conferencia Anual International Embryo Transfer Society IETS, Reproduction, Fertility and Development, 2004. p. 164. [ Links ]
27. LOPATAROVA, M.; CECH, S. and HAVLICEK, L. Effect of Vitrification in Open Pulled Straws on Survival of Bovine Embryos from Superovulated Cows. En: Acta Vet Brno. 2002. Vol. 71, p. 93-99. [ Links ]
28. KUWAYAMA, M.; HAMANO, S. and NAGAI, T. Vitrification of bovine blastocysts obtained by in vitro culture of oocytes matured and fertilized in vitro. En: Journal Reprod Fertil. 1992. Vol. 96, p. 187-193. [ Links ]
29. DINNYES, A.; et al. In vitro survival of in vitro produced bovine embryos frozen or vitrified by techniques suitable for direct transfer. En: Theriogenology. 1995. Vol. 43, p. 197. [ Links ]
30. MAHMOUDZADEH, AR.; et al. Optmization of a simple vitrification procedure for bovine embryos procedure for bovine embryos produced in vitro: effect of developmental stage, twostep addition of cryoprotectant and sucrose dilution on embryonic survival. En: Journ Reprod Fertil. 1995. Vol. 103, p. 33-39. [ Links ]
31. VAJTA, G.; et al. Direct instraw rehydration after thawing of vitrified in vitro produced bovine blastocysts. En: Vet. Rec.1995. Vol. 137, p. 672. [ Links ]
32. DONNAY, I.; et al. Vitrification of in vitro produced bovine blastocysts: methodological studies and developmental capacity. En: Anim Reprod Sci. 1998. Vol. 52, p. 93-104. [ Links ]
33. VARAGO, K. Vitrification of in vitro produced Zebu embryos. En: Anim. Reprod Sci. 2006. Vol. 3, N°3, p. 353-358. [ Links ]
34. BAUDOT, A. and BOUTRON, P. Glass forming tendency and stability of aqueous solutions of diethilformamide and dimethilformamide. En: Cryobiology. 1998. Vol. 37, p. 187-199. [ Links ]
35. HUANG, X.; et al. Effects of cryoprotectant toxity on embryos of the Chinese Mitten Crab, Eriocher sinensis (Decapoda brachyura). En: Crustaceana. 2011. Vol. 84, N°3, p. 281-291. [ Links ]
36. CHEN, S. L. and TIAN, Y. S. Cryopreservation of founder (Paralichthys olivaceus) embryos by vitrification. En: Theriogenology. 2005. Vol. 63, p. 1207-1219. [ Links ]
37. AUGUSTINERAUCH, K; et al. A study of vehicles for dosing rodent whole embryo culture with non aqueous soluble compounds. En: Reprod Toxicol. 2004. Vol. 18, p. 391-398. [ Links ]













