Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.9 no.1 Caldas Jan./June 2012
Artículo original / Original article / Artigo original
* Artículo derivado del proyecto de investigación "Estudio de sistemas de tratamiento para el mejoramiento de la calidad fisicoquímica y microbiológica de aguas para abastecimiento y de vertimiento en hatos lecheros ubicados en la micro cuenca del altiplano del norte y del oriente cercano de Antioquia" realizado en la Universidad de Antioquia entre 2008 y 2011.
** Estudiante de Biología, Grupo GDCON, Universidad de Antioquia.
*** Ingeniera Sanitaria, Magíster Ingeniería, Candidata a doctora, Grupo GDCON, Universidad de Antioquia.
**** Químico. MsC, doctor Química Ambiental, profesor, coordinador Grupo GDCON, Universidad de Antioquia.
Correspondencia: Gustavo Peñuela. e-mail: gpenuela@udea.edu.co.
Artículo recibido: 15/10/2011; Artículo aprobado: 01/08/2012
Resumen
Introduccion. El cadmio es un metal que ha sido encontrado en las leches y que por lo tanto representa un alto riesgo para la salud humana, los biosensores han sido empleados como herramientas para la determinación rápida de compuestos de este tipo en diferentes matrices. Materiales y métodos. Se empleo un biosensor amperométrico y electrodos serigrafados para la inmovilización de la enzima Ureasa empleando el método de entrecruzamiento. El sustrato empleado para la determinación fue la Urea. Previa a la determinación de la concentración de cadmio en la leche, se validó el método realizando curvas de calibración y evaluando la repetibilidad tanto del método como del instrumento. Resultados y discusión. El rango lineal para el método presentado, fue de 5 mM a 60 mM con una alta correlación entre las variables, el límite de cuantificación del método fue de 0.05 mg/L. El coeficiente de variación fue de 7.55 % para los ensayos de repetibilidad del método, indicando una alta precisión en los resultados. A partir de las muestras de leche analizadas, se obtuvieron porcentajes de recuperación mayores al 80%, indicando un bajo efecto matriz y teniendo en cuenta que la leche presenta un alto grado de interferentes para este tipo de métodos. Conclusión. El biosensor amperometrico, demostró ser una herramienta eficaz y rápida para la determinación de cadmio en leches, lo que puede ayudar a un mejoramiento de la calidad de esta desde los planteles porcinos.
Palabras clave: plomo, leches crudas, biosensores.
Abstract
Introduction. Cadmium is a metal that has been found in milks and, therefore, represents a big risk for human health. Biosensors have been used as tools for the rapid determination of this kind of compounds in several matrices. Materials and methods. An amperometric biosensor and screen printed electrodes were used to immobilize the urease enzyme, by the use of the cross linking method. The subtract used for the determination was urea. Before determining the cadmium concentration in the milk, the method used was validated by making calibration curves and evaluating the repeatability of both the method and the instrument. Results and discussion. The linear rank for the method was 5 mM to 60 mM with a high correlation between variables. The quantification limit of the method was 0.05 mg/L. The variation coefficient was 7.55 % for the method's repeatability tests, which indicates a high precision of the results. From the milk samples analyzed, recovery percentages above 80% were obtained. This means a low matrix effect, keeping in mind that milk has a high degree of interfering elements for this kind of methods. Conclusion. The amperometric biosensor demonstrated to be an efficient and fast tool to determine cadmium in milks, and this can be helpful to improve the milk's quality in swine farms.
Key words: Plumber, raw milks, biosensors.Resumo
Introdugão. O cádmio é um metal que foi encontrado nos leites e que portanto representa um alto risco para a saúde humana, os biosensores foram empregados como ferramentas para a determinação rápida de compostos deste tipo em diferentes matrizes. Materiais e métodos. Empregouse um biosensor amperometrico e eletrodos serigrafiados para a imobilização da enzima Ureasa empregando o método de entre cruzamento. O substrato empregado para a determinação foi a Ureia. Prévia à determinação da concentração de cádmio no leite, válidose o método realizando curvas de calibração e avaliando a repetição tanto do método como do instrumento. Resultados e discussão. A casta linear para o método apresentado, foi de 5 MM a 60 MM com uma alta correlação entre as variáveis, o limite de quantificação do método foi de 0.05 mg/L. O coeficiente de variação foi de 7.55 % para os ensaios de repetição do método, indicando uma alta precisão nos resultados. A partir das mostras de leite analisadas, obtiveramse percentagens de recuperação maiores ao 80%, indicando um baixo efeito matriz e tendo em conta que o leite apresenta um alto grau de interferentes para este tipo de métodos. Conclusão. O biosensor amperometrico, demonstrou ser uma ferramenta eficaz e rápida para a determinação de cádmio em leites, o que pode ajudar a um melhoramento da qualidade desta desde os grupos porcinos.
Palavras importantes: chumbo, leites crus, biosensores.
Introducción
El cadmio es un metal toxico que presenta graves riesgos para la salud humana1. Este elemento existe en bajas concentraciones en la naturaleza, pero las actividades antropogénicas han contribuido a incrementar su concentración en el ambiente.
Las leches crudas pueden tener varios tipos de residuos químicos peligrosos, como las afiatoxinas, plaguicidas y metales pesados. Cuando el procesador de la leche cruda la recoge en los hatos lecheros no puede saber inmediatamente si esta leche cruda tiene un riesgo para la salud de las personas, hasta que sea analizada en el laboratorio. Por lo tanto, hay una necesidad de emplear métodos simples para una detección rápida en campo, que permita, de inmediato, rechazar la leche cruda por la presencia de algún residuo tóxico2.
El cadmio, así como algunos metales, suelen ser inhibidores de ciertas enzimas. La ureasa es la enzima más empleada para medir el efecto inhibidor del cadmio en diferentes matrices, y es una enzima importante en los sistemas biológicos ya que cataliza la conversión de la urea en dióxido de carbono y amónico3:
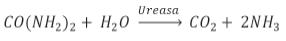
La presencia de cadmio inhibe la enzima, lo que conduce a una disminución en la actividad enzimática y, como consecuencia, una menor cantidad de amonio es liberado. El efecto inhibidor del cadmio en la actividad de la ureasa se debe a su unión a los grupos sulfhidrilo que habitualmente se forman en el centro activo de la enzima.
En la región de pH donde la enzima es activa (alrededor de pH 7.0), los productos de la reacción enzimática disociada son:
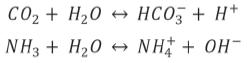
De esta manera, la degradación de la urea por la ureasa genera iones hidroxilo (OH-), incrementando el pH de la solución, lo que hace posible su determinación empleando biosensores ópticos mediante medidas de fluorescencia o amperométricos a partir de cambios en la corriente4.
Los biosensores son dispositivos analíticos que utilizan la sensibilidad y la selectividad de un biorreceptor adherido en la superficie de un transductor, el cual es capaz de responder y transformar una propiedad bioquímica y/o fisicoquímica en una señal medible como resultado de un reconocimiento entre el biorreceptor y el analito objetivo5, en este caso, cadmio.
Los biosensores son equipos portables y económicos, y pueden proveer algunas soluciones para los problemas encontrados en el monitoreo de contaminantes en el ambiente; son generalmente definidos como dispositivos de análisis, acoplados a elementos biológicos de detección tales como enzimas, anticuerpos, microorganismos o ADN, integrados a transductores que pueden ser de tipo electroquímico, óptico, entre otros6. Los biosensores basados en enzimas se emplean para medir la pérdida de actividad o inhibición de la enzima después de la exposición a un contaminante.
Los biosensores amperométricos son sistemas que emplean tres electrodos para su funcionamiento: un electrodo de trabajo a través del cual se aplica un potencial, un electrodo de referencia y un electrodo auxiliar a través del cual fluye la corriente7 la cual es registrada y correlacionada con la concentración de los compuestos; todos estos, integrados mediante un electrodo conocido como "Screen-Printed Electrodes (SPE)". En estos biosensores, la señal de la corriente es generada debido a la oxidación o reducción de los productos metabólicos o intermediarios en la superficie del electrodo de trabajo8.
Materiales y métodos
Reactivos
Solución buffer: PBS (0.1 M, pH 7.0); pesar 7,098 g de fosfato de sodio Na2HPO4 y diluir a 400 ml con agua desionizada, ajustar el pH a 7.0 con NaOH o H2SO4 según sea el caso, terminar de aforar a 500 ml.
Sustrato: urea (80 mM). Pesar 4,8 g de urea para biología molecular ≥ 98% y aforar a 1L de PBS (0.1 M, pH 7.0)
Enzima: ureasa (729.13 U/ml). Pesar 0,033 g de ureasa de Canavalia ensiformis (Jack Bean) de 20990 unidades y agregar 1 ml de agua desionizada.
Albúmina de suero bovino: BSA (1,66 % w/v): pesar 1,66 g de albúmina de suero bovino (Fracción Cohn V > 96%) y aforar en 100 ml de agua desionizada.
Glutaraldehido: GA (2,5 %). Tomar 3,125 ml de solución de glutaraldehído grado I al 8% y aforar a 10 ml con agua desionizada.
Solución estándar de cadmio 1000 mM. Tomar 88,9 ml de estándar de cadmio certificado de 1000 ppm y aforar a 10 ml de agua desionizada.
Solución estándar de trabajo de cadmio de 500 mM. Tomar 5 ml de estándar de cadmio 1000 mM y aforar a 10 ml con PBS (0.1M a pH 7.0).
Equipos y materiales
Análisis con biosensor: biosensor amperométrico, transferpipetas de varios tamaños, electrodos serigrafados (SPE), balanza analítica, sistema de agitación Vortex IKA MS 3-Basic y centrífuga. Contactos electrónicos: plata.
La celda electroquímica contiene: electrodo de trabajo de carbón (4 mm diámetro), electrodo de referencia de plata y electrodo auxiliar de carbón.
El biosensor fue usado a un fujo de 200 ml/ min, un voltaje de +700 mV y una corriente de 5 mA.
Métodos
Inmovilización de la enzima sobre los electrodos (SPE): la ureasa fue inmovilizada por el método de entrecruzamiento (Cross-Linking), que consiste en generar uniones irreversibles entre la enzima y el transductor, empleando reactivos bifuncionales como el glutaraldehído. La ventaja de esta técnica es que la enzima se vuelve estable a condiciones extrema, tanto de pH como de temperatura; sin embargo, el electrodo no puede ser regenerado.
Preparar la siguiente solución: 10 ml de BSA (1.66% w/v), 3.32 ml de ureasa (729.13 U/ml) y 10 ml de GA al 2.5%.
Colocar 5 ml de la solución anterior en el electrodo de trabajo. Se deja secar el electrodo durante 1h a 4°C. Los electrodos pueden usarse inmediatamente, siendo su estabilidad de 6 días, almacenados en seco a 4°C. Después de los 6 días, el electrodo pierde sensibilidad y la enzima pierde actividad. Previo al uso de cada electrodo, se acondicionó con PBS (0.1M a pH 7.0) durante 10 min.
Procedimiento del método con biosensor amperométrico: conectar el SPE (previa inmovilización de la enzima) al equipo y pasar PBS (0.1M a pH 7.0) hasta que la señal se estabilice y esté ≤ 0.1 mA. Se hace pasar urea (80 mM) durante 20 min. Después de este tiempo, se pasa la primera concentración de la curva de calibración, durante 20 min. Se pasa PBS (0.1M a pH 7.0) durante 20 min. para eliminar cualquier traza del contaminante. Se pasa nuevamente urea (80 mM) durante 20 min. El procedimiento anterior se realiza para cada uno de los puntos de la curva de calibración. Las muestras se centrifugan a una aceleración de 3500 rpm durante 15 minutos a 10°C, se retira la grasa y se realiza el análisis, empleando un SPE diferente para cada medición.
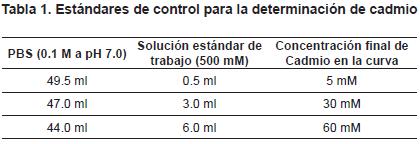
Antes de comenzar a hacer el control analítico es indispensable llevar a cabo la medición de un blanco de reactivos para garantizar que no habrá interferencias, la medición de este blanco es llevada a cabo empleando el mismo procedimiento indicado para las muestras. Se corre un blanco de reactivos al inicio del análisis, con un estándar de control con cualquiera de las concentraciones descritas en la tabla 1, y un duplicado de muestra por cada lote de 15 muestras. Para el blanco de reactivos, estándares de control y muestras adicionadas se utiliza el procedimiento descrito para el análisis de muestras.
Resultados y discusión
Curva de calibración: se realizaron 3 curvas de calibración en diferentes días (figura 1) para cuantificar el cadmio, cada una con 7 puntos, con excelentes R, lo cual es un indicio de que se tiene un rango lineal para cuantificar el cadmio en leches.
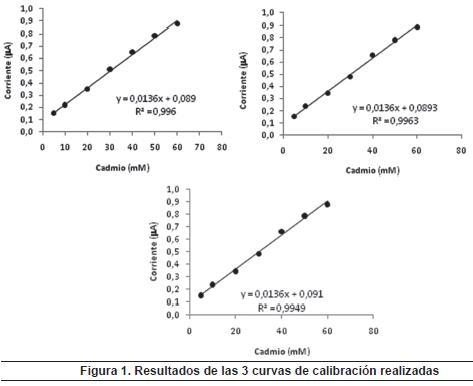
De acuerdo con el procedimiento de control analítico GC-PR-002-GDCON, se tomaron 5 puntos de la curva y se hizo un análisis de rango y linealidad (tabla 2) con el fin de determinar la curva de calibración final para este método (figura 2).
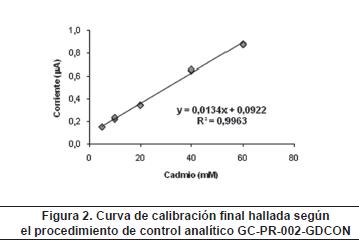
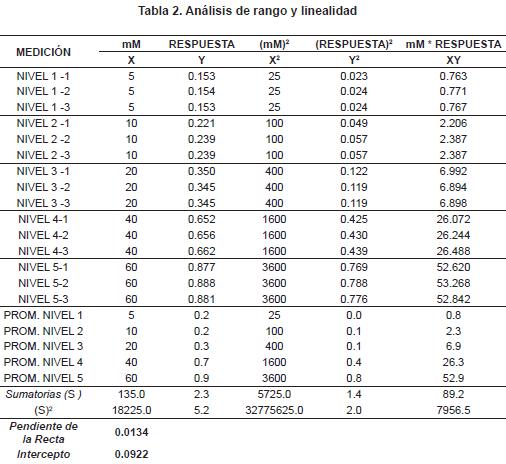
Repetibilidad del método: se prepararon tres niveles de concentración (bajo, medio y alto) de la curva de calibración, y se analizó 10 veces cada nivel. Se midió la corriente y se calcularon los mM de cadmio, se determinó el promedio (x), la desviación de los datos (s) y el coeficiente de variación (CV) (tabla 3). Como era de esperarse, el CV más bajo fue el de mayor nivel y, en cambio, el de menor nivel fue el que presentó el mayor CV. La EPA, dentro de los procedimientos para análisis biológicos9, establece como criterios de aceptación un CV máximo del 25%, lo que quiere decir un criterio de aceptación de 50-150%10. Los resultados de repetibilidad del método estuvieron dentro de ese porcentaje de aceptación.
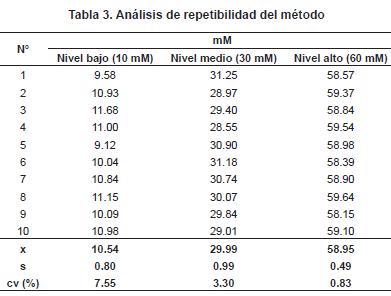
Repetibilidad del instrumento: se prepararon tres niveles de concentración (bajo, medio y alto) de la curva de calibración y se midió la corriente de la misma muestra 10 veces. Se calcularon los mM de cadmio, se determinó el promedio (x), la desviación de los datos (s) y el coeficiente de variación (CV) (tabla 4).
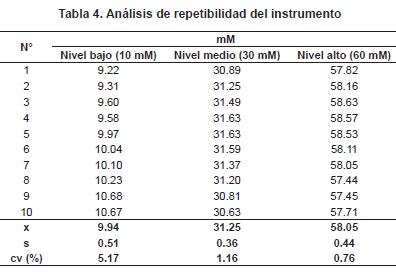
La repetibilidad del instrumento estuvo dentro del rango de aceptación establecido por la EPA. Según AEFI, 2001, un CV (%) instrumental menor a 6.85 tiene un intervalo de aceptación del 75-125%.
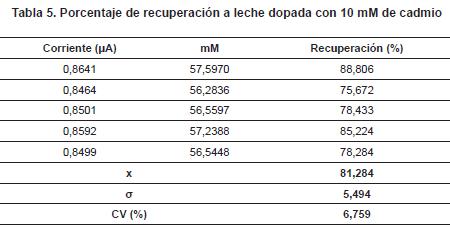
Porcentaje de recuperación con leche dopada con 10 mM de cadmio: A la muestra de leche, se le dopó con un nivel bajo de 10 mM de cadmio, se midió la corriente y se determinó el porcentaje de recuperación (tabla 5). La leche cruda es una matriz difícil para cuantificar varios analitos, en especial cuando se emplean métodos de digestión de la muestra, como la determinación de metales. Por esta razón, y más con la concentración tan baja usada, el porcentaje de recuperación del cadmio es muy bueno. Adicionalmente el CV es muy bajo.
Porcentaje de recuperación con leche dopada con 40 mM de cadmio: a la muestra de leche, se le dopó con un nivel de 40 mM de cadmio, se midió la corriente y se determinó el porcentaje de recuperación (tabla 6).
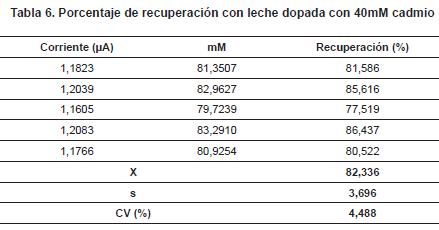
El porcentaje de recuperación con 40 mM mejoró ligeramente en comparación con el de nivel bajo, pero se confirma la exactitud del método.
Límite de cuantificación en leches crudas: se determinó múltiplicando 10 veces la señal de ruido del biosensor amperométrico, y comprobándolo con la curva de calibración. El límite de cuantificación de cadmio en leches crudas usando el biosensor amperométrico dio 0.05 mg/L, el cual es muy bueno para ser un método de detección rápida, pero que es muy bajo comparado con el límite de cuantificación por absorción atómica, que es 0.001 mg/L.
Se pretendía con el método de detección rápida detectar, en campo, residuos de cadmio en leches crudas, para luego comprobarlo con un método más sensible como la absorción atómica o el horno de grafito.
Con un biosensor amperométrico para detectar varios residuos tóxicos se podría rechazar en campo la leche cruda que no cumpliera, y de esta forma se garantizaría la protección a las personas.
Conclusiones
- El rango lineal de la curva de calibración con el biosensor óptico para la determinación de cadmio, cuyos resultados no fueron presentados en este artículo, estuvo entre un rango de 10 mM a 50 mM, mientras que empleando un biosensor amperométrico, se logró obtener un rango de medición más amplio de 5 mM a 60 mM. De esta manera los límites de cuantificación para cada método fueron 10 mM (0.1 mg/L) y 5 mM (0.05 mg/L), respectivamente; esto comprueba que el biosensor amperométrico proporciona una mayor estabilidad a la enzima, y por lo tanto, permite lograr mayores rangos de medición.
- En cuanto a la repetibilidad del método, el biosensor óptico obtuvo un coeficiente de varianza (CV) para el nivel bajo (10 mM) de 23,01%, a diferencia del amperométrico que para el mismo nivel bajo se obtuvo un CV de 7,55%, lo que indica que el intervalo de aceptación para el óptico en este nivel es de 50-150% y para el amperométrico de 85-115%, lo que demuestra una mayor precisión en los datos del nivel bajo empleando un biosensor amperométrico.
- Se obtuvieron muy buenos porcentajes de recuperación biosensor amperométrico, por arriba del 80%.
- El biosensor amperométrico se puede implementar para detectar residuos de cadmio en leches crudas en campo.
Agradecimientos
Los autores de este trabajo agradecen la financiación de la Cooperativa Lechera de Antioquia (COLANTA) y al contrato 102-2008O2368-3619 con el Ministerio de Agricultura y Desarrollo Rural de Colombia.
Referencias bibliográficas
1. LAKARD, B.; et al. Urea potentiometric biosensor based on modifed electrodes with urease immobilized on polyethylenimine films. En: Biosensors and Bioelectronics. 2004. Vol. 19, p. 1641-1647. [ Links ]
2. LEE, S. M. and LEE, W. Y. Determination of Heavy Metal Ions Using Conductometric Biosensor Based on Sol-Gel-Immobilized Urease. En: Korean Chem. Soc. 2002. Vol. 23, N°8, p. 1169-174. [ Links ]
3. TRIVEDI, U. B. Potentiometric biosensor for urea determination in milk. En: Sensors and Actuators B. 2009. Vol. 140, p. 260-266. [ Links ]
4. TSAI, H. S. and DOONG, R.A . Simultaneous determination of pH, urea, acetylcholine and heavy metals using arraybased enzymatic optical Biosensor. En: Biosensors and Bioelectronics. 2005. Vol. 20, p. 1796-1804. [ Links ]
5. ANDREESCU, S. and MARTY, J. L. Twenty years research in cholinesterase biosensors: From basic research to practical applications. En: Biomolecular Engineering. 2006. Vol. 23, p. 1-15. [ Links ]
6. RODRIGUEZ, S.; et al. Biosensors for environmental applications: Future development trends. En: Pure Appl. Chem. 2004. Vol. 76, N°4, p. 723-752. [ Links ]
7. DENNISON, M. J. and TURNER, P. Biosensors for environmental monitoring. En: Biotech Adv. 1995. Vol. 13, p. 1-12. [ Links ]
8. DING, L.; et al. Trends in Cell-Based Electro-chemical Biosensors. En: Curr. Med. Chem. 2008. Vol. 15, p. 3160-3170. [ Links ]
9. WILLIAMS, L. R. Validation of Testing/measurement Methods. EPA Internal report. EPA 600/X-83-060, 1983. [ Links ]
10. ASOCIACIÓN ESPAÑOLA DE FARMACÉUTICOS DE LA INDUSTRIA - AEFI. [ Links ]
11. Validación de Métodos Analíticos. España: Comisión de normas de buena fabricación y control de calidad, 2001. [ Links ]













