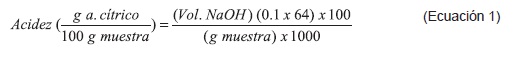Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.9 no.2 Caldas July/Dec. 2012
Artículo original / Original article / Artigo original
Cinética del color durante el almacenamiento de caramelos blandos de uchuva adicionados de calcio y sin sacarosa*
Color kinetics during the storage of uchuva soft candies with calcium and sucrose free
Cinética da cor durante o armazenamento de caramelos macios de uchuva adicionados de cálcio e sem sacarose
Francia Elena Valencia García**, Misael Cortés Rodríguez*** y María Orfilia Román Morales****
* Artículo derivado del proyecto de investigación "Desarrollo y producción industrial de caramelos blandos a base de fruto de uchuva (Physalis peruviana L.) adicionados de calcio, vitamina D y fibra dietaria como un alimento funcional" financiado por el Ministerio de Agricultura y Desarrollo Rural durante el periodo 2008 -2011.
** MSc. en Ciencias Farmacéuticas y Alimentarias énfasis en Alimentos. Docente catedrática Universidad de Antioquia, Facultad de Química Farmacéutica, Departamento de Alimentos. Grupo de Investigación GIAS. Medellín. Colombia.
*** Ph.D. en Ingeniería de Alimentos. Docente Asociado. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Departamento de Ingeniería Agrícola y Alimentos, Medellín-Colombia.
**** MSc. en Ciencias Químicas. Docente Asociada. Universidad de Antioquia, Facultad de Química Farmacéutica, Departamento de Alimentos. Grupo de Investigación GIAS. Medellín. Colombia.
Correspondencia: Francia Elena Valencia García, e-mail: francia.valencia@gmail.com
Artículo recibido: 09/09/2011; artículo aprobado: 15/11/2012
Resumen
Introducción. Los caramelos sin sacarosa son desarrollados para personas que presentan trastornos metabólicos o quieren alcanzar un efecto benéfico para su salud. El color en este producto es un parámetro de aceptación sensorial importante, que puede afectarse por la degradación o formación de algunos compuestos. Objetivo. Este trabajo evaluó la cinética del desarrollo del color en caramelos de uchuva adicionados de calcio y sin sacarosa. Materiales y métodos. El color se evaluó a partir de las coordenadas fijadas por la Comisión Internacional de Iluminación (CIE), luminosidad (L*), cromaticidad verde-rojo (a*), cromaticidad amarillo-azul (b*), tono (hab*), saturación (Cab*) y el cambio total de color (DE). Las cinéticas se evaluaron almacenando las muestras en una cámara de humedad relativa del 75%, temperaturas T1= 50°C, T2= 40°C y T3= 30°C, y seis tiempos diferentes de acuerdo con cada temperatura: T1 (0, 5, 10, 15, 20 y 25 días), T2 (0, 20, 40, 60, 80 y 100 días) y T3 (0, 30, 60, 90, 120 y 150 días). Resultados. A 30°C el color no es un atributo de calidad crítico para los caramelos; mientras que a 40 y 50°C, L*, b*, Cab* y hab* están muy afectados por las condiciones de almacenamiento, tendiendo las muestras a ser oscuras y a disminuir los tonos amarillos con el incremento del tiempo y la temperatura. Las cinéticas que mejor ajuste presentaron fueron de orden 0 y 1 a 40 y 50°C, con coeficientes de regresión mayores de 0,90. Conclusiones. La L* y la cromaticidad b* representan los parámetros de color más importantes en los caramelos, considerándose como variables adecuadas para la fijación del tiempo de vida útil del producto.
Palabras clave: Physalis peruviana L., alimentos funcionales, dulces, caramelos masticables
Abstract
Introduction. Candies without sucrose are developed for people with metabolic problems or for those who want a beneficial effect on their health. Color in this product is an important parameter for its sensory acceptance, which can be affected by degradation or by the formation of some compounds. Objective. This research work evaluated the kinetics of the color development in uchuva candies with calcium and free of sucrose. Materials and methods. The color was evaluated from the coordinates defined by the International Commission of illumination (CIE): Luminosity (L*), green-red chromaticity (a*), yellow-blue chromaticity (b*), tone (hab*), saturation (Cab*) and the total color change (DE). Kinetics were evaluated by storing the samples in a chamber with 75% of relative humidity, temperatures T1= 50°C, T2= 40°C and T3= 30°C, and six different periods of time, according to each temperature: T1 (0, 5, 10, 15, 20 and 25 days), T2 (0, 20, 40, 60, 80 and 100 days) and T3 (0, 30, 60, 90, 120 and 150 days). Results. At 30°C color is not a critical attribute for the can-dies, while at 40 and 50°C, L*, b*, Cab* y hab* they are affected by the storing conditions. The samples tend to get darker and reduce the yellow tones as time and temperature increase. The best adjusted kinetics were those of 0 and 1 at 40 and 50°C with regression coefficients above 0,90. Conclusions. L* and chromaticity b* represent the most important color parameters in the candies, thus being considered as adequate variables to define the useful lifetime of the product.
Key words: Physalis peruviana L, functional food, candies, chewable candies.
Resumo
Introdução. Os caramelos sem sacarose são desenvolvidos para pessoas que apresentam transtornos metabólicos ou querem atingir um efeito benéfico para sua saúde. A cor neste produto é um parâmetro de aceitação sensorial importante, que pode afetarse pela degradação ou formação de algunos compostos. Objetivo. Este trabalho avaliou a cinética do desenvolvimento da cor em caramelos de uchuva adicionados de cálcio e sem sacarose. Materiais e métodos. A cor se avaliou a partir das coordenadas fixadas pela Comissão Internacional de Iluminação (CIE), luminosidade (L*), acromaticidade verde-vermelho (a )*, acromaticidade amareloazul (b*), tom (hab*), saturação (Cab*) e a mudança total de cor (ΔE). As cinéticas se avaliaram armazenando as mostras numa câmara de umidade relativa do 75%, temperaturas T1= 50°C, T2= 40°C e T3= 30°C, e seis tempos diferentes de acordo com cada temperatura: T1 (0, 5, 10, 15, 20 e 25 dias), T2 (0, 20, 40, 60, 80 e 100 dias) e T3 (0, 30, 60, 90, 120 e 150 dias). Resultados. A 30°C a cor não é um atributo de qualidade crítico para os caramelos; enquanto a 40 e 50°C, L*, b*, Cab* e hab* estão muito afetados pelas condições de armazenamento, tendendo as mostras a ser escuras e a diminuir os tons amarelos com o incremento do tempo e a temperatura. As cinéticas que melhor ajuste apresentaram foram de ordem 0 e 1 a 40 e 50°C, com coeficientes de regressão maiores de 0,90. Conclusões. O L* e a acromaticidade b* representam os parâmetros de cor mais importantes nos caramelos, considerando se como variáveis adequadas para a fixação do tempo de vida útil do produto.
Palavras importantes: Physalis peruviana L., alimentos funcionais, doces, caramelos mastigáveis
Introducción
La uchuva (Physalis peruviana L.) es un fruto exótico promisorio muy apreciado en otros países, con un notable aumento en el volumen de exportaciones, que incrementa su productividad. Tiene una mejor coloración y mayor contenido de azúcares con una concentración de sacarosa (1200 - 2800mg/100g), glucosa (800 - 2100mg/100g) y fructosa (300 - 2300mg/100g), altos niveles de minerales Fe y P, vitaminas A y C, y fibra1-5.
En la fabricación de caramelos se suelen usar como materias primas azúcar, glucosa y agua, que se combinan en las proporciones adecuadas para generar un jarabe (almíbar) que, mediante una evaporación a altas temperaturas, elimina agua y queda una pasta de caramelo que puede ser moldeada en diferentes formas. Cuando a la mezcla se adiciona leche, la reacción de sus aminoácidos con los hidratos de carbono (azúcares invertidos) genera compuestos orgánicos cíclicos (reacción de Maillard), que otorgan nuevos sabores y colores característicos6-8. Los cambios químicos y físicos que se producen en el producto terminado son claves para la apariencia, textura y estabilidad en el almacenamiento9,10. Al sustituir la sacarosa en el desarrollo de alimentos, se afectan propiedades funcionales como textura, dulzura y color, entre otros, que deben sustituirse por compuestos como polidextrosa, sorbitol, maltodextrinas, edulcorantes artificiales como acesulfame K, sucralosa, entre otras materias primas11,12
En la actualidad, se emplea calcio en el desarrollo de alimentos funcionales13-19, debido a que es un componente fisiológicamente activo que mejora la salud ósea20-22. Las fuentes de calcio de uso en alimentos tienen diferente contenido de calcio en mg/g de producto y puede variar entre el 9 y 40%, dependiendo del tamaño de las moléculas; el citrato de calcio, por ejemplo, contiene un 50% de calcio23. Entre las fuentes de calcio empleadas para enriquecer leches, bebidas y otros alimentos, se tienen: carbonato de calcio, cloruro de calcio, fosfato de calcio, fosfato cálcico tribásico, malato citrato de calcio, lactato de calcio, gluconato de calcio, gluconato lactato de calcio y calcio lácteo24,25.
El color es uno de los parámetros importantes para la selección del producto, ya que es percibido inmediatamente por el consumidor y es una medida de reacciones que ocurren en los alimentos durante el proceso y almacenamiento, ya sea por la formación y/o degradación de compuestos como los azúcares por medio de las reacciones de Maillard26-28. Los productos que resultan de las reacciones de pardeamiento han sido usados como indicadores potenciales de excesos de temperatura en procesos térmicos y tiempos inadecuados de almacenamiento en diferentes alimentos29-32. Estudios actuales han reportado que las pentosas producen intensidad de color más fuerte que las hexosas33-37.
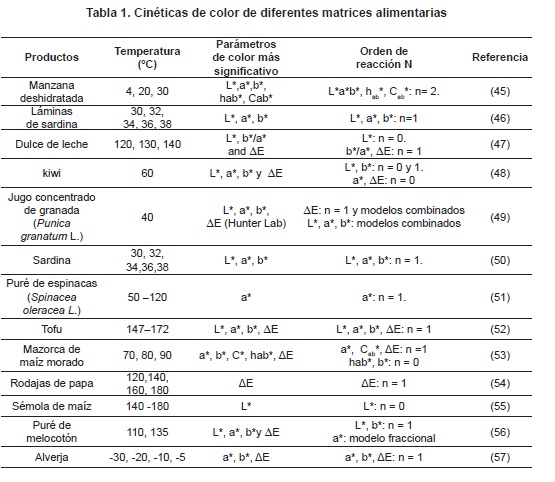
El almacenamiento de caramelos a temperaturas altas como en verano favorece la extensión de las reacciones de degradación de azúcares, afectando el color, atributo de calidad muy importante para la determinación de su tiempo de vida útil38. Algunos autores han evaluado la influencia del calentamiento en el color de turrones39 y en soluciones azucaradas40-45; además, cinéticas del cambio de color en diferentes estructuras de alimentos se han ajustados a modelos de reacción de orden cero y uno ( tabla 1)
Los parámetros cinéticos aportan información valiosa para entender y predecir los cambios que ocurren durante el procesamiento y almacenamiento de alimentos y son importantes para maximizar la calidad y minimizar las pérdidas, e incluyen el orden de la reacción, la constante de la velocidad de reacción y la dependencia de la temperatura58.
El objetivo de este trabajo fue determinar la cinética de los cambios de color en caramelos blandos de uchuva sin sacarosa y adicionados con calcio durante el almacenamiento.
Materiales y métodos
Materia prima. Se utilizaron uchuvas frescas, ecotipo Colombia, (La Unión, Antioquia). Las uchuvas se seleccionaron con una madurez comercial en la escala de color 3-4 según la Norma Técnica Colombiana NTC 458059.
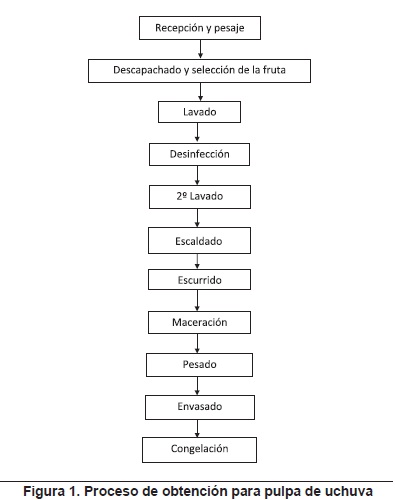
Proceso de elaboración del caramelo blando. La obtención de la pulpa de uchuva se llevó a cabo según el protocolo desarrollado por Echeverri60 (figura 1).
La elaboración del caramelo blando se obtuvo a partir de la siguiente formulación: pulpa de uchuva 37,95% (9,5°Brix ±0,5°Brix), polímero de almidón 23,05%, productos lácteos en polvo 17,63%, polioles 9,45%, fuente de grasa 5,7%, calcio 2,8%, edulcorante artificial 2,59%, conservantes 0,01%, estabilizante 0,34%, regulador de pH 0,16%, emulsificante 0,13, antioxidante 0,19%. Se elaboraron 3 baches de caramelo cada uno de 47 kg, la mezcla se preparó en una marmita de acero inoxidable con capacidad de 200 L, con agitador raspador (60 RPM) y quemador a gas de transferencia directa. El tratamiento térmico se realizó hasta que la mezcla de ingredientes alcanzó 92°C, luego la mezcla se moldeó en bandejas plásticas, recubiertas con bolsas de polietileno transparente y se almacenó en cuarto de reposo (28 ± 3°C) por un período de 24 horas.
Caracterización fisicoquímica de la pulpa. Los análisis fisicoquímicos de la pulpa se hicieron mediante las siguientes metodologías:
Humedad. Las muestras fueron sometidas a temperaturas entre 100-105°C en estufa de aire, teniendo como referencia el método gravi-métrico 966.02 del AOAC Internacional61.
Sólidos solubles. Se realizó midiendo el índice de refracción de las muestras con el Refractómetro marca HANNA HI 96801 graduado en escala de 0-85 ° Brix a 20°C.
Potencial de hidrógeno (pH). Se midió por inmersión directa a través de un electrodo usando pH-metro HANNA HI 9025, previamente calibrado con soluciones buffer 4 y 7 a 20±0,5°C.
Acidez. La muestra disuelta en agua destilada se titula gota a gota con una solución de NaOH 0.1 N, en constante agitación hasta que la lectura en el pH-metro esté entre 8.1 y 8.3. La acidez se expresó como ácido cítrico (eq g 0.06404g. de ácido cítrico) (% p/p) según la ecuación 162.
Medición de color de pulpa de uchuva y caramelos. Se efectuó empleando el espectrofotómetro portátil de esfera marca X-Rite, modelo SP-64, utilizando el iluminante D65, observador 10°, con especular incluida y una ventana de observación de 4 mm. A partir de los espectros de reflexión de las muestras se determinaron las coordenadas de color CIE-L*a*b*, donde L* es la luminosidad, a* indica la cromaticidad en el eje verde (-) a rojo (+), y b* la cromaticidad en el eje azul (-) a amarillo (+), y las coordenadas psi-cométricas tono 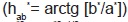 (ecuación 2) y croma
(ecuación 2) y croma 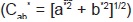 (ecuación 3). Además, se determinó el cambio total de color,
(ecuación 3). Además, se determinó el cambio total de color, 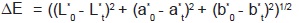 (ecuación 4), donde los parámetros de referencia L*0, a*0 y b*0 corresponden a las muestras de caramelo no almacenadas. Se hicieron lecturas en 5 muestras a cada condición de almacenamiento63. La ubicación de las coordenadas en el plano cromático a*b* se realizó empleando el software Rhinoceros 4.0. Es de anotar que la pulpa se colocó en recipientes cilíndricos opacos de 1 cm de diámetro y 3 cm de altura, para la lectura del color. La medición de color de los caramelos se hizo directamente sobre estos.
(ecuación 4), donde los parámetros de referencia L*0, a*0 y b*0 corresponden a las muestras de caramelo no almacenadas. Se hicieron lecturas en 5 muestras a cada condición de almacenamiento63. La ubicación de las coordenadas en el plano cromático a*b* se realizó empleando el software Rhinoceros 4.0. Es de anotar que la pulpa se colocó en recipientes cilíndricos opacos de 1 cm de diámetro y 3 cm de altura, para la lectura del color. La medición de color de los caramelos se hizo directamente sobre estos.
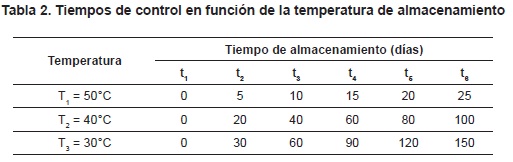
Almacenamiento. El producto moldeado fue cortado en forma manual en porciones de 5,1-5,5 g, las cuales se empacaron en una empacadora automática Pillow-Type packing machine marca TouchWin, utilizando doble empaque; el primero de láminas metalizadas con tres capas: polipropileno bioorientado (BOPP), foil de aluminio y polietileno baja densidad (PEBD), con un gramaje total de 55g/m2, y el empaque secundario son bolsas de BOPP más polietileno, con un espesor de 60 mm y un gramaje es 71 g/m2; se empacaron 8 unidades/bolsa, y luego la bolsa fue sellada térmicamente. Las bolsas selladas fueron mantenidas inicialmente a 25°C durante 2 días, después de los cuales se aplicaron las cinéticas de color, realizando un estudio bajo condiciones de almacenamiento acelerado a una HR = 75% y temperaturas de 50, 40 y 30°C (T1, T2 y T3, respectivamente). Se fijaron los tiempos totales de estudio en 25, 100 y 150 días a T1, T2 y T3, respectivamente, y se establecieron 6 tiempos de control durante el estudio (t1, t2, t3, t4, t5 y t6) (tabla 2). Para cada condición de almacenamiento se realizaron determinaciones en 5 bolsas, a razón de 5 lecturas de color por bolsa.
Modelamiento cinético. El comportamiento de los datos experimentales (L*, a*, b*, Cab*, hab* y DE) en función del tiempo, se modeló a partir de la ecuación general 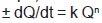 (ecuación 5), donde Q es el parámetro de color que se está evaluando, t es el tiempo, k es la constante de la velocidad de reacción y n el orden de la reacción. El valor del orden de reacción se determinó en función de la representación gráfica que presentara mejor ajuste de regresión lineal (R2 > 0,95).
(ecuación 5), donde Q es el parámetro de color que se está evaluando, t es el tiempo, k es la constante de la velocidad de reacción y n el orden de la reacción. El valor del orden de reacción se determinó en función de la representación gráfica que presentara mejor ajuste de regresión lineal (R2 > 0,95).
Efecto de la temperatura. Para evaluar el efecto de la temperatura se empleó la ecuación de Arrhenius 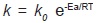 (ecuación 6), donde el k0 es la constante de Arrhenius conocida como factor pre-exponencial o algunas veces llamado factor de frecuencia, Ea es la energía de activación (Cal/mol), R la constante universal de los gases (1,9872 cal/mol K ó 8,314 J/ mol K)64-66.
(ecuación 6), donde el k0 es la constante de Arrhenius conocida como factor pre-exponencial o algunas veces llamado factor de frecuencia, Ea es la energía de activación (Cal/mol), R la constante universal de los gases (1,9872 cal/mol K ó 8,314 J/ mol K)64-66.
Análisis estadístico. Los datos experimentales fueron evaluados a partir de ANOVAS utilizando el método LSD (Mínimas Diferencias Significativas) como método de comparaciones múltiples, con un nivel de confianza del 95% (α=0.05) y un nivel de potencia del 85%. El análisis de varianza fue realizado con el paquete estadístico Statgraphics Centurión XV.
Resultados
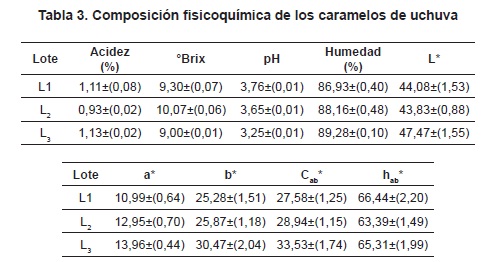
Caracterización fisicoquímica y coordenadas de color para la pulpa de uchuva. La tabla 3 presenta los valores promedio más la desviación estándar de las propiedades fisicoquímicas y del color de la pulpa de uchuva. El ANOVA de los parámetros fisicoquímicos obtenidos para la pulpa de uchuva presentó diferencias significativas (p<0,05) con respecto al factor lote, siendo los coeficientes de variación menores del 5%; igualmente los parámetros de color L*, a*, b*, Cab* y hab* presentaron diferencias signifcativas (p<0,05).
Coordenadas de color durante el almacenamiento de caramelos de uchuva. La figura 2. Presenta los valores medios con intervalos LSD (95%) de los parámetros de color (L*,a*, b*, Cab *, hab *) y la diferencia del color total (DE) de los caramelos almacenados a 50°, 40° y 30°C durante 25, 100 y 120 días, respectivamente.
El ANOVA para todos los parámetros de color presentó diferencias significativas (p<0.05) con respecto a los factores temperatura y tiempo, donde L*, b*, Cab* y hab* presentan una disminución con el incremento de la temperatura y del tiempo, que hace que las muestras se perciban más oscuras.
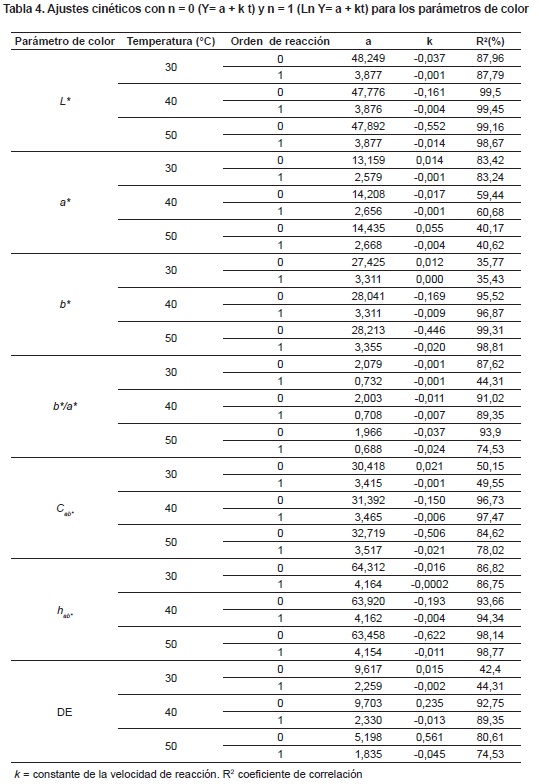
Modelamiento cinético. La tabla 4 presenta los resultados obtenidos de la modelación cinética de L*, a*, b*, b*/ a*, Cab* y hab* y DE con órdenes de reacción 0 y 1.
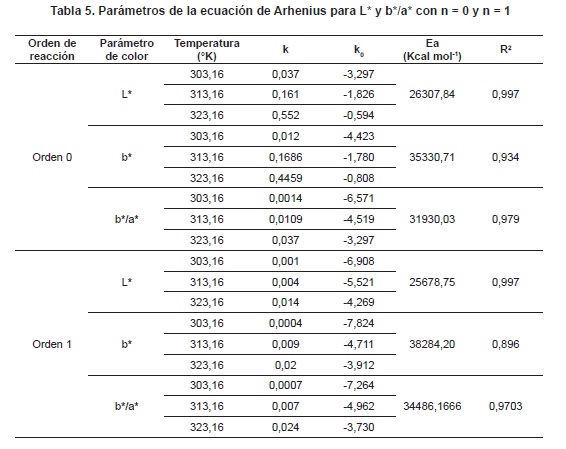
De acuerdo con los resultados de los modelos cinéticos obtenidos para n = 0 y n = 1, se evaluó la influencia de la temperatura sobre los parámetros de color a través de la ecuación de Arrhenius. La tabla 5 presenta los parámetros de color (L*, b* y b*/a*) que mejor ajuste de regresión presentaron en la ecuación de Arrhenius para cada orden de reacción, en caramelos blandos de uchuvas adicionados de calcio y sin sacarosa. Se observa que las constantes de velocidad cinéticas (k) fueron mayores con el incremento de la temperatura.
Discusión
Caracterización fisicoquímica y coordenadas de color para la pulpa de uchuva
La diferencia entre los resultados fisicoquímicos obtenidos para la pulpa de uchuva podría atribuirse a los diferentes grados de maduración de las cosechas empleadas, a los diferentes grados de madurez comercial que tiene el fruto de uchuva y al proceso de elaboración de la pulpa. Se resalta principalmente que la materia prima utilizada representa un producto que no cumplía los criterios de calidad para exportación (NTC 4580). Al comparar los resultados obtenidos por algunos autores para el fruto de uchuva67, 68, se encuentran valores más bajos en la acidez, °Brix, pH, mientras que la humedad fue mayor. El contenido de sólidos solubles varía en los frutos, dependiendo de la hidrólisis del almidón, de la síntesis de azúcares y de la oxidación de ácidos consumidos en la respiración y, a su vez, la acidez disminuye, al utilizarse los ácidos en el proceso de maduración69.
Para el color, los parámetros L*, b* y Cab * presentaron 2 grupos homogéneos, uno conformado por los lotes Ll y L2 y el otro por L3; en todos los casos las muestras de L3 presentaron mayor claridad, mayor cromaticidad en los tonos amarillo (>b*) lo que genera un tono resultante anaranjado de mayor intensidad de color (>Cab*). La cromaticidad a* presentó dos grupos homogéneos, uno conformado por L1 y el otro por los lotes L2 y L3, estos últimos con mayor cromaticidad hacia los tonos rojizos (>a*). Algunas investigaciones han reportados los parámetros de color directamente en el fruto, difiriendo de los resultados encontrados en la presente investigación para la pulpa de uchuva70,71, donde esta última presenta menores valores en L*, a* y b*, lo cual podría ser atribuible al proceso de filtración de la pulpa, donde se elimina gran parte de la cáscara y semillas del fruto, además de la retención de pigmentos carotenoides.
Coordenadas de color durante el almacenamiento de caramelos de uchuva
El oscurecimiento de las muestras de los caramelo blandos de uchuva se hace más evidente con el cambio de L* a las temperaturas de 50° y 40°C, alcanzando una disminución del 27 y 32%, respectivamente, comparado con las muestras almacenadas 80 días a 30°C, las cuales presentaron un cambio del 8%, que tiende a ser constante a partir de este tiempo. La cromaticidad b* a 50°C, alcanzó una variación aproximada 41% durante los 25 días de almacenamiento, mientras que a 40°C se presentan 4 grupos homogéneos (0-20 días, 20-40 días, 40-60 días y 60-80-100 días), alcanzando el último grupo su estabilidad, con una variación aproximada del 54%. A 30°C no se observó una tendencia definida, sino que se observaron fluctuaciones en el rango 30 - 34, lo cual se asumió a las variaciones propias de las materias primas.
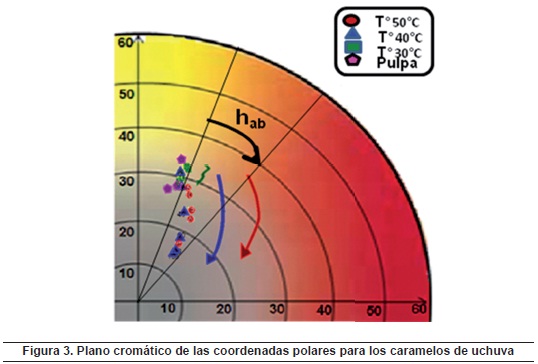
La claridad de los caramelos blandos adicionados con calcio y sin sacarosa es dada por el contenido de leche en polvo y por la presencia del calcio, la cual está influenciada por el tiempo de almacenamiento, la temperatura y el contenido de hidratos de carbono, entre otros, lo que favorece las reacciones de Maillard, cuya etapa final supone procesos de polimerización para producir melanoidinas que son pigmentos pardos de elevado peso molecular, generalmente hidrosolubles, que contienen nitrógeno72, y pueden provocan el oscurecimiento del producto durante el aumento en el tiempo de almacenamiento (figura 3)73,74. Las variaciones en la cromaticidad b* se atribuyen principalmente a la inestabilidad de los carotenoides al tener una estructura química altamente insaturada, que favorece los procesos oxidativos; además, existe una importante influencia por factores como la temperatura, la luz o el pH que inducen a cambios en el compuesto, al inducir a reacciones de isomerización75. Se considera que a temperaturas bajas las interacciones de los carotenoides con la matriz del alimento ofrecen un efecto protector76.
Las coordenadas polares Cab* y hab* presentaron un comportamiento similar a la cromaticidad b*, donde las muestras a 40 y 50°C presentan una mayor intensidad del color, y los tonos, un desplazamiento desde los límites de los tonos amarillo-rojizos en el tiempo t0 hacia los tonos anaranjados en el tiempo t6 de cada temperatura de almacenamiento (< hab*), lo cual puede apreciarse en el plano cromático a*b* (figura 3). Los caramelos que presentaron menor cambio en las coordenadas polares fueron aquellos que se almacenaron a 30°C, (muestras de tono cremoso más claras); esto se atribuye a la poca degradación de los compuestos carotenoides y menor formación de compuestos de color pardo por las reacciones de Maillard.
La cromaticidad a* presenta a 40 y 50°C una tendencia a incrementar en los primeros tiempos de control y luego disminuir; sin embargo, estos Da* se dan en el rango pequeño de 12-16, lo cual no incide apreciablemente en el cambio total del plano a*b*. A 30°C los cambios son menores que a 40 y 50°C, incrementando ligeramente desde 13 hasta 15 en el t6 (150 días). En general, los cambios observados en el plano cromático a*b* son mucho mayores en la cromaticidad b* que en a*, por lo que las muestras presentan un desplazamiento hacia la zona de los grises (figura 3), lo cual acentúa el oscurecimiento identificado en la disminución de L*. Esta situación se ratifica con la evolución de DE en el tiempo, donde los principales cambios presentan mayores pendientes a 50 y 40°C, debido a que se favorece una mayor degradación de los pigmentos carotenoides y mayor pardeamiento no enzimático. En general la cromaticidad a* es más estable durante el almacenamiento que L*, lo cual coincide con lo reportado por Vázquez77 en turrón de jijona.
La figura 4 presenta unas fotografías de los caramelos blandos de uchuvas adicionados con calcio y sin sacarosa a 50°C en función del tiempo. Se observa en los primeros tiempos de control una tonalidad amarilla cremosa, aportada principalmente por la pulpa de uchuva, que la ubica en el plano cromático a*b* enlos límites de las zonas amarilla, gris y anaran-jada78. Se evidencia a 50°C un mayor oscurecimiento con el incremento del tiempo, siendo similar a 40°C, donde el desplazamiento se da en la zona de los grises, favoreciendo el oscurecimiento comentado anteriormente.
Modelamiento cinético. Se observa que los modelos cinéticos de orden 0 y 1 pueden usare adecuadamente para los parámetros L*, b* (40 y 50°C), Cab* (40°C), hab* (50°C), con un ajuste de regresión R2 > 0.95, mientras que hab* s (40°C) presentó un ajuste de regresión 0,90 <R2 < 0.95. Estos ajustes se consideran aceptables y correspondientes a los parámetros de mayor importancia en el dulce de uchuva adicionado con calcio y sin sacarosa. El resto de parámetros no presentó ajustes aceptables (R2<0,90). La Ea depende de la composición de los alimentos, y para el caso del color de los caramelos que está afectado por diferentes mecanismos de degradación, hace que haya un valor de Ea para cada parámetro, siendo más alto para la relación de las coordenadas b*/a*. Lo anterior está acorde con lo anunciado por Jayendra et al.,79, cuando mencionan que los parámetros cinéticos aportan información valiosa para entender y predecir los cambios que ocurren80.
Algunas investigaciones de color en soluciones sobresaturadas de azúcar han encontrado cinéticas de orden cero para DL*, con R2 entre 0.75 y 0.95; además, se han encontrado cinéticas de orden 0 y 1, para L*/L*0 y DE, con R2 entre 0.765 y 0.660. Los valores de Ea para la degradación de reacciones de Maillard en soluciones azucaradas se han reportado entre 105 y 210 J mol-1 81.
Conclusiones
El color de los caramelos blandos de uchuva adicionados con calcio y sin azúcar está muy afectado por las condiciones de almacenamiento, tendiendo a ser más oscuro y disminuir los tonos amarillos con el incremento del tiempo y la temperatura. Los parámetros de color más importantes fueron la luminosidad L* y la cromaticidad b*, las cuales están muy correlacionadas con las coordenadas polares croma (Cab*) y tono (hab*), y podrían considerarse como variables adecuadas para la fijación del tiempo de vida útil del producto. Los parámetros de color que mejor ajustaron la influencia de la temperatura según la ecuación de Arrhenius fueron L*, b* y b*/a*. La medición de color mediante las coordenadas CIEL*a*b* es una herramienta importante en la determinación de calidad de los alimentos.
Agradecimientos
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural, Productos alimenticios KONFYT, Universidad de Antioquia y la Universidad Nacional de Colombia Sede Medellín por su apoyo en la realización de este proyecto.
Referencias bibliográficas
1. PUENTE, L.; PINTO-MUÑOZ, C., CASTRO, E. and CORTÉS, M. Physalis peruviana Linnaeus, the multiple properties of a highly functional fruit: A review. En: Food Research International. 2011. Vol. 44, N.° 1, p. 1733-1740. [ Links ]
2. ÁVILA, J.; MORENO, P.; FISCHEr, G. y MIRANDA, D. Influencia de la madurez del fruto y del secado del cáliz en uchuva (Physalis peruviana l.), almacenada a 18°C. En: Acta Agron (Colombia). 2006. Vol. 55, N° 4, p. 29-38. [ Links ]
3. COLOMBIA. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. Anuario Estadístico Cálculos: Observatorio Agrocadenas Colombia). Bogotá: El Ministerio. Url disponible en www.ag-rocadena.gov.co, www.agronet.gov.co. [ Links ]
4. LETERME, P.; BULDGEN, A.; ESTRADA, F. y LONDOÑO A. M. Mineral content of tropical fruits and unconventional foods of the Andes and the rain forest of Colombia. En: Food Chemistry. April 2005. Vol. 95, N° 4, p. 644-652. [ Links ]
5. COLOMBIA. PROEXPORT. Sitio web. Bogotá: Proexport, 2011. [ Links ]
6. JACKSON, E. B. Sugar Confectionery Manufacture. Blackie and son. 1990. p. 173-189. [ Links ]
7. GIMÉNEZ, M. J. Presencia de hidroximetil furfural en el turrón de Jijona. En: Alimentación Equipos y Tecnología. 2005. Vol. 24, N° 199, p. 58-60. [ Links ]
8. QUINTAS, M.; BRANDA, T.; SILVA, Cristina L. Modelling colour changes during the caramelisation reaction. En: Journal of Food Engineering. 2007. Vol. 11, p. 483-491. [ Links ]
9. JACKSON, E. B. Op. Cit., p. 173-189. [ Links ]
10. Quintas M.; et al. Op. Cit., p. 483-941. [ Links ]
11. VALENCIA, F. E.; MillÁN, L. y RAMÍREZ, N. Evaluación de los efectos en las propiedades fisico-químicas, sensoriales y texturales de polidextrosa, fructosa y sorbitol como sustitutos de azúcar en la elaboración de arequipe. En: Revista Lasallista de Investigación. 2008. Vol. 5, N° 2, p. 20-27. [ Links ]
12. VALENCIA, F. E. Escalamiento industrial de caramelos blandos de uchuva (Physalis peruviana L.) adicionados con calcio, vitamina D y fibra dietaria. Tesis de Doctorado. Universidad de Antioquia. 2012. [ Links ]
13. VALENCIA G., F. E. y ROMÁN, M. O. La fibra dietaria como alimento funcional. En: Vitae. 2004. Vol. 11, N° 2, p. 12-21. [ Links ]
14. HEANEY, Robert. Calcium Nutriture: A Model System for Understanding Menopause-Nutrient Interactions. En: Menopause: biology and pathobiology. Elsevier science Technology books. April 2000. Capítulo 33, p. 481-494. [ Links ]
15. CERKLEWSKI, Florian. Calcium fortification of food can add unneeded dietary phosphorus. En: Journal of Food Composition and Analysis. 2005. Vol. 18, N° 6, p. 595-598. [ Links ]
16. JUNG, Won-kyo; MOON, Sung and KIM, Sekwon. Effect of chitooligosaccharides on calcium bioavailability and bone strength in ovariectomized rats. En: Life Sciences. 2006. Vol. 78, N° 9, p. 970-976. [ Links ]
17. ROMANCHIK-CERPOVICZ, J. and McKEMIE, R. Fortification of All-Purpose Wheat-Flour Tortillas with Calcium Lactate, Calcium Carbonate, or Calcium Citrate Is Acceptable. En: Journal of the American Dietetic Association. 2007. Vol. 107, N° 3, p. 506-509. [ Links ]
18. SINGH, G. and MUTHUKUMARAPPAN, K. Influence of calcium fortification on sensory, physical and rheological characteristics of fruit yogurt. En: LWT. Sept. 2008. Vol. 41, N° 7, p. 1145-152. [ Links ]
19. VALENCIA, F. E.; CARDONA, D. y ROMÁN, M. El calcio en el desarrollo de alimentos funcionales. En: Revista Lasallista de Investigación. 2011. Vol. 8, N°1, p. 123-134. [ Links ]
20. MONTERROSA, Á.; PEÑALOZA, P. y ARTEAGA, M. Cuantificación del calcio presente en la dieta que consumen mujeres entre 45 y 55 años de edad, residentes en Cartagena, Colombia. En: Revista de Menopausia. 2003. Vol. 9, N° 3. [ Links ]
21. GRADOS, Franck; et al. Effects on bone mineral density of calcium and vitamin D supplementation in elderly women with vitamin D deficiency. En: Joint Bone Spine. 2003. Vol. 70, N° 3,p. 203-208. [ Links ]
22. KESSENICH, Cathy. Alternative Choices For Calcium Supplementation. En: The Journal for Nurse Practitioners. January 2008. Vol. 4, N° 1, p. 36-39. [ Links ]
23. AUGSPURGER, N and BAKER, D. Phytase improves dietary calcium utilization in chicks, and oyster shell, carbonate, citrate, and citratema-late forms of calcium are equally bioavailable. En: Nutrition Research. Abr. 2004. Vol. 24, N° 4,p. 293-301. [ Links ]
24. FISHBEIN, L. Multiple sources of dietary calcium-some aspects of its essentiality. En: Regulatory Toxicology and Pharmacology. 2004. Vol. 39, N° 2, p. 67-80. [ Links ]
25. RODRÍGUEZ, M.; et al. Chitosan influence on glucose and calcium availability from yogurt: In vitro comparative study with plants fibre. En: Carbohydrate Polymers. Nov 2008. Vol. 74, N° 4, p. 797-801. [ Links ]
26. QUINTAS, M.; BRANDA, T., SILVA, Cristina, L. M. Modelling autocatalytic behavior of a food model system-Sucrose thermal degradation at high concentrations. En: Journal of Food Engineering. 2007. Vol. 78, N° 1, p. 537-545. [ Links ]
27. VÁSQUEZ, L., et al. Changes in physicochemical properties, hydroximethylfurfural and volatile compounds during concentration of honey and sugars in Alicante and jijona turròn. En: Eur Food Res Technol. 2007, Vol. 225, N° 5-6, p. 757-767. [ Links ]
28. KIM, Ji-Sang and LEE, Young-Soon. Effect of reaction pH on enolization and racemization reactions of glucose and fructose on heating with amino acid enantiomers and formation of melanoidins as result of the Maillard reaction. En: Food Chemistry. 2008. Vol. 108, N°2, p. 582-592. [ Links ]
29. BOLIN, H. R. y STEELE, R. J. Nonenzymatic browning in dried apples during storage. En: J. Food Sci. 1987. Vol. 52, N° 6, p. 1654 -1657. [ Links ]
30. ROCHA, S.; COIMBRA, M.; DELGADILLO, I. Occurrence of furfuraldehydes during the processing of Quercus suber L. cork. Simultaneous determination of furfural, 5-hydroxymethylfurfural and 5-methylfurfural and their relation with cork polysaccharides. En: Carbohydrate Polymers. 2004. Vol. 56, N°3, p. 287-293. [ Links ]
31. WALL, M. and GENTRY, Trevor S. Carbohydrate composition and color development during drying and roasting of macadamia nuts (Macadamia integrifolia). En: LWT. 2007. Vol. 40, N°4, p. 587-593. [ Links ]
32. LAMBERTS, Lieve and ROMBOUTS, Ine. Study of nonenzymic browning in a-amino acid and c-aminobutyric acid/sugar model systems. En: Delcour Food Chemistry. 2008; 111 738-744. AMES, J.M. Applications of the Maillard reaction in the food industry. En: Food Chem. 1998. Vol. 62, N°4, p 431-439. [ Links ]
33. MIGUEL, M. y GIMÉNEZ, J. Presencia de hi-droximetil furfural en el turrón de Jijona. En: Alimentación Equipos y Tecnología. 2005. Vol. 24, N°199, p. 58-60. [ Links ]
34. QUINTAS, M.; et al. Op. Cit., p. 483-941. [ Links ]
35. LAMBERS; et al. Op. Cit., p. 431-439. [ Links ]
36. JAKAS, A.; et al. Glycation of a lysine-containing tetrapeptide by D-glucose and D-fructose-influence of different reaction conditions on the formation of Amadori/Heyns products. En: Carbohydrate Research. 2008. 343, N°14, p. 2475-2480. [ Links ]
37. PEARSON, W. The Science of Sugar Confectionery. Cambrige: Royal Society of Chemistry, 2000.176 p. [ Links ]
38. VÁSQUEZ, L.; et al. Op. Cit., p. 757-767. [ Links ]
39. BOSTAN, A. and BOYACIOGLU, D. Kinetics of non enzymatic color develoment in glucose syr-ups during storage. En: Food Chemistry. 1997. Vol. 60, N° 4, p. 581-585. [ Links ]
40. CARABASA-GIRIBET, M. and IBARZ-RIBAS, A. Kinetics of colour development in aqueous glucose systems at high Temperaturas. En: Journal of Food Engineering. 2000. Vol. 44, N° 1, p. 181-189. [ Links ]
41. VÁSQUEZ, L., et al. Op. Cit., p. 757-767. [ Links ]
42. QUINTAS, M., et al. Op. Cit., p. 537-545. [ Links ]
43. LAMBERS; et al. Op. Cit., p. 431-439. [ Links ]
44. LAROQUE, D.; et al. Kinetic study on the Mail-lard reaction. Consideration of sugar reactivity. En: Food Chemistry. 2008. Vol. 111, N° 4, p. 1032-1042. [ Links ]
45. CORTÉS, M. y CHIRALT, A. Cinética de los cambios de color en manzana deshidratada por aire fortificada con vitamina E. En: VITAE. 2008. Vol. 15, N° 1, p. 8-16. [ Links ]
46. CORZO, O.; BRACHO, N. and MARJAL, J. Color change kinetics of sardine sheets during vacuum pulse osmotic dehydration. En: Journal of Food Engineering. 2006. Vol. 75, N° 1, p. 21-26. [ Links ]
47. JAYENDRA KUMAR, A.; et al. Kinetics of colour and texture changes in Gulabjamun balls during deep-fat frying. En: LWT. 2006. Vol. 39, N° 1, p. 827-833. [ Links ]
48. MASKAN, M. Kinetics of colour change of kiwi-fruits during hot air and microwave drying. En: Journal of Food Engineering. 2001. Vol. 48, N° 1, p. 169-175. [ Links ]
49. MASKAN, M Production of pomegranate (Punica granatum L.) juice concentrate by various heating methods: colour degradation and kinetics. En: Journal of Food Engineering. 2006. Vol. 72, N° 1, p. 218-224. [ Links ]
50. CORZO, O.; BRACHO, N. and MARJAL, J. Color change kinetics of sardine sheets during vacuum pulse osmotic dehydration. En: Journal of Food Engineering. 2006. Vol. 75, N° 1, p. 21-26. [ Links ]
51. NISHA, P.; SINGHAl, R. and PANDIT, A. B. A study on the degradation kinetics of visual green colour in spinach (Spinacea oleracea L.) and the effect of salt therein. En: Journal of Food Engineering. 2004. Vol. 64, N° 1, p. 135-142. [ Links ]
52. BAIK, O. D. and Mittal, G. S. Kinetics of tofu color changes during deep-fat frying. En: LWT - Food Science and Technology. 2006. Vol. 36, N° 1, p. 43-48 [ Links ]
53. YANG, Z.; et al. Thermal degradation kinetics of aqueous anthocyanins and visual color of purple corn (Zea mays L.) cob. En: Innovative Food Science and Emerging Technologies. 2008. Vol. 9, N° 1, p. 341-347. [ Links ]
54. PEDRESCHI, F.; et al. Color kinetics and acryl-amide formation in NaCl soaked potato chips. En: Journal of Food Engineering. 2007. Vol. 79, N° 1, p. 989-997. [ Links ]
55. ILO, S. and BERGHOFER, E. Kinetics of colour changes during extrusion cooking of maize grits. En: Journal of Food Engineering. 1999. Vol. 39, N° 1, p. 73-80. [ Links ]
56. ÁVILA, I. and SILVA, C. Modelling kinetics of thermal degradation of colour in peach puree. En: Journal of Food Engineering. 1999. Vol. 39, N° 1, p.161-166. [ Links ]
57. MARTINS, R.; LOPES, I. and SILVA, C. Accelerated life testing of frozen green beans (Phase-olus vulgaris, L.) quality loss kinetics: colour and starch. En: Journal of Food Engineering. 2005. Vol. 67, N° 1, p. 339-346. [ Links ]
58. JAYENDRA, A.; Op. Cit., p. 827-833. [ Links ]
59. INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN - ICONTEC. Frutas frescas. Uchuva, especificaciones. Bogotá: ICONTEC, 1999. 14 p. (NTC 4580). [ Links ]
60. ECHEVERRI RAMÍREZ, Luz Shirley. Diseño y desarrollo a escala piloto de caramelos blandos a base de fruto de uchuva (Physalis peruviana L.) adicionados de calcio, vitamina D y fibra di-etaria como un alimento funcional. Tesis de Maestría. Universidad de Antioquia. Agosto, 2011. [ Links ]
61. AOAC. International Official Methods of Analysis of AOAC International. 17th edition. Maryland, USA: AOAC, 2003. [ Links ]
62. BOGDANOV, Stephan. Harmonised methods of the international honey commission. Switzerland: International Honey Commission, 2002. 62 p. [ Links ]
63. © X-RITE, INCORPORATED. Guía para entender la comunicación del color. Grandville, Michigan: Colornews Ltda, 2002. 25 p. [ Links ]
64. CHUTINTRASRI, B. and Noomhorm, A. Color degradation kinetics of pineapple puree during thermal processing. En: LWT. 2007. Vol. 40, N° 1, p. 300-306. [ Links ]
65. YANG, Z.; Op. Cit., p. 341-347. [ Links ]
66. CORTÉS, M.; Op. Cit., p. 8-16. [ Links ]
67. CABRERA, Y. A. Uchuva (Physalis peruviana L.) Adicionada con Calcio, Vitaminas B9, D, E, deshidratada por Aire Caliente. Tesis de Maestría. Universidad Nacional de Colombia Sede Medellín, 2011. [ Links ]
68. FLÓREZ, V.; FISCHER, G. y SORA, A. Producción, Poscosecha y Exportación de la Uchuva. Bogotá: Universidad Nacional de Colombia, 2000. p. 131. [ Links ]
69. FLÓREZ, V.; Op. Cit., p. 131. [ Links ]
70. BOTERO, A. Aplicación de la ingeniería de matrices en el desarrollo de uchuva (Physalis Peruviana L.) mínimamente procesada fortificada con calcio y vitaminas C y E. [Tesis de Maestría]. Universidad de Antioquia, Medellín, 2008. [ Links ]
71. CABRERA, Y. A.; Op. Cit., p. 10? [ Links ]
72. HERNÁNDEZ, Gustavo. Desarrollo de productos de Uchuva (Physalis peruviana L.) en Polvo Secada por Atomización Adicionada con Vitaminas C, Ácido Fólico, Hierro y Fibra Soluble. Tesis de Maestría. Universidad Nacional de Colombia Sede Medellín, 2011. [ Links ]
73. NÚÑEZ, J. M. y LAENCINA, J. Reacciones de Maillard en alimentos. En: Alimentación, equipos y tecnología. Abril 1990. p. 103-109. [ Links ]
74. BOSTAN, A. and BOYACIOGLU. Kinetics of non-enzymatic color develoment in glucose syrups during storage. En: Food Chemistry. 1997. Vol. 60, N° 4, p. 581-585. [ Links ]
75. QUINTAS, M.; et al. Op. Cit., p. 483-941. [ Links ]
76. MELÉNDEZ, M. A.; VICARIO, I. and HEREDIA, F. Estabilidad de los pigmentos carotenoides en los alimentos. En: Archivos Latinoamericanos de Nutrición. 2004. Vol. 54, N° 2, p. 209-215. [ Links ]
77. VÁSQUEZ, L.; et al. Op. Cit., p. 757-767. [ Links ]
78. HERNÁNDEZ, G.; Op.Cit, 2011. [ Links ]
79. JAYENDRA; et al. Op. Cit., p. 827-833. [ Links ]
80. QUINTAS M.; et al. Op. Cit., p. 483-941. [ Links ]
81. Ibid; p. 483-941. [ Links ]