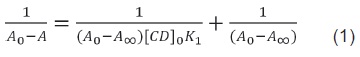Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.9 no.2 Caldas July/Dec. 2012
Artículo original / Original article / Artigo original
Obtención del complejo ciclodextrina-curcumina y su uso como reemplazante de tartrazina*
Obtaining the cyclodextrin-curcumin complex and its use as a substitute of tartrazine
Obtenção do complexo ciclodextrina-curcumina e seu uso como substituto de tartrazina
Alzate Ceballos, J. A.**, López-Padilla, A.***, Caicedo, J. A.****, Cano Salazar, J. A.*****
* Artículo producto de la investigación cofinanciada por el proyecto COLCIENCIAS Código 3387-502-26885, la empresa TECNAS S. A. y la Fundación INTAL.
** Ingeniera química, aspirante a magíster en Ciencias Químicas, Universidad Nacional sede Medellín, asistente de Innovación y Desarrollo en TECNAS S. A.
*** Ingeniero de alimentos, magíster en Ciencias Farmacéuticas, investigador en TECNAS S. A.
**** Ingeniero químico. Aspirante a magíster en Ciencia y Tecnología de Alimentos, auxiliar de Investigación en Fundación INTAL
***** Ingeniero de alimentos, Ph.D., MSc., Ciencia y Tecnología de Alimentos. Coordinador científico-técnico de Proyectos Fundación INTAL
Correspondencia: Johanna Andrea Alzate Ceballos, e-mail: jalzate@tecnas.com.co
Artículo recibido: 22/03/2012; Artículo aprobado: 15/11/2012
Resumen
Introducción. La curcumina es el principal colorante presente en el rizoma de la planta Cúrcuma loriga, y está acompañado por pequeñas cantidades de otros compuestos, siendo todos insolubles en agua, razón por la cual no es ideal su uso en forma pura. Se emplea principalmente disuelta con una mezcla de solventes de grado alimenticio que permite su emulsificación, de esta forma el producto posee cerca del 4 - 10% de curcumina, miscible en agua. También son conocidas otras formas de comercialización, que incluyen la suspensión en aceite vegetal y dispersión de este colorante en almidón. Por su parte, estudios han mostrado que la ciclodextrina (CD) puede ser usada como agente solubilizante para aceites volátiles hidrofóbicos. Está formada por una superficie exterior hidrofílica, y una cavidad interna hidrófoba, la cual le proporciona la capacidad de formar complejos de inclusión con una variedad de huéspedes. Estas características sugieren que la CD puede ser usada para aumenta la solubilidad en agua de la curcumina, hidrofóbica e insoluble en agua, adicionalmente, la microencapsulación protege la curcumina de cambios destructivos, y le permite un flujo libre en polvo. En este estudio, la βCD y γ CD fueron evaluadas como agentes encapsulantes para la curcumina. Objetivo. Obtener el complejo ciclodextrina-curcumina como reemplazante detartrazina. Materiales y métodos. Para el desarrollo de esta investigación se llevaron a cabo 3 experimentos: en el experimento 1 se estudió el efecto de la concentración y tipo de solvente sobre la absorción de la curcumina, en diferentes solventes: agua, etanol, acetona, hexano, propilenglicol, lactato de etilo y etilenglicol. Se prepararon soluciones acuosas en %v/v al 20%, 50%, 80%, 90% para cada uno de los solventes mencionados. Se llevó la concentración final del colorante curcumina a 0.005%. En el experimento 2 se determinó la asociación y relación estequiométrica entre la curcumina y dos ciclodextrinas: β-ciclodextrina (β-CD) y γ-ciclodextrina (γ-CD); para ello se utilizaron soluciones de ciclodextrinas en el rango 0 - 0.02M, y una concentración constante de curcumina de 0.001M, mediante agitación y calentamiento a 50°C por 48 horas. En el experimento 3, se prepararon soluciones independientes de ambas ciclodextrinas en presencia de curcumina, y se utilizaron los métodos de mezcla física y coprecipitación para obtener el complejo curcumina-ciclodextrina, y posterior análisis de Calorimetría Diferencial de Barrido (DSC) para corroborar la formación del complejo. Resultados. Los resultados muestran que la máxima absorbancia de la curcumina se presenta a una longitud de onda de 425nm en presencia de una solución de etanol: agua al 20% (v/v). De otro lado, la β-ciclodextrina (β-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1 con una constante de formación aparente de 5,00x102 mol/L. La y-ciclodextrina (γ-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1 con una constante de formación aparente de 7,51x103 mol/L. Por su parte, la obtención del complejo se presenta a nivel de laboratorio con mejores resultados utilizando el método de coprecipitación, con rendimientos de 85% para la γ-CD, y 69% para β-CD, indicando que la ciclodextrina más apropiada es la y CD. Conclusiones. Se encontró que la curcumina forma complejos de inclusión con βCD y γCD en solución. La solubilidad de la curcumina en presencia de βCD y γCD, ha mostrado ser más efectiva en la segunda. La asociación de ambas ciclodextrinas es de 1:1, indicando que es más fuerte con γCD, debido a su estructura (8 unidades de glucosa). El análisis de DSC muestra que los complejos de inclusión por mezcla física y coprecipitación se formaron. Sin embargo, para efectos de solubilidad, es más recomendable utilizar el método de coprecipitación, dado que hay una prehidratación.
Palabras clave: curcumina, ciclodextrina, complejo, constante de formación, solubilidad, absorbancia, solventes.
Abstract
Introduction. Curcumin is the main colorant that can be found in the Cúrcuma longa's rhizome, in which there are also small quantities of other compounds insoluble in water, so its use in a puré state is not ideal. Curcumin is used, principally, dissolved with a mixture of alimentary degree solvents that allow its emulsification. This way, the product has a 4 - 10% of curcumin contení, miscible in water. Other forms of commercialization are also known, including the suspensión in vegetable oil and dispersión of this colorant in starch. It has also been demonstrated that cyclodextrin (CD) can be used as a solubilizing agent for hydrophobic volatile oils. It is formed by a hydrophilic external surface and an infernal hydrophobic cavity, which provides a capacity to form inclusión complexes with a variety of guests. These characteristics suggest that CD can be used to increase the solubility of hydrophobic and insoluble curcumin in water. Additionally, microencapsulation protects curcumin against destructive changes and allows itto flow freely when presented as powder. In this study, βCD and CD were evaluated as encapsulation agents for curcumin. Objective. Obtaining the cyclodextrin-curcumine complex as a substitute of tartrazine. Materials and methods. To develop this research work, 3 experiments were performed: In experiment 1 the effect of the concentration and of the type of solvent on the curcumin's absorption was studied for different solvents; water, ethanol, acetone, hexane, propylene glycol, ethyl lactate and ethylene glycol. Aqueous solutions were prepared in %v/v at 20%, 50%, 80%, 90% for each of the aforementioned solvents. The final concentration of the curcumin colorant was taken to 0.005%. In experiment 2 the association and the stoichiometric ratio between curcumin and two cyclodex-trins, β-ciclodextrina (β-CD) and γ-ciclodextrina (γ-CD), were determined. Two cyclodextrin solutions in the rank 0 - 0.02M, were used for that, plus a constant curcumin concentration of 0.001M, by means of agitation and heating at 50°C during 48 hours. In experiment 3, independent solutions of both cyclodex-trins were prepared in the presence of curcumin and the physical mixture and the coprecipitation methods were used to obtain the curcumin-cyclodextrin complex. A subsequent Differential Scanning Calorimetry analysis (DSC) was performed to corrobórate the formation of the complex. Results. The results demónstrate that the máximum absorbance of the curcumine takes place at a 425nm wavelength in the presence of a solution of ethanol:water at 20% (v/v). On the other hand, β-cyclodextrin (β-CD) reacts with curcumin to form a host-guest complex 1:1 with an apparent formation constant of 5,00x102 mol/L. The y-cyclodextrin (γ-CD) reacts with curcumin to form a host-guest complex 1:1 with an apparent formation constant of 7,51x103 mol/L. The complex is obtained at a laboratory level with best results by the use of the coprecipitation method, with 85% of performance for y-CD, and 69% for β-CD, so the most adequate cyclodextrin is γCD. Conclusions. Curcumin forms inclusión complexes with βCD and γCD in solution. The solubility of curcumin in the presence of βCD and γCD has demonstrated a higher effectiveness in the second one. The association of both cyclodextrins is 1:1, a fact that indicates that it is stronger with yCD due to its structure (8 units of glucose). The DSC analysis demonstrates that the inclusión complexes by physical mixture and by coprecipitation were formed. Nonetheless, for solubility effects, coprecipitation is more recommended because there is a prehydration.
Key words: curcumin, cyclodextrin, complex, formation constant, solubility, absorbance, solvents.
Resumo
Introdução. A curcumina é o principal corante presente no rizoma da planta Cúrcuma longa, e está acompanhado por pequeñas quantidades de outros compostos, sendo todos insolúveis em água, razáo pela qual não é ideal seu uso em forma pura. Emprega-se principalmente dissolvida com urna mistura de solventes de grau alimentícios que permite sua emulsificação, desta forma o produto possui cerca de 4 - 10% de curcumina, misturável em agua. Também são conhecidas outras formas de comercialização, que incluem a suspensáo em azeite vegetal e dispersáo deste corante em goma. Por sua vez,estudos mostraram que a cilodextrina (CD) pode ser usada como agente solúvel para azeites voláteis hidrofóbicos. Está formada por urna superfície exterior hidrofílica, e urna cavidade interna hidrófoba, a qual Ihe proporciona a capacidade de formar complexos de inclusáo com urna variedade de hóspedes. Estas características sugerem que a CD pode ser usada para aumentá-la solubilidade em água de a curcumina, hidrofóbica e insolúvel em água, adicionalmente, a micro-encapsulacáo protege a curcumina de mudanças destrutivas, e Ihe permite um fluxo livre em pó. Neste estudo, a βCD e y CD foram avahadas como agentes encapsulantes para a curcumina. Objetivo. Obter o complexo ciclodex-trina-curcumina como substituto de tartrazina. Materiais e métodos. Para o desenvolvimento desta investigação se levaram a cabo 3 experimentos: no experimento 1 se estudou o efeito da concentracáo e tipo de solvente sobre a absorcáo da curcumina, em diferentes solventes: água, etanol, acetona, hexano, propilenglicol, lactato de etilo e etilenglicol. Prepararam-se solucóes aquosas em %v/v ao 20%, 50%, 80%, 90% para cada um dos solventes mencionados. Levou-se a concentracáo final do corante curcumina a 0.005%. No experimento 2 se determinou a associação e relação estequiométrica entre a curcumina e duas ciclodextrinas: p-ciclodextrina (β-CD) e γ-ciclodextrina (γ-CD); para isso se utiliza-ram solucóes de ciclodextrinas na casta 0 - 0.02M, e urna concentracáo constante de curcumina de 0.001M, mediante agitacáo e aquecimento a 50°C por 48 horas. No experimento 3, prepararam-se solucóes ¡ndependentes de ambas ciclodextrinas em presença de curcumina, e se utilizaram os mé todos de mistura física e co-precipitacáo para obter o complexo curcumina-ciclodextrina, e posterior análise de Calorimetría Diferencial de Varrido (DSC) para corroborar a formacáo do complexo. Resultados. Os resultados mostram que a máxima absorbencia da curcumina se apresenta a urna longitude de onda de 425nm em presença de urna solucáo de etanol: agua ao 20% (v/v). De outro lado, a β-ciclodextrina (β-CD) reage com curcumina para formar um complexo anftriáo-hóspede 1:1 com urna constante de formacáo aparente de 5,00x102 mol/L. A γ-ciclodextrina (γ-CD) reage com curcumina para formar um complexo anftriáo-hóspede 1:1 com urna constante de formacáo aparente de 7,51x103 mol/L. Por sua vez, a obtencáo do complexo se apresenta em nível de laboratório com melhores resultados utilizando o método de co-precipitacáo, com ren-dimentos de 85% para a γ-CD, e 69% para β-CD, indicando que a ciclodextrina mais apropriada é a y CD. Conclusões. Encontrou-se que a curcumina forma complexos de inclusáo com βCD e γCD em solucáo. A solubilidade da curcumina em presença de βCD e γCD, mostrou ser mais efetiva na segunda. A associacáo de ambas ciclodextrinas é de 1:1, indicando que é mais forte com yCD, devido a sua estrutura (8 unidades de glucosa). A análise de DSC mostra que os complexos de inclusáo por mistura física e co-precipitacáo se formaram. No entanto, para efeitos de solubilidade, é mais recomendável utilizar o método de co-precipitacáo, dado que há urna pré-hidratacáo.
Palavras importantes: curcumina, ciclodextrina, complexo, constante de formacáo, solubilidade, absorbencia, solventes.
Introducción
La curcumina es el principal colorante presente en el rizoma de la planta Cúrcuma longa, posee una masa molar de 368,4 y está acompañado por pequeñas cantidades de otros compuestos, todos insolubles en agua. Este tubérculo se utiliza en condimentos, y es el principal ingrediente del reconocido curry en polvo1. Se ha reportado que la curcumina posee propiedades antinfamatorias, antiartríticas, hepatoprotectivas, antimicrobianas, antitumorales y antivirales2.
Este tubérculo se cultiva en países tropicales incluyendo la India, China, Pakistán, Haití y Perú, usualmente se comercializa como raíz seca que puede ser transformada en polvo insoluble en agua; su color se debe, en parte, a la dispersión en los alimentos o por la disolución en aceites vegetales1.
En forma pura, la curcumina no es ideal para uso directo en la industria de alimentos, principalmente por ser insoluble en agua y poco soluble en otros solventes. En varios países se emplea la curcumina disuelta con una mezcla de solventes de grado alimentario que permite su emulsificación; de esta forma el producto posee cerca del 4-10% de curcumina, miscible en agua. El polisorbato 80 (Tween 80) favorece su emulsificación y es un carrier ideal. Mediante este, la curcumina presenta una coloración amarilla brillante en pequeñas dosis; se sabe además que a niveles superiores a 20 ppm, el color se satura; con base en ello se puede determinar la dosis mínima para que se alcance el color deseado. La coloración que presenta la curcumina es muy parecida a la que se obtiene por el uso del colorante artificial amarillo tartrazina3.
Otras formas de comercialización de la curcumina son conocidas también, e incluyen la suspensión de la curcumina en aceite vegetal y la dispersión de este colorante en almidón. Las diversas aplicaciones de la curcumina en el sector alimentario se presentan en los sectores: lácteo, panadería, dulces, mezclas secas y productos congelados4.
Por otro lado, numerosos reportes han mostrado que la ciclodextrina (CD) puede ser usada como agente solubilizante para aceites volátiles hidrofóbicos5 6. Las ciclodextrinas son oligosacáridos de D-glucopiranos unidos mediante enlaces α-1,4 formando un anillo. Dichos anillos son antipáticos, con una cavidad interior hidrofóbica, y su superficie exterior hidrofílica. La cavidad interna hidrófoba proporciona la capacidad de formar complejos de inclusión con una variedad de huéspedes (moléculas hidrófobas) (p. e., compuestos aromáticos, alcoholes, halogenuros, ácidos grasos, ésteres).
Las CD más comunes son α, β y γCD formadas por seis, siete y ocho unidades de glucosa, respectivamente. Entre las ciclodextrinas, la más utilizada es la βCD, dado que su tamaño de cavidad es adecuado para recibir huéspedes con masas moleculares entre 200 y 800, y también debido a su precio razonable y disponibilidad6.
Estas características sugieren que la CD puede ser usada para aumentar la solubilidad en agua de la curcumina, hidrofóbica e insoluble en agua; adicionalmente, la microencapsulación protege la curcumina de cambios destructivos, y le permite un flujo libre en polvo7.
En este estudio, la βCD y γCD fueron evaluadas como agentes encapsulantes para la curcumina. El método de coprecipitación es más usado en el laboratorio para producir un preciso complejo de inclusión, mientras que el método de mezcla física es más aplicable para producción a gran escala. Por lo tanto, el objetivo del presente estudio fue seleccionar el solvente y su concentración más apropiada (etanol, acetona, hexano, propilenglicol, lactato de etilo y etilenglicol), el tipo de ciclodextrina (βCD o γCD), y el método de encapsulación (mezcla física o coprecipitación), a fin de determinar el mejor procedimiento para obtener el complejo sólido, en polvo. Los complejos formados fueron caracterizados usando calorimetría de barrido diferencial (DSC).
Materiales y métodos
Materiales
El colorante utilizado fue el color amarillo natural, comercializado por la empresa TECNAS S. A., que contiene un 8% de curcumina; las ciclodextrinas usadas fueron βCD (99%, de origen chino, comercializado por Suntram Industrial Group) y γCD (98,9%, de origen chino, comercializado por Eastar Holding Group); los solventes etanol (99,9%), acetona (99,9%), hexano (96%), propilenglicol (99,9%), lactato de etilo (99,8%) y etilenglicol (99,5%) provinieron de la marca Merck.
Efecto de la concentración y tipo de solvente sobre la absorción de la curcumina
Para la determinación del efecto de la concentración y tipo de solvente sobre la absorción de la curcumina, se utilizaron 7 solventes: etanol, acetona, hexano, lactato de etilo, etilenglicol, propilenglicol y agua. Se prepararon soluciones acuosas al 20%, 50%, 80%, 90% y de cada pureza para cada uno de los solventes mencionados. Se llevó la concentración final del colorante curcumina a 0.005%, dado que concentraciones por encima de esta saturaban y no permitían la lectura espectrofotométrica. Se hizo un barrido espectrofotométrico a distintas longitudes de onda (380 nm-700 nm), con el fin de determinar la zona de máxima absorbancia para el colorante curcumina. Cada lectura espectrofotométrica se realizó por triplicado, usando muestras independientes.
Los valores de las lecturas (promedio de las tres lecturas) para cada solvente y su respectiva solución se graficaron (Absorbancia frente a Longitud de onda) y a partir de allí se determinó la zona de máxima absorbancia para cada solución. Luego se compararon las gráficas para cada solución y se determinó la concentración de solvente que presentaba la mayor absorbancia del colorante.
Determinación de la constante de formación aparente
Para determinar la relación estequiométrica se siguió el método modificado mostrado por Abdul et al.8, donde se prepararon mezclas conteniendo curcumina y ciclodextrina. Para cada mezcla se mantuvo la concentración final de curcumina de 0,001M (hallada experimentalmente como la concentración a la cual satura el colorante en una solución ETOH:H20), a través de una solución madre de curcumina 0,005M, y se agregaron cantidades de solución madre de ciclodextrina (0,02M) para proveer concentraciones en el rango de 0 mM - 10mM. Se enrasó a un volumen de 10 mL con la adición de una solución ETOH:H20 (20:80). Se utilizaron frascos ámbar de 20 mL de volumen, para proteger las mezclas de la luz, dado que es un factor que afecta la estabilidad de la curcumina9. A cada frasco se le introdujo un agitador magnético y fueron luego sumergidos en una baño de agua a 50°C, y agitados en una plancha de calentamiento. Transcurridas 48 horas, se filtraron dichas mezclas, y el sobrenadante resultante de cada mezcla se preparó para su lectura espectrofotométrica a 425 nm.
Para determinar la constante de formación aparente se utilizó el modelo matemático propuesto por Benesi-Hildebrand10.
Obtención del complejo de inclusión
Los complejos de inclusión curcumina-βCD y curcumina-γCD fueron obtenidos utilizando los métodos de mezcla física y coprecipitación. El método de mezcla física fue reportado por Espinoza & Hernández11. El método de coprecipitación fue descrito por Waleczek et al6.
Caracterización de complejos
Calorimetría diferencial de barrido (DSC) Se utilizó un equipo DSC Q200 V24.2 Build 107. InstrSerial 0200-1763, en el rango de temperatura 20°C-400°C, temperatura del sistema 25°C, gas de purga NL, y una rampa de temperatura de 10°C/min hasta 300°C, con un portamuestras de aluminio de 5mmx3mm.
Resultados y discusión
Efecto de la concentración y tipo de solvente sobre la absorción de la curcumina
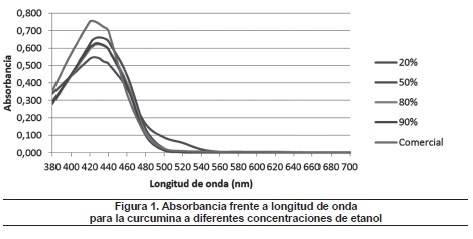
La figura 1 muestra la absorbancia frente a la longitud de onda para la curcumina, en presencia de diferentes concentraciones de etanol.
Se observa en la figura 1 un desplazamiento batocrómico con efecto hipercrómico, al aumentar la concentración de solvente, hasta una determinada concentración (50%), donde empieza a verse un desplazamiento hipsocrómico con efecto hipocrómico, hasta valores de concentración del 90%, y finalmente vuelve a presentarse desplazamiento batocrómico con efecto hipercrómico en concentraciones cercanas al 100% (solvente en su forma comercial).
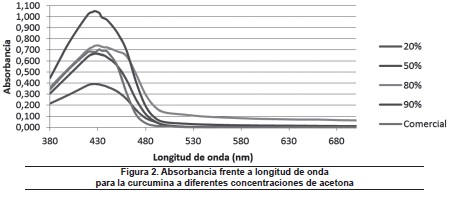
En la figura 2 se evidencia una tendencia leve de desplazamiento batocrómico con efecto hipercrómico, con el aumento de la concentración de solvente, hasta concentraciones cercanas al 90%, a partir del cual se presenta desplazamiento hipsocrómico con efecto hipocrómico, hasta valores de concentraciones cercanas al 100% (solvente en su forma comercial).
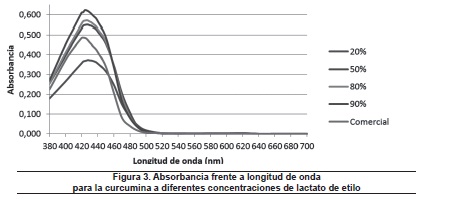
En la figura 3 se observa un desplazamiento batocrómico con efecto hipercrómico, con el aumento de la concentración de solvente, hasta concentraciones cercanas al 90%, a partir del cual se presenta desplazamiento hipsocrómico con efecto hipocrómico, hasta valores de concentraciones cercanas al 100% (solvente en su forma comercial).
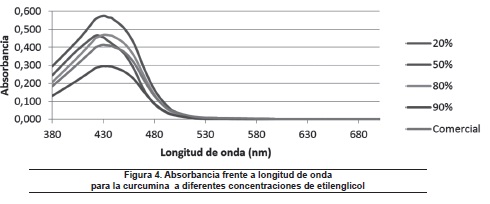
Por su lado, en la figura 4 se observa una tendencia leve de desplazamiento batocrómico con efecto hipercrómico, con el aumento de la concentración de solvente, hasta concentraciones cercanas al 50%, a partir del cual se presenta desplazamiento hipsocrómico con efecto hipocrómico, hasta valores de concentraciones cercanas al 100% (solvente en su forma comercial).
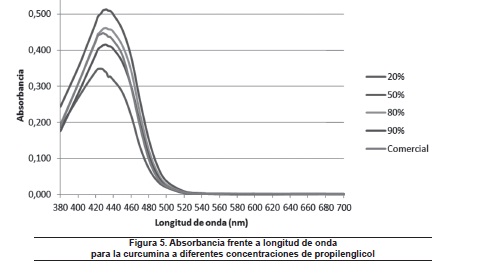
Similarmente que en el caso del etilenglicol, en la figura 5 se evidencia una tendencia leve de desplazamiento batocrómico con efecto hipercrómico, con el aumento de la concentración de solvente, hasta concentraciones cercanas al 90%, a partir del cual se presenta desplazamiento hipsocrómico con efecto hipocrómico, hasta valores de concentraciones cercanas al 100% (solvente en su forma comercial).
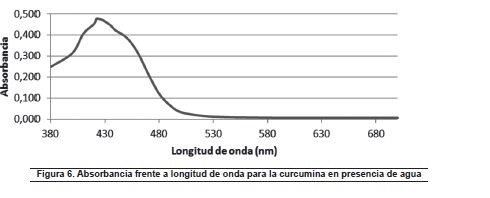
En la figura 6, se observa que la longitud de onda a la cual se presenta la mayor absorbancia de la curcumina es 430 nm.
En general, se muestra una tendencia al desplazamiento batocrómico con efecto hipercró-mico, con el aumento de la concentración del solvente, hasta una determinada concentración, a partir de la cual se empieza a observar un efecto hipocrómico. Los valores de absorbancia máxima se presentaron en una rango de 420-430 nm para todos los solventes orgánicos, lo cual es coherente con lo reportado por otros autores12.
Determinación de la constante de formación parente
El diagrama de solubilidad de fases para la curcumina en presencia de ciclodextrinas se obtuvo utilizando el modelo matemático propuesto por Benesi – Hildebrand10 mediante la ecuación1:
Donde:
A0: absorbancia de la muestra en ausencia de ciclodextrina
A: absorbancia de la muestra (medida luego de 48 horas)
A∞. absorbancia de la muestra en el equilibrio
[CD]: concentración de ciclodextrina (βCD y γCD)
K1: constante de formación
Una representación de 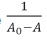 contra
contra 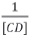 debería darnos una línea recta en el caso que la estequiometría fuera 1:1.
debería darnos una línea recta en el caso que la estequiometría fuera 1:1.
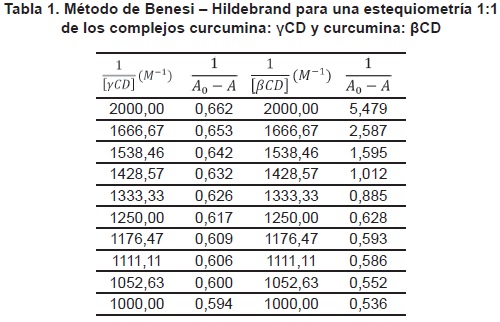
En la tabla 1 se resumen los valores calculados de 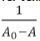 y
y 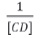 de.
de.
En la figure 7 se muestra una representación gráfica de 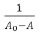 contra
contra 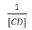 para los complejos curcumina: γCD, y curcumina: βCD. Para el caso de la βCD, se grafican solo 5 puntos, pues son estos los que muestran una tendencia lineal. En los demás puntos el comportamiento es de saturación, presentándose un punto de máximo.
para los complejos curcumina: γCD, y curcumina: βCD. Para el caso de la βCD, se grafican solo 5 puntos, pues son estos los que muestran una tendencia lineal. En los demás puntos el comportamiento es de saturación, presentándose un punto de máximo.
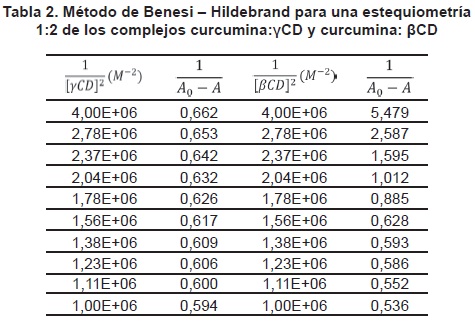
Si en vez de asumir una estequiometría 1:1, se supone una estequiometría 1:2, la representación de 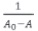 contra
contra 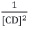 debería darnos una línea recta.
debería darnos una línea recta.
Los valores 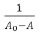 de contra
de contra 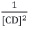 calculados a partir de los datos experimentales obtenidos, están recogidos en la tabla 2 y representados en la figura 2.
calculados a partir de los datos experimentales obtenidos, están recogidos en la tabla 2 y representados en la figura 2.
La figure 8 muestra una representación gráfica de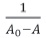 contra
contra 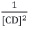 para los complejos curcumina: γCD y curcumina: βCD.
para los complejos curcumina: γCD y curcumina: βCD.
Las figure 7 y figure 8 nos muestran que, aunque en ambos casos los datos se ajustan a una línea recta, la figure 7 muestra un r2 para ambas ciclodextrinas, superior que para el caso de la figure 8, donde se muestra una estequiometría 1:2. Por lo tanto, se determina que la β-ciclodextrina (β-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1, y la y-ciclodextrina (y-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1.
Mediante la representación de los datos experimentales según el método de Benesi-Hildebrand, es posible, asimismo, efectuar el cálculo de la constante de formación del complejo en estudio, una vez determinada la estequiometría.
En este caso, en que la estequiometría es 1:1, a partir de la representación gráfica de 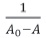 frente a
frente a 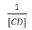 , y tenienedo en cuenta la ecuación (1), la ordenada en el origen nos daría el valor de
, y tenienedo en cuenta la ecuación (1), la ordenada en el origen nos daría el valor de 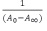 y K podría ser estimada como la ordenada en el origen dividida por la pendiente de la recta.
y K podría ser estimada como la ordenada en el origen dividida por la pendiente de la recta.
En la tabla 3 se recogen las ecuaciones de las rectas obtenidas al suponer estequiometría 1:1.
Los valores obtenidos por este método se resumen en la tabla 4.
De lo anterior se concluye que la β-ciclodextrina (β-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1 con una constante de formación aparente de 5,00x102 mol/L, lo cual está de acuerdo con Swaroop et al. (2007), y la γ-ciclodextrina (γ-CD) reacciona con curcumina para formar un complejo anfitrión-huésped 1:1 con una constante de formación aparente de 7,51x103 mol/L. De los valores anteriores es claro que la vCD presenta una interacción más fuerte, debido a su estructura (compuesta por 8 unidades de glucosa), lo cual le permite formar más enlaces con la curcumina, y quedar encapsulada, mayor cantidad.
Obtención y caracterización de complejos de inclusión
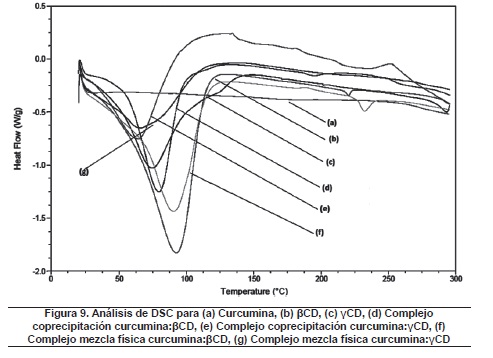
DSC es una herramienta muy útil para recoger información cualitativa sobre el estado físicoquímico de huéspedes en un complejo en el que las interacciones anfitrión-huésped tienen lugar13. La formación del complejo con una molécula huésped puede resultar en la completa desaparición del pico endotérmico o desplazamiento de pico a las otras temperaturas que indican los cambios en la red cristalina, punto de fusión, puntos de ebullición o de sublimación. Los termogramas para la curcumina, βCD, γCD, mezcla física y complejos por coprecipitación se muestran en las figura 9.
La figura 9(a) muestra el termograma diferencial para la curcumina, la cual no presenta transiciones significativas a lo largo del ciclo térmico al que fue sometida.
El termograma diferencial para la βCD (Figura 9(b)) presenta una transición endotérmica inicial a una temperatura de 92.43°C, con una entalpia asociada de 453.3 J/g, y una transición endotérmica a una temperatura de 220.45°C con una entalpia asociada de 1.574 J/g, ambos a causa de la pérdida de agua de la ciclodextrina en su red cristalina.
Por su parte, el termograma diferencial para la γCD (figura 9(c)) muestra una transición endotérmica inicial a una temperatura de 74.33°C, con una entalpia asociada de 290.9 J/g, y de gran amplitud, a causa de la pérdida de agua; por último, se presenta una posible transición endotérmica a una temperatura de 293.55°C.
En la figura 9(d) se muestra el termograma para el complejo curcumina: βCD por el método de coprecipitación la cual presenta una transición endotérmica inicial a una temperatura de 79.78°C, con una entalpia asociada de 195.0 J/g, y, posteriormente, se presenta transición endotérmica a una temperatura de 195.36 °C con una entalpia asociada de 2.697 J/g, indicando el desplazamiento de los picos de transición, con respecto al termograma mostrado en la figura 9(b) para la βCD, y por consiguiente la formación del complejo en mención.
En la figura 9(e) se muestra el termograma obtenido para el complejo curcumina: γCD por el método de coprecipitación, con una transición endotérmica a una temperatura de 65.11°C, con una entalpia asociada de 166.0 J/g, indicando nuevamente un desplazamiento del pico endotérmico a 74.33°C, y la completa desaparición del pico endotérmico a la temperatura de 293.55°C, con la cual se concluye que se presentó la formación de dicho complejo.
El termograma para el complejo curcumina: βCD por el método de mezcla física aparece en la figura 9(f) 14, mostrando el leve desplazamiento de los picos endotérmicos, y la aparición de un pico exotérmico, a causa de la degradación y cambio en la estructura de la ciclodextrina, lo cual demuestra la formación del complejo mencionado.
Finalmente, la figura 9(g) muestra el termograma diferencial generado a partir de la formación del complejo curcumina: γCD, indicando un leve desplazamiento del pico endotérmico para la γCD y la aparición de un pico de fusión suave, a causa del cambio en la estructura de la γCD, y la pérdida de agua de la red cristalina, lo cual permite concluir que se presentó formación del complejo, lo cual está de acuerdo con Krishna et al (2012). Es posible que el método de coprecipitación tenga mayor capacidad de encapsulación, lo cual se debe corroborar con un estudio cuantitativo.
Conclusiones
Se encontró que la curcumina forma complejos de inclusión con βCD y γCD en solución. La solubilidad de la curcumina, en presencia de βCD y γCD, ha mostrado ser más efectiva en la segunda. La asociación de ambas ciclodex-trinas es de 1:1, indicando que es más fuerte con vCD, debido a su estructura (8 unidades de glucosa). Los resultados de DSC muestran que los complejos de inclusión por mezcla física y coprecipitación se formaron. Sin embargo, para efectos de solubilidad, es más recomendable utilizar el método de coprecipitación, dado que hay una prehidratación.
Referencias bibliográficas
1. JASIM, S. & ALI, F. A novel rapid method forthe spectrofuorometric determination of curcumin¡n curcumin spices and flavors. Eji: Microchem-¡stry Journal. 1992. Vol. 46, p. 209-214 [ Links ]
2. RAINA, V. K.; SRIVASTAVA, S. K. & SYAMSUN-DAR, K. V. Rhizome and leaf oil composition of Cúrcuma longa from the lower Himalayan región of Northern India. En Journal of Essential Oil Research. 2005. Vol. 17, p. 556-559. [ Links ]
3. TONNESEN, H. H. Studies on curcumin and curcuminoids XXVIII.Solubility, chemical and photochemical stability of curcumin in surfactants solutions. En: Pharmazie. 2002. Vol. 27, p. 820-824. [ Links ]
4. NAVAS-DÍAZ, A. & RAMOS-PEINADO, M. C.Fluorometric determination of curcumin in yogurt and mustard. En: Journal of Agricultura I and Food Chemistry. 1992. Vol. 4, p. 56-59. [ Links ]
5. BHANDARI, B. R.; D'ARCY, B. R., & PADUKKA, I. Encapsulation of lemon oil by paste method using b-cyclodextrin: Encapsulation effciency and profle of oil volátiles. En: Journal of Agricultural Food Chemistry. 1999. Vol. 47, p. 5194-5197. [ Links ]
6. WALECZEK, K. J.; et al. Phase solubility study of puré (-)-a-bisabolol and camomile essential oil with bcyclodextrin. En: European Journal of Pharmaceutics and Biopharmaceutics. 2003. Vol. 55, p. 247-251. [ Links ]
7. BHOSALE, R., & SINGHAL, R. Process optimizaron for the synthesis of octenylsuccinyl derivative of waxy corn and amaranth starches. En: Carbohydrate Polymers. 2006. Vol. 66, p. 521-527. [ Links ]
8. Abdul, Z.; et al. Characterization of cyclodextrin complexes with turmeric oleoresin. Food Chemistry. 2009. Vol. 114, p. 459-465. [ Links ]
9. DUCHÉNE, D.; DEBRUERES, B. & BRETILLON, A., Les cyclodextrinesnature, origine et intérét en pharmaciegalénique. En Labo-Pharma-Probl. Tech. 1984. Vol. 32, p. 843-850. [ Links ]
10. BENESI, H. A., HILDEBRAND, J. A. The BenesiHildebrand Method for Determination of Kffor DA association and EValues for DA CT absorption. Eji: Journal American Chemical Society 1949. Vol. 71, p. 2703 [ Links ]
11. ESPINOZA, B. F, HERNÁNDEZ, G. Formación, evaluación y caracterización del complejo de inclusión piroxicam/hidroxipropil-b-ciclodextrina. En: Revista Mexicana de Ciencias Farmacéuticas. 2005. Vol. 36, N° 1, p. 18-24. [ Links ]
12. JAYAPRAKASHA, G. K.; et al. Chemistry and biological activities of C. longa. Eji: Trendsin Food Science & Technology 2005. Vol. 16, p. 533-548. [ Links ]
13. YADAV, V. R.; et al. AAPS Pharmacy Science Technology, 2009. Vol. 10, p. 752-762 [ Links ]