Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.10 no.2 Caldas July/Dec. 2013
El virus de la influenza aviar H7N9, una nueva variante que afecta seres humanos
The avian influenza virus H7N9, a new strain that affects human beings
O vírus da influenza aviária H7N9, uma nova variante que afeta seres humanos
María Paula Ortiz R.*, Luis Carlos Villamil Jiménez**
*Asistente de Investigación, Grupo de Epidemiologia y Salud Pública. Facultad de Ciencias Agropecuarias, Programa de Medicina Veterinaria Universidad de La Salle, Bogotá.
**Médico Veterinario MSc, PhD, Profesor titular. Director Grupo de Epidemiologia y Salud Pública. Facultad de Ciencias Agropecuarias, Programa de Medicina Veterinaria Universidad de La Salle, Bogotá.
Correspondencia: María Paula Ortiz, e-mail: mortiz10@unisalle.edu.co.
Artículo recibido: 11/06/2013; Artículo aprobado: 01/11/2013
Resumen
Los virus de influenza aviar interactúan desde tiempos milenarios entre poblaciones humanas y animales, por lo cual estos agentes constituyen un grupo de importancia para la salud pública en el ámbito mundial, dada su capacidad para efectuar rearreglos genéticos que permiten que los virus realicen saltos de especie en ambientes que tienen que ver con las megaciudades, el aumento de fronteras agrícolas y presiones sobre los sistemas de producción animal. En febrero del año 2013 se inició una epidemia de enfermedad respiratoria en humanos provenientes de las ciudades de Shanghái y Anhui en la China; después de realizar las pruebas diagnósticas se determinó que se trataba de un rearreglo genético de Influenza A (H7N9). El origen de este virus involucra aves silvestres y domésticas. Varios estudios han postulado que el lugar más posible donde ocurrió la transmisión pudo estar relacionado con ambientes acuáticos, que facilitaron el encuentro de aves migratorias con aves domésticas que se comercializan en los mercados de las ciudades. Se presentan algunos aspectos relacionados con el origen de la enfermedad, su difusión y algunos interrogantes sobre el comportamiento del agente que quedan pendientes como consecuencia de la emergencia de H7N9.
Palabras clave: influenza, epidemiologia, H7N9, mercados.
Abstract
The avian influenza viruses have been interacting for centuries with human and animal populations, thus being an important group for public health worldwide because of their capacity to perform genetic prearrangements that allow those viruses to pass from one species to another in environments related to mega cities, the increase of the agricultural frontiers and pressures on animal production systems. In February 2013 an epidemic of respiratory disease began in humans from Shanghai and Anhui, in China. After performing diagnosis tests it was determined that it was a genetic rearrangement of Influenza A (H7N9). The origin of this virus involves wild and domestic birds. Several studies have postulated that the most plausible place in which the transmission occurred could have been related to aquatic environments that facilitated the encounter between wild and domestic birds that are commercialized in city markets. Some aspects related to the origin of the disease and its dissemination are introduced, plus some questions about the behavior of the agent that are yet to be known as a consequence of the H7N9 emergency.
Key words: influenza, epidemiology, H7N9, markets.
Resumo
Os vírus de influenza aviária interatuam desde tempos milenares entre populações humanas e animais, pelo qual estes agentes constituem um grupo de importância para a saúde pública no âmbito mundial. Dada sua capacidade para efetuar recombinações genéticas que permitem que os vírus realizem saltos de espécie em ambientes que têm que ver com as megacidades, o aumento de fronteiras agrícolas e pressões sobre os sistemas de produção animal. Em fevereiro do ano 2013 se iniciou uma epidemia de doença respiratória em humanos provenientes da cidade de Shanghái e Anhui na China; depois de realizar as provas diagnósticas se determino que se tratava de uma recombinação genética de Influenza A (H7N9). A origem deste vírus envolve aves silvestres e domésticas. Vários estudos postularam que o lugar mais possível onde ocorreu a transmissão pôde estar relacionado com ambientes aquáticos, que facilitaram o encontro de aves migratórias com aves domésticas que se comercializam nos mercados das cidades se apresentam alguns aspectos relacionados com a origem da doença, sua difusão e alguns interrogantes sobre o comportamento do agente que ficam pendentes como consequência da emergência de H7N9.
Palavras importantes: influenza, epidemiologia, H7N9, mercados.
Introducción
La salud de las poblaciones (humanas y animales) tiene que ver con una sensible interacción entre tres factores: el ambiente (social, geográfico, económico, político), los agentes patógenos, y las poblaciones (humanas y animales), lo cual determina el estado de salud y enfermedad; algunas de las enfermedades consideradas como emergentes, que aparecieron durante los últimos años, tuvieron su origen en la producción animal por desequilibrios en dichos factores. El 31 de marzo de 2013, el Gobierno de China, notificó la presencia en la ciudad de Shanghái y en Anhui, de un nuevo virus de influenza aviar que afectó a seres humanos desde el mes de febrero, clasificado como H7N9. En pocas semanas se diseminó en la población humana por el oriente y el centro del país, cruzó la frontera y apareció en Taiwán (Rongbao et al., 2013).
Este virus posee características que le permitieron de manera más eficaz colonizar las células humanas, logrando así causar enfermedad y muerte. En el presente documento se discuten aspectos relacionados con el virus, señalando los eventos relacionados con la aparición de la enfermedad y el desarrollo de la misma desde el mes de febrero hasta junio de 2013.
Virus de la influenza
Desde tiempos milenarios los agentes virales han acompañado a los humanos y a los animales en una exitosa relación en la que los agentes microscópicos desarrollaron mecanismos de adaptación, saltos de especie, evolucionando al lado del crecimiento demográfico, el aumento de las fronteras agrícolas, las megaciudades, y los cambios y adaptaciones de los sistemas de producción animal y entre estos se cuenta con los virus de la Influenza.
Los virus de Influenza pertenecen a la familia Orthomyxoviridae; dicha familia posee miembros que afectan mamíferos y aves. Los hay propios de humanos (gripe estacional), propios de las aves, o de otras especies (porcinos, entre otros.). Estos virus tienen una tendencia a variar en sus características genéticas, para contar con más capacidad de infectar y a veces con la posibilidad de adquirir los medios para invadir con éxito a especies para las cuales no estaban adaptados, lo que se denomina salto de especie. De acuerdo con Vera, Villamil y Rodríguez (2006), los desarrollos actuales de la biología molecular se han podido aplicar a muestras preservadas de pacientes afectados por la influenza durante pandemias en el siglo pasado, permitiendo identificar las variantes involucradas y conocer con precisión las interacciones y complejas relaciones entre especies y ambiente dentro de la epidemiología de la enfermedad (Vera et al., 2006)
En las pandemias del siglo XX la especie animal más afectada y también una de las directamente involucradas fue la aviar. La capacidad del virus de la influenza para generar cambios y adaptaciones se debe a su alta variabilidad genética. Un virus H1N1 con características aviares y capacidad de transmitirse entre personas fue el causante de la gripe española, pandemia que afectó al mundo en 1918, se estima que causó más de 40 millones de decesos en la población humana, cifra que supera a la de los desaparecidos durante los conflictos bélicos del pasado, aspecto olvidado o tal vez poco analizado, pues no son muchos los que han tenido noticia de la pandemia, comparados con quienes tienen conciencia sobre las guerras del siglo XX (Vera et al., 2006).
Durante 1957, un virus, H2N2, originó otra pandemia; en 1968, apareció el virus H3N2 y el H1N1 reapareció en 1997, ausente desde los años cincuenta, cuando se introdujo como consecuencia del empleo de un virus de laboratorio como cepa vacunal. El virus H5N1 emergió hacia fines del siglo XX, afectando seriamente a las aves y en menor proporción a los humanos. El primer episodio ocurrió en Hong Kong en 1997, donde murieron 6 personas, y millones de aves se sacrificaron para impedir el progreso de la infección. En 2003, un segundo brote se originó en la región sur oriental de Asia, afectó más de 50 países, con más de 300.000 personas infectadas y con una letalidad global del 60 %. Se realizó el sacrificio sanitario de más de 250 millones de aves. La disminución de la demanda de productos de la industria aviar, incluso en países que no sufrieron la enfermedad, ocasionó pérdidas económicas de magnitud (Vera et al., 2006).
En el 2003 se reportó en Holanda el virus H7N7, que fue catalogado como altamente patogénico. Este virus se transmitió de persona a persona, se reportó una solo muerte, y causó 89 casos de infección con signos leves de influenza y conjuntivitis. Algunos autores reportaron estudios filogénicos señalando que el serotipo (H7) había circulado durante algún tiempo en aves de China y Corea. Sin embargo la cepa H7N9 es nueva y se desconoce su capacidad de transmisión, tanto de humano-humano como de ave-ave; no obstante, los aislamientos realizados durante el brote pusieron en evidencia la presencia del virus en aves asintomáticas en mercados de animales vivos en China (Wu et al., 2013).
Lo anterior demuestra cómo la influenza aviar continúa su actividad, con la emergencia de la nueva variante H7N9, que se presenta con características de interés desde la epidemiología y la salud pública, dadas sus características de baja patogenicidad en aves, y alta en mamíferos en este caso humanos, lo que dificulta la vigilancia de la enfermedad animal y convierte a las personas en indicadores de la actividad viral de las aves, con interrogantes sobre su potencial pandémico actual o futuro, dependiente de su capacidad de pasar de humano a humano (Shi, et al., 2013; Uyeki et al., 2013)
La aparición del virus de Influenza A (H7N9)
Durante el mes de febrero de 2013, se presentaron en las ciudades de Shanghái y Anhui –China–, casos clínicos de enfermedad respiratoria, que se incrementaron a partir de la segunda semana de marzo. En vista de los protocolos establecidos, se tomaron muestras del tracto respiratorio, que se remitieron al Centro Nacional Chino de Influenza (CNIC). Las muestras se analizaron, utilizando RT–PCR en tiempo real y aislamiento viral en huevos embrionados de 9-11 días de edad, libres de patógenos; se efectuaron análisis para descartar diferentes virus del tracto respiratorio: H1, H3, H5N1, SARS y Coronavirus (Rongbao et al, 2013).
Las muestras resultaron positivas por RT-PCR para un virus RNA de Influenza A. Después de determinar que se trataba de este tipo de virus se prosiguió a realizar RT-PRC. para caracterizar los aislamientos de acuerdo con el gen que codifica para hemaglutinina (HA) y neuramidasa (NA). Los primeros serotipos que se evaluaron fueron H1, H3 y H5; dichas pruebas resultaron negativas. Se utilizó un KIT (H7 rRT-PCR) para detectar un virus H7 aislado en Eurasia. El cebador utilizado para la detección de H7 fue proporcionado por el Centro de Control de enfermedades (CDC) de los Estados Unidos, a todos los laboratorios autorizados para realizar diagnósticos y vigilancia en China. Los genes implicados en la hemaglutinación tuvieron un 95 % de similitud con H7N3; dicho virus fue aislado en el 2011 en patos que se comercializan en los mercados de aves vivas de China. Posteriormente, se evaluó el gen para NA que demostró un 96 % de similitud con N9, virus que afecta patos domésticos de China y Corea. Se confirmó el diagnóstico de influenza aviar A (H7N9) en los pacientes de Anhui y Shanghái reportados con enfermedad, quienes fallecieron a los pocos días (Rongbao et al; 2013; Wu et al., 2013).
En síntesis, el virus corresponde a una reagrupación de genes procedentes de tres subtipos de virus de origen aviar. La secuencia génica que codifica las proteínas internas muestra que es altamente similar al virus de la influenza aviar A (H9N2), endémico en aves comerciales y silvestres del continente asiático. El gen que codifica la neuramidasa es similar al virus H7N9 que circuló en aves silvestres de Corea del Sur en el 2011, en Jiangsu en el 2010 y en República Checa en el 2005. El gen que codifica la hemaglutinina es similar al de los virus del grupo H7 que circulan en la región euroasiática, y similar al Ha/duck/Zhejiang/12/2011 (McKay, 2013).
Las investigaciones preliminares indican que una de las mutaciones (figura 1) que se ha producido en el gen que codifica la proteína HA permite que el virus reconozca los receptores α- 2,6 presentes en el tracto respiratorio superior del ser humano. También se observó una sustitución en el gen PB2; su presencia indica un aumento de la replicación del virus en los mamíferos (Rongbao et al., 2013).
La difusión de la enfermedad
Los casos en humanos siguieron en aumento. Para los primeros días de abril (un mes después de la detección del virus en humanos), se notificaron ante la OMS, once casos confirmados, y cinco muertes por H7N9; este reporte reconoció la emergencia de un nuevo virus en China. La situación era de alerta sanitaria. El H7N9 se extendió por la región oriental del país. Los primeros casos de la enfermedad se presentaron en Shanghái, Anhui, Zhejiang y Jiangsu, en el orden respectivo.
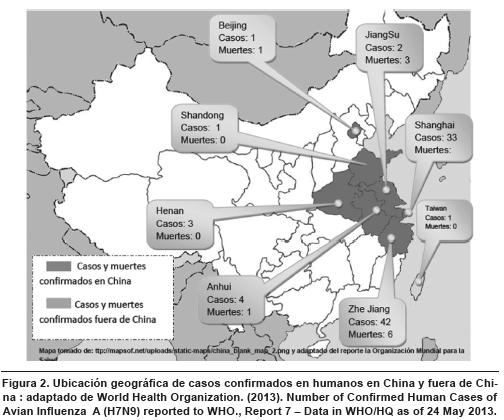
El brote de Influenza por H7N9 empezó a finales de febrero. Durante los meses de abril se reportó la mayoría de casos; en mayo la OMS (Organización Mundial para La Salud) notifico tres casos adicionales; el último caso corresponde a un residente de la ciudad de Zhe Jiang, admitida en el hospital el 8 de octubre de 2013. El área que mostró la mayor incidencia fue Zhejiang (47 casos y 6 muertos) y Shanghái (34 casos, 12 muertos). El mes de abril mostró la mayor cantidad de casos confirmados y de muertes; fue el período de difusión del virus hacia otras regiones, ya que Beijing, Henan, Hunan, Shandong y Fujian reportaron la presencia del agente (figura 2).
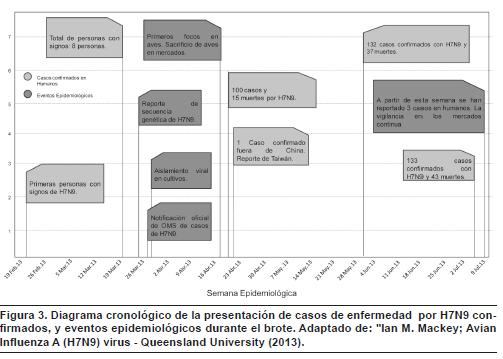
El virus se notificó el 24 de abril fuera del continente, en un residente de Taiwán que había viajado a China continental. En total se notificaron 136 enfermos y 45 muertes, para una tasa de letalidad de 33 % (figura 3). De los casos confirmados, la mayoría (71 %) fueron hombres; 66 enfermos reconocieron haber tenido contacto con pollos y patos; de los demás casos no hay información disponible.
El rango de edad en el cual se presentaron más casos fue de los 50 a 70 años, en hombres de los 65 en adelante y en mujeres de los 25 -54 años. La enfermedad se reportó más en hombres; lo cual puede ser atribuido a factores ocupacionales. No se reportaron casos en escuelas, lo cual indica una baja incidencia de H7N9 en niños, a diferencia de H5N1 el cual tiene importancia en poblaciones infantiles (Butler, 2013).
La fuente de infección
Después del primer reporte en humanos (Shi et al., 2013) del Instituto Chino de Investigación Veterinaria, tomaron muestras de animales durante el brote del presente año para analizarlas en el laboratorio de Influenza Animal de la Academia China de Ciencias Agrícolas. Una paloma proveniente del mercado de Shanghái se confirmó como positiva al virus H7N9, y fue la primera evidencia de una posible fuente de infección; posteriormente el virus se aisló de pollos sanos, lo que desencadenó el sacrificio inicial de 110.000 aves. Durante el 30 y 31 de marzo 2013 se tomaron 280 muestras de tres mercados de aves de Shanghái (cloacales, de tráquea, agua bebida y suelo). Adicionalmente, se tomaron 690 muestras de aves en galpones de la provincia de Shanghái y Anhui. Estos procedimientos se llevaron a cabo en laboratorios con nivel de bioseguridad 3, autorizados por el Ministerio de Agricultura de China. De las muestras analizadas solo se aisló el virus en aves provenientes de los mercados de animales vivos; la presencia de diferentes especies de aves provenientes de diversos lugares en los mercados de aves vivas constituye el escenario ideal donde ocurren los procesos relacionado con rearreglos genéticos del virus de influenza (Shi et al., 2013; Wu, et al., 2013).
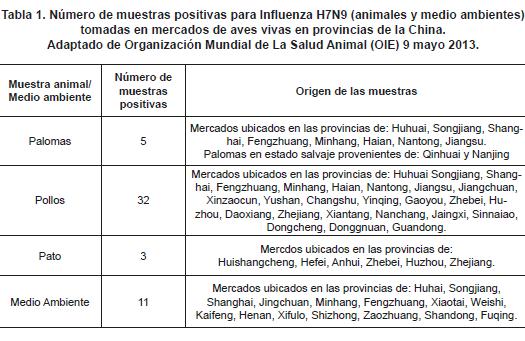
También se tomaron muestras de más de 68000 aves provenientes de mercados de aves vivas, determinando la circulación del virus en aves y en el medio ambiente en dichos merca dos. El día 9 de mayo de 2013, la Organización Mundial para la Sanidad Animal (OIE) reportó las muestras positivas y los mercados de los cuales provenía cada una (tabla 1).
Los mercados de aves vivas desempeñan un papel importante dentro de la cadena de transmisión del H7N9. Estos se intervinieron por parte de las autoridades sanitarias y se clausuraron el 6 de abril de 2013, medida que coincidió con la disminución gradual en la frecuencia de casos clínicos. Hasta fines del mes de agosto los mercados se reactivaron en forma gradual con cierres parciales para realizar prácticas de desinfección, en forma periódica (enero-abril), donde de acuerdo con las autoridades sanitarias existe una mayor probabilidad de presentación de casos (Shanghai Municipal Health Bureau, 2013; Centro de Coordinación de Alertas y Emergencias Sanitarias, 2013).
Comentarios finales
La epidemia reciente de H7N9 reitera el reto permanente que representa la dinámica de los virus de influenza y la interacción de los mismos con el ambiente y las poblaciones humanas y animales. El nuevo virus es de baja patogenicidad en aves, lo que supone que pueden causar infecciones sin signos clínicos evidentes en estos animales. Esto no significa baja patogenicidad en humanos; de hecho es la primera vez que se observa que un virus de baja patogenicidad en aves cause infecciones graves en humanos. Por lo anterior la vigilancia de la enfermedad en aves es compleja e ineficaz, parecería que los humanos fueran los centinelas de la infección en aves.
Rongbao et al. (2013) señalaron que al inicio se sospechó que el virus tenía origen aviar, no obstante la ausencia de síntomas en aves silvestres o migratorias. Los análisis realizados por dichos autores señalan que en los rearreglos intervinieron tres virus, uno de ellos en el delta del río Yangtzé entre segmentos genómicos de H7 y N9, provenientes de aves migratorias, los demás genes internos se originaron en aves domésticas (Rongbao et al., 2013).
Otro aspecto de interés fue el descenso drástico de casos después del cierre de los mercados de aves vivas, donde el manejo dado a los animales que se sacrifican y expenden incluye el uso de peladoras eléctricas que potencian los aerosoles facilitando de esta forma la distribución del virus dentro y fuera de los mercados. En estos establecimientos se acostumbra a utilizar máquinas que contienen agua caliente y tubos que giran a grandes velocidades para desplumar las aves comercializadas. Cuando la máquina se enciende, las gotas de vapor y plumas se diseminan por el lugar; Feng Zijian director del control de emergencias de la CDC-China afirmó que las gotas de vapor que salían de esta máquina podían contener virus, haciendo de las mismas una de las posibles fuentes de infección (Roberts, 2013; Rongbao et al., 2013).
Frente a los brotes por virus de influenza aviar y su posibilidad de pandemias, se han establecido modelos computacionales con el fin de predecir la temporo-espacialidad en la difusión de la enfermedad. Wiwanitkit et al. (2013) generaron mapas de riesgo con relación a H7N9 en las provincias del este de China y analizaron la distribución de las aves de corral frente a patrones migratorios de aves silvestres, (ambos implicados en la transmisión de H7N9) y de esta forma predecir los riesgos de infección. Dichos mapas, cambian con el tiempo; aunque no predicen el número de infecciones en humanos, se pueden emplear para entender y prever los riesgos relativos de diferentes regiones en el tiempo (Wiwanitkit V. et al., 2013).
De esta experiencia quedan más preguntas que respuestas: cuál es el actual estatus sanitario de las aves en China; cuál fue la fuente de infección; cómo evolucionó el virus H7N9 después del brote; teniendo en cuenta la circulación de otras cepas tanto de origen humano como animal, cuáles fueron los mecanismos de transmisión en humanos; en vista de ausencia de contacto con aves en una alta proporción de los individuos enfermos, con qué mecanismos de adecuada sensibilidad diagnóstica se establecerá el programa de vigilancia del nuevo virus en aves domésticas, silvestres y en otras especies animales; cuál será el impacto de la reapertura de los mercados de aves vivas y qué medidas se deben tomar para mitigar el riesgo que estos establecimientos representan dentro de la epidemiología de la enfermedad.
Referencias bibliográficas
• Centro de Coordinación de Alertas y Emergencias Sanitarias. (2013). Nuevo virus de la gripe Aviar A (H7N9) en Humanos en China., Evaluación del Riesgo para España. N° 1. España: Ministerio de Sanidad, Servicios Sociales e Igualdad. [ Links ]
• Declan, B. (2013). Mapping the H7N9 Avian Flu Outbreaks. Where are the 104 cases confirmed so far, and where might the virus go next?. Nature-International Weekly News. [ Links ]
• Koopmans, M., Wilbrink, B.; Conyn, M.; Natrop, G. Hans, Van D., et al. (2004) Transmission of H7N7 avian Influenza A virus to human beings during a large outbreak in commercial poultry farms in the Netherlands. The Lancet, 36. [ Links ]
• Dave, R. (2013). Poultry feather removal machines may be spreading H7N9 - Chinese CD. H7N9 Flu News, Flu Spread. [ Links ]
• Khan, Robert & Juergen, R. (2013). The novel H7N9 Influenza A virus: Its present impact and indeterminate future. One Health - News Letter, 6(2). [ Links ]
• Di Liu, Weifeng; Shi, Yi; Dayan, W.; Haixia, Xiao; Wei, Li, et al. (2013). Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: phylogenetic, structural, and coalescent analyses. The Lancet; 381(9881), 1926-32. [ Links ]
• McKay, Ian. (2013). Avian Influenza A (H7N9) virus; Virology down under. The University of Queensland- Australia. [ Links ]
• Rongbao, G.; Bin, C., Yunwen, H.; Zijian, F.; Dayan, W.; Wanfu, H. et al. (2013). Human Infection with a Novel Avian Origin Influenza A (H7N9) Virus. The New England Journal of Medicine, 368, 1888-97. [ Links ]
• Shanghai Municipal Health Bureau. (2013). Prevention and Control of H7N9 Bird Flu. Foreign Affairs of Shanghai Municipality. [ Links ]
• Jian Zhong, S.; Guo Hua, D.; Pei Hong, L.; Jin Ping, Z. Li Zheng, G., Wen Hui, L.; et al. (2013). Isolation and characterization of H7N9 virus from live poultry markets-Implication of the source of current H7N9 infection in humans. Chinese Science Bulletin, 10.1007/s11434-013-5873-4. [ Links ]
• Uyeki, T. & Cox, N. (2013). Global concerns regarding Novel Influenza A (H7N9) virus infection. The New England Journal of Medicine, 368, 1251-5 [ Links ]
• Vera, V.; Villamil, L. y Rodríguez, A. (2006). Re-emergencia global de la influenza aviar. Realidades y mitos. Plumazos. [ Links ]
• Viroj, W.; Benyun, S.; Shang, X.; Guo-Jing, Y., Xiao-Nong, Z. & Jiming, Liu. (2013). Research priorities in modeling the transmission risks of H7N9 bird flu. Infectious Diseases of Poverty, 2, 17. [ Links ]
• World Health Organization. (2013). Number of Confirmed Human Cases of Avian Influenza A (H7N9) reported to WHO., Report 7 - Data in WHO/HQ as of 24 May 2013. [ Links ]
• Wu, Y. & Gao, G. (2013). Lessons learnt from the human infection of avian origin influenza H7N9 virus: Live free markets and human health. Sci China Life Sci, 56, 493-494. [ Links ]