Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.11 no.2 Caldas July/Dec. 2014
Artículo original / Original article / Artigo original
Evaluación de dos diluyentes para la criopreservación de semen de caballos de la raza criollo colombiano*
Evaluation of two extenders for semen cryopreservation of Colombian creole horses
Avaliação de dois diluentes para a criopreservação de sémen de cavalos da raça crioulo colombiano
Giovanni Restrepo Betancur**, Alexandra Usuga Suarez***, Juan David Montoya Páez****, Álvaro David Celis*****, Andrés Antonio Henao******
* Artículo derivado del proyecto de investigación titulado “Formulación de un diluyente de criopreservación y evaluación de su efecto sobre la fertilidad potencial del semen de equinos buenos y malos congeladores, financiado por el Politécnico colombiano Jaime Isaza Cadavid y realizado entre enero y diciembre de 2013.
** Zoot, MV, MSc., PhD(c). Profesor Asistente, Politécnico colombiano Jaime Isaza Cadavid. Medellín, Colombia.
*** MVZ, PhD(c). Investigadora, Politécnico colombiano Jaime Isaza Cadavid. Medellín;, Colombia.
**** Ingeniero Agropecuario, Investigador, Politécnico colombiano Jaime Isaza Cadavid. Medellín, Colombia.
***** Ingeniero Agropecuario, Investigador, Politécnico colombiano Jaime Isaza Cadavid. Medellín, Colombia.
****** Ingeniero Agropecuario, Investigador, Politécnico colombiano Jaime Isaza Cadavid. Medellín, Colombia.
Correspondencia: Giovanni Restrepo Betancur, e-mail: grestrepo@elpoli.edu.co.
Artículo recibido: 22/11/2013; Artículo aprobado: 31/10/2014
Resumen
Introducción. La composición de los diluyentes para la criopreservación del semen equino es determinante en la criotolerancia y la capacidad fecundante post-descongelación de las células espermáticas. Objetivo. Evaluar dos diluyentes para la congelación de semen de caballos de la raza criollo colombiano. Materiales y métodos. El semen de cuatro caballos de la raza criollo colombiano fue criopreservado mediante un protocolo de congelación rápida con los diluyentes Equipro® y Gent®. La evaluación de la movilidad del semen posdescongelación se realizó mediante un sistema de análisis computarizado de clase (SCA®), con el cual se analizaron la movilidad total (MT), la movilidad progresiva (MP), la velocidad curvilínea (VCL), la velocidad lineal (VSL) y la velocidad media (VAP). La vitalidad espermática (VE) y la morfología normal (MN) se evaluaron mediante tinción con eosina-nigrosina; la integridad de la membrana plasmática se determinó mediante la prueba hipo-osmótica (HOS). Para la evaluación estadística se ajustaron modelos lineales generalizados (GLM) y las medias entre los tratamientos se compararon por la prueba de Tukey. Las asociaciones entre las variables estudiadas se evaluaron mediante un análisis de correlación de Pearson. Resultados. Se halló diferencia estadística significativa (P≤0.05) para la MT con medias de 50.9 % ± 19.4 % y 42.2 % ± 15.1 %, para Equipro® y Gent®, respectivamente. A excepción de la VSL no se encontró diferencia entre los demás parámetros evaluados. Se encontró una alta correlación entre los parámetros de movilidad, vitalidad e integridad de membrana. Conclusión. El diluyente Equipro® produce tasas de movilidad total posdescongelación superiores al diluyente Gent® en el semen de caballos de la raza criollo colombiano.
Palabras clave: congelación, diluyentes, semen equino.
Abstract
Introduction. The composition of the extenders for cryopreservation of stallion semen is crucial in cryotolerance and post-thaw fertilizing capacity of sperm cells. Objective. Evaluate two extenders for freezing the semen of Colombian creole stallions. Materials and methods. Semen of four Colombian creole stallions was cryopreserved by fast freezing protocol with Equipro® and Gent® extenders. Evaluation of sperm post-thaw motility was performed by a Sperm Class Analyzer system (SCA®) to examine total motility (TM), progressive motility (PM), velocity curvilinear (VCL), velocity straight line (VSL) and velocity average path (VAP). The sperm vitality (SV) and normal morphology (NM) were assessed by eosin -nigrosin staining; the plasmatic membrane integrity was determined by the hypo-osmotic swelling test (HOS). For statistical evaluation were adjusted generalized linear models (GLM) and the treatments averages were compared by the Tukey test. Associations between variables were assessed by Pearson correlation analysis. Results. Statistical difference (P≤ 0.05) was found for TM with averages of 50.9% ± 19.4% and 42.2% ± 15.1% for Equipro® and Gent®, respectively. Except for VSL no difference was found between the other evaluated parameters. There was a high association between motility parameters, vitality and membrane integrity. Conclusions. Equipro® extender produces superior post-thaw total motility rates than Gent® extender in sperm of Colombian creole stallions.
Key words: freezing, diluents, equine sperm.
Resumo
Introdução. A composição dos diluentes para a criopreservação do sémen equino é determinante na criotolerância e a capacidade fecundante pósdescongelamento das células espermáticas. Objetivo. Avaliar dois diluentes para o congelamento de sémen de cavalos da raça crioulo colombiano. Materiais e métodos. O sémen de quatro cavalos da raça crioulo colombiano foi criopreservado mediante um protocolo de congelamento rápido com os diluentes Equipro® e Gent®. A avaliação da mobilidade do sémen pós-descongelação se realizou mediante um sistema de análise computadorizada de classe (SCA®), com o qual se analisaram a mobilidade total (MT), a mobilidade progressiva (MP), a velocidade curvilínea (VCL), a velocidade linear (VSL) e a velocidade média (VAP). A vitalidade espermática (VÊ) e a morfologia normal (MN) avaliaram-se mediante coloração com eosina-nigrosina; a integridade da membrana plasmática se determinou mediante a prova soluço-osmótica (HOS). Para a avaliação estatística se ajustaram modelos lineares generalizados (GLM) e as médias entre os tratamentos se compararam pela prova de Tukey. As associações entre as variáveis estudadas se avaliaram mediante uma análise de correlação de Pearson. Resultados. Achou-se diferença estatística significativa (P≤0.05) para a MT com médias de 50.9 % ± 19.4 % e 42.2 % ± 15.1 %, para Equipro® e Gent®, respectivamente. A exceção da VSL não se encontrou diferença entre os demais parâmetros avaliados. Encontrou-se uma alta correlação entre os parâmetros de mobilidade, vitalidade e integridade de membrana. Conclusão. O diluente Equipro® produz taxas de mobilidade total pós-descongelação superiores ao diluente Gent® no sémen de cavalos da raça crioulo colombiano.
Palavras importantes: congelamento, diluentes, sémen equino.
Introducción
La criopreservación de semen es uno de los procedimientos más importantes en el desarrollo de biotecnologías para la reproducción asistida, como la inseminación artificial y la transferencia de embriones (Bailey, Bilodeau, & Cormier, 2000). Esta tecnología permite una máxima distribución y una adecuada disponibilidad de material germinal de ejemplares de interés mediante su conservación a largo plazo (Loomis & Grahman, 2008), lo cual favorece el mejoramiento genético para rasgos de valor comercial en la especie, a través de la selección y de los cruzamientos dirigidos. Para la especie equina es aún limitado el uso de semen criopreservado, debido a una considerable reducción posdescongelación de su capacidad fecundante respecto al semen fresco (Ball, 2008). Adicionalmente, existe una gran variabilidad en los resultados obtenidos entre muchos ejemplares y razas equinas (Stornelli, Tittarelli, Savignone & Stornelli, 2005).
Se han explorado numerosas alternativas para mejorar la fertilidad del semen equino criopreservado. Se han evaluado crioprotectores alternativos como el glicerol, el etilenglicol u otras moléculas que por su bajo peso molecular penetran con mayor facilidad las membranas y, por lo tanto, poseen menor toxicidad osmótica, como la metilformamida (MF) y la dimetilformamida (DMF) (Neira, Ramírez, García & Moreno, 2007; Squires, Keith & Grahman, 2004). Asimismo, se ha estudiado la suplementación de los diluyentes con sustancias proteicas que actúan como crioprotectores extracelulares, tales como la yema de huevo, la albúmina sérica bovina, el suero equino, el suero bovino, la proteína de soya, el alcohol polivinílico y la leche descremada ultra-pasteurizada (Palacios & Quintero, 1996; Boeta & Quintero, 2000). El aprovechamiento de los efectos benéficos combinados de diferentes sustancias útiles para la protección de las células espermáticas ha enfocado muchos esfuerzos en la búsqueda de nuevas formulaciones de diluyentes que mejoren la conservación del semen equino, incluyendo otros ingredientes químicos para ajustar el pH y la osmolaridad, así como la utilización de antibióticos con el fin de inhibir el crecimiento bacteriano y de diversas sustancias antioxidantes (Salazar et al., 2011; Ball, Medina, Gravance & Baumber, 2001; Baumber & Ball, 2005).
Algunos diluyentes comerciales se destacan por su amplio uso para la criopreservación del semen equino, así como por las múltiples investigaciones realizadas para determinar su efectividad, como es el caso de los denominados INRA 82 e INRA 96, formulados con componentes como sales de Hanks, glucosa, lactosa, rafinosa, fosfocaseína, citrato sódico, citrato potásico y leche desnatada, y suplementados comúnmente para congelación con yema de huevo y glicerol (Janett, Sacher, Hassiq & Thun, 2012; Fayrer-Hosken, Abreu-Barbosa, Heusner & Jones, 2008). También han sido desarrollados y estudiados para la criopreservación de semen equino, el diluyente Cáceres, compuesto por solución de Hank suplementada con HEPES, glucosa, lactosa, BSA y fosfocaseinato de leche, yema de huevo, dimetilformamida y glicerol, y el diluyente Botucrio®, compuesto por agua ultrapura, aminoácidos, carbohidratos, glicerol, amidas, gentamicina, penicilina y yema de huevo (Morillo et al., 2011; Morillo, Pessanha, Lopez, Rocha & Peña, 2012). Otras alternativas son el Gent®, un diluyente compuesto de soluciones tampón, leche, yema de huevo y glicerol; y el Equipro®, constituido por caseinatos, proteínas de suero, glucosa, sacarosa y sulfato de gentamicina (Janett et al., 2012). La diversidad de formulaciones existentes en los diluyentes para semen equino, sumada al hecho de que no se tienen mayores antecedentes de evaluación de los mismos en la criopreservación de semen de caballos de la raza criollo colombiano, conduce a que sea importante determinar su efecto sobre diferentes parámetros posdescongelación, como indicadores de la calidad del semen destinado a la inseminación artificial. El objetivo de este estudio fue evaluar el efecto de los diluyentes Gent® y Equipro® sobre la calidad posdescongelación del semen de caballos de la raza criollo colombiano.
Materiales y métodos
Recolección y evaluación del semen fresco
El estudio se desarrolló con cuatro ejemplares equinos de la raza criollo colombiano, ubicados en el municipio de Girardota (Antioquia). Los animales estuvieron sometidos a condiciones iguales de alimentación, ambiente y manejo re-productivo, contaron con una edad entre los 3 y los 8 años, y una condición corporal entre 6 y 7 (escala 1 a 9). Se obtuvieron dos eyaculados por cada animal, con un período de descanso reproductivo de una semana. La recolección del semen se realizó por el método de vagina artificial, utilizando una vagina modelo Missouri (Minitube) lubricada con gel no espermicida.
Una yegua fue empleada para la colecta y la fracción de gel del eyaculado fue removida por filtración. Utilizando un microscopio de contraste de fase Eclipse E200 (Nikon Inc.), se determinó la movilidad espermática promediando los porcentajes de movilidad progresiva de cinco diferentes campos de observación (400X).
La concentración espermática fue establecida a partir de una gota de semen fresco, mediante un fotómetro Spermacue® (Minitube). La morfología, vitalidad e integridad de la membrana plasmática del semen fresco fueron evaluadas mediante las mismas metodologías descritas más adelante para el semen posdescongelación. El semen recién recolectado fue diluido en proporción 1:1 en diluyente Equipro® (Minitube) a 37 ºC y luego fue transportado en condiciones de refrigeración en un Equitainer® (Minitube), durante un término máximo de 2 horas.
Criopreservación del semen
Solo se procesaron los eyaculados con un mínimo de 70 % de movilidad progresiva y 100 millones de espermatozoides por mL. La criopreservación del semen se realizó mediante un protocolo de congelación rápida modificado a partir del descrito por Bustamante et al., (2009). Para ello, cada eyaculado fue dividido en dos alícuotas de igual volumen para los tratamientos, 1: Equipro® y 2: Gent®, las cuales se centrifugaron a 1200 x g por 15 minutos. Posteriormente cada precipitado fue resuspendido en 2mL del diluyente de congelación, correspondiente a cada uno de los tratamientos:
1. Equipro®, constituido por diluyente Equipro® (Minitube) suplementado con 5 % de dimetilformamida (DMF) y 4 % de yema de huevo, y 2: Gent®, diluyente Gent® (Minitube). Posteriormente el semen fue resuspendido en el diluyente según el tratamiento en cantidad suficiente para una concentración final de 100 millones de espermatozoides/mL. El semen diluido se mantuvo en refrigeración a 5 °C por 15 minutos, y se empacó en pajillas de 0.5mL. Las pajillas fueron nuevamente refrigeradas a 5 ºC por 10 minutos, y se sometieron a vapores de nitrógeno líquido en posición horizontal a una distancia de 4 cm de la superficie del mismo, durante 10 minutos. Finalmente se sumergieron en un tanque de almacenamiento de nitrógeno líquido a -196 ºC.
Evaluación posdescongelación del semen
Después de una semana se realizó la descongelación de las pajillas por 60 segundos en un baño María a 37 °C. Mediante un procedimiento modificado al reportado por Hidalgo, Rodríguez, Dorado, Sanz & Soler (2005), se evaluaron los parámetros movilidad total (MT), movilidad progresiva (MP), velocidad rectilínea (VSL), velocidad curvilínea (VCL) y velocidad media (VAP). Se empleó un microscopio de contraste de fase Eclipse E200 (Nikon Inc.) con una cámara digital Scout SCA780 (Basler) adaptada a un computador dotado del software Sperm Class Analizer (SCA®) Motility and Concentration (Microptic S.L.).
La morfología normal (MN) y la vitalidad espermática (VE) se establecieron mediante la técnica modificada de eosina-nigrosina (Brito, Greene, Kelleman, Knobbe & Turner, 2011). Sobre un portaobjetos temperado a 37 °C, se depositó una gota de semen, y a su lado, una gota de colorante eosina-nigrosina (Sigma-Aldrich 861006 y N4763) a 37 °C; ambas gotas se mezclaron durante 30 a 60 segundos, y se realizó un extendido y la fijación del mismo con calor sobre una platina térmica. Se observó la morfología individual de 200 espermatozoides al microscopio (1000X) y se clasificaron los espermatozoides como morfológicamente normales o anormales (Graham & Mocé, 2005). De igual manera, se clasificaron como vivos aquellos espermatozoides que no incorporaron el colorante y como muertos, aquellos que incorporaron el colorante.
Para la evaluación de la integridad de la membrana plasmática de los espermatozoides se utilizó la prueba hipo-osmótica (HOS) de acuerdo con lo reportado por Neild et al., (1999). Un volumen de 0.5 mL de semen descongelado y diluido en 1mL de citrato de sodio al 2.94 % fue centrifugado a 1500 rpm durante 8 minutos. El precipitado fue resuspendido en 500 µL de citrato de sodio al 2.94 %. Luego un volumen de 50µL de esta solución se adicionó a un tubo con 500µL de una solución hipo-osmótica (100mOsmol/L) compuesta por sacarosa 5.4 % y citrato de so-dio 2.94 % en agua grado reactivo. Esta mezcla fue incubada a 37 ºC por 30 minutos para luego evaluarse el hinchamiento espermático de 200 células en mínimo 5 campos diferentes (400X).
Finalmente, se determinó la proporción total de espermatozoides reaccionados.
Análisis estadístico
Se ajustó un modelo lineal generalizado (GLM) para cada variable dependiente (MT, MP, VE, MN, HOS, VCL, VSL, o VAP). Todas las variables respuesta, a excepción de la variable dependiente, fueron incluidas en cada modelo como covariables. A continuación se describe el modelo general empleado:
Yijklmnopqr = µ + Ei + Tj + Rk + Clmnopqr + eijklmnopqr
donde:
Yijklmnopqr = YMT, MP, VE, MN, HOS, VCL, VSL, VAP, del eyaculado anidado dentro del equino i, bajo el tratamiento j, en la repetición k, bajo las covariables l, m, n, o, p, q, r.
µ: Media para la característica.
Ei: Efecto fijo del eyaculado anidado dentro del equino (i).
Tj: Efecto fijo del tratamiento (j). (j = Equipro®, Gent®).
Rk: Efecto fijo de la repeticiín (k). (k = 1…4).
Clmnopqr: Efecto fijo de las covariables (l, m, n, o, p, q, r).
eijklmnopqr: Error aleatorio.
Las medias por tratamiento se compararon por la prueba de Tukey (HSD). Para determinar la asociación entre las variables evaluadas, se realizó un análisis de correlación de Pearson. Para todas las evaluaciones se utilizó el programa SAS 9.2.
Resultados
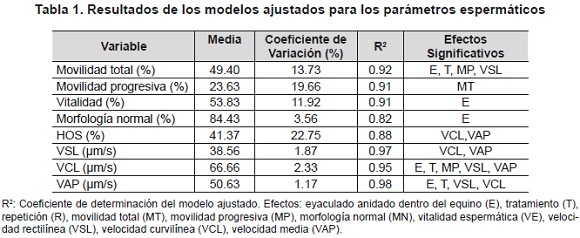
A partir de un total de 8 eyaculados recolectados y evaluados, se halló un volumen de semen promedio (mL) de 33.5 ± 15.4 y una concentración de espermatozoides promedio (106/mL) de 263.6 ± 151.6. Se evaluaron posdescongelación 48 pajillas. Los resultados de los modelos ajustados para los diferentes parámetros espermáticos evaluados se presentan en la tabla 1. Las principales anormalidades observadas fueron gota citoplasmática proximal y distal, microcabeza, pieza media reflejada y doble cabeza.
Discusión
Los altos coeficientes de determinación (R2) para los modelos ajustados muestran que una alta proporción de la variabilidad en los parámetros espermáticos evaluados está explicada por los efectos incluidos (tabla 1). La significancia del efecto del eyaculado anidado dentro del equino para varios de los modelos utilizados denota la influencia de este efecto sobre la calidad seminal, mientras los efectos (covariables) relacionados con la velocidad espermática (VSL, VCL y/o VAP) mostraron tener influencia en la movilidad total y en la integridad de membrana plasmática (tabla 1).
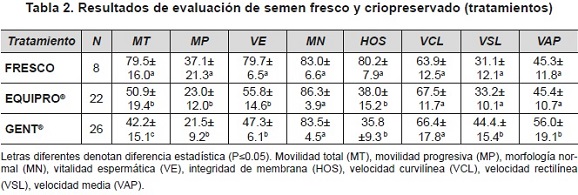
La reducción de la calidad del semen posdescongelacíón respecto al semen fresco ha sido ampliamente descrita en equinos (Salazar et al., 2011). Los resultados de este estudio muestran una reducción significativa de la movilidad total, la movilidad progresiva, la vitalidad y la integridad de la membrana plasmática (tabla 2). No se observó efecto significativo de la criopreservación sobre la morfología normal; sin embargo, autores como Blottner, Warnke, Tuchscherer, Heinen & Torner (2001) y Vlasiu, Groza, Morar & Cătană (2008) han reportado diversas alteraciones de la morfología de espermatozoides equinos criopreservados. Los promedios encontrados de movilidad de semen fresco y criopreservado son equiparables a otros reportados por evaluación con un sistema CASA (Lozano, Gil, & Álvarez, 2011; Hoffmann, Oldenhof, Morandini, Rohn, & Sieme, 2011).
El porcentaje de movilidad total posdescongelación fue superior para el diluyente Equipro®, respecto al diluyente Gent®, mientras que no se encontró diferencia en la movilidad progresiva (tabla 2). Aunque estos diluyentes se han utilizando de forma frecuente en procesos de investigación, son escasos los antecedentes de comparación de los mismos para la criopreservación de semen equino. Jannet et al. (2012) emplearon estos diluyentes para la refrigeración por 24 horas de semen equino, encontrando valores de movilidad total y progresiva de 40.9 % ± 2.5 y 23 % ± 1.9 para Equipro® y de 56.1 % ± 1.9 y 34.9 % ± 1.6 para Gent®. Los crioprotectores constituyentes de los diluyentes empleados podrían, en parte, explicar los resultados obtenidos, teniendo en cuenta la suplementación del Equipro® con DMF y la formulación original del Gent® con glicerol. Se ha descrito que la DMF, por su menor peso molecular (72) respecto al glicerol (93), tiene un mayor potencial para penetrar la membrana plasmática, lo que podría resultar en un más rápido equilibrio entre las regiones extra e intracelular y, en consecuencia, en un menor daño celular por el choque osmótico (Pérez-Osorio et al., 2008). Medeiros, Gómez, Carmo, Papa & Alvarenga (2002) encontraron mayores porcentajes posdescongelación de movilidad total y progresiva con DMF (52.3 % y 12.6 %) respecto al glicerol (27.9 % y 8.7 %). Mesa & Henao (2012) igualmente observaron superioridad de la DMF respecto al glicerol para la conservación de la movilidad de semen equino criopreservado.
Este último estudio es valioso como referente para esta investigación, dado que, de forma adicional a la inclusión de los mismos crioprotectores, también se empleó el sistema SCA® para la evaluación de la movilidad del semen de caballos de la raza criollo colombiano.
No se observó efecto posdescongelación del diluyente sobre la vitalidad espermática, la morfología normal o la integridad de la membrana plasmática (tabla 2). De manera que no sería posible atribuir las diferencias en la movilidad total a alguna alteración específica en la integridad o fisiología de los espermatozoides. Sería recomendable entonces evaluar el efecto de estos diluyentes sobre otras estructuras celulares y sobre diferentes procesos metabólicos del semen.
Entre los parámetros de evaluación de la velocidad de los espermatozoides, la velocidad curvilínea (VCL) no evidenció efecto de la criopreservación o del diluyente empleado; sin embargo, la velocidad rectilínea (VSL) y la velocidad media (VAP) mostraron un incremento significativo para el diluyente Gent®. De acuerdo con esto, podría considerarse en la composición de este último diluyente la presencia de alguna molécula o factor capacitante. Los promedios encontrados para las velocidades espermáticas (tabla 2) fueron mayores en todos los casos a las reportadas por Morillo et al., (2012) para semen congelado con los diluyentes Cáceres1, Gent® e INRA96®, mientras que fueron inferiores a los reportados por Candeias et al., (2012) quienes encontraron valores de VCL (µm/s), VAP (µm/s) y VSL (µm/s) de 121.1 ± 60.6, 63.8 ± 29.4 y 50.31 ± 22.2, respectivamente.
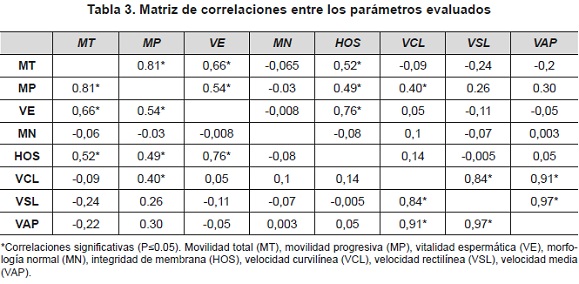
Se observaron altos niveles de asociación entre la movilidad total, la movilidad progresiva, la vitalidad espermática y la integridad de membrana (tabla 3), lo cual denota el papel determinante de la funcionalidad de la membrana plasmática en la capacidad de movimiento de los espermatozoides equinos. De forma similar, Salazar et al., (2011) encontraron una correlación entre la movilidad progresiva y la integridad de la membrana de r = 0.69, mientras Vidament et al., (1998), hallaron una correlación de r = 0.86 entre la movilidad progresiva y la vitalidad en semen equino criopreservado.
Por otro lado, de acuerdo a los resultados los parámetros de velocidad de los espermatozoides estarían asociados de forma positiva a la movilidad progresiva y no necesariamente a la movilidad total (tabla 3), lo que podría explicar la mayor movilidad total del semen congelado con el diluyente Equipro®, a pesar de mayores VCL y VAP para el diluyente Gent®.
Conclusiones
El diluyente Equipro® produce tasas de movilidad total superiores al diluyente Gent®, en el semen descongelado de caballos de la raza criollo colombiano. La semejanza en los resultados para otros parámetros de calidad seminal evaluados, así como las diferencias en algunos indicadores de velocidad y desplazamiento de los espermatozoides, podrían ser atribuidos a efectos inherentes a la composición de cada una de las formulaciones diluyentes evaluadas.
Referencias bibliográficas
Bailey, J., Bilodeau, J., & Cormier, N. (2000). Semen cryopreservation in domestic animals: a damaging and capacitating phenomenon. Journal of Andrology, 2(1), 1-7. [ Links ]
Ball, B., Medina, V., Gravance, C. & Baumbe, J. (2001). Effect of antioxidants on preservation of motility, viability and acrosomal integrity of equine spermatozoa during storage at 5 °C. Theriogenology, 56(4), 577-589. [ Links ]
Ball, B. (2008). Oxidative stress, osmotic stress and apoptosis: impacts on sperm function and preservation in the horse. Animal Reproduction Science, 107(3-4), 257-267. [ Links ]
Baumber, J. & Ball, B. (2005). Determination of glutathione peroxidase and superoxide dismutase-like activities in equine spermatozoa, seminal plasma, and reproductive tissues. American Journal of Veterinary Research, 66(8), 1415-1419. [ Links ]
Blottner, S., Warnke C., Tuchscherer, A., Heinen, V., & Torner H. (2001). Morphological and functional changes of stallion spermatozoa after cryopreservation during breeding and non -breeding season. Animal Reproduction Science, 65(1-2), 75-88. [ Links ]
Boeta, M., & Quintero, L. (2000). Utilización de leche descremada ultrapasteurizada como diluyente de semen refrigerado de burro, destinado a la inseminación de yeguas. Revista veterinaria de México, 31(1), 67-69. [ Links ]
Brito L., Greene, L., Kelleman, A., Knobbe, M., & Turner, R. (2011). Effect of method and clinician on stallion sperm morphology evaluation. Theriogenology, 76(4), 745-750. [ Links ]
Bustamante, I., Pederzolli, C., Sgaravatti A., Gregory, R., Dutra, C., Jobim, M., & Mattos, R. (2009). Skim milk-egg yolk based semen extender compensates for non -enzymatic antioxidant activity loss during equine semen cryopreservation. Animal Reproduction, 6(2), 392-399. [ Links ]
Candeias, M., AlvarengaII, M., Teorodo, M., FerreiraII, H., Souto, M., Torres, R., Ríos, A., & Zandonadi, F. (2012). Semen cryopreservation protocols of Mangalarga Marchador stallions. Revista Brasileira de Zootecnia, 41(9), 1989-1995. [ Links ]
Fayrer-Hosken, R., Abreu-Barbosa, C., Heusner, G., & Jones L. (2008). Cryopreservation of stallion spermatozoa with INRA96 and glycerol. Journal of Equine Veterinary Science, 28(11), 672-676. [ Links ]
Graham, J., & Mocé, E. (2005). Fertility evaluation of frozen /thawed semen. Theriogenology, 64(3), 492-504. [ Links ]
Hidalgo, M., Rodríguez, I., Dorado, J., Sanz, J., & Soler, C. (2005). Effect of sample size and staining methods on stallion sperm morphometry by the Sperm Class Analyzer. Veterinary Medicine - Czech Republic, 50(1), 24-32. [ Links ]
Hoffmann, N., Oldenhof, H., Morandini, C., Rohn, K. & Sieme, H. (2011). Optimal concentrations of cryoprotective agents for semen from stallions that are classified 'good' or 'poor' for freezing. Animal Reproduction Science, 125(1-4), 112- 118. [ Links ]
Janett, F., Sacher, K., Hassiq, M., & Thun, R. (2012). Quality of raw and of cold-stored semen in icelandic stallions. Journal of Equine Veterinary Science, 32(9), 590-595. [ Links ]
Loomis, P. & Graham, J. (2008). Commercial semen freezing: individual male variation in cryosurvival and the response of stallion sperm to customized freezing protocols. Animal Reproduction Science, 105(1), 119-128. [ Links ]
Lozano, D., Gil, L., & Álvarez, C. (2011). Efecto de la adición de plasma seminal en el semen equino descongelado. Sanidad Militar España, 67(3), 284-290. [ Links ]
Medeiros, A., Gómez, G., Carmo, M., Papa, F., & Alvarenga M. (2002). Cryopreservation of stallion sperm using different amides. Theriogenology, 58(2), 273-276. [ Links ]
Mesa, A. & Henao, G. (2012). Efecto del colesterol y la dimetilformamida sobre parámetros posdescongelación en espermatozoides de caballos criollos colombianos. MVZ Córdoba, 17(1), 2908-2915. [ Links ]
Morillo, A., Ortega, C., Macías B., Morrell J., Rodriguez, H., Tapia, J., & Peña, F. (2011). Freezing stallion semen with the new Caceres extender improves post thaw sperm quality and diminishes stallion -to-stallion variability. Animal Reproduction Science, 127(1-2), 78-83. [ Links ]
Morillo, A., Pessanha, T., López, M., Rocha A., & Peña F. (2012). Comparison of two freezing extenders for stallion spermatozoa: Caceres and Botucrio®. Journal of Equine Veterinary Science, 32(8), 499-500. [ Links ]
Neild, D., Chaves, G., Flores, M., Mora, N., Beconi, M., & Agüero, A. (1999). Hypoosmotic test in equine spermatozoa. Theriogenology, 51(4), 721-727. [ Links ]
Neira, J., Ramírez, G., García, S., & Moreno, D. (2007). Efecto de la asociación L-Glutamina-etilenglicol en la criopreservación de semen equino. Revista de Medicina Veterinaria Universidad de la Salle, 14, 93-105. [ Links ]
Palacios, A., & Quintero, L. (1996). Efecto de la sustitución de yema de huevo por albúmina sérica bovina, suero equino o suero bovino en el diluyente de congelación sobre la viabilidad pos-descongelación del espermatozoide equino. Revista Veterinaria de México, 27(3), 221-227. [ Links ]
Perez-Osorio J., Mello, F., Juliani, G., Lagares, M., Lago, L., & Henry, M. (2008). Effect on postthaw viability of equine sperm using stepwise addition of dimethyl formamide and varying cooling and freezing procedures. [ Links ] Animal Reproduction, 3/4(5), 103-109.
Salazar, J., Teague S., Love, C., Brinsko, S., Blanchard, T., & Varner, D. (2011). Effect of crypreservation protocol on post-thaw characteristics of stallion sperm. Theriogenology, 76(3), 409-418. [ Links ]
Squires, E., Keith, S., & Graham, J. (2004). Evaluation of alternative cryoprotectants for preserving stallion spermatozoa. Theriogenolog, 62(6), 1056-1065. [ Links ]
Stornelli, M. C., Tittarelli, C., Savignone, C., & Stornelli, M. A. (2005). Efecto de los procesos de criopreservación sobre la fertilidad seminal. Analecta veterinaria, 25(2), 28-35. [ Links ]
Vidament, M., Cognard, E., Yvon, J., Sattler, M., Palmer, E., & Magistrini, M. (1998). Evaluation of stallion semen before and after freezing. Reproduction of Domestic Animals, 33(3/4), 271-277. [ Links ]
Vlasiu, T., Groza, I., Morar, I. &, Cătană, R. (2008). The effect of different freezing procedures on sperm head morphometry in stallions. Bulletin UASVM, Veterinary Medicine, 65(2), 146-151. [ Links ]