Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.12 no.1 Caldas Jan./June 2015
Biodisponibilidad de Trichoderma asperellumen el tiempo en suelo Andisol en condiciones de laboratorio y campo*
Bioavailability of Trichoderma asperellum over time in Andisol soil in laboratory and field conditions
Biodisponibilidade de trichoderma asperellumen o tempo em solo Andisol em condições de laboratório e campo
Harold Alexander Vargas Hoyos**, Elizabeth Gilchrist Ramelli***
* Artículo original derivado de proyecto de investigación "Evaluación de la actividad enzimática y antagónica de Trichoderma asperellum sobre fitopatógenos comunes en el cultivo de tomate", financiado por Colciencias, desde el año 2011.
** Estudiante de doctorado, magíster en Biología; microbiólogo y bioanalista del Instituto de Biología, Universidad de Antioquia. Medellín, Colombia.
*** Doctora en Ciencias Agropecuarias y magíster en Biotecnología; Ingeniera Agrónoma, docente e investigadora Universidad Nacional de Colombia, sede Medellín, Colombia. E-mail: elygilchrist@hotmail.com.
Autor para correspondencia: Elizabeth Gilchrist Ramelli, e-mail: elygilchrist@hotmail.com
Artículo recibido: 20/02/2014; Artículo aprobado: 15/05/2015.
Resumen
Introducción. El aislamiento de Trichoderma asperellum T109 ha demostrado tener gran capacidad antagónica in vitro contra hongos fitopatógenos. Sin embargo, existe la necesidad de conocer la respuesta biológica de este aislamiento bajo condiciones in vitro y de campo con el fin de obtener su densidad poblacional. Objetivo. El objetivo de este trabajo fue evaluar diferentes concentraciones de inóculo y frecuencias de aplicación en la biodisponibilidad de Trichoderma asperellum T109. Materiales y métodos. Las concentraciones de inóculo utilizadas fueron de 1x106 y 1x108 conidias. mL-1, las cuales se evaluaron en condiciones controladas de laboratorio y de campo, con diferentes tiempos de aplicación; se utilizó la técnica de conteo en placa de Petri para determinación de UFC.g-1 de suelo. Resultados. La biodisponibilidad de T. asperellum T109 se vio afectada por la frecuencia de aplicación, y con alta significancia (p<0,001) por la concentración inicial de inóculo. En el muestreo final, para el ensayo en condiciones controladas, la concentración de 1x106 conidias.mL-1 presentó diferencia altamente significativa (p<0,001) con respecto a 1x108 conidias mL-1, obteniéndose el máximo valor de UFC.g-1 de suelo al realizar la aplicación cada 4 días. Para el ensayo en campo, se obtuvieron diferencias altamente significativas (p<0,001) al emplear conjuntamente la concentración de 1x108 conidias mL-1 y frecuencia de aplicación de 7 días. Conclusión: Se pudo establecer que la densidad poblacional de T. asperellum T109 es importante en el establecimiento del hongo en el suelo.
Palabras clave: biocontrol, concentración de inóculo, frecuencia de aplicación, densidad poblacional.
Abstract
Introduction. Trichoderma asperellum strain T109 has shown great antagonism activity in vitro against phytopathogenic fungi. However, it is necessary the real understand of this strain into spatial organization in soil under in vitro and field conditions to know the population density. Objective. The aim of this study was to evaluate different inoculum concentrations and frequencies of application in Trichoderma asperellum T109 bioavailability. Materials and methods. Spore suspensions containing 1x106 and 1x108 conidia.mL-1, were evaluated under controlled laboratory and field conditions, with different application times. We used the technique of Petri plate count for determination of CFU.g-1 of soil. Results. The T109 bioavailability was affected by the frequency of application and highly significant (p<0.001) for the initial concentration of inoculum. The last sampling under in vitro conditions showed that the concentration of 1x106 conidia mL-1 was significantly different (p<0.001) when compared to 1x108 conidias.mL-1, yielding maximum value of CFU.g-1 of soil for every 4 days of application. For field conditions, we obtained significant differences (p<0.001) when the concentration of 1x108conidias mL-1 and application of 7 days were tested concomitantly. Conclusions. We can determine that the population density of T. asperellum T109 is important in the establishment of the fungus in the soil.
Key words: biocontrol, inoculums, concentrations, application rate, population density.
Resumo
Introdução. O isolamento de Trichoderma asperellum T109 demonstrou ter grande capacidade antagónica in vitro contra fungos fitopatógenos. No entanto, existe a necessidade de conhecer a resposta biológica deste isolamento sob condições in vitro e de campo com o fim de obter sua densidade populacional. Objetivo. O objetivo deste trabalho foi avaliar diferentes concentrações de inóculo e frequências de aplicação na biodisponibilidade de Trichoderma asperellum T109. Materiais e métodos. As concentrações de inóculo utilizadas foram de 1x106 e 1x108 conidias mL-1, as quais se avaliaram em condições controladas de laboratório e de campo, com diferentes tempos de aplicação; utilizou-se a técnica de contagem em placa de Petri para determinação de UFC.g-1 de solo. Resultados. A biodisponibilidade de T. asperellum T109 se viu afetada pela frequência de aplicação, e com alta significância (p<0,001) pela concentração inicial de inóculo. Na amostragem final, para o ensaio em condições controladas, a concentração de 1x106 conidias mL-1 apresentou diferença altamente significativa (p<0,001) com respeito a 1x108 conidias mL-1, obtendo-se o máximo valor de UFC.g-1 de solo ao realizar a aplicação cada 4 dias. Para o ensaio em campo, obtiveram-se diferenças altamente significativas (p<0,001) ao empregar conjuntamente a concentração de 1x108 conidias.ML-1e frequência de aplicação de 7 dias. Conclusão: Pôde-se estabelecer que a densidade populacional de T. asperellum T109 é importante no estabelecimento do fungo no solo.
Palavras Chaves: biomonitoração, concentração de inóculo, frequência de aplicação, densidade populacional.
Introducción
Para asegurar mayor actividad antagónica y mejor efecto biológico, los agentes biocontroladores deben tener mayor tolerancia al estrés que los fitopatógenos que deben enfrentar (Kredics et al, 2004, 491-498). Generalmente, la acción antagónica de Trichoderma sp. se evalúa bajo condiciones controladas de laboratorio, en algunos casos, sin tener en cuenta las condiciones ambientales que se pueden presentar en los campos de cultivo (Ferenczy, Antal, Manczinger, Szakac, Tengerdy, 2000, 545-549; Skekeres Leitgeb, Kredics, Manczinger, Vágvőlgyi, 2006, 619-622; Moghaddam, Shaigan, Seraji, 2008, 2346-2350). Trichoderma sp. es el hongo más usado en el mundo para control biológico (Verma Brar, Tyagi, Surampalli, Valéro (2007, 1-20), y representa alrededor del 50 % de los productos comerciales a base de hongos antagonistas; dichos bioformulados han sido aplicados en diferentes cultivos en diversas latitudes de la Tierra (Anees et al, 2010, 691 - 701; De Respinis et al, 2010, 19-100). Para el año 2013, donde se realizó el más reciente inventario de especies de Trichoderma se identificaron cerca de 200 especies (Jaklitsch, Voglmayr, 2015, 1-87), y se han descrito variadas metodologías que demuestran la importancia de este microorganismo en el área de la micología y, en especial, del control biológico. En Colombia, la especie asperellum es la más prevalente del género Trichoderma (Hoyos-Carvajal, Orduz, Bisset, 2009b, 615631); sin embargo, es poco el conocimiento de la ecología y el comportamiento bajo condiciones de campo de esta especie, lo cual se ve reflejado en el menor número de productos a base de esta. Por lo tanto, resulta de vital importancia conocer los aspectos biológicos y ecológicos de los aislamientos de T. asperellum que poseen potencial como agentes de control biológico.
Algunos factores que determinan la biodisponibilidad del microorganismo antagonista en el suelo son la concentración y la frecuencia de aplicación. Thangavelu, Palaniswami, Velazhahan (2004, 259-263) evaluaron una cepa de Trichoderma harzianum aislada de la rizósfera de banano con el fin de controlar la infección por Fusarium oxysporum, cuando realizaron aplicaciones en suelo; además de aumentar considerablemente la cantidad de unidades formadoras de colonia por gramo de suelo (UFC.g-1de suelo) de 104 a 1013, se evidenció un control efectivo de F. oxysporum comparado con el fungicida químico carbendazim. Esto indica que posiblemente, altas concentraciones de bioformulados exhiben un mejor desempeño que los productos agroquímicos. Ardores y Mamani (2008, 1-11) evaluaron el efecto de la frecuencia de aplicación (7, 14 y 30 días) de Trichoderma sp. contra Rhizoctonia solani en un cultivo de café; al realizar aplicaciones cada 7 días encontraron menor incidencia de la enfermedad damping off, mayor tamaño de las hojas y aumento en la altura en las plantas y en la longitud de las raíces, lo cual indica que mantener una población constante del antagonista en el suelo potencia significativamente el crecimiento de las plantas y puede disminuir el efecto de algunos fitopatógenos.
Teniendo en cuenta lo descrito anteriormente y utilizando una cepa de Trichoderma asperellum (T 109) con capacidad para controlar el crecimiento de R. solani en condiciones de laboratorio (Vargas-Hoyos, Rueda-Lorza y Gilchrist-Ramelli (2012, 103-112), se evaluó la influencia de la concentración de inóculo y de la frecuencia de aplicación en la biodisponibilidad a través del tiempo en condiciones de laboratorio y campo.
Materiales y métodos
Evaluación en condiciones controladas
Para evaluar la persistencia en el suelo a través del tiempo de la cepa de Trichoderma asperellum T109, se utilizaron tres regímenes de aplicación y tres concentraciones de inóculo. En recipientes de poliestireno, de 7 cm de alto por 11 de ancho, fueron agregados 400 g de suelo tipo Andisol sin esterilizar provenientes de la zona del oriente antioqueño. Los regímenes a evaluar fueron: Régimen de aplicación de laboratorio 1 (L1) en el que se realizaron dos inoculaciones al suelo (día 8 y día 16); Régimen de aplicación de laboratorio 2 (L2), contó con 4 aplicaciones cada 4 días y Régimen de aplicación de laboratorio 3 (L3) en el cual se realizaron 8 aplicaciones cada 2 días durante todo el periodo de evaluación (16 días). En todos los regímenes se realizó una inoculación el día cero y se finalizaron las aplicaciones el día 16. Las concentraciones a evaluar fueron: 0 (como control), 1x106 y 1x108 conidias. mL-1. Para este experimento se incluyeron cuatro repeticiones por tratamiento, para un arreglo factorial de 3 regímenes x 3 concentraciones x 4 repeticiones = 36 unidades experimentales. El ensayo se repitió dos veces en el tiempo. Los diferentes regímenes y concentraciones de T. asperellum T109 fueron incubados con un fotoperiodo 12/12 y con ciclo de temperatura de 10/20ºC (Thermo Scientific™ Precision Standard Incubators 818).
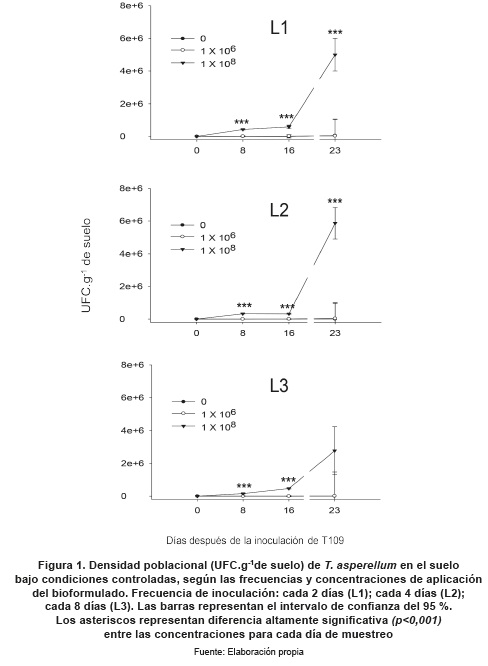
Para evidenciar la dinámica de crecimiento del hongo antagonista se hicieron muestreos de suelo los días 0, 8, 16 y 23. Con el fin de evidenciar el proceso acumulativo de T. asperellumT 109 el día 23, se efectuó un muestreo final y se compararon los regímenes de aplicación y las concentraciones empleadas, determinando las UFC.g-1 de suelo. Para esto se prepararon diluciones seriadas a partir de 1 g de suelo hasta 10-4 y se platearon 100 μl en cajas Petri con PDA suplementado con Igepal CA-630 (Sigma-Aldrich, St. Lois. USA) al 0.05 %; se incubaron a 25 +/- 2°C por 5 días. Para determinar la cantidad de UFC.g-1 de suelo, se utilizó el siguiente cálculo:
Unidades Formadoras de Colonia.g-1 suelo = Colonias en PDA x 104.
Evaluación en condiciones de campo
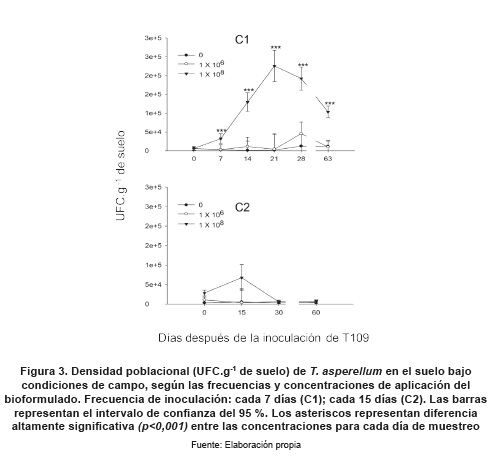
Para evaluar la persistencia de T. asperellum T109 en campo, se realizó el ensayo en la zona del oriente antioqueño (Centro experimental Paysandú; Universidad Nacional de Colombia, Santa Elena, Antioquia-Colombia (6°12' 37' N y 75°30'11" O), que se encuentra a 2550 msnm, con temperatura promedio anual de 14 °C, dispuesto en parcelas de 1m2 y 40 cm de profundidad con suelo clasificado como Andisol (United States Department of Agriculture-USDA, 1999, 869) que fue inoculado con 0 (como control), 1x106 y 1x108 conidias mL-1 de la cepa de T. asperellum T109. El ensayo se llevó a cabo durante 60 días. En el Régimen de aplicación en campo 1 (C1), se aplicaron inoculaciones al suelo los primeros 30 días, cada 7; el Régimen de aplicación en campo 2 (C2) contó con aplicaciones cada 15 días. Para realizar la dinámica de crecimiento se muestrearon los días 0, 7, 14, 21, 28 y 63 para C1, y los días 0, 15, 30 y 60 para C2. Con el fin de comparar los regímenes de aplicación y las concentraciones, el día 60 se tomó un muestreo final, y se determinaron lasUFC.g-1de suelo de Trichoderma sp. Por cada combinación de concentración de T. asperellum T109 y frecuencia de aplicación se dispuso de 3 réplicas. Las suspensiones de T. asperellum T109 se prepararon a partir de una concentración inicial de 1x109 conidias mL-1 de la cual se hicieron diluciones para alcanzar las concentraciones requeridas y aplicar 40 mL por parcela. Para los conteos de las colonias se repitieron los procedimientos de dilución, siembra, incubación y cálculo, mencionados en la metodología anterior.
Análisis estadístico
Los tratamientos se compararon utilizando un análisis de varianza (ANOVA) seguida de la comparación de medias de Tukey. Se realizaron evaluaciones de homocedasticidad y normalidad de los datos utilizando los test de Levene y Kolmogorov-Smirnov, respectivamente.
Resultados
La biodisponibilidad de T. asperellum T109 se vio afectada por la frecuencia de aplicación y con alta significancia (p<0,001) por la mayor concentración. En el ensayo en condiciones controladas, cuando se aplicó cada 2 días se observan diferencias altamente significativas (p<0,001) de la concentración 1x108 conidias mL-1 desde el primer muestreo (día 8). Se alcanzó el mayor valor de UFC.g-1 de suelo (6.8 x 106) cuando se realizó aplicación cada 4 días. Se observaron diferencias altamente significativas (p<0,001) entre la concentración 1x108 conidias mL-1 y las otras concentraciones. En el régimen de aplicación cada 8 días, en los dos primeros muestreos se observa diferencia altamente significativa de la concentración 1x108 conidias mL-1, pero en el último muestreo no existieron diferencias, aunque se observa la tendencia a presentar mayor concentración de UFC.g-1 de suelo (figura 1).
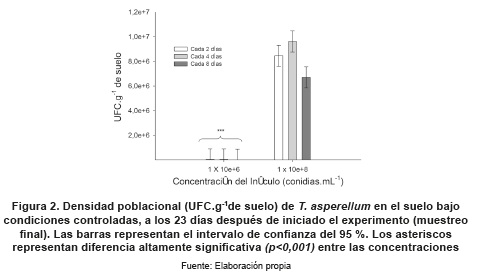
En el muestreo final, en condiciones controladas se observaron diferencias altamente significativas (p<0,001) entre las concentraciones 1x106 y 1x108 conidias mL-1; en esta última concentración no se observaron diferencias significativas entre las frecuencias de aplicación, pero se evidencia una tendencia a presentar mayor biodisponibilidad cuando se aplicó cada 4 días (figura 2).
El ensayo en condiciones de campo mostró que al aplicar el bioformulado de T. asperellum cada 7 días, se encontraron diferencias altamente significativas (p<0,001) entre las concentraciones empleadas; 1x106 y 1x108 conidias mL-1 desde el primer muestreo (día 7); en la mayor concentración se observó un máximo de presencia de T. asperellum (2,25 x 105 UFC.g-1 de suelo) al día 21; el día 28 disminuyó levemente (1,90 x 105 UFC.g-1de suelo) y no se presentaron diferencias significativas en la presencia de T. asperellum. Un mes después de la última aplicación (aprox. Día 63) la población de T. asperellum disminuyó un 54 % (Figura 3).
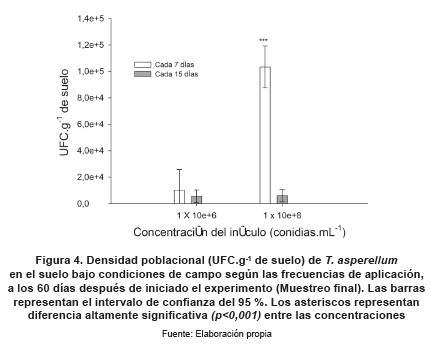
En el muestreo final en condiciones de campo se observaron diferencias altamente significativas (p<0,001) entre 1x106 y 1x108 conidias mL-1; la menor concentración empleada no mostró diferencias significativas en las frecuencias de aplicación; se observó tendencia de mayor biodisponibilidad cuando se aplica cada 7 días. En la concentración de 1x108 conidias mL-1, se encontraron diferencias altamente significativas (p<0,001) entre la aplicación a los 7 y 15 días (figura 4). Haciendo aplicaciones de T. asperellumT109 a 1x108 conidias mL-1 cada 7 días, se encontraron, luego de 60 días de la primera aplicación, 1x105 UFC.g-1 de suelo disponibles para efectuar su papel antagónico en condiciones ambientales de campo (figura 4).
Discusión
En este estudio, se observó el comportamiento de la densidad poblacional de la cepa de T. asperellum T109 en condiciones in vitro y en campo. En nuestro conocimiento, es la primera vez que se evalúa la cepa T109 de esta manera en suelos de tipo Andisol. La concentración de inóculo influyó significativamente (p<0,001) en la biodisponibilidad de T. asperellumT109, tanto en condiciones controladas de laboratorio como en condiciones de campo, por lo que podemos considerar que la concentración del inóculo de T. asperellum T109 es determinante para mantener su biodisponibilidad en el suelo.
La concentración de 1x108 conidias mL-1 favoreció el establecimiento y aumento de la población del hongo en el suelo (figura 1; L1 y figura 2; C1). Los ensayos en condiciones controladas de laboratorio revelaron que es necesario un período de establecimiento y adaptación antes de presentarse un aumento poblacional significativo. Los suelos con enmiendas orgánicas y fertilización sintética favorecen el crecimiento de propágulos de Trichoderma spp. (Bulluck III, Brosius, Evanylo y Ristaino et al. 2002,147-160). Este tipo de suelo se encuentra en la zona del oriente antioqueño de donde se realizó el ensayo en campo y se obtuvo el material para realizar los ensayos en condiciones controladas; por lo tanto, es un ambiente ideal para la utilización del aislamiento T109. El ensayo en condiciones controladas evidenció que frecuencias medias de aplicación favorecen la presencia de T. asperellum en el suelo.
En cuanto a las frecuencias de aplicación evaluadas, se observó que en condiciones controladas los regímenes de aplicación cada 2 y 4 días presentaron mayor presencia en el suelo al día 23 (figura 1; L1 y L2), al obtener concentraciones finales de 5x106 y 5.8x106 UFC.g-1 de suelo, respectivamente. Para el ensayo en campo, el régimen de aplicación cada 7 días presentó el valor máximo de presencia al día 21 con 2.25 x105 UFC.g-1 de suelo, y no se observaron diferencias significativas con el día 28, lo cual indica que durante este período se presentó la mayor biodisponibilidad de conidias del hongo en el suelo. Al aplicar cada 15 días, no se observaron diferencias drásticas entre las concentraciones (figura 3). Este régimen de aplicación se asemeja a las frecuencias de
aplicación utilizadas comúnmente en un cultivos comerciales; por lo tanto, con estas evaluaciones se comprobó la persistencia del bioformulado a base de Trichoderma asperellum, aún en las condiciones adversas propias de un ambiente agrícola. El ensayo en condiciones de campo evidenció que una frecuencia de aplicación cada 7 días refleja de mejor manera lo acontecido en suelos agrícolas, y facilita la presencia y establecimiento de T. asperellum en la rizósfera.
Conclusiones
La concentración del inóculo de T. asperellum es un factor determinante para aumentar la biodisponibilidad de conidias en el suelo; de tal manera, a mayor concentración se podrá asegurar la densidad adecuada de propágulos que podrán ejercer biocontrol sobre los fitopatógeno.
En condiciones de laboratorio, se encontró que frecuencias cortas de aplicación favorecen la presencia de T. asperellum, y benefician el proceso de renovación de propágulos viables para el control biológico. Esta tendencia fue consistente en el ensayo en condiciones de campo. Resulta trascendental realizar estudios que pretendan conocer a fondo la ecología de este microorganismo, y que permitan dilucidar las interacciones biológicas en las cuales está constantemente involucrado Trichoderma asperellum.
Agradecimientos
A la Corporación para Investigaciones Biológicas por facilitar del material biológico. Este trabajo fue posible, gracias al soporte financiero de Colciencias: Proyecto # 15959-Contrato 298 de 2008 y a la Dirección de Laboratorios de la Universidad Nacional de Colombia, sede Medellín.
Referencias bibliográficas
Anees, M.; Tronsmo, A.; Edel-Hermann, V.; Hjeljord, L. G.; Héraud, C. y Steinberg, C. (2010). Characterization of field isolates of Trichoderma antagonistic against Rhizoctonia solani. Fungal Biology, 114, 691-701. [ Links ]
Antal, Z.; Manczinger, L.; Szakacs, G.; Tengerdy, R. y Ferenczy, L. (2000). Colony growth, in vitro antagonism and secretion of extracellular enzymes in cold-tolerant strains of Trichoderma species. Mycological Research, 104(5), 545-549. [ Links ]
Ardores, R. y Mamani, C. (2008). Evaluación del hongo Trichoderma spp, en el control de Rhizoctonia solani (damping off) en la provincia Caranavi. Memorias del Simposio: Café Amigable con la Naturaleza (marzo: 2008: Yapacani, Santa Cruz), 1-11. [ Links ]
Bulluck III, L. R.; Brosius, M.; Evanylo, G. K. y Ristaino, J. B. (2002). Organic and synthetic fertility amendments influence soil microbial, physical and chemical properties on organic and conventional farms. Applied Soil Ecology, 19, 147-160. [ Links ]
De Respinis, S.; Vogel, G.; Benagli, C.; Tonolla, M.; Petrini, O. y Samuels, G. J. (2010). MALDITOF MS of Trichoderma: A model system for the identification of microfungi. Mycologycal Progress, 9, 79-100. [ Links ]
Hoyos-Carvajal, L.; Orduz, S. y Bisset, J. (2009). Genetic and metabolic biodiversity of Trichoderma from Colombia and adjacent neotropic regions. Fungal Genetics and Biology, 46, 615-631. [ Links ]
Jaklitsch, W. M. y Voglmayr, H. (2015). Biodiversity of Trichoderma (Hypocreaceae) in Southern Europe and Macaronesia. Studies in mycology, 96, 1-87. [ Links ]
Kredics, L.; Manczinger, L.; Antal, Z.; Pénzes, Z.; Szekeres, A.; Kevei, F. y Nagy, E. (2004). In vitro water activity and pH dependence of mycelial growth and extracellular enzyme activities of Trichoderma strains with biocontrol potential. Journal of Applied Microbiology, 96, 491-498. [ Links ]
Moghaddam, S.; Shaigan, S. y Seraji, A. (2008). Identification and investigation on antagonisc effect of Trichoderma spp. on tea seedlings white foot and root rot (Sclerotium rolsfii Sacc) in vitro condition. Pakistan journal of biological science, 11(19), 2346-2350. [ Links ]
Skekeres, A.; Leitgeb, B.; Kredics, L.; Manczinger, L. y Vágvőlgyi, C. (2006). A novel, image analysis-based method for the evaluation of in vitro antagonism. Journal of microbiological methods, 65(3), 619-622. [ Links ]
Thangavelu, R.; Palaniswami, A. y Velazhahan, R. (2004). Mass production of Trichoderma harzianum for managing fusarium wilt of banana. Agriculture, Ecosystems and Environment, 103, 259-263. [ Links ]
USDA the United States Department of Agriculture. (1999). Soil taxonomy, a basic system of soil classification for making and interpreting soil surveys. USDA Handbook Natural Resources Conservation Service, Segunda edición, 436. [ Links ]
Vargas-Hoyos, H. A.; Rueda-Lorza, E. A. y Gilchrist-Ramelli E. (2012). Actividad antagónica de Trichoderma asperellum (Fungi: Ascomycota) a diferentes temperaturas. Actualidades Biológicas, 34(96), 103-112. [ Links ]
Verma, M.; Brar, S. K.; Tyagi, R. D.; Surampalli, R. Y. & Valéro, J. R. (2007). Antagonistic fungi, Trichoderma spp.: Panoply of biological control. Biochemical Engineering Journal, 37, 1-20. [ Links ]