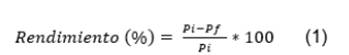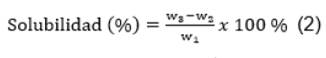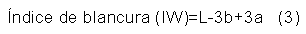Introducción
Los gusanos de seda Bombixmori son insectos lepidópteros originarios de China, cuyos capullos les proporcionan protección mecánica para realizar su metamorfosis (Danks, 2004). La seda comercial proviene del procesamiento de dichos capullos (Cifuentes & Sohn Wook, 1998). Esta fibra se compone de dos proteínas principales, fibroína (70% 80%) y sericina (20%-30%) (Patel & Modasiya, 2011). La fibroína es una proteína fibrosa presente en forma de doble filamento, los cuales están unidos por enlaces disulfuro y envueltos por sucesivas capas adhesivas de sericina, que es una proteína globular que ayuda en la formación del capullo (Ki, Kim, Oh, Lee & Park, 2007; Poza, Pérez Rigueiro, Elices & Lorca, 2002; Wu, Wang & Xu, 2007).
La sericina se remueve de los filamentos de seda en un proceso conocido como desengomado, el cual se basa originalmente en la solubilidad de la proteína en agua caliente. Este proceso tiene por objetivo remover parte del color amarillo y la rigidez de las fibras, otorgando a las muestras un aspecto suave y brillante (Lee, Kim, Um & Lee, 2011). El desengomado se puede realizar pordiversos métodos que varían en la técnica empleada y en las características del producto que se obtiene, principalmente en el peso molecular y en la pureza de la muestra. Una de las técnicas se basa, principalmente, en su solubilidad en agua caliente, otras emplean detergentes, álcalis, ácidos, enzimas proteolíticas alcalinas, sistemas de calentamiento infrarrojo o tecnologías desonicación (Miguel, 2014). Su extracción en agua caliente, con un alto rendimiento, se ha logrado utilizando altas temperaturas y presiones con el uso de un autoclave, esta técnica presenta la ventaja de no requerir procesos posteriores depurificación (Aramwit, Siritientong & Srichana, 2012).
En la industria de la seda la sericina es generalmente considerada un residuo, por lo que, luego del proceso de desengomado, es descartada y vertida en efluentes acuosos (Kundu et al., 2008). En Colombia, a pesar de que la producción de seda se lleva a cabo a nivel artesanal, estos vertimientos se suman a los problemas de contaminación del medio ambiente, contribuyendo principalmente a la demanda química y bioquímica de oxígeno (DQO/DBO) en las aguas residuales. Es importante tener en cuenta que la recuperación de la sericina podría representar un beneficio no solo ambiental, sinotambién económico y social (Kundu et al., 2008), debido a que, gracias a sus propiedades, puede ser aprovechada industrialmente en el área de la medicina, en la industria alimenticia o de cosméticos, entre otras.
Por ser una proteína natural, la sericina es susceptible a la acción de enzimas proteolíticas, por lo tanto es digerible, biocompatible y biodegradable (Padamwar & Pawar, 2004). Puede tener actividad anticoagulante, fibrinolítica y de antiagregación. Se ha encontrado que la sericina posee propiedades para la cicatrización de heridas (Wu et al., 1996); también ha sido usada en cosméticos para la obtención de lociones y cremas mostrando un aumento en la elasticidad de la piel y un efecto antiarrugas y antienvejecimiento (Padamwar & Pawar, 2004). Adicionalmente, se ha reportado que la sericina puede ser aprovechada en el área de los alimentos debido a que posee propiedades como actividad antioxidante y antitirosinasa (Capar, Aygun & Gecit, 2008, Manosroi, Boonpisuttinant, Winitchai, Manosroi&Manosroi, 2010), entre otras. Por ejemplo, se han desarrollado investigaciones para evaluar su incorporación en productos de panificación y vinagretas (Takechi, Maekawa & Sugimura, 2011; Takechi, Wada, Fukuda, Harada, STakamura, 2014).
Por todo lo antes descrito, este proyecto tiene como objetivo evaluar las propiedades de la sericina de seda colombiana extraída con agua caliente en autoclave y secada por aspersión. Se va a trabajar con hilos, ya que en Colombia la empresa que transforma la seda (CORSEDA) hace el proceso de desengomado sobre estos. Además, la literatura generalmente trabaja sobre sericina extraída de capullos, por lo que las propiedades de la sericina extraída de hilos de seda son aún poco conocidas. El método de secado se seleccionó ya que permite obtener un material de calidad, con buena presentación y de fácil manejo (Siccha & Ugaz, 1995).
En este trabajo se determinaron propiedades como: solubilidad, actividad acuosa, color, punto isoeléctrico, contenido de proteína y actividad antimicrobiana, con el fin de buscar alternativas futuras para el aprovechamiento de este residuo en el desarrollo de productos de alto valor agregado para las industrias alimenticia, farmacéutica y de cosméticos.
Materiales y métodos
Obtención del material. La sericina fue extraída a partir de hilos de seda sin desengomar, los cuales fueron adquiridos en la Corporación para el Desarrollo de la Sericultura del Cauca (CORSEDA), Popayán Colombia.
Extracción y secado de la sericina. Para la extracción de la sericina se trabajó con una relación de baño 1:30 (p/v) de acuerdo con ensayos preliminares, utilizando madejas de hilos de seda secas y agua destilada. El desengomado se llevó a cabo en un autoclave a vapor (All American 25X-1), la muestra se mantuvo a una presión de 15 PSI y una temperatura de 105 °C por 30 minutos (Padamwar & Pawar, 2004). Terminado el tiempo de tratamiento, la solución resultante se separó de las madejas de hilos y se filtró con papel filtro de celulosa (whatman N° 4) para retirar cualquier impureza que pudiera contener. Los hilos se secaron en un horno de convección forzada a 105 °C hasta alcanzar peso constante y, posteriormente, el rendimiento de extracción de las muestras se calculó empleando las diferencias de peso de los hilos de seda obtenidos antes y después del proceso de desengomado, como se observa en la ecuación 1.
Donde, Pi es el peso madeja seca antes de extracción y Pf el peso madeja seca después de extracción.
Con el fin de obtener la sericina en polvo, la solución obtenida fue secada por aspersión en un Mini Spray Dryer (BUCHI-B 290). La solución fue bombeada en la cámara de secado con un caudal de 6,30mL/min, a una temperatura de entrada de 160 °C y flujo de aspersión de 40 m3/h de acuerdo con ensayos realizados preliminarmente.
Morfología. La morfología de la superficie de los hilos desengomados y de la sericina seca fue observada utilizando un microscopio electrónico de barrido en alto vacío con un detector de electrones secundarios (JEOL JSM-6490LV). Antes de la observación se realizó un recubrimiento delgado en oro hasta lograr un espesor aproximado de 7 nm (ENTON VACUUM Desk IV). Posteriormente, las muestras fueron fijadas en una cinta de grafito. El voltaje de aceleración para la imagen fue 20 kV. Las imágenes fueron capturadas con unas ampliaciones de 1000x y 3000x. La observación de los hilos se realizó sobre muestras longitudinales transversales. Para este último, los hilos fueron cortados usando un micrótomo.
Determinación del contenido de proteína. Sedeterminó mediante el método Kjeldahl. La prueba se realizó utilizando 0.50 g de muestra. Esta metodología está compuesta por 3 fases: digestión, destilación y titulación. La digestión se realizó en un equipo Kjeldahl DKL heating digestor (Velp Scientifica), la destilación se llevó a cabo en UDK 149 (Velp Scientifica) y la titulación se realizó empleando HCl estandarizado al 0.0940 M.
Determinación del punto isoeléctrico. Sesolubilizaron tres muestras de sericina en polvo y agua destilada, bajo agitación magnética entre 500 700 rpm a 90 °C por 30 min. Las soluciones formadas se centrifugaron en una centrífuga (EBA 20 HETTICH Zentrifugue) a 6000 rpm durante 15 min. Se reunieron los sobrenadantes y se tomaron 6 alícuotas de 5 ml cada una, las cuales se llevaron a diferentes pHs desde 5,10 hasta 2,70. Posteriormente cada alícuota se centrifugó a 6000 rpm durante 20 min y se recuperaron los sobrenadantes para determinar el porcentaje de proteína contenido en cada alícuota por el método de biuret (Gonçalvess et al., 1997). Previo a los ensayos se realizó una curva de calibración utilizando una solución estándar de proteína (sericina comercial S5201-1G SIGMA-ALORICH). Las alícuotas mezcladas con el reactivo de biuret se dejaron en reposo por 30 min a temperatura ambiente para el desarrollo del color, posteriormente se leyó su absorbancia a 550 nm en un espectrofotómetro ultravioleta-visible.
El punto isoeléctrico se determinó como el pH de la alícuota del sobrenadante de la solución de sericina en la cual se obtuvo la menor concentración de proteína. Esto se debe a que, a ese valor, la proteína no tiene carga eléctrica y es incapaz de desplazarse en un campo eléctrico, por lo que no existe repulsión electrostática entre las moléculas de proteína vecinas y, por tanto, tienden a precipitarse (Serpa, Hincapié& Álvarez, 2014).
Actividad antimicrobiana. Para evaluar el potencial antimicrobiano de la sericina se empleó el método de dilución en agar (Ramírez & Marín, 2009). Se tomó una muestra de 0,25 g de la muestra en polvo, la cual fue rehidratada con 5 ml de agua destilada, a partir de la cual se obtuvieron soluciones con concentraciones al 5%; 2,50% y 1% de sericina, denominadas C1, C2 y C3 respectivamente.
Las cepas testeadas se obtuvieron del cepario del GRAIN -UPB. Se emplearon los siguientes especímenes bacterianos: Escherichia coli TCC 25982 (B1), Estafilococo aureus ATCC 6538 (B2), Pseudomona fluorescens (B3) y la levadura Candida guilliermondii (L1).
El agar Mueller-Hinton se inoculó por el método de siembra en profundidad con la suspensión bacteriana (turbidez equivalente al patrón 0,50 McFarland), y con dos controles (positivo: amoxicilina 10% y negativo: agua estéril). Con un sacabocados estéril se perforó el medio de cultivo hasta el fondo de la caja de petri obteniéndose un pozo de 6 mm de diámetro. Se evaluó una concentración por caja (triplicado). En cada pozo se inocularon 20 uL de la concentración a probar, usando un pozo para agua estéril como control negativo. Los medios fueron incubados a una temperatura aproximada de 37 °C durante 18 24 h. Finalmente se realizó la lectura de la susceptibilidad antimicrobiana por observación y medición del halo de inhibición alrededor de cada pozo.
Solubilidad. Se pesaron aproximadamente 0.50 g de sericina en tubos falcon y se mezclaron con 10 mL de agua destilada. Las muestras se calentaron a 30, 60 y 90 °C por 30 min. Transcurrido este tiempo las muestras se centrifugaron a 6000 rpm durante 15 min. Posteriormente, se separó el precipitado del sobrenadante, llevando este último a un horno de convección forzada hasta llegar a peso seco. El cálculo de solubilidad se realizóutilizando la ecuación 2.
Donde W1, W2 y W3, representan el peso de la muestra en polvo (g), el peso de la cápsula de porcelana (g) y el peso de la cápsula con el sobrenadante seco (g), respectivamente.
Actividad acuosa (aw). Esta prueba se realizó por el método AOAC 978.18., empleando 0,60 g de polvo de sericina seca y una lectura directa en un equipo HYGROPALM modelo aw1.
Colorimetría. Se realizó una lectura directa sobre una muestra de 0,50 g de sericina, empleando un espectrofotómetro de esfera (X-RITE modelo SP-60). Esta prueba se realizó por el método de coordenadas Commision Internationale de l'Éclairage (CIE) L*a*b* en materiales sólidos; donde L* es un indicador de la luminosidad, a* representa la cromaticidad verde (-) a rojo (+) y b* representa la cromaticidad azul (-) a amarillo (+). Además, se le calculó el índice de blancura (IW) como se muestra en la ecuación 3 (Montoya-López, J., Giraldo-Giraldo, G. A., & Lucas-Aguirre, 2012).
Las pruebas de solubilidad, actividad acuosa y color se realizaron por triplicado. Además, se realizó un análisis de varianza (ANOVA) con tres tratamientos (30, 60 y 90 °C) y tres repeticiones para validar diferencias estadísticamente significativas para las pruebas de solubilidad, utilizando el software Statgraphics Centurión XVI.
Resultados
Después de la extracción de la sericina de seda, se obtuvo una solución en la cual se observó que, al disminuir la temperatura, esta se gelificaba -propiedad que ha sido observada por diferentes autores (Zhu, Arai, & Hirabayashi, 1995; Padamwar & Pawar, 2004)-. Con base en lo anterior, el secado de la sericina por aspersión se realizó manteniendo la solución extraída a una temperatura no inferior a 40 °C.
De acuerdo con los cálculos de rendimiento de extracción, el proceso de desengomado en autoclave removió aproximadamente 27,50% del peso de la muestra, correspondiente a la sericina y a otras sustancias presentes en el capullo como son carbohidratos, ceras y pigmentos (Mondal, Trivedy, & Kumar 2007), los cuales se encuentranen bajas concentraciones.
Morfología de los hilos desengomados y la sericina secada por aspersión. La remoción de la sericina de los hilos de seda puede ser evidenciada en la gráfica 1 en la que, claramente, los hilos engomados se observan con una capa rugosa (izquierda), correspondiente a la sericina que recubre a la fibroína, mientras que los hilos desengomados presentan una superficie lisa (medio). De acuerdo con lo observado en el corte transversal, aun después del desengomado, los hilos conservan porciones de sericina, lo cual se evidencia en la capa irregular no definida que se observa a uno de los lados de los cortes del hilo (derecha).

Gráfica 1 Morfología superficial de los hilos de seda. Vista longitudinal a) hilos engomados (izquierda) y desengomados (medio); y c) corte transversal hilos desengomados (derecha)
Contenido de proteína y punto isoeléctrico. El porcentaje de proteína en la sericina fue del 99,50% en base seca y su punto isoeléctrico (PI) de 4,07.
Actividad antimicrobiana. Después de las 24 h de incubación de los microorganismos, se observó que para ninguna de las tres concentraciones de sericina utilizadas (C1, C2 y C3) se presentó un halo de inhibición y, por el contrario, se presentó crecimiento microbiano. En las cajas de Petri, cuyo contenido carecía de solución de sericina, se presentó crecimiento microbiano de cada una de las cepas estudiadas. En las cajas A, que contenían el control positivo, se observó la formación de un halo de inhibiciónalrededor del pozuelo, lo cual confirmó la actividad antimicrobiana del antibiótico con los microorganismos estudiados.
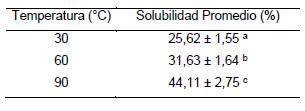
Solubilidad. En la tabla 1 se aprecian los resultados de solubilidad de la sericina a tres temperaturas diferentes. Se observó que entre mayor es la temperatura, mayor es la solubilidad. Se obtuvo que para una temperatura de 30 °C la sericina tiene un promedio de 25,62% de solubilidad, mientras que, para una temperatura de 90 °C, el promedio incrementa hasta 44,11%. De acuerdo con la ANOVA realizada, los resultados con diferente letra indican que si existe una diferencia estadísticamente significativa entre las tres temperaturas de solubilidad utilizadas.
Actividad Acuosa. Esta actividad corresponde al contenido de agua disponible en la sericina, la cual es capaz de permitir el crecimiento de los microorganismos en esta proteína (Moreno & Benavides, 1988). Teniendo en cuenta los resultados obtenidos se tiene que la sericina en polvo secada por aspersión tiene una actividad acuosa promedio de 0,29 ± 0,03.
Color. Los resultados obtenidos por la prueba de color mostraron que la sericina estudiada en este trabajo presenta un promedio de luminosidad de 89,55 ± 0,20, un índice de blancura de 75,39 y valores a* y b* de +0,44 ± 0,04 y +5,16 ± 0,30 respectivamente. Los resultados indican que la muestra presenta alta luminosidad (L), y una tendencia al color amarillo (b*).
Discusión
Cuando la sericina se extrae en autoclave, sale del equipo a temperaturas superiores a los 90 °C, sin embargo, mientras se lleva a cabo el proceso de secado por aspersión, esta temperatura disminuye aumentando la viscosidad de la muestra hasta formar un gel, condición que impide el proceso de bombeo al equipo de secado. Se ha reportado que la gelación de la sericina ocurre a bajas temperaturas (<10 °C) y bajos pHs (6-7) (Aramwit et al., 2012). La concentración de la muestra también juega un papel importante. Por ejemplo, se ha observado que por encima del 1%, la gelación de la solución se pude dar en un día y puede formar agregados fácilmente a temperatura ambiente hasta precipitar (Kim et al., 2012). La gelación de la sericina, que es un mecanismo de autoensamblaje de las regiones cristalinas hoja  físicamente reticuladas, se debe a cambios en su estructura secundaria. La sericina nativa posee una región amorfa de espirales al azar (fácilmente soluble) y una región cristalina denominada hoja (difícil de disolver), la cual predomina a bajas temperaturas (Dash, Ghosh, Kaplan, y Kundu, 2007). Cuando la muestra se somete a altas temperaturas se degradan las hojas
físicamente reticuladas, se debe a cambios en su estructura secundaria. La sericina nativa posee una región amorfa de espirales al azar (fácilmente soluble) y una región cristalina denominada hoja (difícil de disolver), la cual predomina a bajas temperaturas (Dash, Ghosh, Kaplan, y Kundu, 2007). Cuando la muestra se somete a altas temperaturas se degradan las hojas  , aumentando la solubilidad y movilidad de la sericina en agua caliente. Este fenómeno es reversible cuando se alcanzan nuevamente bajas temperaturas, lo que lleva a la formación de un gel de sericina.
, aumentando la solubilidad y movilidad de la sericina en agua caliente. Este fenómeno es reversible cuando se alcanzan nuevamente bajas temperaturas, lo que lleva a la formación de un gel de sericina.
De acuerdo con los resultados obtenidos, los valores de rendimiento de extracción, color, contenido de proteína, y el punto isoeléctrico de la sericina extraída de hilos de seda y secada por aspersión son similares con valores reportados por otros autores (Ribani, Gimenes & Scheer, 2012; Chollakup, Smitthipong, Mougin & Nardin, 2015; Gulrajani et al., 2009; Haggag, El-Sayed, & Allam, 2007). La prueba de actividad antimicrobiana contradice los resultados de otras investigaciones, y no se han encontrado reportes del aw ni de la solubilidad para poder hacer un análisis comparativo.
De acuerdo con la literatura, el rendimiento de extracción de la sericina usando autoclave está por encima del 20%, reportando valores hasta de un 25,7%. Los trabajos encontrados indican una relación directa de estos valores con el tiempo y la temperatura de trabajo (Rutherford & Harris, 1940; Padamwar & Pawar, 2004; Kurioka, Kurioka & Yamazaki, 2004; Silva, Ribani, Gimenes & Scheer, 2012). De acuerdo a estos reportes, el rendimiento de extracción alcanzado en este trabajo esbastante alto (27,50%).
La morfología que presentó la sericina seca, coincide con la reportada por otros autores (Genc et al., 2009; Gulrajani, Purwar, Prasad & Joshi, 2009; Chollakup, Smitthipong, Mougin & Nardin, 2015). De acuerdo con la literatura, la estructura colapsada de las partículas es una consecuencia de la evaporación rápida del agua interna, lo cual deja una concentración de gotas que tienden a formar abolladuras (Gulrajani et al., 2009). En el caso del contenido proteico, se ha reportado que la sericina extraída con agua caliente en autoclave también juega un papel importante. Por ejemplo, se ha observado que por encima del 1%, la gelación de la solución se pude dar en un día y puede formar agregados fácilmente a temperatura ambiente hasta precipitar (Kim et al., 2012). La gelación de la sericina, que es un mecanismo de auto ensamblaje de las regiones cristalinas hoja  físicamente reticuladas, se debe a cambios en su estructura secundaria. La sericina nativa posee una región amorfa de espirales al azar (fácilmente soluble) y una región cristalina denominada hoja (difícil de disolver), la cual predomina a bajas temperaturas (Dash, Ghosh, Kaplan, y Kundu, 2007). Cuando la muestra se somete a altas temperaturas se degradan las hojas, aumentando la solubilidad y movilidad de la sericina en agua caliente. Este fenómeno es reversible cuando se alcanzan nuevamente bajas temperaturas, lo que lleva a la formación de un gel de sericina.
físicamente reticuladas, se debe a cambios en su estructura secundaria. La sericina nativa posee una región amorfa de espirales al azar (fácilmente soluble) y una región cristalina denominada hoja (difícil de disolver), la cual predomina a bajas temperaturas (Dash, Ghosh, Kaplan, y Kundu, 2007). Cuando la muestra se somete a altas temperaturas se degradan las hojas, aumentando la solubilidad y movilidad de la sericina en agua caliente. Este fenómeno es reversible cuando se alcanzan nuevamente bajas temperaturas, lo que lleva a la formación de un gel de sericina.
De acuerdo con los resultados obtenidos, los valores de rendimiento de extracción, color, contenido de proteína, y el punto isoeléctrico de la sericina extraída de hilos de seda y secada por aspersión son similares con valores reportados por otros autores (Ribani, Gimenes & Scheer, 2012; Chollakup, Smitthipong, Mougin & Nardin, 2015; Gulrajani et al., 2009; Haggag, El-Sayed, & Allam, 2007). La prueba de actividad antimicrobiana contradice los resultados de otras investigaciones, y no se han encontrado reportes del aw ni de la solubilidad para poder hacer un análisis comparativo.
De acuerdo con la literatura, el rendimiento de extracción de la sericina usando autoclave está por encima del 20%, reportando valores hasta de un 25,7%. Los trabajos encontrados indican una relación directa de estos valores con el tiempo y la temperatura de trabajo (Rutherford & Harris, 1940; Padamwar & Pawar, 2004; Kurioka, Kurioka & Yamazaki, 2004; Silva, Ribani, Gimenes & Scheer, 2012). De acuerdo a estos reportes, el rendimiento de extracción alcanzado en este trabajo esbastante alto (27,50%).
La morfología que presentó la sericina seca, coincide con la reportada por otros autores (Genc et al., 2009; Gulrajani, Purwar, Prasad & Joshi, 2009; Chollakup, Smitthipong, Mougin & Nardin, 2015). De acuerdo con la literatura, la estructura colapsada de las partículas es una consecuencia de la evaporación rápida del agua interna, lo cual deja una concentración de gotas que tienden a formar abolladuras (Gulrajani et al., 2009). En el caso del contenido proteico, se ha reportado que la sericina extraída con agua caliente en autoclave presenta un alto porcentaje de esta (98,7%) (Gulrajani et al., 2009), en comparación con muestras extraídas por otras técnicas tales como desengomado con licores alcalinos (92%) y con jabón alcalino (58%). Otros autores han observado que la sericina obtenida de aguas provenientes del desengomado, precipitadas con etanol y deshidratadas por liofilización, pueden contener hasta un 91,6% de proteína (Jin-Hong, Zhang & Shi-Ying, 2007). En cuanto al punto isoeléctrico, se observó que este se encuentra cercano al dato teórico, el cual está en el límite 3,9-4,3 ya que esta es una proteína anfótera (Voegeli, 1993; Haggag et al., 2007). De acuerdo con la literatura este valor puede variar según el método de extracción (Aramwit, Kanokpanont, Nakpheng & Srichana, 2010).
Teniendo en cuenta los resultados de actividad antimicrobiana, se puede afirmar que la sericina extraída de hilos de seda colombiana, bajo las condiciones indicadas en el presente estudio, no posee dicha actividad para las cepas estudiadas en las concentraciones señaladas. Con el fin de descartar el efecto de la concentración, se realizó una prueba adicional utilizando sericina en polvo sin solubilizar. Los resultados obtenidos fueron igualmente negativos.
Estudios de diferentes investigadores muestran actividad antimicrobiana de la sericina frente a bacterias Gram negativas como Escherichiacoli y bacterias Gram positivas como Bacillussubtilis (Aramwit et al., 2012; Zhao et al., 2014). Otros autores han reportado que la seda de gusano de seda contiene, además de sericina y fibroína, otros componentes que han sido identificados, estos incluyen enzimas, inhibidores de proteasas, seroínas y proteínas de función desconocida (Dong et al., 2016). De estos componentes se sabe que hay abundantes proteínas antimicrobianas, incluyendo los inhibidores de proteasa (actividad antifúngica) y las seroínas (actividad antiviral y antibacteriana). Teniendo en cuenta este hecho, y que las propiedades de la sericina dependen de las características genéticas y modificables del gusano de seda, las cuales se dan por el lugar de producción, el manejo del ambiente (temperatura, humedad ambiental, aire, iluminación) y las características del alimento que se les ofrezca (Pescio et al., 2009), es importante considerar que por la domesticación del gusano de seda en Colombia, esta especie no produce moléculas proteicas con dichas características, ya que el ambiente en el que se desarrolla no lo requiere. No obstante, se necesita una investigación más detallada a fin de determinar cuál es la razón por la cual la sericina extraída en este trabajo no presenta actividad antimicrobiana.
En cuanto a la solubilidad, se sabe que la estructura de la sericina está conformada principalmente por espirales al azar, que le otorgan una solubilidad en agua a 50-60 °C (Padamwar & Pawar, 2004), y una menor cantidad de hojas p. Esta última es insoluble en agua fría, pero las altas temperaturas la degradan, aumentando la solubilidad de la sericina en agua caliente (Kundu et al., 2008). Este comportamiento es reversible y, por tanto, al bajar la temperatura, la solubilidad de la sericina disminuye debido a que sus moléculas de espirales al azar son transformadas en hojas p (Aramwit et al., 2012; Padamwar & Pawar, 2004).
Hasta ahora, en la bibliografía no se han encontrado valores de solubilidad de la sericina secada por aspersión; sin embargo, en estudios anteriores se ha descrito que su solubilidad se puede clasificar en A, B y C, que representan, respectivamente, la capa más externa, la capa intermedia y la capa más adyacente a la fibroína. De estas, la sericina A es la más soluble en agua caliente, y la sericina C es la más insoluble, la cual solo se remueve con tratamientos calientes a altas presiones o con álcalis (Padamwar & Pawar, 2004; Miguel, 2014).
De acuerdo con los resultados obtenidos se podría decir que la sericina solubilizada es de tipo A, la cual es la más soluble en agua caliente; y de tipo B, debido a que la extracción se realiza a alta presión. La sericina tipo C, que es aquella que presenta mayor resistencia a solubilizarse, se puede asociar, como se mostró en las imágenes de SEM, con aquellas fracciones que se conservan sobre la muestra luego del desengomado. Para poder solubilizar esta sericina remanente, la proteína debería ser sometida a una mayor presión, bajo la presencia de soluciones ácidas o alcalinas fuertes (Urribarrí, Ferrer & Colina, 2004). Otros de los factores que altera la solubilidad de la sericina es la presencia de estructura p-hoja, la cual puede ser afectada por el método de secado utilizado (Tsukada 1980; Kim et al., 2012).
De acuerdo con los resultados obtenidos, se puede afirmar que el agua disponible en la sericina seca es agua que se encuentra débilmente ligada, debido a que su aw se encuentra entre 0,20 y 0,75 (Acosta, 2008), y supondría una multicapa de moléculas de agua unidas por puentes de hidrógeno a la monocapa en contacto directo con constituyentes no acuosos. Esta agua débilmente ligada supone la mayor parte de la esfera de hidratación de la proteína (Rodríguez & Magro, 2008).
Teniendo en cuenta lo anterior, se tiene que la sericina extraída del hilo de seda y secada por aspersión a las condiciones de este trabajo, es una proteína resistente a la alteración microbiana, debido a que su aw se encuentra en niveles inferiores a 0,85 (Acosta, 2008). También es importante mencionar que la sericina secada por aspersión, al quedar con humedades tan bajas, absorbe fácilmente humedad del ambiente, lo cual llevaría a un cambio de su aw, y por lo tanto afectar su conservación, por esta razón, esta proteína debe ser almacenada en empaques con barrera a la humedad.
Generalmente el color corresponde a una percepción e interpretación subjetiva para cada persona, por lo tanto, se debe expresar en términos numéricos y objetivos, y de esta manera se asegura que la muestra cumpla con un estándar. Kurioka y otros (2004) evaluaron el color de sericina de seda, extraída con ácido cítrico (SSac) y álcali (SSal) y secada por liofilización, utilizando el sistema de coordenadas CIE L*a*b*. Los resultados obtenidos por los investigadores (ver Tabla N°2) evidencian una muestra con alta luminosidad, y una tendencia al amarillo, lo que coincide con los valores obtenidos en el presente estudio, donde la coordenada a* es cercana a cero (+0,44) y la coordenada b* está entre los valores de estas investigaciones (+5,16), al igual que la luminosidad (89,55) (Ramírez-Navas, 2010). Al calcular los índices de amarillamiento de estas muestras (ver tabla N°2) se puede corroborar que ellas no tienen un color blanco ideal, sino que presentan un color blanco amarillento, el cual se puede deber a la presencia de pigmentos (Mondal, Trivedy, & Kumar 2007).
Tabla N°2 Prueba de colorimetría evaluada sobre sericina extraída con ácido cítrico (SSac) y álcali (SSal)
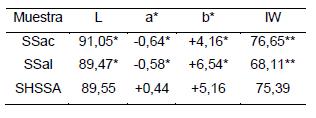
Tomado de: Kurioka et al., 2004 Valores calculados en este trabajo
Teniendo en cuenta los resultados de la Tabla N°2, se puede afirmar que, a diferencia de otras propiedades de la sericina, el color no varía según el método de extracción y secado de una manera significativa, por lo menos comparando estos tres métodos.
Conclusiones
En este estudio se obtuvo sericina de seda por un método de extracción que proporciona menor contenido de impurezas en comparación con otros métodos de extracción, lo cual se puede ver reflejado en el alto contenido proteico obtenido en la sericina analizada. Se encontró que la muestra presenta un punto isoeléctrico con un valor de 4,07, y una solubilidad parcial, dependiente de la temperatura. Al tener un aw de 0,29 ± 0,03, esta muestra no es propensa al ataque de microorganismos, y su color blanco amarillento, con luminosidad alta, es una característica importante que puede ser aprovechada en diferentes industrias (alimentos, cosméticos, fármacos).
En este estudio no se logró evidenciar la actividad antimicrobiana de la sericina de seda secada por aspersión a las concentraciones evaluadas, por lo tanto, para futuros trabajos se sugiere estudiar esta propiedad a concentraciones mayores, o bajo otras metodologías.