Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Ciencia
Print version ISSN 1794-9165
ing.cienc. vol.8 no.16 Medellín July/Dec. 2012
ARTÍCULO ORIGINAL
Estudio catalítico comparativo de los sistemas TiO2 y Nb2O5 · 3H2O en la degradación de cianuro en función del tipo de oxidante
Comparative Study of Catalytic Systems TiO2 and Nb2O5 · 3H2O in Cyanide Degradation According to Oxidant Type
Aida Liliana Barbosa López 1, Isel María Castro Sierra2
1 Ph.D en Ciencias Químicas, Programa de Química-Catálisis Química, abarbosal@unicartagena.edu.co, Universidad de Cartagena, Cartagena-Colombia. 2 Química y Estudiante de Maestría en Química , cexlicatruc@unicartagena.edu.co, Universidad de Cartagena, Cartagena-Colombia.
Recepción:01-jun-2012, Aceptación:25-oct-2012
Disponible en línea: 30-nov-2012
PACS:82.65+r
Resumen
La viabilidad del uso de otros agentes fotocatalizadores como el niobio, radica en disminuir las energías altas de la banda prohibida para hacerlo competitivo frente al TiO2, sin embargo la presencia de coayudantes de oxidación, tales como H2O2 y O3 podrían presentar resultados sorprendentes en el desempeño catalítico, debido a una mayor generación del radicales OH·. La obtención de óxidos de mayor área y propiedades texturales diferentes al oxido de niobio comercial, mejoran su actividad catalítica en la remoción de cianuro libre. El trabajo presenta resultados experimentales de fotodegradación de cianuro 100mg=l sobre TiO2 Degussa P - 25 y Nb2O5 · 3H2O, usando un fotorreactor CPC con una capacidad de 4L de solución, usando como fuente de radiación la luz solar, tomando una inclinación igual a la latitud de Cartagena 10.45°, los resultados indicaron un claro efecto del pH, el tipo de catalizador y el coayudante de oxidación. La reducción de ion cianuro del efluente contaminado aumento por la adición del agente oxidante (O3 y H2O2). Sugiriendo una mayor susceptibilidad del cianuro libre, para oxidarse a cianato de forma indirecta, por una mayor generación de radicales hidroxilos, inducidos por la presencia de H2O2 o del O3 bajo radiación solar. Se obtuvo porcentajes de oxidación fotocatalítica de cianuro libre, entre el 64% y 72% usando Nb2O5 · 3H2O y un rango entre 67% y 71% usando TiO2 Degussa P - 25. Los catalizadores fueron caracterizados estructuralmente usando DRX, BET,Raman e FT-IR, con la finalidad de correlacionar los cambios morfológicos con el desempeño catalítico.
Palabras claves: fotocatálisis, ozono, oxido de niobio, oxido de titanio, peróxido de hidrógeno.
Abstract
This article discusses the viability of using agents such as niobium photocatalyst in decreasing higher energy of the band gap. To do so competitively with TiO2, the presence of oxidation helpers such as H2O2 and O3 could present surprising results in the catalytic performance due to higher generation of OH o radicals. Oxidation helpers are shown to assist in obtaining larger area oxides and textural properties different from commercial niobium oxide, and enhancing its catalytic activity in free cyanide removing. The article presents experimental results of cyanide photodegradation of 100mg/l with Degussa P- 25 TiO2 and Nb2O5·3H2O, using a type CPC photoreactor and sunlight as the radiation source. Taking an inclination equal to Cartagena latitude of 10,450, the results show a clear effect of pH, catalyst type and oxidation auxiliar agent on photodegradation reaction. The ion cyanide reduction of polluted effluent was enhanced by oxidizing agent (O3 and H2O2) addition. This may suggest a greater susceptibility to free cyanide oxidation and cianate indirect oxidation due to higher hydroxyl radical generation, which was induced by H2O2 or O3 presence under solar radiation. The results showed free cyanide photocatalytic oxidation percentages between 64% and 72% using Nb2O5 · 3H2O and 67% and 71% using TiO2 Degussa P-25. The catalysts were characterized structurally by XRD, BET, Raman and FTIR, with the purpose of correlating morphological changes in catalytic performing.
Key words: photocatalysis, ozone, niobium oxide, titanium oxide, hydrogen peroxide
1 Introducción
El tratamiento de aguas contaminadas con compuestos químicos industriales que implique costo-beneficio y avances tecnológicos, se ha convertido en una necesidad del mundo moderno [1]. La presencia de agentes oxidantes como H2O2 en procesos avanzados de oxidación (PAOs), para la oxidación de cianuro fue estudiada por diversos autores [2],[3],[4],[5],[6],[7],[8],[9],[10],[11],[12]. El H2O2 es capaz de oxidar directamente el cianuro y algunos de los intermediarios, generando en el proceso de la reacción de oxidación radicales ·OH adicionales, los cuales también pueden atacar de una forma débil a complejos de cianuro con metales [13].
La combinación de H2O2 con tecnologías como ultrasonido (H2O2-ultrasonido), optimizan la generación de radicales y lo acumulan en el medio de reacción, para el posterior ataque del agente contaminante. Los métodos más empleados a nivel industrial incluyen; las combinaciones UV=H2O2 y TiO2=O3. Se han planteado el uso de otros oxidantes en procesos avanzados de oxidación (PAOs), cuya fuerza se estipula en los potenciales redox siguiendo el orden de magnitud: Flúor >Radical hidroxilo >Oxígeno atómico >Ozono >Peróxido de hidrógeno >Radical perhidroxilo >Permanganato >Dióxido de cloro >Ácido hipocloroso >Cloro >Bromo >Yodo [14]. Para usos especiales se ha empleado el ozono [3],[4],[5]. Estos oxidantes son utilizados para el tratamiento de aguas industriales textiles, que poseen una alta carga de compuestos orgánicos e inorgánicos de naturaleza recalcitrante [15]. Sin embargo su uso está restringido respecto a la concentración de H2O2, dado que posee una velocidad muy baja de transferencia de masa y requiere de mayor concentración para lograr una degradación efectiva [16], [17]. El uso combinado de H2O2 y O3 desinfecta, pero también induce a la formación de subproductos indeseados [7]. La fotodegradación catalítica de ion cianuro con H2O2 se lleva a cabo por vía oxidación, sugiriendo que la molécula de peróxido es fragmentada para formar radicales hidroxilos, de otra parte los iones cianuro libres reaccionan con las vacancias cationicas (h+) formando radicales libres que en presencia del radical hidroxilo produce incremento de la acidez y iones cianato [18]:
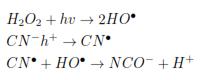
En tanto que el mecanismo de reacción con O3, estaría regida por las siguientes reacciones [4],[5]:
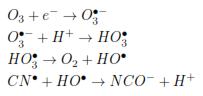
Óxidos semiconductores han sido empleados para la remoción fotocatalítica de cianuro libre [19],[20],[21], pero aun sigue siendo ampliamente usado el TiO2 [8],[22],[23],[24] : sin embargo sistemas basados en oxido de niobio hidratado han mostrado ser potencialmente útiles para oxidar ion cianuro a ion cianato y aniones inorgánicos como amonio y nitratos [25],[26],[27]. El propósito de esta investigación, fue realizar un análisis comparativo de la influencia del tipo de agente oxidante en la degradación de cianuro libre, utilizando como catalizador el óxido de titanio Deggusaa P-25 y pentóxido de niobio hidratado, con muestras preparadas en el laboratorio y empleando como agentes oxidantes H2O2 y O3 y sistemas luz solar=H2O2 y luz solar=H2O2=O3.
2 Metodología
2.1 Materiales y reactivos
Dos fuentes de óxidos semiconductores fueron utilizados: TiO2 Degussa P-25 (80 % anatasa y 20 % rutilo), 99 % de pureza y Nb2O5 · 3H2O, donado por CBMM (Compañía Brasilera de Metalurgia), 98 % pureza. Para los experimentos cinéticos se usó KCN (Panreac) como fuente de cianuro, HCl (Merck) y NaOH (Carlo Erba) grado reactivo para ajustar el pH entre 9,5 y 12.
2.2 Caracterización de los catalizadores
El área superficial de los catalizadores se determinó por el método Brunauer, Emmett y Teller (B.E.T), basado en la teoría de adsorción en multicapas, en un equipo ASAP Micromeritics 2010. La difracción de rayos-x (DRX), se realizó en un Rigaku miniflex, usando radiación Cu K (α)(λ = 1,5418A°),operado a 40 Kv y 30 mA para cuantificar y confirmar la presencia de las fases cristalinas. Los espectros infrarrojos se realizaron en un Infrared spectrophotometer SHIMADZU FT-IR-8400S (120V) empleando pastillas de KBr. Esta última técnica fue complementada por espectroscopia Raman que se realizó en un espectrofotómetro Dimensión P1 Raman System con Láser de Diodos (785 nm) para determinar la frecuencia de vibración de los enlaces Nb-O y Ti-O.
2.3 Experimental
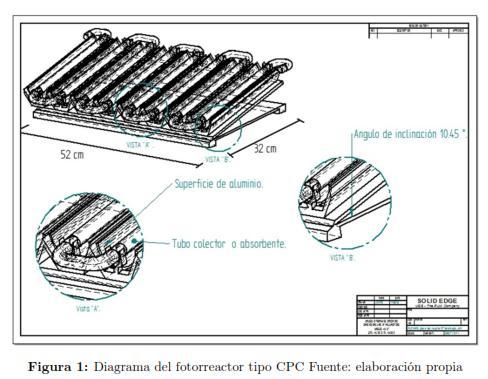
Los experimentos fueron llevados a cabo en un reactor tipo CPC con una capacidad de 4l de solución, compuesto de 5 tubos de borosilicato, con una inclinación igual a la latitud de Cartagena 10.450 (ver fig.1). La solución contaminante se impulsó hacia los tubos colectores por medio de una bomba tipo sumergible (con una tensión y frecuencia de 110V/60Hz-230V/50Hz, una potencia de 35 Watt, y una proporción de flujo constante de 200 a 250 l/h). El equipo de fotorreacción se expuso a la luz solar a cielo abierto. Los ensayos fotocatalíticos fueron realizados entre las 11:00 a.m. y 1:00 p.m, tomando muestras periódicamente para su posterior análisis.
2.3.1 Procedimiento analítico La determinación y cuantificación de la concentración de cianuro libre fue llevado a cabo mediante el método potenciométrico siguiendo el manual de métodos normalizados 4500-CN C [28], utilizando un potenciómetro de electrodo ión selectivo de cianuro marca HANNA Cyanide Ion Selective Electrode HI 4109 acoplado a un medidores de sobremesa pH/mV/°C HI 223. Las soluciones empleadas en cada uno de los ensayos de fotodegradación, se prepararon a una concentración de 100 mgCN-/l a partir de una solución patrón de 1000 mgCN-/l, la cual fue estandarizada con una solución de AgNO3 que previamente se titulo con una solución patrón de NaCl.
2.4 Diseño estadístico de experimentos
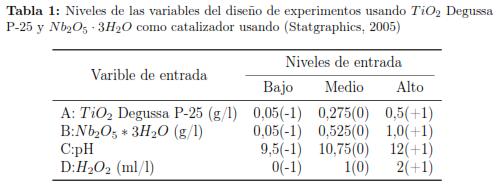
Los ensayos de fotodegradación de cianuro se basaron en un diseño estadístico de experimentos. Utilizando la metodología de superficie de respuesta tipo Box Behnken [30], para el diseño factorial de este tipo, se manejaron como variables de entrada un valor menor y uno mayor en el rango a utilizar en los experimentos, se usaron las letras A, B, C y D como convención que denotaban: A: la concentración de óxido de titanio Degussa P-25; B: la concentración de pentóxido de niobio; C: pH y D: concentración de peróxido de hidrogeno. Con el fin de establecer un comportamiento a lo largo de un rango de valores, el programa introduce un valor medio, que es la mitad del valor entre el menor y el valor más alto, los cuales son representados en la tabla 1. Para lograr finalmente la optimización de la respuesta (% degradación de cianuro) [29]. En la tabla 1 se muestran los niveles de las variables del diseño de experimentos usando TiO2 degussa P-25 y Nb2O5 · 3H2O como catalizador, pH y concentración de H2O2, fue colocado dentro de paréntesis los números -1, 0 y +1 a la derecha del valor tomado para cada variable, los cuales son las convenciones que utiliza un modelo factorial tipo Box Becken.
La optimización del proceso consistió en estudiar la respuesta de las combinaciones estadísticamente diseñadas, que se ajustaron mejor a las condiciones experimentales, logrando la predicción de la respuesta del modelo previamente ajustado, a las siguientes ecuaciones:
empleando TiO2 Degussa P-25 como catalizador:

Para llevar a cabo los ensayos con una mayor confiabilidad en los resultados, se mantuvieron algunas variables puntualizadas, por ejemplo la concentración inicial de la solución de cianuro (100mg/L) y el tiempo total de la fotorreacción (2 horas).
3 Resultados y discusión
3.1 Caracterización de los catalizadores
Los análisis texturales, tabla 2, muestran una ventaja del Nb2O5 · 3H2O, con relación al TiO2 Degussa P-25 siendo su superficie específica (SB.E.T) cerca de 3 veces mayor y un diámetro de poro 7.7 nm cercano al TiO2, lo que podría permitirle un mejor desempeño catalítico, sin embargo el volumen de poro (VP) es tan solo de 0.18 (cm3=l), cerca de 5 veces menor con relación al TiO2 Degussa P-25, restringiendo en parte la interacción con moléculas voluminosas como podría ser el ion cianuro.
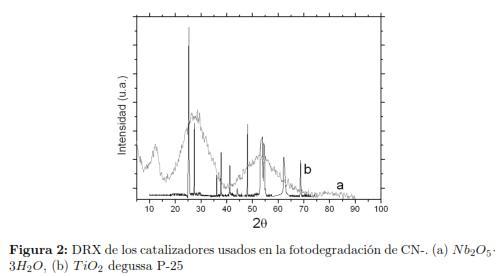
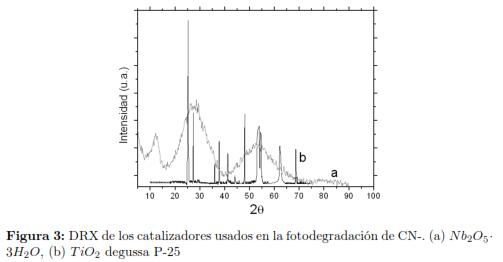
El análisis de DRX reveló que el TiO2 Degussa P-25, poseía una estructura cristalina con el pico agudo de mayor intensidad relativa en 2Θ = 25,30°, seguido por de mediana intensidad relativa en 2Θ = 48,10°, 53.90°,54.26° y 37.82° finalmente se apreciaron señales de baja intensidad relativa en 2Θ = 62,74° correspondientes a la fase anatasa bien desarrollada, con señales de mediana intensidad relativa en 2Θ = 27,46°,36.10°,41.22°,44.10° y 68.96° pertenecientes a la fase rutilo, de acorde con el porcentaje de mezcla de fases del TiO2 Degussa P-25 comercial (80% anatasa y 20% rutilo) [24],[31].
El Nb2O5·3H2O mostró un difractograma menos resuelto correspondiente a un sólido muy amorfo (ver fig. 2), en parte debido a las aguas de hidratación existentes en la red cristalina. Podemos notar dos señales anchas característicos en 2Θ = 25,2° y 2Θ = 52,1° lo cual está acorde con lo reportado en la base de datos PDFWIM #802493 y PDFWIM #760326 [32]. Los valores de superficie especifica para el Nb2O5 · 3H2O fueron mayores, lo que sería útil para la acción catalítica sin embargo, el volumen de poro resulta ser tres veces menor que el TiO2 Degussa P-25, lo que dificultaría la interacción con moléculas grandes como cianuro, estos resultados son consistentes con los obtenidos por Aguado y col.[22],[34]. En la fig. 3 se presenta el espectro FTIR de los catalizadores estudiados, se registró una banda de absorción amplia alrededor de 3200 cm-1 - 3500 cm-1, asignadas al modo de estiramiento del grupo OH pertenecientes a enlaces Nb - OH libres y H enlazados a grupos OH del agua [35] más acentuadas que el TiO2 por su condición de oxido hidratado, habido se adsorber humedad. El análisis de la región a bajas frecuencias mostró una banda presente entre 1600 cm-1-1650 cm-1, debido al modo tijereteo de las moléculas de H2O absorbidas, que no se observó para el TiO2, las bandas entre 500 cm-1 y 750 cm-1, fueron asignadas al modo de estiramiento Nb - O - Nb [35].
También se apreciaron estiramientos simétricos del Ti-O-Ti en 1527 cm-1 y asimétricos entre 400 cm-1 y 723 cm-1, mientras que las bandas en 1643 cm-1 y 3438 cm-1 se atribuyeron a flexiones tipo tijera y estiramientos simétricos de grupos OH, provenientes de las moléculas de hidratación y del enlace Ti-OH [36].
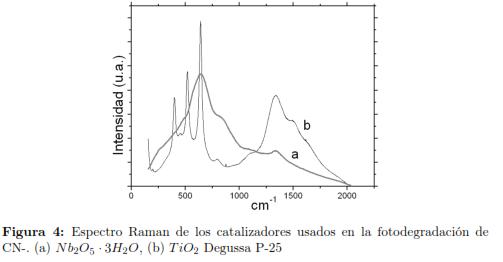
En el espectro Raman, fig. 4, para el Nb2O5 · 3H2O, se aprecio una banda principal alrededor de los 650 cm-1 correspondiente a octaedros de NbO6 [37]. La región de los 500 cm-1 y 700 cm-1 presentó una serie de bandas de mediana intensidad, debidos a estiramientos Nb-O, una banda débil y poco definida alrededor de los 290 cm-1 ,se asignó al enlace Nb-OH [37],[38]. La muestra de Nb2O5 · 3H2O puso a la vista una señal intensa y amplia cerca de 650 cm-1 que fue asignada a los estiramientos simétricos de los poliedros del enlace Nb-O [39], ligeramente distorsionados. La banda alrededor de los 230 cm-1 aparece debido al modo de flexión del enlace Nb-O-Nb [39], también podrían estar relacionadas con los enlaces Nb-O-Nb, estiramientos simétricos Nb-O del Nb2O5 anhidro y estiramientos simétricos Nb=O presentes en la superficie tanto del oxido anhidro como el hidratado [40].
Por otra parte para el TiO2 degussa P-25 mostró un espectro con bandas más definidas y características en 395 cm-1 , 516 cm-1 y 640 cm-1 atribuidos a los cristales de la fase anatasa y la señal a 446 cm-1 atribuida a la fase rutilo. La señal ancha entre 1148 cm-1 y a 1003 cm-1 es debida probablemente a los estiramientos asimétricos de Ti-O [41].
Estas bandas caracteristicas fueron determinados por comparación de la posición relativa y la intensidad con los valores reportados por [42]. La señal amplia entre los 1200 cm-1 y 1800 cm-1 se debe a un modo activo de la fase anatasa [43]. Puede apreciarse que el patrón de bandas correspondiente a las vibraciones M-O-M (M=metal) es diferente para ambos óxidos debido a la naturaleza del metal, el niobio posee un radio más grande que el titanio y permite acomodar especies poliédricas del enlace Nb-O [39] en su estructura, influyendo así en la apariencia e intensidad de las bandas M-O-M, con respecto al TiO2 degussa P-25.
3.2 Diseño de experimentos
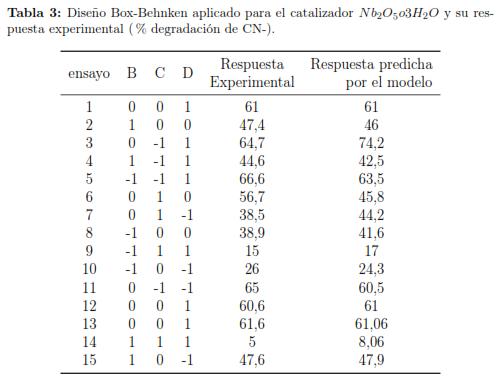
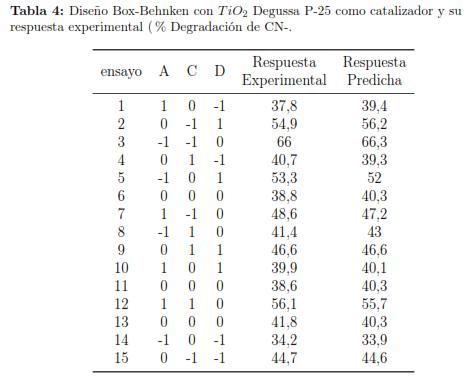
Con el fin de minimizar el número de ensayos experimentales, para la degradación de cianuro y a su vez optimizar el porcentaje (variable de respuesta), se realizaron 15 ensayos para cada catalizador mediante el diseño experimental Box-Behnken, debido a su eficiencia en termino de ensayos requeridos para optimizar la variable de respuesta a analizar [29]. En las tablas 3 y 4 se revelan las características experimentales para cada uno de los ensayos, usando como catalizador Nb2O5o3H2O y TiO2 Degussa P-25 respectivamente.
Para ambos diseños experimentales podemos observar que a menores valores de pH la variable de respuesta experimental mostró mejor eficiencia en la degradación de cianuro, sin embargo debido a la formación de HCN a pH bajos [29], no podemos analizar el comportamiento de la variable de respuesta experimental a valores de pH inferiores a 9.5.
Cuando se estudió la influencia de la concentración de H2O2, se apreció que este, al ser una fuente de radicales oOH, incrementó el carácter oxidante de la reacción fotocatalítica, lo cual se vió expresado en una mayor degradación del contaminante. Por otra parte podemos ver que los valores de pH suministrados al modelo que fueron 9.5, 10.75 y 12, tabla 1, el menor valor requirió una concentración mayor de Nb2O5 · 3H2O en comparación con el TiO2 Degussa P-25 para obtener altos valores de porcentajes de degradación de cianuro.ara el caso de la concentración de H2O2.
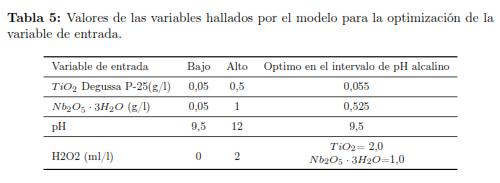
La Tabla 5, resume los valores de las variables halladas por el modelo para obtener el máximo porcentaje de reducción de la concentración de cianuro para el Nb2O5 ·3H2O y el TiO2 Degussa P-25 respectivamente. Dichos valores se hallan dentro del intervalo determinado previamente para el diseño de experimentos. Por tanto no se es posible hablar de un óptimo estricto o global, sino de un óptimo local dentro del intervalo de estudio de las variables previamente establecidos. Además, debido a que las condiciones seguras de trabajo nos restringen a pH en la zona alcalina, no es posible verificar si existe un valor óptimo por debajo del arrojado por el software (0,055g/l) que se encuentra en el límite inferior del rango en el cual se trabajó la concentración de este catalizador y realizar el estudio cinético a pH ácidos.
El valor de pH óptimo (9.50) en las condiciones alcalinas estudiadas, tiende a ubicarse en el nivel inferior del intervalo de estudio de la variable para ambos catalizadores.
En lo relacionado con la concentración de los catalizadores observamos que el valor optimo en condiciones alcalinas para el TiO2 Degussa P-25 se encuentro en el límite inferior mientras que para el Nb2O5 · 3H2O el valor óptimo en condiciones alcalinas, se encuentra en el punto medio del rango experimental de esta variable. En la figura 5a y 5b se muestran los diagramas de contornos de superficie de respuesta para el Nb2O5 · 3H2O y el TiO2 Degussa P-25 respectivamente. Este modelo nos permite optimizar la variable de respuesta, maximizando así el porcentaje de reducción de la concentración de cianuro. En este caso observamos que se asignan como parámetros del gráfico el pH, la concentración de los respectivos catalizadores y el porcentaje de reducción del cianuro (variable de respuesta), la otra variable de entrada (concentración de peróxido de hidrogeno), se le asigna el valor óptimo hallado por el modelo, esto aplica para ambos catalizadores.
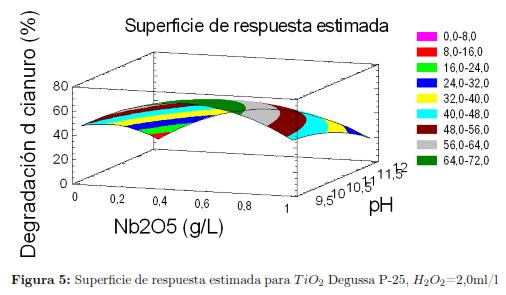
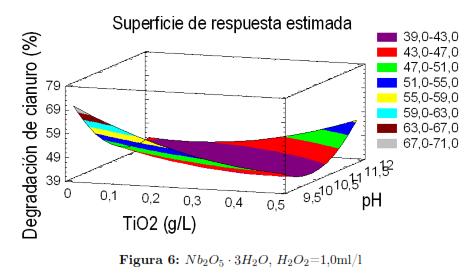
Dichos diagramas nos muestran diferentes contornos, en el cual cada uno de ellos corresponde a un rango de porcentaje de reducción en la concentración obtenida, pronosticada por el modelo e ilustran la forma en que este responde, a las variaciones de los valores de los parámetros del diseño de experimentos. Las gráficas muestran una superficie curva, con formas poco complejas, también podemos observar que predicen un rango entre 64% y 72 %, en la degradación de cianuro usando Nb2O5 · 3H2O y un rango entre 67% y 71 %, usando TiO2 Degussa P-25 como catalizador respectivamente, lo cual está dentro de los resultados experimentales obtenidos para las curvas cinéticas de degradación las cuales se mostrarán en la siguiente sección.
3.3 Oxidación fotocatalítica de cianuro
Dada las condiciones óptimas para obtener los máximos valores en la degradación de cianuro predichos por el modelo del diseño de experimentos Box- Behnken descrito en la sección anterior, se procedió al análisis de la influencia del tipo de agente oxidante en la degradación fotocatalítica de cianuro.
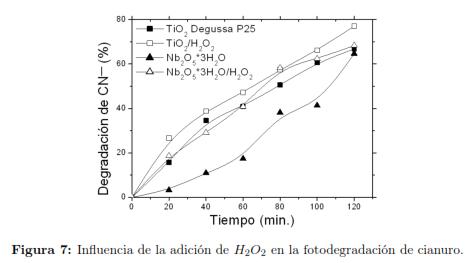
3.3.1 Efecto del H2O2 en la degradación de cianuro La fig. 7 muestra las curvas de degradación fotocatalítica de cianuro libre en presencia y en ausencia de peróxido de hidrogeno en la concentración óptima arrojada por el diseño de experimentos para cada catalizador, podemos apreciar que el óxido de niobio mostró un porcentaje bajo de remoción alrededor del 15 %, durante la primera hora de reacción con un periodo de inducción largo debido a su solubilidad pobre, una vez es irradiado y agitado por más tiempo, registró un mejoramiento en su comportamiento alcanzando cerca de un 60 %, la presencia de enlaces tipo Nb-O-Nb y estiramientos simétricos Nb=O los cuales marcan su carácter reductor [33], podrían ser los causantes de facilitar la oxidación del cianuro libre. La adición de H2O2 el cual se ioniza a un pH alcalino [18], en presencia del oxido de niobio hidratado inducen la formación de complejos peroxo-niobio los cuales se reportan en la bibliografía [44],[45], como generadores de una actividad química alta para la reacción de oxidación de compuestos orgánicos lo que generaría un incrementando en la degradación del ion cianuro, desde los primeros minutos de la reacción como se aprecia en la fig. 7. A esto puede sumarse la acción del anión perhidroxilo (-OOH) que al ser una especie activa de propiedad oxidante, ataca el triple enlace en los iones de cianuro para oxidar a cianato, favoreciendo el aumento de la degradación para alcanzar un 60% de remoción.
El catalizador que presenta mejor actividad en la fotodegradación del cianuro libre fue el TiO2 Degussa P-25, el cual al ser excitado por fotones energéticos a (λ= 385nm) induce la transición de electrones desde la banda de valencia a la banda de conducción del semiconductor y se generan pares de vacancias cationicas (h+) favoreciéndose la reacción redox [7],[46],[47]. El comportamiento cinético correspondió con una cinética de pseudo-primer orden para bajas concentraciones de este contaminante, reportado por otros autores [46],[7], lo que se debe a la afinidad alta que poseen los iones cianuro libres por la superficie del TiO2 Degussa P-25, durante la reacción. Confirmándose por la realización de ensayos de foto-oxidación de iones cianato los cuales no presentaron afinidad por el TiO2 de una manera significativa en comparación con los iones cianuro cuando están presentes en solución.
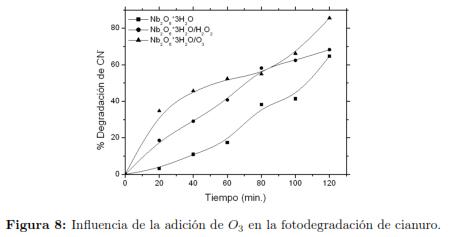
3.3.2 Efecto del O3 en la degradación de cianuro La descomposición del ozono en medio acuoso depende del pH de la solución y de la temperatura del medio y es iniciada por los iones hidroxilos generando oxigeno y el ion perhidroxilo. Se analizó la reacción de oxidación del cianuro en presencia de ozono y esta última fue más rápida que la descomposición de ozono y es proporcional a la concentración de ozono en el medio [3]. El ozono que interviene en la reacción de oxidación incrementa cuando la concentración de cianuro es baja ( 30 mg/l), esto nos da un indicio que el tamaño del reactor no afecta el consumo de ozono y que todo el cianuro reacciona con el ozono presente oxidando el cianuro libre a cianato, que se transforma posteriormente en CO2 y amoníaco [48],[49],[7]. Con la finalidad de mejorar el comportamiento catalítico en la remoción de cianuro se empleo ozono como coayudante de oxidación, el cual registró una remoción superior al 80 %, fig. 8, se puede apreciar una clara diferencia en comparación con la curva cinética del H2O2 como agente oxidante, presentando un comportamiento más lineal, sin alcanzar una saturación como la que presentó el H2O2 cerca de 60 %, esto se debe a que cuando el ozono está presente en la solución acuosa de iones cianuro, varias rutas de reacción pueden estar presentes, para pH básicos como los estudiados, el ozono disuelto reacciono indirectamente a través de la generación de radicales OH o los cuales son cinéticamente más reactivos que el ozono puro [50], los cambios de pendiente de la curva cinética estárian asociados con reportes en la bibliografía que describen que la descomposición del ozono en el agua se produce a través de un mecanismo de cadena de radical complejo que es iniciada por los iones hidroxilo. [49],[51].
4 Conclusiones
El empleo de ozono como coayudante de oxidación mejoró la remoción de cianuro libre para ambos catalizadores con porcentajes superiores al 80% con radiación solar en un pH 9.5, debido a su solubilidad en el efluente acuoso que genera una mayor población de radicales hidroxilos. Cuando se empleó H2O2 en presencia del Nb2O5 · 3H2O, se inducen la formación de complejos peroxo-niobio lo cual podría favorecer su desempeño en la oxidación de cianuro libre, al igual que la presencia de enlaces Nb-O-Nb y Nb=O asociados con su carácter reductor.
Agradecimientos
Los autores, miembros del Laboratorio de Investigaciones en Catálisis y Nuevos materiales Licatuc, agradecen a la vicerectoria de Investigaciones Unicartagena por el proyecto 01-07-2010 y el plan de sostenibilidad de grupos 2010. A Colciencias por la beca de Joven Investigador Isel Castro Sierra (2009-2011). A Companhia Brasileira de Metalurgia e Mineração (CBMM) por las muestras de niobio. Al MSc en Ingeniería ambiental Abigail Camargo y Q.F Orlando de la Rosa de la unidad de Prestación de Servicios de la Universidad de Cartagena.
Referencias
1. G. Saupe, Y. Zhao, J. Bang, N. Yesu, G. Carballo, R. Ordonez, T. Bubphamala. ''Evaluation of a new porous titanium-niobium mixed oxide for photocatalytic water decontamination''. Microchemical Journal, no. 81, pp. 156-162, 2005. [ Links ] Referenciado en 259
2. T. Agustina, H. Ang, V. Vareek. ''A review of synergistic effect of photocatalysis and ozonation on wastewater treatment''. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, n° 6 , pp. 264-273, 2005. [ Links ] Referenciado en 259
3. F. Barriga Ordonez, F. Nava Alonso, A. Uribe Salas. ''Cyanide oxidation by ozone in a steady state ow bubble column''. Minerals Engineering, n°19, pp. 117-122, 2006. [ Links ] Referenciado en 259, 273
4. J. Parga, S. Shukla, F. Carrillo Pedroza. ''Destruction of cyanide waste solutions using chlorine dioxide, ozone and titania sol''. Waste Management, no 23, pp. 183-191, 2003. [ Links ] Referenciado en 259, 260
5. R. Kumar, P. Bose. ''Modeling free and copper-complexed cyanide degradation in a continuous ow completely mixed ozone contactor''. Ind. Eng. Chem. Res. , n° 44, pp. 776-788, 2005. [ Links ] Referenciado en 259, 260
6. M. Hernández Alonso, J. Coronado, A. Mair, J. Soria, V. Loddo, V. Augugliaro. ''Ozone enhanced activity of aqueous titanium dioxide suspensions for photocatalytic oxidation of free cyanide ions''. Applied Catalysis B: Environmental, no 39 pp. 257-267, 2002. [ Links ] Referenciado en 259
7. U. Kepa, E. Stanczyk Mazanek, L. Stepniak. ''The use of the advanced oxidation process in the ozone + hydrogen peroxide system for the removal of cyanide from water''. Desalination, vol. 223, pp. 187-193, 2008. [ Links ] Referenciado en 259, 273, 274
8. A. Bozzi, I. Guasaquillo, J. Kiwi. ''Accelerated removal of cyanides from industrial effluents by supported TiO2 photo-catalysts''. Applied Catalysis B: Environmental, vol. 51, pp. 203-211, 2004. [ Links ] Referenciado en 259, 260
9. A. Durán, J. Monteagudo, I. San Martín, M. Aguirre. ''Decontamination of industrial cyanide containing water in a solar CPC pilot plant A''. Solar Energy, vol. 84, pp. 1193-1200, 2010. [ Links ] Referenciado en 259
10. E. Yazici, H. Deveci, I. Alp, T. Uslu. ''Generation of hydrogen peroxide and removal of cyanide from solutions using ultrasonic waves''. Desalination, vol. 216, pp. 209-221, 2007. [ Links ] Referenciado en 259
11. M. Kitis, E. Karakaya, N. Yigit, G. Civelekoglu, A. Akcil. ''Heterogeneous catalytic degradation of cyanide using copper-impregnated pumice and hydrogen peroxide''. Water Research, vol. 39, pp. 1652-1662, 2005. [ Links ] Referenciado en 259
12. A. Yeddou, S. Chergui, A. Chergui, F. Halet, A. Hamza, B. Nadjemi, A. Ould- Dris, J. Belkouch. ''Removal of cyanide in aqueous solution by oxidation with hydrogen peroxide in presence of copper impregnated activated carbon''. Minerals Engineering, vol. 24, pp. 788-793, 2011. [ Links ] Referenciado en 259
13. E. Yazici, H. Deveci, I. Alp. ''Treatment of cyanide effluents by oxidation and adsorption in batch and column studies''.Journal of Hazardous Materials, vol. 166, pp. 1362-1366, 2009. [ Links ] Referenciado en 259
14. J. Blanco, S. Malato, C. Estrada, E. Bandala, S. Gelover, T. Leal. ''Purificación de aguas por Fotocatálisis heterogénea: Estado del Arte''. En Eliminación de contaminantes por Fotocatálisis Heterogénea. Editorial CNEA, Buenos Aires, pp. 57-62, 1998. [ Links ] Referenciado en 259
15. R. Rice ''Applications of ozone for industrial wastewater treatment-a review'', Ozone Sci. Eng. , vol. 18, pp. 477-515, 1997. [ Links ] Referenciado en 259
16. Y. Hsu, Y. Chen, J. Chen. ''Decolorization of dye RB-19 solution in a continuous ozone process''. J. Environ. Sci. Heal. A. , vol. 39, pp. 127-144. 2004. [ Links ] Referenciado en 259
17. R. Mudliar, S. Umare, D. Ramtekea, S. Watea. ''Energy efficient-Advanced oxidation process for treatment of cyanide containing automobile industry wastewater''. Journal of Hazardous Materials. 164, pp. 1474-1479, 2009. [ Links ] Referenciado en 259
18. M. Sarla, M. Pandita, D. Tyagi, J. Kapoora. ''Oxidation of cyanide in aqueous solution by chemical and photochemical process'', Journal of Hazardous Materials B, vol. 116, pp. 49-56, 2004. [ Links ] Referenciado en 259, 272
19. A. Mills, S. Le Hunte. ''An overview of semiconductor photocatalysis'', Journal of Photochemistry and Photobiology A: Chemistry. , vol. 108, pp. 1-35, 1997. [ Links ] Referenciado en 260
20. M. Stoyanova, St. Christoskova, M. Georgieva. ''Aqueous phase catalytic oxidation of cyanides over iron-modified cobalt oxide system''. Applied Catalysis A: General. , vol. 274, pp. 133-138, 2004. [ Links ] Referenciado en 260
21. St. Christoskova, M. Stoyanova. ''Catalytic oxidation of cyanides in an aqueous phase over individual and manganese-modified cobalt oxide systems''. Journal of Hazardous Materials. 165, pp. 690-695, 2009. [ Links ] Referenciado en 260
22. J. Aguado, R. van Grieken, M. López Muñoz, J. Marugán. ''Removal of cyanides in wastewater by supported TiO2-based photocatalysts'', Catalysis Today, vol. 75, pp. 95-102, 2002. [ Links ] Referenciado en 260, 265
23. K. Osathaphan, B. Chucherdwatanasak, P. Rachdawong, V. Sharma. ''Photocatalytic oxidation of cyanide in aqueous titanium dioxide suspensions: Effect of ethylenediaminetetraacetate''. Solar Energy, vol. 82, pp. 1031-1036, 2008. [ Links ] Referenciado en 260
24. K. Jae-Hyun, L. Ho-In. ''Effect of Surface Hydroxyl Groups of Pure TiO2 and Modified TiO2 on the Photocatalytic Oxidation of Aqueous Cyanide''. Korean J. Chem. Eng. , vol. 21, pp. 116-122, 2004. [ Links ] Referenciado en 260, 264
25. A. Barbosa, S. Gutierrez, I. Castro. ''Comparison of analytical methods for the measurement as cyanate degradation product cyanide doped TiO2 heteropolymolybdates of copper in sewage''. Memorias del 43rd IUPAC World Chemistry Congress, 2011. [ Links ] Referenciado en 260
26. A. Barbosa, N. Cardona, D. Reyes, I. Castro. ''Efecto del carácter ácido de sólidos de niobio en la remoción fotocatalitica de cianuros''. Memorias del VII Simposio Colombiano de Catálisis SICCAT-2011, 2011. [ Links ] Referenciado en 260
27. I. Nowak, M. Ziolek. ''Niobium Compounds, pp. Preparation, Characterization, and Application in Heterogeneous Catalysis''. Chem. Rev. , vol. 99, pp. 3603- 3624, 1999. [ Links ] Referenciado en 260
28. APHA, AWWA, WPCF. ''Métodos normalizados para el análisis de aguas potables y residuales''. Editor, Díaz de Santos, S. A. Madrid, p. 1268. 1992. [ Links ] Referenciado en 261
29. M. Muthukumar, D. Mohan, M. Rajendran. ''Optimization of mix proportions of mineral aggregates using Box Behnken design of experiments''. Cement & Concrete Composites, vol. 25, pp. 751-758, 2003. [ Links ] Referenciado en 262, 267, 268
30. E. Gil. ''Oxidación fotocatalíica de aguas residuales de la industria de lavandería utilizando TiO2 como catalizador y luz UV''. Ingeniería y Ciencia, vol. 1, n°. 1, pp. 25-40, 2005. [ Links ] Referenciado en 262
31. R. Amal, T. Tran. ''Photocatalytic degradation of cyanide using titanium dioxide modified with copper oxide''. Advances in Environmental Research. , vol. 6, pp. 471-485, 2002. [ Links ] Referenciado en 264
32. B. Li, Y. Hakuta, H. Hayashi. ''The synthesis of titanoniobate compound characteristic of various particle morphologies through a novel solvothermal route''. Materials Letters, vol. 61, pp. 3791-3794, 2007. [ Links ] Referenciado en 265
33. I. E. Wachs,J. -M. Jehng, G. Deo, H. Hu, N. ''Arora Redox properties of niobium oxide catalysts''. Catalysis Today, vol. 28, pp. 199-205, 1996. [ Links ] Referenciado en 272
34. C. Alfonso, G. Aleixo, A. Ramirez, R. Caram. ''Influence of cooling rate on microstructure of Ti-Nb alloy for orthopedic implants''. Materials Science and Engineering C. , vol. 27, pp. 908-913, 2007. [ Links ] Referenciado en 265
35. Q. Sun, Y. Fu, H. Yang, A. Auroux, J. Shen. ''Dehydration of methanol to dimethyl ether over N b2O5 and N bOP O4 catalysts, pp. Microcalorimetric and FT-IR studies''. Journal of Molecular Catalysis A. , vol. 275, pp. 183-193, 2007. [ Links ] Referenciado en 265
36. L. Zhou, S. Yan, B. Tian, J. Zhang, M. Anpo. ''Preparation of TiO2 SiO2 lm with high photocatalytic activity on PET substrate''. Materials Letters, vol. 60, pp. 396-399, 2006. [ Links ] Referenciado en 266
37. I. Barros, V. Braga, D. Pinto, J. Macedo, G. Filho, J. Dias, S. Dias. ''Effects of niobium addition on ZSM-5 studied by termal and spectroscopy methods''. Microporous and Mesoporous Materials, vol. 109, pp. 485-493, 2008. [ Links ] Referenciado en 266
38. R. Poliah , S. Sreekantan. ''Characterization and Photocatalytic Activity of Enhanced Copper-Silica-Loaded Titania Prepared via Hydrothermal Method''. Journal of Nanomaterials, 2011. [ Links ] Referenciado en 266
39. A. Schulte, Y. Guo, W. Schirmacher, T. Unruh, T. Cardinal. ''Low-Frequency Vibrational Excitations in a Niobium-Phosphate Glass for Raman Gain Applications''. Vibrational Spectroscopy. 12-15, 2007. [ Links ] Referenciado en 266, 267
40. Hiroshi Kominami, Kazuhide Oki, Masaaki Kohno, Sei-ichi Onoue, Yoshiya Kera, Bunsho Ohtani. ''Novel solvothermal synthesis of niobium(V) oxide powders and their photocatalytic activity in aqueous suspensions''. Journal of Materials Chemistry. , vol. 11, pp. 604-609, 2001. [ Links ] Referenciado en 266
41. J. Medina, J. Garcia, C. Frausto, S. Calixto. ''Encapsulamiento de Anatasa Comercial en películas Delgadas de TiO2 depositadas sobre microrodillas de vidrio para la fotodegradación de fenol''. Revista Mexicana de Ingeniería Química, vol. 4, pp. 191-201, 2005. [ Links ] Referenciado en 267
42. B. Xim, Z. Ren, P. Wang, J. Liu, L. Jing, H. Fu. ''Study on the mechanisms of photoinduced carriers separation and recombination for Fe 3+TiO2 photocatalysts''. Applied Surface Science, vol. 253, pp. 4390-4395, 2007. [ Links ] Referenciado en 267
43. T. Maiyalagan, B. Viswanathan. ''Fabrication and characterization of uniform TiO2 nanotube arrays by sol-gel template method''. Bull. Mater. Sci. , vol. 29, n° 7, pp. 705-708, 2006. [ Links ] Referenciado en 267
44. T. Ramalho, L. Oliveira, K. Carvalho, E. Souza, E. da Cunha, M. Nazzaro. ''The molecular basis for the behaviour of niobia species in oxidation reaction probed by theoretical calculations and experimental techniques'', Mol. Phys. , vol. 107, pp. 171-179, 2009. [ Links ] Referenciado en 272
45. A. Silva, R. Cepera, M. Pereira, D. Lima, J. Fabrisc, L. Oliveira. ''Heterogeneous catalyst based on peroxo-niobium complexes immobilized over iron oxide for organic oxidation in water''. Appl. Catal. B: Environmental. , vol. 107, pp. 237- 244, 2011. [ Links ] Referenciado en 272
46. S. Frank , A. Bard. ''Heterogeneous Photocatalytic Oxidation of Cyanide and Sul te in aqueous solutions at semiconductor powders''. The Journal Physical Chemistry, vol 81, pp. 1484-1848, 1997. [ Links ] Referenciado en 273
47. K. Chiang, R. Amal, T. Tran. ''Photocatalytic degradation of cyanide using titanium dioxide modified with copper oxide''. Advances in Environmental Research, vol. 6, pp. 471-485, 2002. [ Links ] Referenciado en 273
48. T. Mudder. ''Making sense of cyanides, in The cyanide compendium''. Editorial Mining Journal Books Limited, London, p. 1-11, 1999. [ Links ] Referenciado en 274
49. R. Rajeswari, S. Kanmani. ''A study on synergistic effect of photocatalytic ozonation for carbaryl degradation''. Desalination,vol. 242, pp. 277-285, 2009. [ Links ] Referenciado en 274
50. S. T. Oyama. ''ChemInform Abstract, pp. Chemical and Catalytic Properties of Ozone''. 1758-2946. ChemInform., vol. 32, n° doi: 10. 1002/chin. 200103238, 2001. [ Links ] Referenciado en 274
51. M. Hernández Alonso, J. Coronado , J. Maira , J. Soria, V. Loddo, V. Augugliaro. ''Ozone enhanced activity of aqueous titanium dioxide suspensions for photocatalytic oxidation of free cyanide ions''. Appl. Catal. B: Environmental, vol. 39, pp. 257-267, 2002. [ Links ] Referenciado en 274