Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Ciencia
Print version ISSN 1794-9165
ing.cienc. vol.8 no.16 Medellín July/Dec. 2012
REVISIÓN
Síntesis de nopol a partir de trementina: revisión del estado del arte
Nopol Synthesis from Turpentine: Review of State of Art
Edwin A. Alarcón1, Aída L. Villa2
1 Doctor en Ciencias Químicas, ealarcon@udea.edu.co, profesor, Grupo Catálisis Ambiental, Departamento de Ingeniería Química, Universidad de Antioquia, Medellín–Colombia.
2 Doctora en Ciencias Biológicas Aplicadas, alvilla@udea.edu.co, profesora asociada, Grupo Catálisis Ambiental, Departamento de Ingeniería Química, Universidad de Antioquia, Medellín–Colombia.
Recepción:29-mar-2012, Aceptación:18-oct-2012
Disponible en línea: 30-nov-2012
MSC: 92.E20
Resumen
En esta contribución se hace una revisión de los métodos para la síntesis del nopol. Los procesos convencionales abarcan la síntesis térmica y la catalítica con ZnCl2 y los emergentes corresponden a los catalíticos heterogéneos. Se destaca el uso de catalizadores de Sn soportado en materiales mesoporosos producto de las investigaciones de la última década en el Grupo Catálisis Ambiental. La evaluación de las tecnologías existentes de producción de nopol muestra ventajas de la síntesis térmica y la catálisis heterogénea frente al uso de ZnCl2, especialmente por los costos potenciales en la separación y tratamiento de las sales inorgánicas. No obstante, cualquier intento de obtener una alternativa comercial de la tecnología reciente debería reducir los costos requeridos en la producción y regeneración del material catalítico y minimizar el requerimiento de solvente, con el fin que las condiciones moderadas de reacción de la catálisis heterogénea compense adecuadamente los requerimientos energéticos y de tiempo del proceso térmico.
Palabras claves: nopol, trementina, β-pineno, terpenos, terpenoides, reacción de Prins.
Abstract
A review about nopol synthesis is included in this contribution. The traditional methodologies include the thermal synthesis and the use of ZnCl2 as a catalyst, and the emergent processes are the heterogeneous catalytic processes. The use of catalysts based on Sn supported on mesoporous materials, as reported by the Environmental Catalysis Research Group 10 years ago, is widely discussed. Among the reported procedures, the homogeneous catalytic processes have the disadvantage of costs associated with separation and treatment of inorganic salts generated during the processes. The commercial alternative for nopol production by heterogeneous catalytic processes should include reduction of costs associated with the production and regeneration of the catalysts. It should also include the minimization of the solvent required for compensating the requirements of time and energy associated with the thermal process with respect to the moderate reaction conditions of the heterogeneous catalytic processes.
Key words: nopol, turpentine, β-pinene, terpenes, terpenoids, Prins reaction.
1 Introducción
Los terpenos son una denominación genérica de una serie de compuestos naturales conformados por unidades de isopreno, 2-metil-1,3-butadieno (Figura 1). La fórmula general de los hidrocarburos derivados de terpenos es (C5H8)x, donde x es el número de unidades de isopreno. Por ejemplo, los monoterpenos, sesquiterpenos y diterpenos están constituidos por 2, 3 y 4 unidades de isopreno, respectivamente. Según el número de anillos que contienen, los terpenos también se pueden clasificar en terpenos acíclicos, monocíclicos, bicíclicos o tricíclicos. En la práctica se consideran terpenos no solo los oligómeros del isopreno sino también los denominados terpenoides que son sus derivados oxigenados (alcoholes, cetonas, aldehídos, ácidos) y productos de su reducción parcial o completa [1].
Los terpenos más importantes comercialmente son los monoterpenos que se obtienen de aceites esenciales como la trementina, aceite de pino, aceite de frutos cítricos, aceite de menta, aceite de canfor, aceite de citronela y aceite de hierba limón [1]. Entre los monoterpenos con mayor volumen de producción se encuentran los hidrocarburos bicíclicos α- y β-pineno y el monocíclico limoneno [2],[3]; siendo los dos primeros obtenidos principalmente del componente más volátil de la resina de diversas especies de pino en forma de aceite de trementina.
1.1 Aceite de trementina y su comercialización
De aproximadamente 100 especies de pino, cerca de una docena han sido comercializadas para la producción de la oleorresina exudada de la cual se obtiene la colofonia y trementina (Tabla 1). Las demás especies, por ejemplo Pinus patula, registra cantidades o calidades bajas (en términos del contenido total de pinenos), haciendo que la producción sea poco viable económicamente [4]. La especie de pino que produce el rendimiento de trementina más alto es la Pinus caribaea y la de mayor contenido de pinenos es la Pinus radiata, las cuales se producen mayoritariamente en Venezuela y Kenia, respectivamente (Tabla 1). En Suramérica, los mayores productores de trementina son Brasil, Argentina, Venezuela y Chile, obteniéndose principalmente de Pinus caribaea, Pinus oocarpa, Pinus elliottii y Pinus radiata [5]. El rendimiento estimado para que el proceso de exudación de la oleorresina sea económicamente viable debe ser igual o superior a 3 kg/árbol/año [4],[6]. La oleorresina también se genera como subproducto del proceso Kraft o pulpa al sulfato de la industria papelera con un rendimiento promedio de 5–10 kg de trementina/tonelada de pulpa [7].
La colofonia se obtiene en mayor proporción que la trementina y corresponde al subproducto de menor volatilidad de la oleorresina. El rendimiento aproximado es 70–75% colofonia y 15–20% trementina [4]. La oleorresina de Pinus roxburghii de la India puede producir 76% de colofonia y 18% de trementina [8]. La colofonia es un sólido de color ámbar insoluble en agua pero soluble en muchos solventes orgánicos que se comercializa según su color, a mayor transparencia mejor es su calidad. La colofonia es una mezcla de diterpenos tricíclicos que consiste principalmente de los ácidos abiético y primárico, que posibilitan su utilización como materia prima de sales, ésteres, anhídridos y polímeros. Los usos más importantes se encuentran en la manufactura de adhesivos, agentes de encolado de papel, tintas de impresión, las soldaduras y fundentes, diversos recubrimientos superficiales, materiales aislantes para la industria electrónica, caucho sintético, gomas de mascar y los jabones y detergentes [4]. Por otra parte, la trementina es un líquido claro, inflamable, inmiscible con agua, de menor densidad que el agua y con un punto de ebullición que oscila entre 150 y 170 °C. La trementina es una mezcla de monoterpenos cuya composición es más variable que en la colofonia, dependiendo en gran medida de la especie de pino. Sus principales componentes son α- y β-pineno [4] y en menor proporción suelen encontrarse limoneno, canfeno, p-cimeno, β-felandreno, β-terpineol, entre otros [1]. Esta mezcla se usa principalmente en la fabricación de pegamentos, fijadores y solventes de pinturas y barnices, materiales para lustrar y de limpieza, tinturas y soluciones desengrasantes [5]. Los mayores derivados de la trementina son el aceite de pino sintético usado como agente desinfectante y de limpieza y el alcanfor para la industria de fragancias y farmacéutica. También se obtienen resinas terpénicas, medicamentos, insecticidas, desinfectantes y componentes de perfumes [9]. En medicina, la trementina actúa como un potente estimulante y se emplea a menudo como antiespasmódico y astringente. Las oportunidades en la comercialización de la trementina se deben a que sus principales derivados monoterpénicos tales como el linalol, citral, citronelol, citronelal y mentol, son usados tal cual o como intermediarios en fragancias y saborizantes [4]. Otros derivados de interés a partir α- y β-pineno se discutirán en la sección 1.2.
En 1995 el comercio mundial estimado de colofonia y aceite de trementina fue de 1,2 millones y 330 mil toneladas, respectivamente [3],[4]; la producción fue de 100 mil toneladas de trementina por el método de sangrado y el restante como subproducto del proceso al sulfato. Estadísticas de los principales países productores de oleorresinas de pino, incluyendo colofonia y trementina, comercio mundial, costos e inversión, entre otros aspectos, son reportados por Coppen y Hone [4]. Se estima que el 9% de la producción de trementina se consume en la industria de fragancias y saborizantes [3]. En Colombia se produce trementina en pequeña escala en el Centro Experimental las Gaviotas; en el año 2000 se obtuvieron 120 toneladas aceite de trementina y 1200 toneladas de colofonia de las plantaciones de Pinus caribaea por el proceso de exudación, cuyos rendimientos se ubican por encima de 3 kg/árbol/año en ciclos de 5 años [10]. Este centro de investigación ubicado en la Orinoquía colombiana, fundado por Paolo Lugari en 1971, ha sido auspiciado por el gobierno Nacional y el Japonés a través del proyecto ZERI (de sus siglas en inglés Zero Emissions Research and Initiatives). En el megaproyecto hay propuestas de ampliar los cultivos de pino Caribe en cerca de 100 mil hectáreas en las Gaviotas, Carimagua y Marandúa [11]. En diversas zonas de la geografía colombiana se registran otras especies de pino como Pinus patula, Pinus kesiya, Pinus oocarpa, Pinus tecunumanii, Pinus maximinoi y Pinus radiata [12]. Solo algunas de estas especies pueden ser viables de explotación comercial para la producción de trementina según el reporte de la FAO (Tabla 1) y su utilización en Colombia ha sido principalmente para la producción maderera.
Según registros de la ANDI (Asociación Nacional de Industriales) en el período 1999–2007 y de la página electrónica Scavage en el período 2002–2010 [13], las exportaciones colombianas de trementina desde 1999 no superan una tonelada del producto, con excepción del año 2001 cuando se exportaron 12 toneladas hacia México. Por el contrario, se han registrado importaciones de trementina, las cuales han estado disminuyendo desde 83 hasta 14 toneladas en el período 1999–2010. Es probable que a partir del año 2002 la producción de trementina de las Gaviotas sea suficiente para reemplazar parte de las importaciones y abastecer totalmente el mercado interno. En el período 1999– 2007, las exportaciones de colofonia disminuyeron de 1153 a 677 toneladas; mientras que las importaciones presentaron una tendencia a aumentar, con un máximo en el año 2007 y un promedio de 2340 ± 650 toneladas. Los registros más recientes indican una disminución de las importaciones por debajo de este promedio ubicándose en 807 toneladas en el año 2010. Esto indica que el mercado interno ha aumentado paulatinamente la demanda de este producto usado principalmente en la industria de pinturas y papel y que la producción de las Gaviotas también ha ganado espacio en este mercado. La creciente producción de este recurso renovable y su potencial uso pueden aprovecharse no solo en estas industrias sino también como precursor de sustancias con alto valor agregado, útiles en diversos sectores industriales, los cuales se resaltan en esta contribución.
1.2 Principales transformaciones del β-pineno del aceite de trementina
Adicional al impacto económico positivo generado por la extracción, producción y comercialización de la colofonia y trementina, se puede obtener un mayor beneficio económico si los principales componentes del aceite de trementina se transforman en productos de mayor valor agregado que pueden ser potencialmente utilizados en diversas aplicaciones, especialmente en la industria farmacéutica y de fragancias. Generalmente estos productos provienen de reacciones de oxifuncionalización de los pinenos. El α-pineno isomerizado hacia canfeno constituye una ruta de interés en la producción de alcanfor [3]; oxidado alílicamente produce verbenol y verbenona [14]; oxidado hacia su epóxido es materia prima para la producción de carveol, carvona y aldehído canfolénico [2]. En la literatura abierta, algunas de las transformaciones del β-pineno han sido objeto de estudio: la isomerización a β-pineno, mirceno, canfeno y limoneno [3]; hidroformilación con hidrógeno y monóxido de carbono a 10-formil pinano [2]; polimerización o copolimerización para la producción de resinas terpénicas [9]]. El β-pineno se puede transformar por oxidación alílica a pinocarveol, pinocarvona, mirtenol, mirtenal y los acetatos de pinocarveol y mirtenol [15]. Adicionalmente, de la epoxidación de β-pineno se obtiene el epóxido de β-pineno. El alcohol primario insaturado, nopol, se obtiene de la condensación de Prins entre el β-pineno y el polímero anhidro del formaldehído denominado paraformaldehído [16]. Es en esta reacción en la cual se enfocará esta revisión, resaltándose las aplicaciones del nopol y los métodos reportados para su síntesis. Ya que a la fecha no existe en la literatura abierta una recopilación y discusión de los procesos de producción de nopol, esta contribución abarca los procesos convencionales de síntesis térmica y catálisis homogénea conocidos desde hace 65 años y los procesos de catálisis heterogénea reportados desde hace 10 años, en los que particularmente se han realizado contribuciones significativas desde la Universidad de Antioquia.
2 Aplicaciones del nopol
Aunque los principales usos del nopol es como agente aromatizante, perfume o saborizante, puede también ser utilizado como intermediario en la síntesis de productos empleados en la producción de saborizantes, pesticidas, fragancias de detergentes, ceras y en general de productos para el hogar [17]. Como alcohol posee potencial actividad antibacterial contra bacterias Gram positivas [18]. El nopol y otros monoterpenoides oxigenados presentes en el aceite de cedro Criptomeria japonica son ingredientes activos como preservativos de componentes oftálmicos con menor toxicidad que el cloruro de benzalconio, usualmente usado en dichas formulaciones [19]. En aplicaciones farmacológicas los derivados del nopol se han utilizado como broncodilatadores [20], agentes contra secreciones mucosas [21] y sustancias antibacteriales [22]. El nopol y el dinopil éter, incluyendo otros compuestos terpénicos del aceite esencial del tabaco, se han usado en formulaciones de bioinsecticidas [23]. Los alcoholes terpénicos, incluyendo el nopol, son potencialmente útiles en formulaciones de pesticidas y fertilizadores foliales, mejorando la adhesión de los ingredientes activos en las hojas [24] y en formulaciones de tintas de impresión como solventes biodegradables [25]. Similarmente, sobresale su aplicación en formulaciones biodegradables de pinturas reactivas, evitando el uso de compuestos menos amigables ambientalmente tales como cloruro de metileno, fenol, metanol, tolueno, acetona y compuestos cáusticos o corrosivos [26]. El nopol es un alcohol efectivo en la inhibición de la autoxidación de azufre, modificando drásticamente la cinética de la formación de la lluvia ácida en las nubes [27]. El nopol inmovilizado en los poros de una membrana de polietileno es un medio eficiente para el transporte enantioselectivo de hidrocloruros de aminoácidos [28]. El nopol fundido en hidróxido de sodio, y sus derivados sulfonados o fosforados, se han empleado con éxito en formulaciones de grasas lubricantes [29]. Adicionalmente, el nopol se ha evaluado en formulaciones de pastas adhesivas de plata–vidrio sobre circuitos integrados basados en silicio [30].
Entre otras aplicaciones específicas también se destaca su utilización en la producción de polímeros [31], membranas de separación de aminoácidos [32] y como ligando de complejos para síntesis asimétrica [33]. El potencial del nopol como intermediario se debe a la estructura análoga al β-pineno, con un doble enlace, y la presencia del grupo alcohol que lo hacen susceptible de las transformaciones típicas de estas sustancias, con la posibilidad de formar dienos conjugados.
3 Síntesis del nopol
El nopol, 2-(6,6-dimetilbiciclo[3.1.1] hept-2-en-2-il)-etanol, es un alcohol bicíclico primario insaturado presente en algunas fuentes naturales como componente de aceites esenciales. Estos incluyen los obtenidos de la especie de cedro japonés Anthemis werneri cultivada en Grecia con 15% [34], la especie Curcuma soloensis de la familia Zingiberaceae de origen indonesio hasta con 32% [18] y la cúrcuma de origen chino con 22 %, esta última denominada aceite de turmérico [35]. Se encuentra en concentraciones menores de 2% en las especies de cedro japonés Cryptomeria japonica [36], cedro noruego Chamaecyparis lawsoniana [37] y Pinus brutia y Pinus nigra en Turquía [38] y en comestibles como la zanahoria [39] y las moras [40].
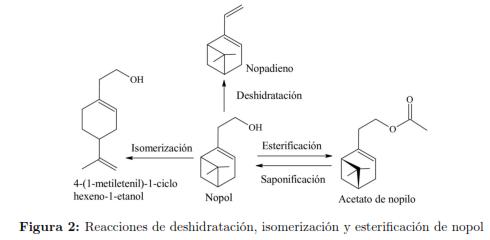
A pesar de su disponibilidad en la naturaleza, el nopol se obtiene mayoritariamente mediante rutas sintéticas a través de la denominada reacción de Prins. Mediante esta reacción ocurre una condensación entre un alqueno y un aldehído; que en el caso de la síntesis de nopol corresponden al β-pineno y el paraformaldehído, respectivamente, utilizándose temperaturas de alrededor 200 °C o temperaturas menores si la reacción se realiza en presencia de catalizadores en fase homogénea o heterogénea. El primer reporte sobre la síntesis de nopol fue en la década de 1940 por Bain [16], mediante la condensación de Prins entre β-pineno y paraformaldehído con ácidos Lewis como el ZnCl2 en fase homogénea o en autoclave entre 150 y 230 ºC. Los procesos catalíticos en fase heterogénea se han reportado desde 2002 [41],[42],[43],[44],[45]. Otro método para la síntesis de nopol incluye la saponificación del acetato de nopilo (Figura 2), sustancia que se obtiene con baja selectividad llevando a cabo la reacción de β-pineno y paraformaldehído en ácido acético [16]. En la Figura 2 también se presentan los productos de isomerización y deshidratación de nopol, que se favorecen a condiciones de reacción que se describen posteriormente en este manuscrito.
La reacción de Prins involucra la adición de un aldehído a un compuesto insaturado [46]. En medio acuoso el formaldehído promueve la formación de m–dioxanos y glicoles; en ausencia de agua la reacción favorece la producción de un alcohol α, β- insaturado usando una fuente anhidra de formaldehído comúnmente conocida como paraformaldehído [47]. El paraformaldehído es un polímero de polioximetilen diol, que se depolimeriza a temperaturas superiores a 80 °C y que posee un máximo de cien unidades monómericas de formaldehído [48]. Para favorecer la formación de nopol se requieren temperaturas altas o catalizadores ácidos tipo Lewis. La reacción para producir el nopol en presencia de catalizadores también se puede considerar como una reacción eno entre un alqueno que contiene un hidrógeno alílico (β-pineno) que interacciona con un doble o triple enlace de un enófilo (HCHO) [49]. Desde el punto de vista mecanístico la reacción térmica entre 100 y 200°Cprocede de forma concertada a través de un estado de transición cíclico mientras que la reacción catalizada por ácido consiste de un mecanismo por etapas que involucra un carbocatión como intermediario [49, 50].
3.1 Síntesis de nopol por el método de autoclave (método térmico)
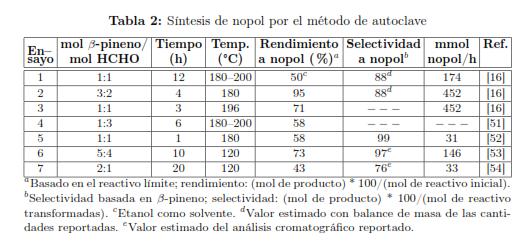
La reacción térmica para la producción de nopol se lleva a cabo en un recipiente a presión autógena usualmente entre 180 y 220 °C, condiciones bajo las cuales la depolimerización del paraformaldehído se favorece termodinámicamente. En la Tabla 2 se presentan las condiciones de síntesis reportadas para la producción de nopol por reacción de paraformaldehído y β-pineno en autoclave a temperaturas superiores a 120 °C. Usualmente las reacciones se han reportado en ausencia de solvente. El rendimiento a nopol basado en paraformaldehído disminuye de 95 a 50% en presencia de un solvente polar como el etanol (ensayos 1 y 2), aunque la selectividad es la misma (88 %). Cuando se usan cantidades de β-pineno equimolares o en exceso de paraformaldehído el rendimiento a nopol es menor (ensayos 3 a 5), por lo tanto es razonable que se prefiera el paraformaldehído como reactivo límite. En contribuciones recientes se reportó una selectividad a nopol superior a 88% (ensayos 5 y 6). La selectividad para el ensayo 7 se estimó con el rendimiento reportado para nopol y su subproducto de isomerización 4-(1-metiletenil)-1-ciclohexeno-1-etanol (Figura 2). Al aumentar la temperatura se genera mayor cantidad de subproductos. Con una relación de β-pineno / formaldehído entre 1 y 1,25, a 120 °C, se requiere un tiempo de reacción tres veces mayor para lograr rendimientos similares respecto a la reacción a 196 °C (ensayos 3 y 6). Con un exceso de β-pineno, no fue suficiente duplicar el tiempo de reacción para mejorar el rendimiento a 120 °C (ensayo 6 y 7). Los ensayos 5 y 6 sugieren algunas condiciones deseables para la producción de nopol por síntesis térmica, es decir, alta selectividad con conversiones razonablemente altas.
3.2 Síntesis de nopol con catalizadores homogéneos
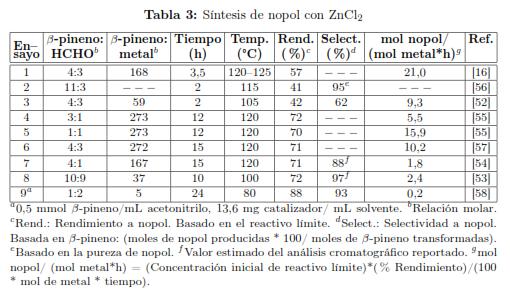
Después del primer reporte de Bain sobre el uso de ZnCl2 para la producción de nopol, este catalizador se ha usado ampliamente para tal fin [16]. La Tabla 3 presenta las condiciones de síntesis de nopol más representativas usando ZnCl2. Normalmente las reacciones se han efectuado en ausencia de solvente a temperaturas entre 100 y 120 ºC. En los primeros reportes (ensayos 1 a 3) el rendimiento a nopol varió entre 41 y 57 %. Con una relación fija de β-pineno/catalizador alrededor de 272, el rendimiento no se afecta significativamente con la relación de reactivos (ensayos 4 a 6). Al comparar los ensayos 1 y 7, con una relación β-pineno/catalizador de 167, el incremento del rendimiento en un 20% se puede atribuir principalmente al aumento del tiempo de reacción en cerca de cuatro veces. El ensayo 6 corresponde a un estudio de optimización que sugiere llevar a cabo el proceso con un ligero exceso de β-pineno y una relación molar de β-pineno: ZnCl2 de aproximadamente 272, para obtener rendimientos de 71% a 120 ºC y 15 h; el tiempo podría reducirse incluso hasta 12 h, pero comparado con la síntesis térmica (Tabla 2, ensayo 6), realizar la reacción con ZnCl2 a estas condiciones, no representa una ventaja significativa, por los posibles costos asociados al uso y recuperación del catalizador. Con SnCl4 como catalizador en lugar de ZnCl2 bajo las mismas condiciones de reacción del ensayo 5, se obtuvo un rendimiento a nopol del 73% [55]; sin embargo, el tetracloruro de estaño es un precursor tóxico que requiere condiciones especiales para su manipulación. Con acetonitrilo como solvente y a una temperatura menor (ensayo 9), se requiere una gran cantidad de catalizador y mayor tiempo de reacción. A 100 °C y un tiempo inferior que el utilizado en los ensayos 4 a 7, se pueden obtener selectividades a nopol hasta del 97 %, pero con mayor cantidad de catalizador (ensayo 8). Como la depolimerización de paraformaldehído se favorece a temperaturas superiores a 80 °C, se tendría una cantidad mayor de formaldehído disponible para la condensación de β-pineno a estas temperaturas.
En la producción de nopol con catalizadores homogéneos se han observado subproductos de alto peso molecular atribuidos a reacciones colaterales promovidas por el ácido Lewis y que en el proceso térmico ocurren a temperaturas superiores a 200 ºC. Las reacciones colaterales corresponden a la isomerización y polimerización de β-pineno y de nopol, a la condensación de nopol con formaldehído o a la deshidratación de nopol. Con tolueno a 50 °C se ha reportado la polimerización de β-pineno y β-pineno a resinas terpénicas en presencia de ácidos Lewis [9]. La formación de isómeros y productos de polimerización del nopol se favorece en el proceso térmico a temperaturas superiores a 225 ºC [16],[59]. La formación del 4-(1-metil etenil)-1-ciclohexeno-1-etanol también denominado 1,8-p-mentadieno-7-carbinol, dipenteno-7-carbinol o el homoperilil alcohol, a través de isomerización por apertura del anillo de cuatro miembros del nopol se ha reportado tanto en síntesis térmica como catalítica [53],[60]. La producción del dialqueno denominado nopadieno que se obtiene por deshidratación del nopol, Figura 2, se ha reportado con ZnCl2 [57].
3.3 Síntesis de nopol con sistemas catalíticos heterogéneos
Los sistemas catalíticos heterogéneos ofrecen una alternativa de producción más limpia que su contraparte en fase homogénea. Adicionalmente, desde el punto de vista económico, resulta conveniente desarrollar procesos que operen bajo condiciones moderadas de reacción, es decir, bajas temperaturas y tiempos cortos de reacción. Los primeros reportes conocidos de la síntesis de nopol con catalizadores heterogéneos se publicaron en el año 2002 [41].
La actividad de los materiales utilizados en la síntesis de nopol mediante procesos catalíticos heterogéneos depende de sus características estructurales y de la acidez. Con materiales no mesoporosos como Sn–keniaíta [42], Sn–SiO2 [61], Sn–β, [62], aluminosilicatos, HY, Hβ, H–mordenita y H–ZSM–5 [63] o con los materiales mesoporosos MCM–41 [41],[62] y Al–MCM–41 [63] la actividad es baja. La selectividad hacia nopol de las zeolitas MCM–22, MCM–36 y ITQ–2 se asoció a la acidez de los materiales [64]. Se ha sugerido que para la reacción de Prins se requiere de especies ácidas de tipo Lewis entre débil y media [65]. La actividad del material FePO4 mesoporoso para la síntesis de nopol se ha asociado con los sitios ácidos débiles [66]. En el material Sn-MCM- 41 se identificaron sitios de acidez muy débil, débil y media, encontrándose que las especies más selectivas hacia nopol eran de acidez media [43],[44].
En la Tabla 4 se presentan los rendimientos a nopol con catalizadores heterogéneos. Con el catalizador Sn–MCM–41 obtenido por deposición química al vapor, CVD (de sus siglas en inglés Chemical Vapor Deposition), al disminuir el contenido de Sn en el catalizador se lograron rendimientos a nopol mayores en menor tiempo (ensayos 1 y 2). Al comparar la actividad de catalizadores Sn–MCM–41 con contenidos de estaño en el rango de 30–500 μmol Sn/g, se observaron menores conversiones y selectividades con las mayores cargas de metal [42]. En ausencia de solvente la producción de nopol disminuyó (ensayos 3 y 4). Con el catalizador Sn–MCM–41 obtenido por síntesis hidrotérmica a 135 °C (ensayo 5) se obtuvo un alto rendimiento a nopol con un solvente débilmente básico. El mejor rendimiento a nopol ha sido reportado por Pillai y Sahle (ensayo 6) con fosfato de hierro mesoporoso y acetonitrilo como solvente [66]. Cuando se usa tolueno como solvente, el rendimiento a nopol disminuye hasta el 33 %. Aunque el hierro es un metal inocuo al compararlo con el estaño, en la síntesis de fosfato de hierro se requieren mayores cantidades de la especie activa respecto a Sn–MCM–41 [44],[62],[66]. Adicionalmente, en la síntesis del catalizador se utiliza ácido fluorhídrico que es una sustancia muy reactiva y tóxica.
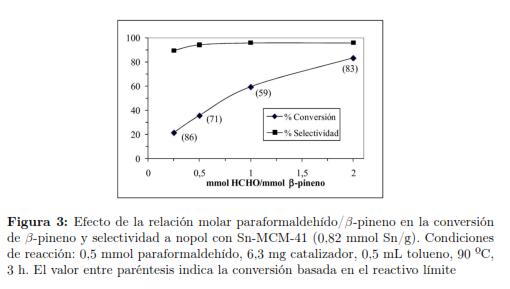
El catalizador Zn–montmorillonita (ensayo 7) tiene la desventaja de presentar lixiviación de las especies activas [58]. Con Zn–Al–MCM-41 (ensayo 8), el nopol se obtiene con rendimientos similares a los reportados con Zn– montmorillonita, pero a tiempos menores de reacción y a 90 ºC. Con ZnCl2 soportado en una resina de intercambio aniónico (ensayo 9), el rendimiento a nopol fue menor respecto al material Zn–Al–MCM-41 pero en ausencia de solvente. Recientemente se reportaron selectividades a nopol hasta de 96 %, con complejos de cianuro de Fe y Zn en acetonitrilo como solvente, a conversión menor y tiempo de reacción mayor (ensayo 10). Con irradiación de microondas (600 W, 110 °C, 2,5 h) y catalizadores de óxidos mixtos de zirconia titania sulfatada el rendimiento reportado fue de 60% [69]. La zirconia sulfatada se constituye en otra de las alternativas recientes para la síntesis de nopol en acetonitrilo como solvente y rendimientos superiores a 95% [71]. El sistema de ferrita de zinc sulfatada con tolueno como solvente bajo reflujo por 12 h produce un 70% de conversión de β-pineno y selectividad a nopol de 88 %, la cual se logra con un exceso molar de paraformaldehído de 3 veces respecto al β-pineno [72]. Con catalizadores superácidos se reportaron rendimientos a nopol del 50% [73]. Con materiales de estaño soportados en SBA–15, se han reportado conversiones mayores a 95% a 110 °C [70]. Dependiendo de las condiciones de reacción, la conversión de β-pineno con los sistemas catalíticos heterogéneos se encuentra entre 58 y 100 %, y la formación de subproductos se favorece a temperaturas superiores a 110 ºC [70]. La Figura 3 muestra que la relación β-pineno: HCHO no afecta apreciablemente la selectividad a nopol, pero si la conversión del substrato, la cual aumenta con el contenido de paraformaldehído. Recientemente se han profundizado los estudios de materiales de Sn–SBA–15 obtenidos con precursores de Sn(IV) por síntesis hidrotérmica [74] y métodos post-síntesis [75]. Con catalizadores heterogéneos, además de las reacciones colaterales descritas en la sección 3.2 con catalizadores homogéneos, también se promueve la oxidación alílica del β-pineno.
Con catalizadores heterogéneos (Tabla 4) se obtienen rendimientos y selectividades a nopol superiores a los obtenidos con catalizadores homogéneos (Tabla 3), a tiempos y temperaturas moderadas. Esto implica que las mayores relaciones de cantidad de nopol producido por cantidad de catalizador y tiempo sean notablemente mayores con los catalizadores heterogéneos (326,7 h-1, ensayo 3 de Tabla 4) que con los homogéneos (21,0 h-1, ensayo 1 de Tabla 3). Cuando la reacción se llevó a cabo sobre Sn–MCM–41, con aceite de trementina y sin solvente, la selectividad a nopol fue de 75 %, esta selectividad se aumentó a 85% con cantidades de tolueno entre 0,1 y 0,5 mL por 0,5 mmol de β-pineno.
La naturaleza del solvente también es un factor a considerar en los sistemas catalíticos heterogéneos [45],[62],[66]. Los solventes se pueden clasificar de muchas formas entre las que se pueden incluir propiedades como la polaridad, acidez, propiedades de par–electrón o protón-donante, entre otras características que se han determinado principalmente mediante medidas espectroscópicas, termodinámicas y cinéticas [76]. Uno de los parámetros más aceptados como medida de la polaridad de una sustancia y con mayor cantidad de datos disponibles es el parámetro empírico solvatocrómico basado en medidas espectroscópicas  [77], que se define como la energía molar, en kcal/mol, para la transición electrónica de longitud de onda larga del colorante 2,6-difenil-4- (2,4,6-trifenilpiridinio)fenolato (colorante Betaina de Dimroth-Reichardt) en una solución del solvente bajo estudio a 25 °C y una presión de 0,1 MPa [76]. Dependiendo de la polaridad de los solventes, en términos del parámetro empírico
[77], que se define como la energía molar, en kcal/mol, para la transición electrónica de longitud de onda larga del colorante 2,6-difenil-4- (2,4,6-trifenilpiridinio)fenolato (colorante Betaina de Dimroth-Reichardt) en una solución del solvente bajo estudio a 25 °C y una presión de 0,1 MPa [76]. Dependiendo de la polaridad de los solventes, en términos del parámetro empírico  , se reportó una relación entre la conversión de β-pineno y la selectividad a nopol con el catalizador Sn-MCM-41 sintetizado por CVD [45]. En alcoholes, excepto con el tert-butanol, la actividad es prácticamente nula; con solventes de menor polaridad, 2-butanona (MEK) y acetato de etilo se obtuvieron selectividades mayores que con tolueno y la conversión no disminuyó apreciablemente. Resultados similares se reportaron con Sn–SBA–15 [74],[75]. El fosfato de hierro se desempeña mejor en un solvente débilmente básico como el acetonitrilo que con tolueno. Se ha determinado también que el solvente no solo afecta la solubilidad de los reactivos, sino también la estabilidad de los intermediarios. Se encontró que con formaldehído acuoso los catalizadores Sn–MCM–41 preparados por CVD no son activos para la formación de nopol. Sin embargo, la presencia de agua en el sistema de reacción con el polímero anhidro en una proporción molar respecto al paraformaldehído menor que la unidad, no afecta la actividad de los materiales de Sn soportados por CVD en MCM–41 y SBA–15 [62],[75]. Dado que el metanol se usa como estabilizador de soluciones acuosas de formaldehído, las especies estabilizadas formadas no suelen ser tan reactivas, y por ende el formaldehído acuoso no ha sido tan atractivo como reactivo en la reacción de Prins para producir alcoholes.
, se reportó una relación entre la conversión de β-pineno y la selectividad a nopol con el catalizador Sn-MCM-41 sintetizado por CVD [45]. En alcoholes, excepto con el tert-butanol, la actividad es prácticamente nula; con solventes de menor polaridad, 2-butanona (MEK) y acetato de etilo se obtuvieron selectividades mayores que con tolueno y la conversión no disminuyó apreciablemente. Resultados similares se reportaron con Sn–SBA–15 [74],[75]. El fosfato de hierro se desempeña mejor en un solvente débilmente básico como el acetonitrilo que con tolueno. Se ha determinado también que el solvente no solo afecta la solubilidad de los reactivos, sino también la estabilidad de los intermediarios. Se encontró que con formaldehído acuoso los catalizadores Sn–MCM–41 preparados por CVD no son activos para la formación de nopol. Sin embargo, la presencia de agua en el sistema de reacción con el polímero anhidro en una proporción molar respecto al paraformaldehído menor que la unidad, no afecta la actividad de los materiales de Sn soportados por CVD en MCM–41 y SBA–15 [62],[75]. Dado que el metanol se usa como estabilizador de soluciones acuosas de formaldehído, las especies estabilizadas formadas no suelen ser tan reactivas, y por ende el formaldehído acuoso no ha sido tan atractivo como reactivo en la reacción de Prins para producir alcoholes.
En los sistemas catalíticos heterogéneos es importante considerar los costos asociados con la síntesis del catalizador, su recuperación y regeneración. Los costos de síntesis del catalizador se podrían compensar con su facilidad de recuperación respecto al proceso homogéneo; las condiciones moderadas de reacción y los procesos de regeneración del catalizador deberían compensar los costos energéticos del proceso de síntesis térmica. Para la síntesis de Sn–MCM– 41 se han propuesto rutas más favorables desde el punto de vista técnicoeconómico; de estas rutas, se destacan las que utilizan SnCl2•2H2O, precursor de costo similar al SnCl4, con la ventaja de no requerir condiciones especiales para su manipulación. Este precursor se ha utilizado en la síntesis de Sn– MCM–41 por CVD, síntesis directa a temperatura ambiente e impregnación húmeda incipiente por disolución en acetato de etilo [43],[44],[45], obteniéndose materiales tan activos como los obtenidos por CVD con SnCl4. La actividad del material obtenido por impregnación se puede recuperar al lavarse con acetona. Los estudios más recientes del Grupo Catálisis Ambiental se han centrado en la utilización de SnCl2•2H2O para obtener materiales de Sn–SBA–15 tan activos como sus análogos en MCM–41. La ventaja de SBA–15 como soporte se atribuye a su mayor estabilidad debido a paredes más gruesas.
4 Conclusiones
Esta revisión se centró en los procesos reportados para la síntesis de nopol, haciéndose énfasis en los procesos catalíticos heterogéneos, que corresponden a alternativas más eficientes energética y ambientalmente respecto a los procesos convencionales, que se realizan a temperaturas altas o en presencia de catalizadores en fase homogénea. Las comparaciones indican que el proceso térmico en autoclave se caracteriza por su simplicidad, selectividad alta con conversión no despreciable y ausencia de solvente, siendo esta metodología atractiva desde el punto de vista técnico. Con procesos catalíticos homogéneos, típicamente con ZnCl2 a 120 °C, se obtienen rendimientos a nopol del 71% con cantidades moderadas de catalizador y con exceso de cualquiera de los dos reactivos, paraformaldehído o β-pineno, siendo preferible un exceso de éste último dado el mayor costo del paraformaldehído. Ambos procesos convencionales requieren un balance apropiado entre la temperatura y el tiempo de reacción con el fin de maximizar el rendimiento sin comprometer la selectividad.
Con catalizadores heterogéneos especialmente con materiales de tipo mesoporoso tales como Sn–MCM–41, Zn–MCM–1 y FePO4 se obtienen selectividades y rendimientos a 90 °C superiores a las obtenidas con catalizadores homogéneos. La elección de un solvente apropiado de acuerdo a las características ácidas del catalizador, es fundamental para promover una mayor selectividad. El catalizador Sn–MCM–41 sintetizado con SnCl4 por CVD es un material atractivo debido a las bajas cargas de metal requeridas, tiempo de reacción moderado, selectividad superior a 80% y buena actividad partiendo de trementina, con o sin solvente.
El análisis de los métodos de obtención de nopol indica que entre los dos procesos convencionales es preferible la síntesis térmica, especialmente por los costos asociados con las etapas de separación y tratamiento de las sales inorgánicas. Comparando las condiciones típicas de la síntesis térmica a 120–180 °C y 4–10 h con la catálisis heterogénea a 90 °C y 1–4 h, los costos de producción, recuperación y regeneración de catalizador y los asociados al uso y recirculación de solvente deben ser lo suficientemente bajos para compensar las condiciones típicas del primer método. Así, cualquier intento para obtener una alternativa comercial de la tecnología emergente debería reducir los costos requeridos en la producción y regeneración del material catalítico y minimizar el requerimiento de solvente. Los últimos reportes del Grupo Catálisis Ambiental sugieren la técnica de impregnación húmeda incipiente de SnCl2•2H2O sobre materiales mesoporosos para obtener catalizadores con actividad comparable a Sn–MCM–41 obtenido por CVD, con la ventaja adicional de requerir condiciones ambientales en la etapa de incorporación del metal usando un precursor de estaño más estable.
Otro aporte de esta revisión, en la línea de producción de oleorresina de pino, es el planteamiento de las posibilidades de aprovechar la trementina no solo como solvente, sino también como materia prima de sustancias de mayor valor agregado que tienen aplicaciones en en las industrias de fragancias y saborizantes, productos farmacéuticos, polímeros, pesticidas e insecticidas.
Agradecimientos
Los autores agradecen el apoyo financiero de la Universidad de Antioquia mediante la Estrategia de Sostenibiliad 2011 – 2012. E.A. agradece a Colciencias la beca para estudios doctorales.
Referencias
1. JO. Bledsoe. ''Terpenoids''. En KirkOthmer Encyclopedia of Chemical Technology, J.I. Kroschwitz, M. Howe-Grant (Eds.), New York: Wiley, pp. 833-882, 1997. [ Links ] Referenciado en 282, 283, 284
2. J. Monteiro, CO Veloso. ''Catalytic Conversion of Terpenes into Fine Chemicals'', Topics in Catalysis, vol. 27, n.o 1, pp.169-180, 2004. [ Links ] Referenciado en 283, 286
3. K. Swift, ''Catalytic Transformations of the Major Terpene Feedstocks'', Topics in Catalysis, vol. 27, n.o 1, pp. 143-155, 2004. [ Links ] Referenciado en 283, 285, 286
4. J. Coppen, G. Hone, F., A. O. of the U. Nations, N. R. I. (Great Britain), Gum naval stores: turpentine and rosin from pine resin, FAO. Food and Agriculture Organization of the United Nations, 1995. [ Links ] Referenciado en 283, 284, 285
5. B. Eastman, G. Del Gallego, J. Quintero, J. Giraldo. Aprovechamiento de los desechos de maderas coníferas para extracción de trementina y colofonia, Medellín: Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, 1990. [ Links ] Referenciado en 283, 284
6. FEDEPALMA, La agroindustria de la palma de aceite en Colombia, Federación Nacional de Cultivadores de Palma de Aceite, 2006. [ Links ] P. Referenciado en 283
7. Stenius, Ed., Forest Products Chemistry, 1st ed. Helsinki, Finland: Fapet Oy, 2000. [ Links ] Referenciado en 283
8. S. Negi, Forests For Socio-Economic And Rural Development In India. New Deli: M.D. Publications Pvt. Ltd., 1996. [ Links ] Referenciado en 284
9. C. Gonzebach, M. Jordan, R. Yunick, ''Terpene Resins'', Encyclopedia of Polymer Science and Technology. Plastics, Resins, Rubbers, Fibers. Vol. 10: Phenolic Resins to Polyelectrolytes. Vol. 11: Polyesters to Rayons. Vol. 12: Reinforced Plastics to Starch. [ Links ] Referenciado en 285, 286, 292
10. P. Lugari, ''Gaviotas: Premio Mundial Del Medio Ambiente'', Revista Virtual- PRO, vol. 52, pp. 5-6, 2006. [ Links ] Referenciado en 285
11. C. Cano, Desafíos y Oportunidades Energéticas de la Agricultura Tropical. Bogotá, Colombia: Ministerio de Agricultura y Desarrollo Rural de la República de Colombia, 2004. [ Links ] Referenciado en 285
12. S. Bahamón-Dávila, F. Hoyos-Ocampo, G Ulloa-Castillo, Antioquia Forestal. Plan de Desarrollo Forestal para el Departamento 2005-2040, 1.a ed. Medellín, Colombia: Secretaría de Agricultura y Desarrollo Rural Cadena Forestal de Antioquia, 2005. [ Links ] Referenciado en 285
13. ''Scavage-Comercio exterior de Colombia'', ene-2012. [Online]. Available: http://www.scavage.com/?menu=trade.co.import&collection=import&option=default. [ Links ] Referenciado en 285
14. R. Barrera, E. Alarcón, L. González, A. Villa, C. Montes de C, ''Síntesis de carveol, carvona, verbenol y verbenona'', Revista Ingeniería y Competitividad, vol. 10, pp. 46-63, 2008. [ Links ] Referenciado en 286
15. P. Robles-Dutenhefner, M. da Silva, L. Sales, E. Sousa, E. Gusevskaya, ''Solventfree liquid-phase autoxidation of monoterpenes catalyzed by sol-gel Co/SiO2'', Journal of Molecular Catalysis A: Chemical, vol. 217, n.o 1-2, pp. 139-144, ago. 2004. [ Links ] Referenciado en 287
16. J. Bain, ''Nopol. I. The reaction of β-pinene with formaldehyde'', Journal of the American Chemical Society, vol. 68 n.o 4, 638-641, 1946. [ Links ] Referenciado en 287, 288, 291, 292
17. K. Bauer, D. Garbe, H. Surburg, Common Fragrance and Flavor Materials: Preparation, Properties and Uses, 4th Completely Revised Edition. Wiley-VCH, 2002. [ Links ] Referenciado en 287
18. T. Murningsih, S. Rezeki, S. Priyono, A. Taufiq, ''The chemical composition and anti bacteria activity analysis of essential oil of ''Temu glenyeh'' (Curcuma soloensis Val.)'', Warta AKAB, vol. (no. 12) p. 37-45, 2000. [ Links ] Referenciado en 287, 288
19. T. Kimura, J. Koike, M. Sakaguchi, K. Masuda, ''Ophthalmic pharmaceuticals containing cedar oil components'', U.S. Patent JP20020377472002. [ Links ] Referenciado en 287
20. T. Kawasuji, T. Matsunaga, H. Suzuki, T. Akiyama, T. Morikawa, ''Bronchodilator'', U.S. Patent JP20032127632003. [ Links ] Referenciado en 287
21. C. Corvi-Mora, ''Derivative of (-)-6,6-dimethylbicyclo 3.1.1.hept-2-ene-2-ethanol having mucosecretolytic activity, a process for its preparation and pharmaceutical compositions containing the same'', U.S. Patent US46440872003. [ Links ] Referenciado en 287
22. S.Walker-Kahne, ''Bacterial transglycosylases: assays for monitoring the activity using Lipid ...'', U.S. Patent US6911318. [ Links ] Referenciado en 287
23. E. Loginova, A. Mateeva, J. Dimitrov, G. Papanov, S. Iliev, P .Malakov, ''Insecticidal effect of byproducts of tobacco processing and essential oil manufacture'', Vissh Selskostopanski Institut ''Vasil Kolarov'' Plovdiv Nauchni Trudove, vol. 34, no. 3, 179-186, 1989. [ Links ] Referenciado en 287
24. G.Dufau, A. Querrioux, G. Molla, M. Barsacq. ''Use of terpenes as pesticide and plant nutrient formulation adjuvants with foliar retention-increasing activity'', Europe Patent No. FR2828064, 2003. [ Links ] Referenciado en 287
25. A. Yang, Y. Leu, T. Hsueh, J. Hsueh, C. Huang, L. Rau, ''Fragrant ink for ink-jet printers'', U.S. Patent US6123757. [ Links ] Referenciado en 287
26. E. Stevens, ''Paint Stripping Compositions And Methods'', U.S. Patent US559778819, jun-1995. [ Links ] Referenciado en 287
27. J. Ziajka, W. Pasiuk-Bronikowska, ''Autoxidation of sulphur dioxide in the presence of alcohols under conditions related to the tropospheric aqueous phase'', Atmospheric Environment, vol. 37, n.o 28, pp. 3913-3922, sep. 2003. [ Links ] Referenciado en 288
28. M. Bryjak, J. Kozlowski, P. Wieczorek, P. Kafarski, ''Enantioselective transport of amino acid through supported chiral liquid membranes'', Journal of Membrane Science, vol. 85, n.o 3, pp. 221-228, dic. 1993. [ Links ] Referenciado en 288
29. A. Morway, ''Grease process utilizing the alkali fusion products of cyclic alcohols'', U.S. Patent 280197408-jun-1957. [ Links ] Referenciado en 288
30. S. Dershem, ''Resinless pseudoplastic bonding compositions'', U.S. Patent 53063331994. [ Links ] Referenciado en 288
31. A. Gilbert, N. Allen, ''Polymer photochemistry'', in Photochemistry, vol. 26, Cambridge: The Royal Society of chemistry, pp. 361-426, 1995. [ Links ] Referenciado en 288
32. E. Drioli, E. Giorno, Biocatalytic Membrane Reactors: Applications in Biotechnology and the Pharmaceutical Industry. CRC PressINC, 1999. [ Links ] Referenciado en 288
33. L. Paquette, Handbook of Reagents for Organic Synthesis, Chiral Reagents for Asymmetric Synthesis. Chichester, UK: John Wiley & Sons, 2003. [ Links ] Referenciado en 288
34. V. Saroglou, N. Dorizas, Z. Kypriotakis, y H. Skaltsa, ''Analysis of the essential oil composition of eight Anthemis species from Greece'', J Chromatogr A, vol. 1104, n.o 1-2, pp. 313-322, feb. 2006. [ Links ] Referenciado en 288
35. T. Ke-wen, C. Guo-bin, ''Analysis of Chemical Component of Volatile Oil From Turmeric by Gas Chromatography-Mass Spectrometry'', Journal of Chinese Mass Spectrometry Society, vol. 25, n.o 3, pp. 163-165, 2004. [ Links ] Referenciado en 288
36. S. Cheng, H. Lin, S. Chang, ''Chemical composition and antifungal activity of essential oils from different tissues of Japanese Cedar (Cryptomeria japonica)'', J. Agric. Food Chem., vol. 53, n.o 3, pp. 614-619, feb. 2005. [ Links ] Referenciado en 288
37. ''Port Orford Cedar, Chamaecyparis lawsoniana essential oil'', Oshadhi Ltd. [Online]. Available: http://www.oshadhi.co.uk/port-orford-cedar-chamaecyparis-lawsoniana/. [ Links ] Referenciado en 288
38. M. Ucar, ''Composition of sulfate turpentine from Turkey'', European Journal of Wood and Wood Products, vol. 58, n.o 4, pp. 292-293, 2000. [ Links ] Referenciado en 288
39. D. Alabran, H. Moskowitz, A. Mabrouk, ''Carrot-root oil components and their dimensional characterization of aroma'', J. Agric. Food Chem., vol. 23, n.o 2, pp. 229-232, mar. 1975. [ Links ] Referenciado en 288
40. M. Qian, Y. Wang, ''Seasonal Variation of Volatile Composition and Odor Activity Value of'Marion'(Rubus spp. hyb) and'Thornless Evergreen'(R. laciniatus L.) Blackberries'', Journal of Food Science, vol. 70, n.o 1, pp. C13-C20, 2005. [ Links ] Referenciado en 288
41. E. Alarcón, A. Villa, C. de Correa, ''Synthesis of nopol over MCM-41 catalysts'', Chem. Commun., n.o 22, pp. 2654-2655, nov. 2002. [ Links ] Referenciado en 289, 293, 294
42. E. Alarcón, A. Villa, C. de Correa, ''Nopol synthesis over Sn-MCM-41 and Snkenyaite catalysts'', Catalysis Today, vol. 107-108, pp. 942-948, oct. 2005. [ Links ] Referenciado en 289, 293, 294
43. E. Alarcón, A. Villa, C. de Correa, ''Efecto de las condiciones de síntesis hidrotérmica de Sn-MCM-41 en la producción de nopol'', Revista Facultad de Ingeniería Universidad de Antioquia, n.o 49, pp. 19-29, 2009. [ Links ] Referenciado en 289, 293, 297
44. E. Alarcón, A. Villa, C. de Correa, ''Characterization of Sn- and Zn-loaded MCM-41 catalysts for nopol synthesis'', Microporous and Mesoporous Materials, vol. 122, n.o 1-3, pp. 208-215, jun. 2009. [ Links ] Referenciado en 289, 293, 294, 297
45. E. Alarcón, A. Villa, C. de Correa, ''Nopol production over Sn-MCM-41 synthesized by different procedures - Solvent effects'', Microporous and Mesoporous Materials, vol. 136, n.o 1-3, pp. 59-67, dic. 2010. [ Links ] Referenciado en 289, 296, 297
46. Pastor, M. Yus, ''The Prins Reaction: Advances and Applications'', Current Organic Chemistry, vol. 11, n.o 10, pp. 925-957, 2007. [ Links ] Referenciado en 289
47. E. Arundale, L. Mikeska, ''The Olefin-Aldehyde Condensation. The Prins Reaction.'', Chemical Reviews, vol. 51, n.o 3, pp. 505-555, dic. 1952. [ Links ] Referenciado en 289
48. G. Reuss, W. Disteldorf, A. Otto, A. Hilt, ''Formaldehyde'', in Ullmann's Encyclopedia of Industrial Chemistry, F. Ullmann, Ed. Weinheim, Germany: Wiley- VCH, pp. 1-34, 2005. [ Links ] Referenciado en 289
49. M. Clarke, M. France, ''The carbonyl ene reaction'', Tetrahedron, vol. 64, n.o 38, pp. 9003-9031, sep. 2008. [ Links ] Referenciado en 289, 290
50. B. Snider, ''2.1 - The Prins and Carbonyl Ene Reactions'', in Comprehensive Organic Synthesis, Barry M. Trost y Ian Fleming, Eds. Oxford: Pergamon, pp. 527-561, 1991. [ Links ] Referenciado en 290
51. B. Rutovskii, L. Alferova. ''Preparation of nopol and its derivatives'', Russian Journal of Applied Chemistry, vol. 24, pp. 1090-1095, 1951. [ Links ] Referenciado en 291
52. J. Ricca, P. Derian, J. Hecaen, J. Mercier, ''Derivatives of terpene origin, surfactant and/or fragrant composition containing them and detergent formulation based on this composition'', U.S. Patent US5674823. [ Links ] Referenciado en 291, 292
53. Z. Xiao, Z. Li, J. Chin, Y. Fu, M. Wang, ''Analysis and identification of the structure of the main by-product in the synthetic reaction of nopol'', Journal of Jiangxi Normal University, vol. 23, n.o 3, pp. 360-362, 1999. [ Links ] Referenciado en 291, 292, 293
54. Y. Feng-ping, L- Wei-guang, Z. Yong-hong, L. Xiong-min, ''Study on synthesis of nopol by closed-vessel and catalyst'', JOURNAL OF GUANGXI UNIVERSITY( NATURAL SCIENCE EDITION), vol. 26, n.o 2, pp. 108-111, 2001. [ Links ] Referenciado en 291, 292
55. Y. Feng-ping, L- Wei-guang, Z. Yong-hong, L. Xiong-min, ''Synthesis of Nopol'', Chemical World, vol. 42, n.o 2, pp. 93-94, 2001. [ Links ] Referenciado en 291, 292
56. E. Grozeva, ''Fragrant products from terpene hydrocarbons'', Godishnik na Visshiya Khimikotekhnologicheski Institut, vol. 29, n.o 2, pp. 285-288, 1983. [ Links ] Referenciado en 292
57. Y. FengPing, K. Min, y W. LiSheng, ''Study on optimum condition of reaction between β-pinene and paraformaldehyde catalyzed by ZnCl2.'', Chemistry and Industry of Forest Products, vol. 20, n.o 4, pp. 55-58, 2000. [ Links ] Referenciado en 292, 293
58. M. Yadav, R. Jasra, ''Synthesis of nopol from b-pinene using ZnCl2 impregnated Indian Montmorillonite'', Catalysis Communications Catalysis Communications, vol. 7, n.o 11, pp. 889-895, 2006. [ Links ] Referenciado en 292, 294
59. J.Bain, A. Best, R. Webb, ''Nopol. III. Thermal Isomerization in the Liquid Phase'', J. Am. Chem. Soc., vol. 74, n.o 17, pp. 4292-4296, sep. 1952. [ Links ] Referenciado en 292
60. R. Webb, J. Bain, ''Nopol. IV. Synthesis of 1(7),8-p-Menthadiene and 1(7)-p- Menthene'', J. Am. Chem. Soc., vol. 75, n.o 17, pp. 4279-4281, sep. 1953. [ Links ] Referenciado en 293
61. E. Alarcón, A. Villa, C. Montes, ''Síntesis de nopol a partir de - pineno y aceite de trementina con el catalizador Sn-MCM-41'', Revista Facultad de Ingeniería Universidad de Antioquia, nº 36, 44-55, 2006. [ Links ] Referenciado en 293, 294
62. A. Corma, M. Renz, ''Water-resistant Lewis-acid sites: carbonyl-ene reactions catalyzed by tin-containing, hydrophobic molecular sieves'', ARKIVOC, n.o 8, pp. 40-48, 2007. [ Links ] Referenciado en 293, 294, 296, 297
63. M. Selvaraj, S. Kawi, ''Highly selective synthesis of nopol over mesoporous and microporous solid acid catalysts'', Journal of Molecular Catalysis A: Chemical, vol. 246, n.o 1-2, pp. 218-222, mar. 2006. [ Links ] Referenciado en 293, 294
64. J. Wang, S. Jaenicke, G. K. Chuah, W. Hua, Y. Yue, Z. Gao, ''Acidity and porosity modulation of MWW type zeolites for Nopol production by Prins condensation'', Catalysis Communications, vol. 12, n.o 12, pp. 1131-1135, jul. 2011. [ Links ] Referenciado en 293
65. E. Dumitriu, V. Hulea, I. Fechete, C. Catrinescu, A. Auroux, J.-F. Lacaze, C. Guimon, ''Prins condensation of isobutylene and formaldehyde over Fe-silicates of MFI structure'', Applied Catalysis A: General, vol. 181, n.o 1, pp. 15-28, may 1999. [ Links ] Referenciado en 293
66. U. Pillai, E. Sahle-Demessie, ''Mesoporous iron phosphate as an active, selective and recyclable catalyst for the synthesis of nopol by Prins condensation'', Chem. Commun. (Camb.), vol. 10, n.o 7, pp. 826-827, abr. 2004. [ Links ] Referenciado en 293, 294, 296
67. Z. Qing-you, Z. Ming-rong, ''Synthesis of Nopol with Catalysis of Zinc Chloride Supported on Anion-Exchange Resin'', Biomass Chemical Engineering, vol. 40, n.o 3, pp. 6-8, 2006. [ Links ] Referenciado en 294
68. M. Patil, M. Yadav, R. Jasra, ''Prins condensation for synthesis of nopol from β-pinene and paraformaldehyde on novel Fe-Zn double metal cyanide solid acid catalyst'', Journal of Molecular Catalysis A: Chemical, vol. 273, n.o 1-2, pp. 39-47, ago. 2007. [ Links ] Referenciado en 294
69. L. Chuan-tao, LUO J-y, ''Syntheses of Nopol Catalyst by SO4 ~ (2-)/ZrO2 - TiO2 in Microwave Irradiation'', Journal of Nanjing Forestry University(Natural Sciences Edition), vol. 31, n.o 3, pp. 91-94, 2007. [ Links ] Referenciado en 294, 295
70. V. Ramaswamy, P. Shah, K. Lazar, A. V. Ramaswamy, ''Synthesis, Characterization and Catalytic Activity of Sn-SBA-15 Mesoporous Molecular Sieves'', Catal Surv Asia, vol. 12, n.o 4, pp. 283-309, dic. 2008. [ Links ] Referenciado en 294, 295
71. S. Jadhav, K. Jinka, H. Bajaj, ''Synthesis of nopol via Prins condensation of β- pinene and paraformaldehyde catalyzed by sulfated zirconia'', Applied Catalysis A: General, vol. 390, n.o 1-2, pp. 158-165, dic. 2010. [ Links ] Referenciado en 295
72. ''Federación Nacional de Biocombustibles de Colombia''. [Online]. Available: http://www.fedebiocombustibles.com/v2/. [ Links ] Referenciado en 295
73. H. Chen, H.Wang, J. Xu, ''The Preparation of Nanosolid Superacid and Apply to the Synthesis of Nopol'', Journal of Nanjing Forestry University (Natural Sciences Edition), vol. 27 nº 4, 295-297, 2003. [ Links ] Referenciado en 295
74. M. Selvaraj, Y. Choe, ''Well ordered two-dimensional SnSBA-15 catalysts synthesized with high levels of tetrahedral tin for highly efficient and clean synthesis of nopol'', Applied Catalysis A: General, vol. 373, n.o 1-2, pp. 186-191, ene. 2010. [ Links ] Referenciado en 295, 296
75. M. Selvaraj, P. Sinha, ''Highly selective and clean synthesis of nopol over wellordered mesoporous tin silicate catalysts'', New J. Chem., vol. 34, n.o 9, pp. 1921-1929, sep. 2010. [ Links ] Referenciado en 295, 296, 297
76. A. Katritzky, D. Fara, H. Yang, K. Tämm, T. Tamm, M. Karelson, ''Quantitative measures of solvent polarity'', Chem. Rev., vol. 104, n.o 1, pp. 175-198, ene. 2004. [ Links ] Referenciado en 296
77. C. Reichardt, ''Solvents and Solvent Effects: An Introduction'', Org. Process Res. Dev., vol. 11, n.o 1, pp. 105-113, ene. 2007. [ Links ] Referenciado en 296