Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Ciencia
Print version ISSN 1794-9165
ing.cienc. vol.8 no.16 Medellín July/Dec. 2012
REVISIÓN
Técnicas de fermentación y aplicaciones de la celulosa bacteriana: una revisión
Fermentation Tecniques and Applications of Bacterial Cellulose: a Review
Luz Dary Carreño Pineda1, Luis Alfonso Caicedo Mesa2 y Carlos Arturo Martínez Riascos3
1 Ingeniera Química Dr.Ing. ldcarrenop@unal.edu.co, Grupo de Investigación en Procesos Químicos y Bioquímicos,Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia.
2 Ingeniero Químico Dr.Sc., lacaicedom@unal.edu.co, Grupo de Investigación en Procesos Químicos y Bioquímicos, Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia.
3 Ingeniero Químico Dr.Eng. , camartinezri@unal.edu.co,Grupo de Investigación en Procesos Químicos y Bioquímicos, Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia.
Recepción:21-nov-2011, Aceptación:26-sep-2012 Disponible en línea: 30-nov-2012
MSC: 92-03
Resumen
La celulosa bacteriana es un polímero obtenido por fermentación con microrganismos de los géneros Acetobacter, Rhizobium, Agrobacterium y Sarcina, de las cuales la especie más eficiente es la Acetobacter Xylinum. Este polímero presenta la misma estructura química de la celulosa de origen vegetal, pero difiere en su conformación y propiedades fisicoquímicas, lo que lo hace atractivo para diversas aplicaciones, especialmente en las áreas de alimentos, procesos de separación, catálisis y en medicina, gracias a su biocompatibilidad. Sin embargo, el principal problema es la producción a gran escala limitada por los bajos rendimientos, lo que genera la necesidad de desarrollar alternativas que permitan disminuir o eliminar las causas de esta limitación. En este artículo se hace una revisión acerca de la síntesis, producción, propiedades y principales aplicaciones de la celulosa bacteriana, así como de algunas alternativas estudiadas para disminuir los inconvenientes en el escalamiento del proceso.
Palabras claves: Celulosa Bacteriana, Acetobacter xylinum, Fermentación Estática, Reactor Airlift, Ingeniería de Tejidos, Membranas de celulosa.
Abstract
Bacterial cellulose is a polymer obtained by fermentation with microorganisms from Acetobacter, Rhizobium, Agrobacterium and Sarcina genera. Among them, Acetobacter xylinum is the most efficient specie. This polymer has the same chemical composition of plant cellulose, but its conformation and physicochemical properties are different, making it attractive for several applications, especially in the areas of food, separation processes, catalysis and health, due to its biocompatibility. However, the main problem is the production in mass that is constrained by low yield. It is therefore necessary to develop some alternatives. This paper presents a review about synthesis, production, properties and principal applications of bacterial cellulose, as well as some alternatives to reduce the difficulties for process scaling.
Key words: Bacterial Cellulose, Acetobacter xylinum, Static Culture, Airlift reactor, Tissue Engineering, Cellulose membrane.
1 Introducción
La celulosa es la molécula biológica más abundante y constituye el mayor porcentaje de los biopolímeros en la tierra, siendo inclusive mayor que el de todos los demás juntos [1],[2],[3]. Su estructura es lineal y está formada por 2000 a 14000 unidades de β-(1,4) glucosa en cadenas no ramificadas, unidas entre sí con enlaces tipo puente de hidrógeno. Es un biopolímero insoluble en agua que posee regiones con un alto ordenamiento (cristalinas), y otras donde el grado de ordenamiento es bajo. Presenta varias formas cristalinas, dando lugar al polimorfismo de la celulosa. Se conocen seis diferentes estructuras (I, II, IIII , IIIII , IVI y IVII ) que pueden ser convertidas unas en otras mediante calor o tratamiento con agentes químicos [4],[5],[6]. La celulosa tiene una gran variedad de aplicaciones en las industrias del papel, textil, alimenticia, de explosivos y de azúcares fermentables, entre otras, además de aplicaciones específicas en medicina y biotecnología, así como que en la fabricación de membranas usadas como agentes se separación. La mayor parte de la celulosa utilizada en la industria es de origen vegetal, que se encuentra asociada a lignina y hemicelulosa; sin embargo, en los últimos veinte años la celulosa de origen bacteriano ha tomado importancia debido a sus propiedades mecánicas, de pureza y alto grado de cristalinidad, entre otras, que la hacen atractiva para aplicaciones específicas. La literatura relacionada con este polímero es extensa y ha aumentado considerablemente en el transcurso de los últimos cinco años. Del total de artículos, cerca del 96% del total han sido publicados desde 1990. Los estudios de la celulosa bacteriana han considerado diversas áreas tales como la biosíntesis, la estructura, la producción por cultivo estático y agitado y la de las aplicaciones, esta última área incluye más del 40% de las publicaciones. El propósito de este trabajo es presentar una revisión acerca de la celulosa bacteriana: generalidades, obtención, técnicas de fermentación y aplicaciones, así como las alternativas, reportadas hasta la fecha, para hacer de este polímero un producto de uso común en un futuro cercano.
2 Celulosa de Origen Bacteriano a Partir de Bacterias del Género Acetobacter
La celulosa bacteriana es un polímero extracelular sintetizado por bacterias principalmente del género Acetobacter. Aunque su formación fue reportada por primera vez en 1886 por J. Brown, sólo ha sido objeto de atención a partir de la segunda mitad del siglo XX; debido a su alto grado de cristalinidad, pureza, conformación reticulada y estructura tridimensional, este polímero es atractivo en diversas aplicaciones, especialmente en el área de la salud [1],[7].
La celulosa es sintetizada por bacterias pertenecientes a los géneros Acetobacter, Rhizobium, Agrobacterium y Sarcina[8]. Los productores más eficientes son las bacterias Gram-Negativas del género Acetobacter, Acetobacter xylinum (reclasificadas como Gluconoacetobacter xylinus), que se usan como microorganismos modelo en los estudios básicos y aplicados sobre este producto. Un número importante de investigaciones se ha enfocado en el mecanismo de síntesis del biopolímero, así como en su estructura y en las propiedades que determinan su uso práctico; los estudios sobre la estructura y las propiedades de este biopolímero muestran que su composición química es idéntica a la de la celulosa de origen vegetal, aunque presenta diferencias significativas respecto a su conformación estructural y propiedades físicas [9],[10]. Una de las características más importantes de la celulosa bacteriana es su pureza, que la distingue de la celulosa vegetal usualmente asociada a hemicelulosa y lignina[7]. Otra característica es su alto grado de cristalinidad (mayor a 60 %); estos cristales están compuestos de celulosa tipo Iα y Iβ; la relación entre las dos formas cristalinas depende del microorganismo y de las condiciones de cultivo (fuente de carbono, suplementos, temperatura) [7]. Una vez purificada, la celulosa bacteriana es no tóxica, no alergénica, biocompatible y biodegradable [11].
2.1 Biosíntesis de Celulosa Bacteriana
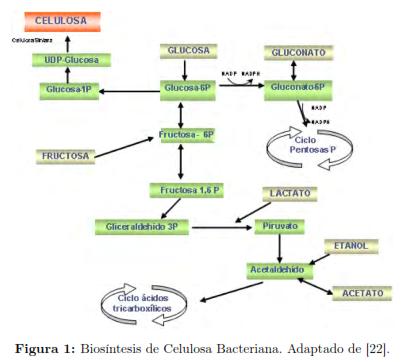
Las bacterias del género Acetobacter producen celulosa a partir de fuentes de carbono como glucosa, sacarosa, glicerol, manitol o arabitol [12],[13],[14]. La síntesis de celulosa consta de dos etapas principales: la primera es la conversión de la fuente de carbono en uridin difosfato glucosa (UDP-glucosa), que es el sustrato usado para producir la celulosa; la segunda etapa es la formación de la celulosa y su secreción al medio del cultivo [7],[15].
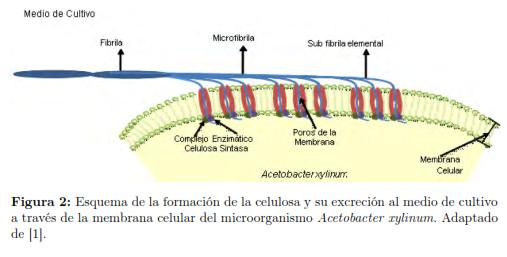
La primera etapa inicia con el ingreso del sustrato al microorganismo y su conversión a glucosa-6-fosfato por la enzima glucoquinasa; posteriormente, la glucosa-6-fosfato pasa a glucosa-1-fosfato por la acción de la enzima fosfoglucomutasa. En el siguiente paso, la glucosa-1-fosfato se convierte en UDP-glucosa en presencia de la enzima UDPG pirofosforilasa; finalmente, por la acción de la enzima celulosa-sintasa, que es la encargada de realizar la polimerización de la glucosa, se forma la celulosa [16],[17]. La figura 1 presenta un esquema del metabolismo de las bacterias Acetobacter incluyendo la ruta para la producción de celulosa. La segunda etapa es la polimerización de la glucosa seguida de la excreción de la celulosa al medio de cultivo. El microorganismo posee una serie de poros de 3.5 nm alineados diametralmente en la membrana celular. En la cara interna de la membrana se encuentra el complejo enzimático celulosa-sintasa rodeando cada uno de los poros [18]. La celulosa es secretada al medio de cultivo como una subfibrilla elemental de 1.5 nm de diámetro; al juntar estas subfibrillas se forma una microfibrilla y el empaquetamiento de microfibrillas produce las fibras y las cintas de celulosa (figura 2) [7],[17],[19],[20],[21].
2.2 Función Fisiológica
Todas las bacterias productoras de celulosa conocidas hasta hoy, se distinguen porque el polímero producido se encuentra en forma de agregados extracelulares, atribuidos principalmente a la autoafinidad que presenta el material. En hábitat natural, muchos microorganismos sintetizan polisacáridos extracelulares que envuelven las células;l la celulosa bacteriana es un ejemplo de estos polisacáridos. En las especies de Rhizobium y Agrobacterium, el polímero facilita la adhesión celular en interacciones simbióticas e infecciosas, mientras que para A. xylinum y Sarcina ventriculi, la celulosa confiere protección mecánica, química y biológica dentro del hábitat natural. En ese caso las células productoras son atrapadas en la red del polímero, que mantiene la población en la interfase aire-líquido [16].
La matriz polimérica facilita el suministro de nutrientes a la célula, pues éstos se concentran mejor debido a las propiedades de adsorción con las que cuenta la estructura de celulosa, de esta forma, la matriz polimérica genera condiciones más favorables que si el microorganismo se encontrara solamente en el medio acuoso. En el caso del cultivo estático empleando A. xylinum, la celulosa se produce en forma de película en la interfase aire/líquido; se presume que en este caso, el propósito de la síntesis de la celulosa es proveer una matriz superficial firme, que permita al microorganismo, un aerobio estricto, estar cerca a la fase gaseosa [7],[16]. Otros autores suponen que la celulosa sintetizada juega un importante papel de almacenamiento de alimento que el microorganismo utilizaría en momentos de escasez. La presencia de exo y endoglucanasas, en el caldo de cultivo de algunas fermentaciones con A.xylinum refuerza esta suposición [23],[24].
2.3 Técnicas de Fermentación
Las técnicas utilizadas para producir celulosa bacteriana son el cultivo estático y el agitado; en cada técnica se obtiene celulosa con morfología diferente. A continuación se presentan algunos trabajos que estudian el efecto de la técnica de cultivo en la producción de celulosa bacteriana.
2.3.1 Cultivo Estático En el cultivo estático, la celulosa se obtiene en forma de gel, en el cual la celulosa es aproximadamente el 1% del peso total. (figura 3). Estudios realizados muestran que, en un primer estado, el microorganismo incrementa su población gracias al consumo de oxígeno disuelto que se encuentra en el medio de cultivo; durante este tiempo, el microorganismo sintetiza cierta cantidad de celulosa en el medio líquido. Sólo las bacterias que se encuentran cerca de la interfase aire/medio de cultivo y tienen disponibilidad de oxígeno, pueden mantener su actividad y producir celulosa, la cual forma capas superpuestas; a medida que transcurre el tiempo de fermentación, el espesor de la película se incrementa por la generación de nuevas capas en la superficie, formando una estructura de capas suspendidas en el medio de cultivo [25],[26]. El principal inconveniente con las fermentaciones en cultivo estático es que se requiere de tiempos largos y una gran área superficial, lo que no hace práctica su producción a gran escala [27].
2.3.2 Cultivo Agitado Al realizar las fermentaciones en cultivo agitado se pueden obtener pellets de celulosa o aglomeraciones amorfas de las fibras, los cuales dependen del tipo de reactor y condiciones de operación empleados. Estos cultivos pueden realizarse por lotes o en continuo, en reactores de tanque agitado o airlift. El cultivo agitado se investiga con miras a escalar el proceso a nivel industrial, pero las bajas productividades reportadas, menores que en cultivos estáticos, hacen que no sea fácil su escalamiento; la baja productividad obedece al hecho de que la agitación favorece el crecimiento de células no productoras de polímero que consumen el sustrato, denominadas celulosa(-); algunos autores atribuyen este fenómeno a mutaciones que lesionan la maquinaria enzimática encargada de la polimerización de la glucosa [28],[29]. Por otra parte, se han aislado y caracterizado cepas altamente productoras en cultivo agitado, tales como Acetobacter xylinum BCR5 [29], Acetobacter xylinum subsp. sucrofermentans BPR2001 [30] y Acetobacter sp. A9 [31]; la producción encontrada es 1.4, 4.0 y 2.3 veces superior respectivamente con relación a la reportada empleando la cepa caracterizada ATCC 10245. Un inconveniente adicional que presenta este método de cultivo es la habilidad de las células de Acetobacter para convertir la glucosa en ácidos glucónico y cetoglucónico, por lo que se consume la glucosa del medio en detrimento del rendimiento para la celulosa.
2.3.3 Efecto de las condiciones de cultivo sobre la producción de celulosa bacteriana Schramm y Hestrim (1954), realizaron uno de los primeros trabajos sobre producción de celulosa bacteriana, empleando Acetobacter xylinum en cultivo estático [28]. En ese estudio se encontró que la producción de celulosa es función del suministro de oxígeno, tanto para cultivo estático como agitado, pues bajo una atmósfera de nitrógeno no hubo producción significativa, mientras que la producción óptima se encontró utilizando aire enriquecido. Posteriormente Hestrin y Schramm (1954), desarrollaron un medio compuesto por: glucosa 2% (p/v), peptona 0.5 %, extracto de levadura 0.5 %, fosfato disódico 0.27% y ácido cítrico 0.115% a pH 6.0; este medio se concoe como H-S y es uno de los más utilizados en estudios de producción de celulosa bacteriana [32]. Trabajos posteriores se encaminaron a describir la síntesis del biopolímero, así como la ruta oxidativa de la fuente de carbono [33],[34]. Dudman (1959), presentó un estudio acerca del efecto de las condiciones de cultivo sobre la producción de celulosa empleando como microorganismo Acetobacter acetigenum y encontró que el uso de glicerol como fuente de carbono aumenta la producción de celulosa en un 40 %, comparado con glucosa y fructosa [8].
Para las fuentes de carbono complejas, este mismo autor muestra cómo al utilizar melaza hidrolizada se obtienen producciones hasta 88% superiores a las alcanzadas en medios con glucosa como fuente de carbono. El aumento en la producción se atribuye a que el uso de glucosa como única fuente de carbono promueve la producción por parte del microorganismo de ácido (ceto) glucónico, lo que no beneficia la producción de celulosa puesto que este ácido no sólo disminuye la cantidad de glucosa disponible para su polimerización, sino que conduce a niveles de pH que afectan la viabilidad celular. Más recientemente Keshk y colaboradores (2006) emplearon melaza de remolacha como fuente de carbono y Gluconacetobacter xylinus ATCC 10245 como microorganismo y obtuvieron un aumento en la producción de celulosa de 31% con respecto al uso de glucosa como única fuente de carbono; este aumento se atribuye a la cantidad de micronutrientes adicionales presentes en la melaza, especialmente sulfuros y nitrógeno orgánico, que favorecen el crecimiento del microorganismo [35].
Bae y Shoda (2005), también emplearon melaza previamente tratada con H2SO4 como fuente de carbono y Acetobacter xylinum subsp. sucrofermentans BPR2001 como microorganismo y encontraron que la producción de celulosa se incrementa en 76% con respecto a la melaza sin tratar; los autores encontraron que además de celulosa, el microorganismo produce algunos polisacáridos como acetan y levana y que su producción es mayor cuando se emplea la melaza sin tratar, razón por la cual la producción de celulosa decrece [36].
Con el fin de reducir los costos de producción asociados a la fuente de carbono, se han estudiado otras fuentes de carbono complejas. Hong y Qiu (2008) emplearon harina de konjac hidrolizada con hidróxido de calcio y como microorganismo Acetobacter aceti subsp. xylinus ATCC 23770 y encontraron que la producción de celulosa fue tres veces mayor que al emplear glucosa como fuente de carbono. El aumento en la producción se atribuye tanto a la hidrólisis de la harina como a la presencia del ión Ca++ en el medio de cultivo, lo que favorece la acción de la celulosa sintasa, y por ende, la producción de celulosa [37]. Kurosumi y colaboradores (2009) compararon el uso de diversos jugos de fruta (naranja, piña, manzana, pera japonesa y uva) como fuente de carbono en un medio H-S modificado con éstos (medio I), con el medio H-S suplementado con glucosa, sacarosa y fructosa ajustados en la proporción en que se encuentran en los respectivos jugos de fruta (medio II), y con un medio compuesto por el jugo de fruta al que solamente se le ajustó el pH inicial (medio III). El microorganismo fue Acetobacter xylinum. La mayor producción de celulosa se obtuvo con el medio I para todos los jugos de fruta empleados, lo que, según los autores, se debe a la presencia de las fuentes de nitrógeno propias del medio H-S y a algunos compuestos adicionales presentes en las frutas que favorecen el crecimiento del microorganismo y la producción de celulosa [38]. Wu y Liu (2012) evaluaron la vinaza proveniente de la producción de vino de arroz como fuente de carbono en un medio H-S sobre la producción de celulosa bacteriana, empleando como microrganismo Gluconcetobacter xylinus BCRC 12334 y encontraron que la producción se incrementa 2,5 veces con respecto al medio H-S tradicional. Los autores atribuyen este aumento a la presencia de nutrientes y aminoácidos en la vinaza que inhiben la producción de ácidos orgánicos y favorecen la producción de celulosa [39].
Watanabe y Yamanaka (1995), examinaron los efectos de la tensión de oxígeno en la fase gaseosa del medio de cultivo y encontraron que su incremento favorece la producción de celulosa; sin embargo, cuando el valor de la tensión de oxígeno supera el 15% la producción de celulosa comienza a decrecer mientras aumenta la cantidad de CO2 producida, por lo que se verifica que el oxígeno es indispensable para el metabolismo de estas bacterias como ya había sido observado por Schramm (1954), pero también se puede concluir que la alta tensión de oxígeno estimula el proceso oxidativo de la ruta metabólica disminuyendo la producción de celulosa [40].
En cultivo agitado, Matsuoka y colaboradores (1996) desarrollaron un medio sintético para producción de celulosa, compuesto por: fructosa 4% (p/v); fosfato ácido de potasio 0.1 %; sulfato de magnesio 0.025 %; solución de sales mixtas 1 %; solución de vitaminas 1 %. Este medio se utilizó como referencia y se comparó con éste mismo suplementado con lactato y metionina y con un medio complejo que contiene licor de maíz; el microorganismo empleado fue Acetobacter xylinum subsp. Sucrofermentans. Se encontró que el medio sintético alcanza producciones de celulosa 10% inferiores a las alcanzadas con el licor de maíz. El lactato al ser consumido por el microorganismo e ir hacia el ciclo de los ácidos tricarboxílicos en la ruta metabólica, permite que la fructosa sea empleada para producción de celulosa. La metionina por su parte, estimula el crecimiento celular en las primeras etapas de cultivo, disminuyendo la fase lag y por tanto aumentando la velocidad de producción de celulosa [41].
En su trabajo, Jung y colaboradores (2010) estudiaron el proceso con glicerol como fuente de carbono en cultivo agitado empleando Acetobacter sp. V6 y encontraron que la producción de celulosa es 91% superior con el empleo de glicerol en lugar de glucosa, resultado similar al encontrado por Dudman (1959) en cultivo estático [42]. Una explicación a este comportamiento puede encontrarse en el trabajo de Sternberg y colaboradores (1986), quienes proponen que el microorganismo convierte este sustrato en dihidroxiacetona fosfato, que puede ser precursor de la síntesis de celulosa, pero que también puede convertirse en D-gliceraldehido 3-fosfato (ésta reacción es reversible), precursor del ácido glicérico. La reversibilidad de esta última reacción permite una mayor disponibilidad del sustrato para la síntesis de celulosa, reduciendo la producción de ácido glicérico [43].
Otros autores han estudiado el efecto de la adición de polisacáridos solubles al medio de cultivo sobre la producción de celulosa; se cree que su presencia disminuye los esfuerzos cortantes dentro del reactor y que de esta forma reducen el riesgo de mutación de las células productoras a no productoras de celulosa. Bae y Shoda (2005) encontraron a través de un trabajo de optimización en un medio con licor de maíz suplementado con fructosa con Acetobacter xylinum BPR2001, que al incrementar la viscosidad del medio con pequeñas cantidades de agar, la producción de celulosa en cultivo agitado aumenta [44]; otros polisacáridos empleados son: Alginato de sodio [45], Agar [46] y goma xantana [47]. El aumento en la producción de celulosa respecto al medio sin adición de polisacárido es de 58 %, 56% y 17% respectivamente. Ha y Park (2012), evaluaron la producción de celulosa por Acetobacter xylinum adicionando al medio de cultivo un oligosacárido soluble en agua producido por Gluconacetobacter hansenii PJK. Se encontró que la adición de 1% de este oligosacárido incrementa la producción de celulosa en cultivo estático en 89% si el microorganismo usado es Acetobacter xylinum y en 52.3% si se emplea Gluconacetobacter hansenii. La explicación de este incremento se atribuye a que estos microrganismos producen oligopolisacáridos junto con la celulosa [48].
Con el fin de incrementar la producción de celulosa se ha estudiado el efecto de la adición de algunos co-sustratos como CO2, etanol y ácidos orgánicos en un medio con Acetobacter xylinum subsp. sucrofermentans BPR3001A. Los resultados muestran que la adición de etanol y lactato al medio de cultivo incrementa la producción de celulosa en 16% y 22% respectivamente [49],[50]. Por el contrario, se observó que la adición de CO2 inhibe el crecimiento del microorganismo y por ello disminuye la producción de celulosa [51]. Por su parte, Son y colaboradores (2001), evaluaron el efecto de la adición de varios co-sustratos, entre ellos algunos ácidos orgánicos para el microorganismo Acetobacter sp A9; en todos los casos hubo un incremento en la celulosa obtenida con respecto al medio sin co-sustrato. El aumento en la producción de celulosa puede deberse a que la presencia de co-sustratos permite a la glucosa una mayor disponibilidad para producir celulosa por parte del microorganismo mientras el co-sustrato se utiliza en el crecimiento y producción de energía, pues la mayor parte de estos compuestos generan metabolitos cercanos al ciclo de los ácidos tricarboxílicos [31].
En relación con la temperatura, algunos autores han observado que la máxima producción de celulosa tanto para glucosa como para sacarosa, se logra a 30°C. A 25°C y 35°C las producciones son similares en si, pero menores que a 30°C, mientras a 40circC no existe crecimiento del microorganismo y, consecuentemente, no se presenta producción de celulosa [52],[53].
Respecto al tipo de reactor utilizado, Kouda y colaboradores (1996) estudiaron el efecto de la configuración del agitador dentro de un fermentador de tanque agitado en un medio con Acetobacter xylinum subsp. sucrofermentans BPR 2001, utilizando diferentes agitadores como el de turbina, el de tornillo, el agitador tipo hélice, y el agitador maxblend® , y se encontró que con este último se logra mayor producción. Los resultados se explican porque, en un medio no newtoniano donde la viscosidad aumenta a medida que se produce la celulosa, este tipo de agitador facilita el transporte de oxígeno y nutrientes del medio al microorganismo y disminuye las zonas muertas dentro del reactor. El principal inconveniente que este grupo de investigación identifica en los reactores de tanque agitado es la gran cantidad de energía que se necesita para mantener un buen mezclado incrementando los costos de producción [54],[56]. Posteriormente, Chao y colaboradores (2001) presentaron una alternativa para enfrentar este problema para Acetobacter xylinum utilizando reactores de columna de burbujeo, aunque la producción de celulosa decrece con respecto al tanque agitado; con el empleo de aire enriquecido la producción puede llegar a ser equivalente [47]. Cheng y colaboradores (2002), emplearon un reactor de columna de burbujeo y encontraron que este consume cerca de la sexta parte de la energía empleada en el reactor de tanque agitado, lo cual es una ventaja significativa al realizar el escalado del proceso, y al modificar la configuración del sistema de aireación de un reactor airlift, lograron que la producción de celulosa fuera tres veces superior a la obtenida en el reactor convencional sin necesidad de emplear aire enriquecido [57].
Los reactores de película son aquellos donde se permite que el microorganismo forme una película biológica para que se adhiera; esta es una manera de aumentar la densidad celular y por ende la producción de celulosa bacteriana. Uno de estos reactores es el rotatorio; en el estudio realizado por Caicedo y colaboradores (2002), se mostró que con este tipo de reactor no se reduce significativamente la capacidad de producción del microrganismo comparado con el cultivo estático; sin embargo, presentó problemas para un mezclado eficiente, debido a la presencia de zonas muertas dentro del sistema [22]. Una variante de este tipo de reactor es el empleado por Serafica y colaboradores (2002), que presenta discos de material polimérico en el eje rotatorio sobre los cuales se forma la celulosa; al emplear este tipo de reactor se redujo el tiempo de fermentación a la cuarta parte en relación con el cultivo estático [58]. Cheng y colaboradores (2009), emplearon un reactor de película para evaluar el efecto del material de soporte sobre la producción de celulosa y encontraron un aumento en la producción de 2.5 veces con respecto a la obtenida con el reactor sin los soportes [59].
2.4 Aplicaciones de la Celulosa Bacteriana
Son numerosos los campos en que la celulosa bacteriana podría tener aplicación; sin embargo, son pocas las aplicaciones a nivel comercial que existen actualmente. Algunos productos comerciales son Biofill® que es un producto para cubrir heridas y Gengiflex®, material utilizado para elaborar implantes dentales [15],[60],[61]. En Filipinas se emplea como alimento llamado ''nata de coco'' [62]. Otra aplicación comercial de la celulosa bacteriana es en los transductores acústicos, dada la gran resistencia mecánica que adquiere después de ser sometida a un tratamiento químico [63],[64],[65].
Además de las aplicaciones comerciales, existen otras en fase de desarrollo; en el campo de la medicina se ha evaluado varias aplicaciones, una de ellas como sustituto temporal de la piel para el tratamiento de heridas, quemaduras, úlceras y abrasiones en la epidermis [60],[66],[67],[68],[69]. Para permitir que ese revestimiento tenga un mayor efecto antimicrobiano, Maneerung y colaboradores (2008) desarrollaron un compósito de celulosa bacteriana y nanopartículas de plata, que mostró su eficiencia para proteger las heridas de microorganismos tanto Gram-negativos como Gram-positivos [70]. Yang y colaboradores (2012) estudiaron el efecto de las condiciones de cultivo y la cantidad de nanoparticulas de plata sobre su efecto antimicrobiano y encontraron que para la celulosa obtenida a partir de maltosa y un contenido de 1.06% de nanopartículas de plata se presenta el mejor efecto antimicrobiano para el microrganismo E. coli [71].
Otra aplicación fue lograda por Klemm y colaboradores (2001), quienes desarrollaron implantes vasculares para microcirugía gracias al diseño de un reactor que permite obtener celulosa bacteriana en forma tubular [26]. Estos implantes fueron probados in vivo en cerdos y se encontró que presentan buena compatibilidad con los tejidos del animal [72]. En la búsqueda de aplicaciones en medicina, se han estudiado las propiedades mecánicas con resultados similares a los obtenidos con tejidos vasculares naturales [73]; otros investigadores modificaron la superficie de los implantes para aumentar su potencial hidrofílico y permitir así una mejor adhesión de las células; se encontró que el soporte tiene buena resistencia mecánica, además de permitir la proliferación de keratocitos humanos y conservar su viabilidad [74],[75],[76],[77],[78],[79],[80],[81], [82],[83].
La estructura tridimensional de la celulosa bacteriana, que puede ser vista en la Figura 4, es una característica clave para su uso como soporte en ingeniería de tejidos pues facilita el anclaje y proliferación de las células que conformarán el tejido nuevo. Los hidrogeles formados por celulosa bacteriana y colágeno presentan resistencia a la compresión de varios órdenes de magnitud mayor que la de la estructura de celulosa, y cercana a la del tejido cartilaginoso, lo que hace de este material compuesto un candidato para la sustitución de tejidos [84]. También, en el área de los materiales compuestos para sustitución de tejido, la celulosa bacteriana se ha probado como compósito con hidroxiapatita el para remplazo de tejido óseo [85],[86],[87],[88],[89],[90],[91], [92],[93],[94],[95], y con alcohol polivinílico (PVA), para implantes de córnea, mostrando biocompatibilidad y ausencia de necrosis en el tejido implantado [96],[97],[98].
Los sensores de glucosa convencionales (que usan con frecuencia los pacientes diabéticos) están recubiertos con una membrana de celulosa de origen vegetal; una de sus principales desventajas es su corta vida útil. Al recubrir estos sensores con celulosa bacteriana, Ammon y colaboradores (1995), encontraron que la vida útil aumenta así como la estabilidad al contacto con la sangre [99]. Otras aplicaciones potenciales en el área de la medicina debido a sus propiedades son: servir como soporte para cultivo de células de mamíferos [100], inmovilización de enzimas y otras biomoléculas [101],[102],[103], sustrato para cultivo de tejidos y el uso en sistemas de liberación controlada de medicamentos [105],[106],[107],[108]. La posibilidad de inmovilizar células también ha sido evaluada en procesos industriales, como en la producción de etanol [109] y de vino [110] con levaduras inmovilizadas.
En el campo de la electrónica se han desarrollado membranas con alta conductividad eléctrica y dispositivos emisores de luz, incorporando algunos metales en la estructura de la celulosa [111],[112],[113],[114],[115]. También se han modificado algunas membranas con paladio y platino para ser utilizadas en celdas de combustible y reactores catalíticos, mostrando buena adhesión de las sustancias introducidas en la estructura de celulosa [116],[117],[118],[119],[120], [121],[122].
f
Otros estudios han probado membranas de celulosa bacteriana en procesos de separación, como en el de Wanichapichart y colaboradores (2002), en el que se evaluaron membranas de celulosa bacteriana para la permeación de soluciones de suero bovino y se encontró que el porcentaje de retención estaba entre el 67% y 99% [123]. Las membranas también se han utilizado para separación de polioles [41], clarificación de jugo de frutas [124], pervaporación de mezclas etanol-agua [11],[125],[126], pervaporación de componentes aromáticos de frutas [127], diálisis [128],[129], y permeación de gases [27],[130],[131]. En todos los casos las membranas han presentado selectividad para los componentes estudiados; sin embargo, uno de los principales inconvenientes es que para la mayor parte de los procesos de separación estudiados, el flux de permeado es bastante bajo.
Los obtención de derivados de celulosa, como el acetato de celulosa, a partir de celulosa bacteriana también ha sido estudiada [132],[133],[?], logrando materiales con tasa de biodegradación e hidrofobicidad controlable, lo que expande aún más las posibles aplicaciones de la celulosa bacteriana.
3 Conclusión
Siendo la celulosa un polímero de origen vegetal y uno de los más usados en la industria, la producción de origen bacteriano se presenta como una alternativa para su obtención, con sus respectivas ventajas y dificultades. Los estudios de este proceso se iniciaron en la década de 1950 y se concentraron, inicialmente, en la definición del medio de cultivo, con especial énfasis en el efecto de la fuente de carbono y en la identificación del proceso de biosíntesis. Posteriormente, las investigaciones realizadas en las décadas de 1990 y 2000 han buscado la implementación y mejoramiento de las técnicas de cultivo para superar los retos de la producción comercial de celulosa bacteriana, tales como la baja productividad, la posibilidad de mutación de las células productoras a no productoras y el incremento de la viscosidad del medio a medida que aumenta la concentración de celulosa en cultivo agitado. Adicionalmente, se ha evaluado la posibilidad de emplear fuentes de carbono complejas con resultados promisorios en la productividad, lo que permitirá disminuir los costos de producción. Actualmente, las posibles aplicaciones de la celulosa bacteriana se extienden desde las convencionales de la celulosa de origen vegetal, hasta aplicaciones en el campo médico y en tecnologías de separación. Para las aplicaciones en el área médica, las características del polímero permiten su implementación a pesar del elevado costo de producción; y para otras aplicaciones como las electrónicas o en procesos reactivos y de separación, las estructuras y membranas obtenidas han mostrado propiedades interesantes; sin embargo, para la masificación de estos usos es necesario superar los inconvenientes que se presentan en el escalado del proceso de producción. De esta forma, analizando el desarrollo que se ha tenido en los procesos para obtención de celulosa bacteriana, se puede inferir que a mediano plazo se logrará viabilizar nuevas aplicaciones para este biopolímero, así como su producción en gran escala.
Referencias
1. R. Jonas, L. Farah ''Production and applications of microbial cellulose.'' Polymer Degradation ans Stability, vol. 59, pp. 101 - 106, 1998. [ Links ] Referenciado en 308, 309, 311
2. E. Vandamme, S. De Baets, A. Vanbalaen, K. Joris, P. De Wulf. ''Improved production of bacterial cellulose and its application potential''Polymer Degradation and Stability, vol. 59, pp. 93 - 99, 1998. [ Links ] Referenciado en 308
3. J. Mathews, C. Skopec, P. Manson, P. Zuccato, R. Torget, J. Sugiyama, M. Himmel, J. Brady. ''Computer Simulation studies of microcrystalline cellulose Ib.'' Carbohydrate Research., vol. 341 no. 1, pp.138 - 152, 2006. [ Links ] Referenciado en 308
4. A. O'Sullivan ''Cellulose: The structure slowly unravels.'' Cellulose, vol. 4 no. 3, pp. 173 - 207, 1997. [ Links ] Referenciado en 308
5. M. Akerholm, y L. Salmén. ''Dynamic FT-IR Spectroscopy for carbohydrate analysis of wood pulps.'' Journal of Pulp and Paper Science, vol. 28 no. 7, pp. 245 - 249, 2002. [ Links ] Referenciado en 308
6. M. Akerholm, M, B. Hinterstoisser, L. Salmén. ''Characterization of the crystalline structure of cellulose using static and dynamic FT-IR spectroscopy'' Carbohydrate Research., vol. 339 no. 3, pp. 569 - 578, 2004. [ Links ] Referenciado en 308
7. S. Bielecki, A. Krystynowicz, M. Turkiewicz, H. Kalinowska. ''Bacterial Cellulose'' Biopolymers online., 2005. [ Links ] Referenciado en 309, 310, 311, 312
8. W. Dudman ''Cellulose production by Acetobacter acetigenum and other Acetobacter spp''. Journal of General Microbiology., vol. 21 no. 2, pp. 312 - 326, 1959. [ Links ] Referenciado en 309, 314
9. J. Jung, J. Park, H. Chang. ''Bacterial cellulose production by Gluconacetobacter hansenii in an agitated culture without living non-cellulose producing cells''. Enzyme and Microbial Technology., vol. 37 no. 3, pp. 347 - 354, 2005. [ Links ] Referenciado en 310
10. S. Keshk. ''Physical properties of bacterial cellulose sheets produced in presence of lignosulfonate''. Enzyme and Microbial Technology, vol. 40 no. 1, pp. 9- 12, 2006. [ Links ] Referenciado en 310
11. V. Duvey, C. Saxena, L. Singh, K. Ramana, R. Chauhan. ''Pervaporation of binary water - ethanol mixtures through bacterial cellulose membrane''. Separation and Purification Technology, vol. 27 no. 3, pp. 163 - 171, 2002. [ Links ] Referenciado en 310, 321
12. T. Oikawa, T. Ohtori, M. Ameyama. ''Production of cellulose from D. mannitol by Acetobacter xylinum KU - 1''. Bioscience, Biotechnology, and Biochemistry, vol 59 no. 2, pp 331 - 332, 1995. [ Links ] Referenciado en 310
13. M. Ishihara, m. Matsunaga, N. Hayashi, V. Tisler. ''Utilization of D - xylose as carbon source for production of bacterial cellulose''. Enzyme and Microbial Technology., vol. 31 no. 7, pp. 986 - 991, 2002. [ Links ] Referenciado en 310
14. S. Keshk, K. Sameshima. ''Evaluation of different carbon sources for bacterial cellulose production''. African Journal of Biotechnology., vol. 4 no. 6, pp. 478 - 482, 2005. [ Links ] Referenciado en 310
15. P. Chawla, I. Bajaj, S. Survase, R. Singhal. ''Microbial Cellulose: Fermentative production and applications''. Food Technology and Biotechnology., vol. 47 no. 2, pp. 107 - 124, 2009. [ Links ] Referenciado en 310, 319
16. P. Ross, R. Mayer, M. Benziman. ''Cellulose Biosynthesis and Funtion in Bacteria''. Microbiol Rev., vol. 55 no. 1, pp. 35 - 58, 1991. [ Links ] Referenciado en 310, 312
17. N. Han, F. Robyt. ''The mechanism of Acetobacter xylinum celullose biosynthesis: direction of chain elongation and the role of lipid pyrophosphate intermediates in the cell membrane''. Carbohydrate Research., vol. 313 no. 2, pp. 125 -133, 1998. [ Links ] Referenciado en 310, 311
18. M. Marx-Firgini, B. Pion. ''Kinetic invetigations of biosynthesis of cellulose by Actobacter xylinum''. Biochimica et Biophysica Acta, BBA) - General Subjects ., vol. 338 no. 2, pp. 382 - 393, 1974. [ Links ] Referenciado en 310
19. K. Zaar. ''Visualization of Pores, Export Sites) Correlated with Cellulose Production in the Envelope of the Gram-negative Bacterium Acetobacter xylinum''. Journal of Cell Biology., vol 80 no. 3, pp. 773 - 777, 1979. [ Links ] Referenciado en 311
20. F. Horii, H. Kaji, A. Hirai, Y. Tsunashima, K. Ohmine. ''Cellulose assemblies produced by Acetobacter xylinum''. ICR Annual Report, vol 6, pp. 28- 29, 1999. [ Links ] Referenciado en 311
21. I. Saxena, M. Brown Jr. ''Cellulose synthases and related enzymes''. Current Opinion in Plant Biology., vol. 3 no. 6, pp. 523 - 531, 2000. [ Links ] Referenciado en 311
22. L. Caicedo, F. De França, L. De Almeida. ''Produção de Celulose Bacteriana em Reatores de Tambor Rotatório''. Tesis para la obtención del grado de Doctor en Ciencias. Escola de Química. Río de Janeiro, Universidade Federal do Rio de Janeiro, 2002. [ Links ] Referenciado en 311, 319
23. T. Okamoto, S. Yamano, H. Ikeaga, K. Nakamura. ''Cloning of the Acetobacter xylinum cellulase gene and its expression in Escherichia coli and Zymomonas mobilis''. Applied Microbiology and Biotechnology., vol. 42 no. 4, pp. 563 -568, 1994. [ Links ] Referenciado en 312
24. N. Tahara, N. Tonouchi, H. Yano, F. Yoshinaga. ''Purification and characterization of exo-1,4-glucosidase from Acetobacter xylinum BPR2001''. Journal of Fermentation and Bioengineering., vol. 85 no. 6, pp. 589 - 594, 1998. [ Links ] Referenciado en 312
25. W. Borzani, S. De Souza. ''Mechanism of the film thickness increasing during the bacterial production of cellulose on non-agitated liquid media''. Biotechnology Letters., vol. 17 no. 11, pp. 1271 - 1272, 1995. [ Links ] Referenciado en 313
26. D. Klemm, D. Schumann, U. Udhardt, S. Marsch. ''Bacterial synthesized cellulose -artificial blood vessels for microsurgery''. Progress in Polymer Science., vol. 26 no. 9, pp. 1561 - 1603, 2001. [ Links ] Referenciado en 313, 320
27. L. Carreño. ''Efecto de las condiciones de cultivo y purificación sobre las propiedades fisicoquímicas y de transporte en membranas de celulosa bacteriana''. Tesis para la obtención del grado de Doctor en Ingeniería. Departamento de Ingeniería Química. Bogotá, Universidad Nacional de Colombia, 2011. [ Links ] Referenciado en 313, 321
28. M. Schramm, S. Hestrin. ''Cellulose production by Acetobacter acetigenum and other Acetobacter spp''. Journal of General Microbiology., vol. 1350-0872, no. 1, pp. 123 - 129, 1954. [ Links ] Referenciado en 314
29. Y. Yang, Y, S. Park, J. Hwang, Y. Pyun, Y. Kim. ''Factors affecting Production of Cellulose at the Air/Liquid Interface of a Culture of Acetobacter xylinum''. Journal of Fermentation and Bioengineering., vol. 85 no. 3, pp. 312 - 317, 1998. [ Links ] Referenciado en 314
30. H. Toyosaki, T. Naritomi, A. Seto, M. Matsuoka, T. Tsuchida, Yoshinaga, F. ''Screening of bacterial cellulose-producing Acetobacter strains suitable for agitated culture''. Bioscience, Biotechnology and Biochemistry., vol. 59 no. 98, pp. 1498 - 1502, 1995. [ Links ] Referenciado en 314
31. H. Son, M. Heo, Y. Kim, S. Lee. ''Optimization of fermentation conditions for the production of bacterial cellulose by a newly isolated Acetobacter''. Biotechnology and Applied Biochemistry., vol 33 no. 1, pp. 1 - 5, 2001. [ Links ] Referenciado en 314, 318
32. S. Hestrin, M. Schramm. ''Synthesis of cellulose by Acetobacter xylinum. II. Preparation of freeze-dried cells capable of polymerizing glucose to cellulose''. Biochemical Journal., vol. 58 no2, 1954. [ Links ] Referenciado en 314
33. M. Schramm, Z. Gromet, S. Hestrin, ''Synthesis of Cellulose by Acetobacter xylinum 3. Substrates and Inhibitors''. Biochemical Journal., vol. 67 no. 4, pp. 669 - 679, 1957. [ Links ] Referenciado en 314
34. Z. Gromet, M. Schramm, S. Hestrin, ''Synthesis of cellulose by Acetobacter xylinum. 4. Enzyme systems present in a crude extract of glucose-grown cells''. Biochemical Journal., vol. 67 no. 4, pp. 679 - 689, 1957. [ Links ] Referenciado en 314
35. S. Keshk, T. Razek, K. Sameshima. ''Bacterial cellulose production from beet molasses''. African Journal of Biotecgnology., vol, 5 no. 17, pp. 1517 - 1523, 2006. [ Links ] Referenciado en 315
36. S. Bae, M. Shoda. ''Production of bacterial cellulose by Acetobacter xylinum BPR2001 using molasses medium in a jar fermentor''. Applied Microbiology and Biotechnology, vol. 67 no. 1, pp. 45 - 51, 2005. [ Links ] Referenciado en 315
37. F. Hong, K. Qiu. ''An alternative carbon source from konjac powder for enhancing production of bacterial cellulose in static cultures by a model strain Acetobacter aceti subsp. xylinus ATCC 23770''. Carbohydrate Polymers., vol. 72 no. 3, pp. 545 - 549, 2008. [ Links ] Referenciado en 315
38. A. Kurosumi, C. Sasaki, Y. Yamashita, Y. Nakamura ,''Utilization of various fruit juices as carbon source for production of bacterial cellulose by Acetobacter xylinum NBRC 13693''. Carbohydrate Polymers., vol. 76 no. 2, pp. 333 -335, 2009. [ Links ] Referenciado en 315
39. J.Wu, R. Liu. ''Thin stillage supplementation greatly enhances bacterial cellulose production by Gluconacetobacter xylinus''. Carbohydrate Polymers., vol. 90 no. 1, pp. 116 - 121, 2012. [ Links ] Referenciado en 316
40. K.Watanabe, S. Yamanaka. ''Effects of Oxygen Tension in the Gaseous Phase on Production and Physical Properties of Bacterial Cellulose Formed under Static Culture Conditions''. Bioscience, Biotechnology and Biochemistry., vol. 59 no. 1, pp. 65 - 68, 1995. [ Links ] Referenciado en 316
41. M. Matsuoka, T. Tsuchida, K. Matsushita, O. Adachi, F. Yoshinaga. ''A Synthetic Medium for Bacterial Cellulose Production by Acetobacter xylinum subsp. Sucrofermentans''. Bioscience, Biotechnology, Biochemistry., vol. 60 no. 4, pp. 575 - 579, 1996. [ Links ] Referenciado en 316, 321
42. H. Jung, J. Jeong, O. Lee, G. Park, K. Kim, H. Park, S. Lee, Y. Kim, H. Son. ''Influence of glycerol on production and structural - physical properties of cellulose from Acetobacter sp. V6 cultured in shake flasks''. Bioresource Technology., vol. 101 no. 10, pp. 3602 - 3608, 2010. [ Links ] Referenciado en 316
43. L. Sternberg, M. Deniro, R. Savidge. ''Oxygen Isotope Exchange between Metabolites and Water during Biochemical Reactions Leading to Cellulose Synthesis''. Plant Physiology., vol. 82, pp. 423 - 427, 1986. [ Links ] Referenciado en 317
44. S. Bae, M. Shoda. ''Statistical optimization of culture conditions for bacterial cellulose production using Box-Behnken design''. Biotechnology and Bioengineering., vol. 90 no. 1, pp. 20 - 28, 2005. [ Links ] Referenciado en 317
45. L. Zhou, D. Sun, L. Hu, Y. Li, J. Yang. ''Effect of addition of sodium alginate on bacterial cellulose production by Acetobacter xylinum''. Journal of Industrial Microbiology & Biotechnology., vol. 34 no. 7, 483 - 489, 2007. [ Links ] Referenciado en 317
46. T. Ishida, Y. Sugano, T. Nakai, M. Shoda. ''Effects of acetan on production of bacterial cellulose by Acetobacter xylinum''. Bioscience, Biotechnology, Biochemistry., vol. 66 no. 8, pp. 1677 - 1681, 2002. [ Links ] Referenciado en 317
47. Y. Chao, M. Miratai, Y. Sugano, M. Shoda. ''Effect of addition of water-soluble polysaccharides on bacterial cellulose production in a 50-L airlift reactor''. Biotechnology Progress., vol. 17 no. 4, pp. 781 - 785, 2001. [ Links ] Referenciado en 317, 318
48. J. Ha, J. Park. ''Improvement of bacterial cellulose production in Acetobacter xylinum using byproduct produced by Gluconacetobacter hansenii''. Korean Journal of Chemical Engineering., vol. 29 no. 5, pp. 563 - 566, 2012. [ Links ] Referenciado en 317
49. T. Naritomi, T.Kouda, H. Yano, F. Yoshinaga. ''Effect of Ethanol on Bacterial Cellulose Production from Fructose in Continuous Culture''. Journal of Fermentation and Bioengineeering., vol. 85 no. 6, pp. 598 - 603, 1998. [ Links ] Referenciado en 317
50. T. Naritomi, T. Kouda, H. Yano, F. Yoshinaga. ''Effect of lactate on bacterial cellulose production from fructose in continuous culture''. Journal of Fermentation and Bioengineering., vol. 85 no. 1, pp. 89 - 95, 1998. [ Links ] Referenciado en 317
51. T. Naritomi, T. Kouda, H. Yano, F. Yoshinaga. ''Inhibitory effect of carbon dioxide on bacterial cellulose production by Acetobacter in agitated culture''. Journal of Fermentation and Bioengineeering., vol. 85 no. 3, pp. 318 - 321, 1998. [ Links ] Referenciado en 317
52. T. Oikawa, T. Ohtori, M. Ameyama. ''Production of Cellulose from D-Arabitol by Acetobacter xylinum KU-1''. Bioscience, Biotechnology and Biochemistry.,vol. 59 no. 8, pp. 1564 - 1565, 1995. [ Links ] Referenciado en 318
53. L. Carreño y L. Caicedo. ''Producción de Membranas de Celulosa Bacteriana a Partir de Diferentes Fuentes de Carbono''. Memorias, II Simposio sobre Biofábricas. Medellín, Colombia, 2005. [ Links ] Referenciado en 318
54. T. Kouda, H. Yano, F. Yoshinaga, M. Kaminoyama, M. Kamiwano. ''Characterization of non-newtonian behavior during mixing of bacterial cellulose in a bioreactor''. Journal of Fermentation and Bioengineering., vol. 82 no. 4, pp. 382 - 386, 1996. [ Links ] Referenciado en 318
55. T. Kouda, T. Naritomi, H. Yano, F. Yoshinaga. ''Cultivation of Acetobacter xylinum for bacterial cellulose production in a modified airlift reactor''. Journal of Fermentation and Bioengineering., vol. 84 no. 2, pp 124 - 127, 1997. [ Links ]
56. T. Kouda, H. Yano, F. Yoshinaga. ''Effect of agitator configuration on bacterial cellulose productivity in aerated and agitated culture''. Journal of Fermentation and Bioengineering, vol. 83 no. 4, pp. 371 - 376, 1997. [ Links ] Referenciado en 318
57. H. Cheng, P. Wang, J. Chen, W. Wu. ''Cultivation of Acetobacter xylinum for bacterial cellulose production in a modified airlift reactor''. Biotechnology and Applied Biochemistry., vol. 35 no. 2, pp. 125 - 132, 2002. [ Links ] Referenciado en 318
58. G. Serafica, R. Mormino, H. Bungay. ''Inclusion of solid particles in bacterial cellulose''. Applied Microbiology and Biotechnology., vol. 58 no. 6, pp. 756- 760, 2002. [ Links ] Referenciado en 319
59. K. Cheng, J. Catchmark, A. Demirci. ''Enhanced production of bacterial cellulose by using a biofilm reactor and its material property analysis''. Journal of Biological Engineering., vol 3 no. 12, 2009. [ Links ] Referenciado en 319
60. J. Fontana, A. De Souza, C. Fontana, C., I. Torriani, J. Moreschi, B. Gallotti. ''Acetobacter cellulose pellicle as a temporary skin substitute''. Applied Biochemistry and Biotechnology., vol. 24-25 no. 1, pp. 253 - 264, 1990. [ Links ] Referenciado en 319
61. F. Yoshinaga, N. Tonouchi, K. Watanabe. ''Research Progress in production of Bacterial Cellulose by Aeration and Agitation Culture and Its application as a New Industrial Material''. Bioscience, Biotechnology, Biochemistry., vol. 61 no. 2, pp. 219 - 224, 1997. [ Links ] Referenciado en 319
62. M. Iguchi, S. Yamanaka, A. Budhiono. ''Bacterial bellulose: A master piece of nature's arts''. Journal of Materials Science., vol. 35 no. 2, pp. 261 - 270, 2000. [ Links ] Referenciado en 319
63. S. Yamanaka, K. Watanabe, N. Kitamura. ''The structure and mechanical properties of sheets prepared from bacterial cellulose''. Journal of Materials Science., vol. 24 no. 9, pp. 3141 - 3145, 1989. [ Links ] Referenciado en 319
64. N. Nishi, M. Uryu, S. Yamanaka, K. Watanabe, N. Kitamura. ''The Structure and Mechanical Properties of Sheets Prepared from Bacterial Cellulose. Part 2. Improvement of the mechanical Properties of sheets and their applicability to diaphragms of electroacoustic transducers''. Journal of Materials Science., vol. 25 no. 6, pp. 2997 - 3001, 1990. [ Links ] Referenciado en 319
65. D. Ciechanska, H. Struszczyk, J. Kazimierczak, K. Guzinska, M. Pawlak, E. Kozlowska, G. Matusiak, M. Dutkiewicz. ''New electro-acoustic transducers based on modified bacterial cellulose''. Fibres and Textiles in Eastern Europe., vol. 36 no. 1, 2002. [ Links ] Referenciado en 319
66. W. Czaja, A. Krystynowicz, S. Bielecki, Brown, R. ''Microbial cellulose: the natural power to heal wounds''. Biomaterials., vol. 27 no. 2, pp. 145 - 151, 2006. [ Links ] Referenciado en 319
67. W. Czaja, D. Young, M. Kawecki, R. Brown. ''The Future Prospects of Microbial Cellulose in Biomedical Applications''. Biomacromolecules., vol. 8 no. 1, pp. 1 - 12, 2007. [ Links ] Referenciado en 319
68. Z. Cai, H. Jin, J. Kim. ''Chitosan blended bacterial cellulose as a smart material for biomedical application, (Proceedings Paper)''. Nanosensors, Biosensors, and Info-Tech Sensors and Systems 2009, Proceedings., vol. 7291, 2009. [ Links ] Referenciado en 319
69. G. Olyveira, L. Costa, P. Basmaji. ''Nanoskin bacterial cellulose structured - Towards the development of regenerative medicine''. Nanotechnology 2011: Bio Sensors, Instruments, Medical, Environment and Energy., vol. 3, pp. 267 - 270, 2011. [ Links ] Referenciado en 319
70. T. Maneerung, S. Tokura, R. Rujiravanit. ''Impregnation of silver nanoparticles into bacterial cellulose for antimicrobial wound dressing''. Carbohydrate Polymers., vol. 72 no. 1, pp. 43 - 51, 2008. [ Links ] Referenciado en 319
71. G. Yang, J. Xie, F. Hong, Z. Cao, X. Yang. ''Antimicrobial activity of silver nanoparticle impregnated bacterial cellulose membrane: Effect of fermentation carbon sources of bacterial cellulose''. Carbohydrate Polymers., vol. 87 no. 1, pp. 839 - 845, 2012. [ Links ] Referenciado en 319
72. D. Schumann, J Wippermann, D. Klemm, F. Kramer, D. Koth, H. Kosmehl, T. Wahlers, S. Salehi-Gelani, ''Artificial vascular implants from bacterial cellulose: preliminary results of small arterial substitutes''. Cellulose., vol. 16 no. 5, pp. 877 - 885, 2009. [ Links ] Referenciado en 320
73. H. Backdahla, G. Helenius, A. Bodina, U. Nannmarkc, B. Jahanssonc, B. Risberg, P. Gatenholm. ''Mechanical properties of bacterial cellulose and interactions with smooth muscle cells''. Biomaterials., vol. 27 no. 9, pp. 2141 - 2149. 2006. [ Links ] Referenciado en 320
74. P. Charpentier, A. Maguire, W. Wan. ''Surface modification of polyester to produce a bacterial cellulose-based vascular prosthetic device''. Applied Surface Science., vol. 252 no. 18, pp. 6360 - 6367, 2006. [ Links ] Referenciado en 320
75. F. Andrade, R. Costa, L. Domingues, R. Soares, M. Gama. ''Improving bacterial cellulose for blood vessel replacement: Functionalization with a chimeric protein containing a cellulose-binding module and an adhesion peptide''. Acta Biomaterialia., vol. 6 no. 10, pp. 4034 - 4041, 2010. [ Links ] Referenciado en 320
76. A. Lloyd. ''Bacterial cellulose scaffolds for cartilage repair: Tissue engineering''. Materials Today., vol. 7 no. 11, 28, 2004. [ Links ] Referenciado en 320
77. A. Svensson, E. Nicklasson, T. Harrah, B. Panilaitis, D. Kaplan, M. Brittberg, M. Gatenhol. ''Bacterial cellulose as a potential scaffold for tissue engineering of cartilage''. Biomaterials., vol. 26 no. 4, pp. 419 - 431, 2005. [ Links ] Referenciado en 320
78. N. Sanchavanakit, W. Sangrungraungroj, R. Kaomongkolgit, T. Banaprasert, P. Pavasant, M. Phisalaphong. ''Growth of Human Keratinocytes and Fibroblasts on Bacterial Cellulose Film''. Biotechnology Progress., vol. 22 no. 4, 1194 - 1199, 2006. [ Links ] Referenciado en 320
79. S. Concaro, B. Aase, P. Gatenholm, M. Brittberg, ''Bacterial cellulose as a potential material for meniscal tissue engineering''. Osteoarthritis and Cartilage., vol. 15 no. B, pp. B75 - B75, 2007. [ Links ] Referenciado en 320
80. Z. Wang, Y. Jia,Y. Shi, D. Cong, Y. Chen, S. Jia, Y. Zhou, ''Research on characterization and biocompatibility of nano-bacterial cellulose membrane''. Chemical Journal of Chinese Universities., vol. 30 no. 8, pp. 1553 - 1558, 2009. [ Links ] Referenciado en 320
81. H. Zahedmanesh, P. Gatenholm, C. Lally. ''Bacterial cellulose: A potential vascular graft and tissue engineering scaffold''. Proceedings of the ASME Summer Bioengineering Conference 2009, SBC2009, PART A., no. 2009. [ Links ] Referenciado en 320
82. B. Brackmann, A. Bodin, M. Akeson, P. Gatenholm, A. Enejder. ''Visualization of the cellulose biosynthesis and cell integration into cellulose scaffolds''. Biomacromolecules., vol. 11 no. 3, pp. 542 - 548, 2010. [ Links ] Referenciado en 320
83. N. Nwe, T. Furuike, H. Tamura. ''Selection of a biopolymer based on attachment, morphology and proliferation of fibroblast NIH/3T3 cells for the development of a biodegradable tissue regeneration template: Alginate, bacterial cellulose and gelatin''. Process Biochemistry., 45 no. 4, pp. 457 - 466, 2010. [ Links ] Referenciado en 320
84. A. Nakayama, A. Kakugo, J.P. Gong, Y. Osada, M. Takai, T. Erata, S. Kawano. ''High Mechanical Strengh Double-Network Hydrogel with Bacterial Cellulose''. Advanced Functional Materials., vol. 14 no. 11, pp. 1124 - 1128, 2004. [ Links ] Referenciado en 320
85. L. Hong, Y.Wang, S. Jia, Y. Huang, C. Gao, Y.Wan. ''Hydroxyapatite/bacterial cellulose composites synthesized via a biomimetic route''. Materials Letters., vol. 60 no. 13-14, pp. 1710 - 1713, 2006. [ Links ] Referenciado en 320
86. Y. Wan, Y. Huang, C. Yuan, S. Raman, Y. Zhu, H. Jiang, F. He, C. Gao, ''Biomimetic synthesis of hydroxyapatite/bacterial cellulose nanocomposites for biomedical applications''. Materials Science and Engineering: C ., 27 no. 4, pp. 855 - 864, 2007. [ Links ] Referenciado en 320
87. B. Rambo, D. Recouvreux, C. Carminatti, A. Pitlovanciv, R. António, L. Porto. ''Template assisted synthesis of porous nanofibrous cellulose membranes for tissue engineering''. Materials Science and Engineering: C, 28 no. 4, pp. 549- 554, 2008. [ Links ] Referenciado en 320
88. C. Grande, F. Torres, C. Gomez, M. Bañó. ''Nanocomposites of bacterial cellulose/ hydroxyapatite for biomedical applications''. Acta Biomaterialia., vol. 5 no. 5, pp. 1605 - 1615, 2009. [ Links ] Referenciado en 320
89. J. Li, Y. Wan, L. Li, H. Liang, J. Wang. ''Preparation and characterization of 2,3-dialdehyde bacterial cellulose for potential biodegradable tissue engineering scaffolds''. Materials Science and Engineering: C ., vol. 29 no. 5, pp. 1635- 1642, 2009. [ Links ] Referenciado en 320
90. S. Zhang, G. Xiong, G., F. He, Y. Huang, Y. Wang, Y. Wan. ''Characterisation of hydroxyapatite/bacterial cellulose Nanocomposites''. Polymers and Polymer Composites., vol, 17 no. 6, pp. 353 - 358, 2009. [ Links ] Referenciado en 320
91. K. Zimmermann, J. Leblanc, K. Sheets, R. Fox, P. Gatenholm. ''Biomimetic design of a bacterial cellulose/hydroxyapatite nanocomposite for bone healing applications''. Materials Science and Engineering: C , vol 31 no. 1, pp. 43- 49, 2011. [ Links ] Referenciado en 320
92. Q. Zheng, T. Xi, Y. Chen, Z.Wang, Y.Wan, C. Gao. ''Cytocompatibility of nanohydroxyapatite/ bacterial cellulose nanocomposites and its residues''. Journal of Clinical Rehabilitative Tissue Engineering Research., vol 14 no. 3, pp. 405 - 409, 2010. [ Links ] Referenciado en 320
93. M. Zaborowska, A. Bodin, H. Backdahl, J. Popp, A. Goldstein, P. Gatenholm. ''Microporous bacterial cellulose as a potential scaffold for bone regeneration''. Acta Biomaterialia., vol. 6 no. 7, pp. 2540 - 2547, 2010. [ Links ] Referenciado en 320
94. N. Yin, S. Chen, Y. Ouyang, L. Tang, Z. Li, J. Yang, Q. Xu, H.Wang. ''Biomimetic mineralization synthesis of hydroxyapatite bacterial cellulose nanocomposites''. Progress in Natural Science: Materials International, vol. 21 no. 6, pp. 472 - 477, 2011. [ Links ] Referenciado en 320
95. Y. Ouyang, N. Yin, S. Chen, L. Tang, H. Wang. ''Synthesis and characterization of bacterial cellulose / calcium silicate composites''. Advanced Materials Research.,vol. 476-478, pp. 863 - 866, 2012. [ Links ] Referenciado en 320
96. H. Jia, Y. Jia, J. Wang, Y. Hu, Y. Zhang, S. Jia. ''Potentiality of bacterial cellulose as the scaffold of tissue engineering of cornea''. Proceedings of the 2009 2nd International Conference on Biomedical Engineering and Informatics, BMEI 2009 . no. 2009. [ Links ] Referenciado en 320
97. H. Jia, Y. Jia, J. Wang, Y. Hu, Y. Zhang, Y. Zhou, P. Wang. ''Method to construct tissue engineering corneal stroma with bacterial cellulose and its evaluation''. Journal of Jilin University, Medicine Edition., vol. 36 no. 2, pp. 303 - 307, 2010. [ Links ] Referenciado en 320
98. J. Wang, C. Gao, Y. Zhang, Y. Wan. ''Preparation and in vitro characterization of BC/PVA hydrogel composite for its potential use as artificial cornea biomaterial''. Materials Science and Engineering: C ., vol. 30 no. 1, pp. 214 - 218, 2010. [ Links ] Referenciado en 320
99. H. Ammon, W. Ege, M. Oppermann, W. Gopel, S. Eisele. ''Improvement in the long-term stability of an amperometric glucose sensor system by introducing a cellulose membrane of bacterial origin''. Analytical Chemistry., vol. 67 no. 2, pp. 466 - 471, 1995. [ Links ] Referenciado en 320
100. K. Watanabe, Y. Eto, S. Takano, S. Nakamori, S. Yamanaka. ''A New Bacterial Cellulose Substrate for Mammalian Cell Culture''. Cytotechnology., vol. 13 no. 2, pp. 107 - 114, 1997. [ Links ] Referenciado en 320
101. S. Wu, Y. Lia. ''Application of bacterial cellulose pellets in enzyme immobilization''. Journal of Molecular Catalysis B: Enzymatic. , vol. 54 no. 3-4, pp. 103 - 108, 2008. [ Links ] Referenciado en 320
102. C. Zhijiang, Y. Guang. ''Bacterial cellulose/collagen composite: Characterization and first evaluation of cytocompatibility''. Journal of Applied Polymer Science., vol. 120 no. 5, pp. 2938 - 2944, 2011. [ Links ] Referenciado en 320
103. J.Wang, Y.Wan, H. Luo, C. Gao, Y. Huang. ''Immobilization of gelatin on bacterial cellulose nanofibers surface via crosslinking technique''. Materials Science and Engineering C ., vol. 32 no. 3, pp. 536 - 541, 2012. [ Links ] Referenciado en 320
104. A. Stoica-Guzun, M. Stroescu, F.Tache, T. Zaharescu, E. Grosu''. Effect of electron beam irradiation on bacterial cellulose membranes used as transdermal drug delivery systems''. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms, vol. 265 no. 1, pp. 434 - 438, 2007. [ Links ]
105. R. Mori, T. Nakai, K. Enomoto, Y. Uchio, K. Yoshino''. Increased antibiotic release from a bone cement containing bacterial cellulose''Clin Orthop Relat Res., vol. 469 no. 2, pp. 600 - 606, 2011. [ Links ] Referenciado en 320
106. M. Amin, A. Abadi, N. Ahmad, H. Katas, J. Jamal. ''Bacterial cellulose film coating as drug delivery system: Physicochemical, thermal and drug release properties''. Sains Malaysiana., vol. 41 no. 5, pp. 561 - 568, 2012. [ Links ] Referenciado en 320
107. E. Trovatti, C. Freire, P. Pinto, I. Almeida, P. Costa, A. Silvestre, C. Neto, C. Rosado. ''Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies''. International Journal of Pharmaceutics., vol. 435 no. 1, pp. 83 - 87, 2012. [ Links ] Referenciado en 320
108. W. Yao, X. Wu, J. Zhu, B. Sun, Y. Zhang, C. Miller. ''Bacterial cellulose membrane - A new support carrier for yeast immobilization for ethanol fermentation''. Process Biochemistry., vol. 46 no. 10, pp. 2054 - 2058, 2011. [ Links ] Referenciado en 320
109. N. Ton, V. Le. ''Application of immobilized yeast in bacterial cellulose to the repeated batch fermentation in wine-making''. International Food Research Journal., vol. 18 no. 3, pp. 983 - 987, 2011. [ Links ] Referenciado en 320
110. C. Legnani, C. Vilani, V. Calil, H. Barud, W. Quirino, C. Achete, S. Ribeiro, M. Cremona, ''Bacterial cellulose membrane as flexible substrate for organic light emitting devices''. Thin Solid Films., vol. 517 no. 3, pp. 1016 - 1020, 2008. [ Links ] Referenciado en 320
111. X. Li, S. Chen, W. Hu, S. Shi, W. Shen, X. Zhang, H. Wang. ''In situ synthesis of CdS nanoparticles on bacterial cellulose nanofibers''. Carbohydrate Polymers., vol., 76 no. 4, pp. 509 - 512, 2009. [ Links ] Referenciado en 321
112. W. Shen, S. Chen, S. Shi, X. Li, X. Zhang, W. Hu, H. Wang. ''Adsorption of Cu no. II) and Pb no. II) onto diethylenetriamine-bacterial cellulose''. Carbohydrate Polymers., vol. 75 no. 1, pp. 110 - 114, 2009. [ Links ] Referenciado en 321
113. D. Muller, J. Mandelli, J. Marins, B. Soares, L. Porto, C. Rambo, G. Barra. ''Electrically conducting nanocomposites: preparation and properties of polyaniline, PAni)-coated bacterial cellulose nanofibers, BC)''. Cellulose., vol. 19 no. 5, pp. 1645 - 1654, 2012. [ Links ] Referenciado en 321
114. S. Ummartyotin, J. Juntaro, M. Sain, H. Manuspiya. ''Development of transparent bacterial cellulose nanocomposite film as substrate for flexible organic light emitting diode, OLED) display''. Industrial Crops and Products., vol. 35 no. 1, pp. 92 - 97, 2012. [ Links ] Referenciado en 321
115. H. Take, S. Yamanaka, M. Ishihara, K. Yoshino. ''Anode performance of pyrolyzed bacterial cellulose in secondary lithium-ion batteries and the effect of added metal phthalocyanines''. Japanese Journal of Applied Physics, Part 1 ., vol. 41 no. 5A, pp. 3137 - 3139, 2002. [ Links ] Referenciado en 321
116. B. Evans, H. O'Neill, V. Malyvanh, I. Lee, J. Woodward. ''Palladiumbacterial cellulose membranes for fuel cells''. Biosensors and Bioelectronics., vol. 18 no. 7, pp. 917 - 922, 2003. [ Links ] Referenciado en 321
117. M. Mukai, D. Tatsumi, T. Matsumoto. ''Evaluation of bacterial cellulose membrane for fuel cells''. Polymer Preprints., 55 no. 2, 2006. [ Links ] Referenciado en 321
118. U. Patel, S. Suresh. ''Complete dechlorination of pentachlorophenol using palladized bacterial cellulose in a rotating catalyst contact reactor''. Journal of Colloid ans Interface Science., vol. 319 no. 15, pp. 462 - 469, 2008. [ Links ] Referenciado en 321
119. J. Yang, D. Sun, J. Li, X. Yang, J. Yu, Q. Hao, W. Liu, J. Liu, Z. Zou, J. Gu. ''In situ deposition of platinum nanoparticles on bacterial cellulose membranes and evaluation of PEM fuel cell performance''. Electrochimica Acta., vol. 54 no. 26, pp. 6300 - 6305, 2009. [ Links ] Referenciado en 321
120. D. Sun, J. Yang, J. Li, J. Yu, X. Xu, X. Yang. ''Novel Pd-Cu/bacterial cellulose nanofibers: Preparation and excellent performance in catalytic denitrification''. Applied Surface Science., vol. 256 no. 7, pp. 2241 - 2244, 2010. [ Links ] Referenciado en 321
121. G. Jiang, J. Qiao, F. Hong. ''Application of phosphoric acid and phytic aciddoped bacterial cellulose as novel proton-conducting membranes to PEMFC''. International Journal of Hydrogen Energy., vol. 37 no. 11, pp. 9182 - 9192 no. 2012. [ Links ] Referenciado en 321
122. P. Wanichapichart, S. Kaewnopparat, K. Buaking y W. Puthai. ''Characterization of cellulose membranes produced by Acetobacter xyllinum''. Songklanakarin Journal of Science and Technology., vol. 24, pp. 855 - 862, 2002. [ Links ] Referenciado en 321
123. A. Krystynowicz, S. Bielecki, W. Czaja, M. Rzyska, J. Tramper, P.Jacek. ''Application of bacterial cellulose for clarification of fruit juices''. Progress in Biotechnology., vol. 17, pp. 323 - 327, 2000. [ Links ] Referenciado en 321
124. L. Pandey, C. Saxena, V. Duvey. ''Studies on pervaporative characteristics of bacterial cellulose membrane''. Separation and Purification Technology., vol. 3, pp. 213 - 218, 2005. [ Links ] Referenciado en 321
125. V. Duvey, L. Pandey, C. Saxena. ''Pervaporative separation of ethanol/water azeotrope using a novel chitosan-impregned bacterial cellulose membrane and chitosan-poly no. vinil alcohol) blends''. Journal of Membrane Science., vol. 251, pp. 131 - 136, 2005. [ Links ] Referenciado en 321
126. J. Tiongson, E. Bugante, E. Del Rosario. ''Development of ultrafiltration membranes from bacterial cellulose, nata de coco) for the separation of mango volatile organic compounds''. Philippine Agricultural Scientist., vol. 85 no. 3, pp. 256 - 265, 2002. [ Links ] Referenciado en 321
127. H. Shibazaki, S. Kuga, F. Onabe, M. Usuda. ''Bacterial Cellulose as a Separation Medium''. Journal of Applied Polymer Science., vol. 50 no. 6, pp. 965 - 969, 1993. [ Links ] Referenciado en 321
128. A. Sokolnicki, R. Fisher, T. Harrah, D. Kaplan, ''Permeability of bacterialcellulosemembranes''. Journal of Membrane Science., vol. 272 no. 1-2, pp. 15 - 27, 2006. [ Links ] Referenciado en 321
129. J. George, K. Ramana, S. Sabapathy, J. Jagannath, A. Bawa ''Characterization of chemicallytreatedbacterial, Acetobacterxylinum) biopolymer: Some thermomechanicalproperties''. International Journal of Biological Macromolecules., vol. 37 no. 4, pp. 189 - 194, 2005. [ Links ] Referenciado en 321
130. C. Clasen, B. Sultanova, T. Wilhelms, P. Heisig, W. Kulicke. ''Effects of Different Drying Processes on the Material Properties of Bacterial Cellulose Membranes'' Macromolecular Symposia., vol. 244, pp. 48 - 58, 2006. [ Links ] Referenciado en 321
131. H. Barud, A. Junior, D. Santos, R. De Assunção, C. Meireles, D. Cerqueira, G. Filho, C. Ribeiro, Y. Messadeq, S. Ribeiro. ''Thermal behavior of cellulose acetate produced from homogeneous acetylation of bacterial cellulose''. Thermochimica Acta. , vol. 471 no. 1-2, pp. 61 - 69, 2008. [ Links ] Referenciado en 321
132. D. Kim, Y. Nishiyama, Kuga, S. ''Surface acetylation of bacterial cellulose''. Cellulose., vol. 9, pp. 361 - 367, 2002. [ Links ] Referenciado en 322
133. O. Saibuatong, M. Phisalaphong. ''Novo aloe vera - bacterial cellulose composite fillm from biosynthesis''. Carbohydrate Polymers., vol. 792, pp. 455 - 460, 2010. [ Links ] Referenciado en 322