Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y Ciencia
versão impressa ISSN 1794-9165
ing.cienc. vol.9 no.17 Medellín jan./jun. 2013
ARTÍCULO ORIGINAL
Efecto de la presencia de sales inorgánicas sobre la inactivación fotocatalítica de E. Coli en agua
Effect of the Presence of Inorganic Salts on the Photocatalytic Inactivation of E. Coli in Water
Edwing Velasco1, Andrea L. Moreno2 y Sonia A. Giraldo3 1 Ingeniero Químico, edwingvelasco@gmail.com, Universidad Industrial de Santander, Bucaramanga, Colombia. 2 Magíster en Ingeniería Química, liliana9494@hotmail.com, Universidad Industrial de Santander, Bucaramanga, Colombia. 3 Doctora en Ciencias Naturales Aplicadas, sgiraldo@uis.edu.co, Universidad Industrial de Santander, Bucaramanga, Colombia. Recepción: 25-05-2012, Aceptación: 08-02-2013 Disponible en línea: 22-03-2013 MSC:65c20, 34-99 / PACS:82.65.+r, 61.82.Fk, 82.50.-m
Resumen
En este artículo se presenta el efecto de las sales inorgánicas MgSO4, NaCl y CaCO3 en la desinfección fotocatalítica del agua. Se usó TiO2-P25 como fotocatalizador y E. Coli como microorganismo contaminante. Las pruebas de desinfección se realizaron mediante la iluminación controlada de reactores batch cargados con agua contaminada, sales y TiO2. Los resultados de estas pruebas fueron usados para determinar los parámetros cinéticos de un modelo tipo Langmuir-Hinshelwood. Se encontró que las sales tienen una fuerte influencia sobre la inactivación fotocatalítica de E. Coli, y que cada sal y su concentración afectan la desinfección de forma diferente y en el siguiente orden: NaCl>CaCO3>>MgSO4. Adicionalmente, el valor de los parámetros calculados fue diferente para cada sal, evidenciando que las sales afectan el proceso por varios mecanismos relacionados con las interacciones ion-bacteria, ion-especie oxidante e ion-TiO2.
Palabras clave: fotocatálisis, TiO2, desinfección, sales inorgánicas, cinética.
Aspectos relevantes
• Las sales inorgánicas inhiben la inactivación fotocatalítica de E. coli. • En presencia de NaCl (0.07-2 mmol/L) no se alcanza la desinfección efectiva del agua. • La constante de velocidad de inactivación varía con la sal presente en la desinfección.
Abstract
This article presents the effect of inorganic salts MgSO4, NaCl and CaCO3on the photocatalytic water disinfection. TiO2-P25 was used as a photocatalyst, and E. Coli was used as a contaminant. Disinfection tests were performed by controlling lighting of batch reactors loaded with contaminated water, salts and TiO2. The results of these tests were used to determine the kinetic parameters of a type Langmuir-Hinshelwood model. It was found that the salts have a strong influence on the photocatalytic inactivation of E. Coli and that each salt and its concentration affect disinfection differently in the following order: NaCl>CaCO3 >>MgSO4. Additionally, the value of the calculated parameters was different for each salt, showing that the salts affect the process by several mechanisms related to the ion-bacteria interactions, ion-oxidizing species and ion-TiO2.
Key words: photocatalysis, TiO2, disinfection, inorganic salts, kinetic.
1 Introducción
La desinfección fotocatalítica de agua (DFA) es un proceso con gran potencial para disminuir la cantidad de bacterias presentes en las fuentes de agua cruda usadas para abastecer al ser humano [1],[2]. En éste proceso, la inactivación de bacterias se logra mediante el uso de un semiconductor que en presencia de una fuente de luz, genera especies oxidantes capaces de reaccionar con la membrana celular y ocasionar lisis y posterior muerte del microorganismo [3],[4]. El TiO2 es el semiconductor más utilizado en procesos fotocatalíticos debido a que presenta una alta actividad, es económico y amigable con el medio ambiente [5],[6]. Sin embargo, el desempeño del fotocatalizador en la DFA puede ser afectado por algunos parámetros operacionales como su concentración, la potencia de irradiación, la concentración inicial de microorganismos, la temperatura del agua y la geometría del reactor [7],[8]. Algunas características del agua como su composición y pH, también afecta la eficiencia del proceso fotocatalítico, y más aún, cuando se desea implementar este proceso en agua proveniente de fuentes de agua natural o cruda y de efluentes de aguas residuales, en los que la carga orgánica e inorgánica puede variar considerablemente dependiendo de la región geográfica.
Coleman et al. [9] revisaron la influencia del NaHCO3E. coli utilizando TiO> y encontraron que la presencia de esta sal provoca un decrecimiento en la eficiencia bactericida debido a la competición del ion 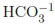 con las especies oxidantes causantes de la muerte del microorganismo. Gourmelot et al. [10] encontraron que la DFA en presencia de Cl-1 en concentraciones superiores a 10 mmol/L es acelerada debido a que este ion produce cambios en la permeabilidad de la membrana celular, ocasionando un aumento en el flujo de sustancias nocivas al interior de la bacteria. Otros autores como Rincón y Pulgarin [11] estudiaron el efecto de diversos iones como
con las especies oxidantes causantes de la muerte del microorganismo. Gourmelot et al. [10] encontraron que la DFA en presencia de Cl-1 en concentraciones superiores a 10 mmol/L es acelerada debido a que este ion produce cambios en la permeabilidad de la membrana celular, ocasionando un aumento en el flujo de sustancias nocivas al interior de la bacteria. Otros autores como Rincón y Pulgarin [11] estudiaron el efecto de diversos iones como 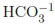 ,
, 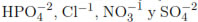 y determinaron que estas especies (especialmente
y determinaron que estas especies (especialmente 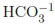 y
y 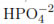 ) retardan la velocidad de inactivación del microorganismo debido a la competencia por las especies oxidantes o al bloqueo de los sitios activos del TiO2. Recientemente, Castro et al. [12] analizaron el efecto de las sales CaHCO3, MgSO4, Na2PO4 y NaCl sobre la inactivación fotocatalítica de una cepa nativa de E. coli ; estos autores realizaron los experimentos de fotodesinfección utilizando potencias de irradiación superiores a los 400 W/m2 y obtuvieron tiempos de desinfección inferiores a los 60 min.
) retardan la velocidad de inactivación del microorganismo debido a la competencia por las especies oxidantes o al bloqueo de los sitios activos del TiO2. Recientemente, Castro et al. [12] analizaron el efecto de las sales CaHCO3, MgSO4, Na2PO4 y NaCl sobre la inactivación fotocatalítica de una cepa nativa de E. coli ; estos autores realizaron los experimentos de fotodesinfección utilizando potencias de irradiación superiores a los 400 W/m2 y obtuvieron tiempos de desinfección inferiores a los 60 min.
En este trabajo se realizó un análisis de la DFA en presencia de sales inorgánicas desde un punto de vista cinético usando un modelo tipo LangmuirHinshelwood de tres parámetros propuesto por Marugan et al. [13] y validado por Moreno et al. [14]. Para lo anterior, se determinaron el efecto de sales inorgánicas como el MgSO4, NaCl y CaCO3 sobre la inactivación fotocatalítica de E. coli y los parámetros cinéticos. Todos los ensayos de fotodesinfección fueron realizados a una potencia de irradiación de 250 W/m2. El uso de una potencia de irradiación baja, permitió observar algunos fenómenos cinéticos asociados con la inhibición de la DFA. El fotocatalizador elegido para realizar la DFA fue el TiO2-P25. Adicionalmente se analizaron los efectos de posirradiación de cada reacción de fotodesinfección, mediante la determinación del tiempo de desinfección efectivo después de un periodo de oscuridad de 24 h (TDE24).
2 Metodología
El fotocatalizador usado fue el TiO2 comercial P-25 (Evonik; antes Degussa) con 70:30 anatasa:rutilo, área superficial 55 m2/g y tamaño de partícula promedio de 30 nm. Las sales inorgánicas utilizadas en las reacciones fueron de tipo analítico: carbonato de calcio (Carlo Erba), sulfato de magnesio (Merck) y/o cloruro de sodio (Merck).
2.1 Crecimiento bacteriano
La cepa bacteriana usada como microorganismo modelo fue E. Coli ATCC 11229 (E. coli). Dos colonias de la cepa bacteriana en fase estacionaria del crecimiento se inocularon en 5 ml de medio nutritivo Luria Bertani (LB: 1g de triptona (Oxoid); 1g de extracto de levadura (Oxoid) y 0,5 g de NaCl (Carlo Erba) diluidos en 100 mL de agua destilada) y se incubaron durante 8 h a 35°C con agitación constante a 100 rpm en condiciones aeróbicas. El caldo de cultivo resultante se adicionó a 25 mL de LB fresco y se dejó en incubación durante 15 h a las mismas condiciones de agitación y temperatura hasta alcanzar la fase estacionaria de crecimiento. Seguidamente, 1 ml del cultivo resultante se centrifugó a 3000 rpm durante 15 min; se recuperó el pellet de biomasa el cual se lavó dos veces con 1 ml de solución salina (0,85 g NaCl diluidos en 100 mL de agua destilada) previamente esterilizada, se suspendió en 1 ml de agua esterilizada y se agregó al sistema de reacción.
2.2 Ensayos de fotodesinfección
Los reactores o frascos de borosilicato de 50 mL fueron cargados con agua contaminada con E. coli una concentración (C0) de 107 unidades formadoras de colonias por mililitro (UFC/mL), 0,25 g/L de TiO2 y CaCO3, NaCl, o MgSO4 a una concentración entre 0,04 y 2 mmol/L. Estos reactores se irradiaron a 250 W/m2 y 35°C por un periodo de 3 h dentro de una cámara de simulación solar (suntest CPS+, con control de temperatura, irradiación entre 300 a 800 nm y 7 de fotones emitidos UV-A, con sistemas de agitación multiposiciones externo). Durante la irradiación se tomaron muestras para determinar la concentración de bacterias sobrevivientes (C) frente al proceso de desinfección. Adicionalmente, se hicieron reacciones de referencia en ausencia de TiO2 y de luz (control en la oscuridad).
Con el fin de obviar los efectos del pH sobre la DFA y los efectos de cambio de concentración de la sal por adsorción en el catalizador, previo al inicio de cada reacción, el pH de la solución fue ajustado a 7±0,2 con NaOH o HCl a 0,1 N y todas las soluciones se mantuvieron en oscuridad durante 30 min. Por otra parte, se determinó el tiempo de desinfección efectivo TDE24 que corresponde al tiempo mínimo al que debe estar el agua contaminada con bacterias bajo irradiación, para que después de un periodo de 24 h en oscuridad no se evidencie el recrecimiento de la bacteria.
2.3 Análisis cinético
Los resultados experimentales de la DFA en presencia de cada sal fueron utilizados para determinar en cada caso los parámetros cinéticos de un modelo tipo Langmuir-Hinshelwood propuesto por Marugán et al. [13] y validado por Moreno et al. [14]. Este modelo describe la inactivación fotocatalítica de E. coli en agua mediante las Ecuaciones (1) y (2)
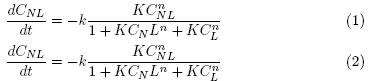
El modelo permite conocer la velocidad de desaparición de las bacterias vivas lastimadas (dCL/dt) y no lastimadas (dCNL/dt) en función de tres parámetros: constante de velocidad de inactivación (k), constante de interacción bacteriaTiO2 (K) y coeficiente de inhibición (n). La resolución de estas ecuaciones se hizo mediante un algoritmo iterativo compuesto por un método de regresión no lineal en simultáneo con una integración numérica Runge-Kutta de quinto orden [14],[15]. Cada parámetro puede ser asociado a tres zonas características de las curvas de desinfección fotocatalítica (bacterias sobrevivientes vs. tiempo de reacción). Estas zonas son: hombro, decrecimiento exponencial y cola, y corresponden a un retraso inicial o decaimiento suave al comienzo de la reacción, una región de inactivación log-lineal que cubre la mayor parte de la reacción y una desaceleración del proceso al final de la reacción, respectivamente [16],[17]. Adicionalmente, se establecieron valores relativos para cada parámetro (P*) mediante la Ecuación (3).

Donde P corresponde al parámetro determinado para la DFA en presencia de cada sal, y Po corresponde al parámetro determinado para la DFA en ausencia de sales.
3 Pruebas y resultados
3.1 Efecto de las sales CaCO3, NaCl y MgSO4en la DFA
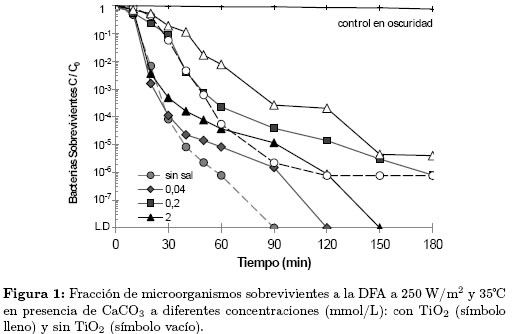
La Figura 1 muestra los resultados de la inactivación de E. coli en presencia de CaCO3 a concentraciones entre 0 y 2 mmol/L. En esta figura se observa que el CaCO3 en el rango de concentraciones estudiado, afectó apreciablemente el comportamiento del microorganismo frente al proceso fotocatalítico e inhibió la DFA; sin embargo, el aumento en la concentración de la sal no generó una mayor inhibición, por el contrario, este efecto fue menos notable a 2 mmol/L que a 0,2 mmo/L, donde no se alcanzó la DFA después de 3 h de irradiación. Los efectos inhibitorios causados por el CaCO3 en la DFA pueden ser provocados por interacciones entre los iones 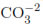 (formados al disociarse la sal en el agua) y el catalizador, las especies oxidantes y/o la bacteria. Algunos autores [13] han estudiado el efecto de esta sal en la DFA y han reportado que las modificaciones en el comportamiento del microorganismo se presentan debido a que las especies causantes del daño celular son reducidas por los carbonatos produciendo radicales carbonato (
(formados al disociarse la sal en el agua) y el catalizador, las especies oxidantes y/o la bacteria. Algunos autores [13] han estudiado el efecto de esta sal en la DFA y han reportado que las modificaciones en el comportamiento del microorganismo se presentan debido a que las especies causantes del daño celular son reducidas por los carbonatos produciendo radicales carbonato (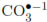 ) menos reactivos y poco perjudiciales para la bacteria, como se muestra en la Ecuación. (4)
) menos reactivos y poco perjudiciales para la bacteria, como se muestra en la Ecuación. (4)
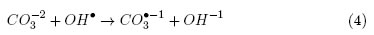
De acuerdo con la ecuación anterior, cuando la concentración de OH- es superior a la de 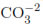 , un aumento en la cantidad de CaCO3 provocara mayor inhibición en la DFA; Sin embargo, en la Figura 1 se observa que la concentración más alta de sal no provocó la mayor inhibición. Estos resultados indican que esta sal en concentraciones cercanas a 0,2 mmol/L, puede afectar el metabolismo de la bacteria y generar condiciones favorables que le permitieron sobrevivir en un medio altamente oxidante. Rincón y Pulgarin [11] reportaron resultados similares con el uso de
, un aumento en la cantidad de CaCO3 provocara mayor inhibición en la DFA; Sin embargo, en la Figura 1 se observa que la concentración más alta de sal no provocó la mayor inhibición. Estos resultados indican que esta sal en concentraciones cercanas a 0,2 mmol/L, puede afectar el metabolismo de la bacteria y generar condiciones favorables que le permitieron sobrevivir en un medio altamente oxidante. Rincón y Pulgarin [11] reportaron resultados similares con el uso de 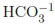 en experimentos de inactivación fotocatalítica de E. coli K12. Estos autores, obtuvieron un tiempo de inactivación mayor en las pruebas realizadas a 0,2 mmol/L que en pruebas similares realizadas con otras concentraciones del ion.
en experimentos de inactivación fotocatalítica de E. coli K12. Estos autores, obtuvieron un tiempo de inactivación mayor en las pruebas realizadas a 0,2 mmol/L que en pruebas similares realizadas con otras concentraciones del ion.
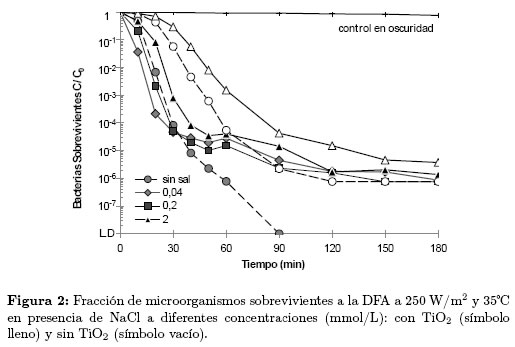
La Figura 2 muestra los resultados de la inactivación de E. coli en presencia de NaCl a concentraciones entre 0 y 2 mmol/L. En esta figura se observa que en todas las reacciones de fotodesinfección en presencia del NaCl la inactivación fue incompleta en el tiempo observado, que la variación en la concentración de la sal no modificó apreciablemente el comportamiento de la bacteria y que entre los 50 y 90 min ocurrió un cambio en la tendencia de los resultados para las pruebas fotocatalíticas.
En general, el NaCl es una sal muy usada para mantener el equilibrio osmótico de las células y su presencia en el agua contaminada, pudo favorecer los mecanismos de defensa de la bacteria provocando la inhibición de la DFA. El recrecimiento bacteriano observado entre los 50 y 90 min es posiblemente el producto de una combinación de dos efectos: el primero que obedece a la generación de condiciones osmóticas favorables para el microorganismo, y el segundo que tiene que ver con la liberación acelerada de sustancias orgánicas producto de la inactivación previa a los 50 min. Algunos autores proponen que los productos de la lisis bacteriana, actúan como barrera de protección del microorganismo contra las especies oxidantes y que esto a su vez promueve su restauración natural [18].
Abdullah et al. [19] establecieron que el incremento en la concentración de cloruros de 0,02 a 0,1 mmol/L provoca un retardo en la fotodesinfección debido a que estos aniones reaccionan con las especies oxidantes (Ox•) tales como los radicales OH• y 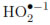 , como se muestra la Ecuación. (5)
, como se muestra la Ecuación. (5)
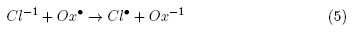
Como se observa en las Ecuaciones (4) y (5), la adición de sales a la DFA puede provocar reacciones simultáneas entre los aniones y las especies reactivas Ox•, que disminuyen el poder oxidante del sistema y su capacidad desinfectante. Sin embargo, estas reacciones no ocurren a la misma velocidad para todas las especies, por ejemplo, la constante de velocidad de reacción (Kc) del Cl-1 con el radical hidroxilo es aproximadamente 4,3 x 109(mol/L)-1s-1, mientras que la constante de velocidad de reacción del 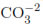 es 5,7 x 106(mol/L)-1s-1 [11]. De acuerdo con lo anterior, la diferencia entre estos valores de Kc reportados en la literatura puede relacionarse con las diferencias encontradas en los experimentos de desinfección en presencia de NaCl y CaCO3 en los que se observó una mayor inhibición de la DFA cuando se utilizó NaCl.
es 5,7 x 106(mol/L)-1s-1 [11]. De acuerdo con lo anterior, la diferencia entre estos valores de Kc reportados en la literatura puede relacionarse con las diferencias encontradas en los experimentos de desinfección en presencia de NaCl y CaCO3 en los que se observó una mayor inhibición de la DFA cuando se utilizó NaCl.
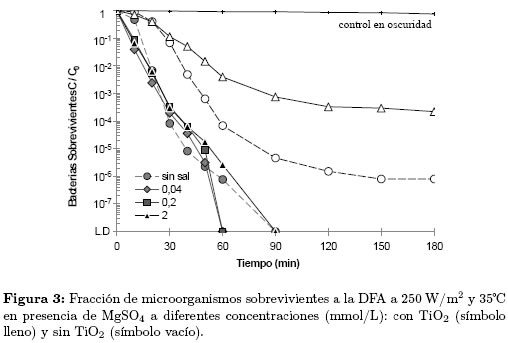
La Figura 3 muestra los resultados de la inactivación de E. coli en presencia de MgSO4 a concentraciones entre 0 y 2 mmol/L. Se observa que la presencia del MgSO4 favorece la DFA y que con el aumento en la concentración de la sal, se prolongó levemente el tiempo de inactivación del microorganismo. Los iones sulfato son altamente reactivos con el radical hidroxilo (Kc=6x1010 (mol/L)-1s-1) y en un sistema fotocatalítico pueden formar el radical anión sulfato (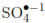 ) de alto poder oxidante y muy perjudicial para la bacteria [11],[13], como se muestra en la Ecuación. (6) Por esta razón, a diferencia de los demás sistemas fotocatalíticos, en presencia de este ion se observa altas velocidades de inactivación.
) de alto poder oxidante y muy perjudicial para la bacteria [11],[13], como se muestra en la Ecuación. (6) Por esta razón, a diferencia de los demás sistemas fotocatalíticos, en presencia de este ion se observa altas velocidades de inactivación.
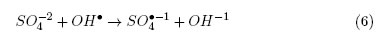
Adicionalmente, los iones también pueden alterar la DFA al adsorberse sobre la superficie del TiO2 y reaccionar con los huecos (h+) fotogenerados (Ecuación (7)), formando una capa de carga negativa que repele la bacteria y disminuye su interacción con las especies oxidantes, evitando la producción de OH• nocivos para la bacteria [9],[16]. La adsorción de los iones en la superficie del fotocatalizador y la reacción entre estas especies (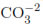 y Cl-1) y los OH•, disminuyen la calidad y cantidad de especies oxidantes producidas en la DFA que pueden atacar al microorganismo.
y Cl-1) y los OH•, disminuyen la calidad y cantidad de especies oxidantes producidas en la DFA que pueden atacar al microorganismo.

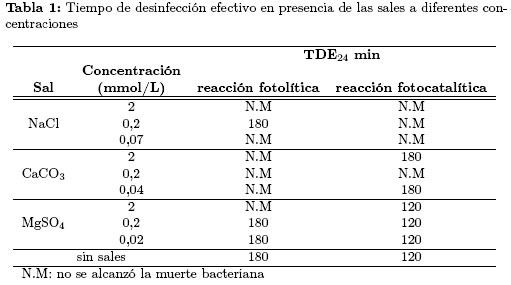
La Tabla 1 muestra el TDE24 determinado para las reacciones de fotodesinfección en presencia de cada sal. Se observa que en los experimentos realizados con NaCl no se alcanzó la desinfección efectiva, a diferencia de las pruebas realizadas con CaCO3 y MgSO4. Es posible que el NaCl genere condiciones que favorecen la regeneración de la bacteria [20]. Los carbonatos también influencian el proceso e inhiben la desinfección efectiva, mientras que los sulfatos no provocan modificaciones dicho proceso.
3.2 Análisis cinético de la DFA en presencia de sales inorgánicas
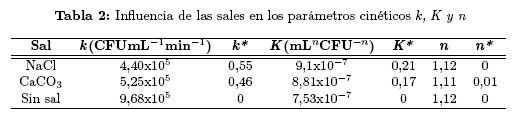
En la Tabla 2 se reportan los valores relativos de los parámetros calculados con el modelo cinético. Se observa que la presencia de sales modifica considerablemente la constante de velocidad de inactivación y en menor proporción la constante de interacción bacteria-TiO2; el coeficiente de inhibición fue aproximadamente el mismo en presencia o ausencia de sales. Teniendo en cuenta que los valores de los parámetros cinéticos pueden ser asociados a las interacciones dentro del sistema de reacción, la similitud entre los coeficientes de inhibición relativos indica que la presencia de las sales en la DFA no afecta la regeneración celular provocada por los productos orgánicos de la desinfección [21],[22]. Por el contrario, las diferencias observadas al comparar los parámetros k* y K* señalan que el mecanismo de inhibición de la DFA predominante corresponde a la reacción entre los aniones y los radicales oxidantes, y en menor proporción a la reacción entre los aniones y los fotohuecos generados en la superficie del TiO2 [23].
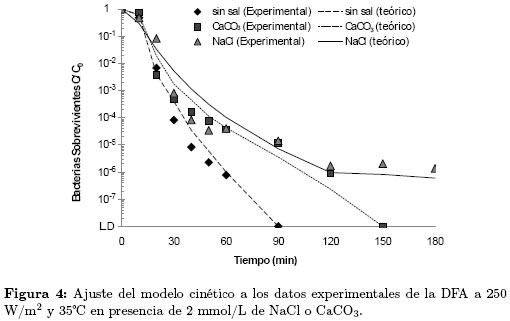
En la Figura 4 se presentan los resultados experimentales de la DFA en presencia de las sales inorgánicas y los obtenidos teóricamente utilizando el modelo cinético (Ecuaciones (1) y (2)). Se observa que para las pruebas de DFA con NaCl, CaCO3y sin sal, los resultados teóricos son cercanos a los experimentales. Sin embargo, los resultados correspondientes a las pruebas realizadas con MgSO4 no fueron representados satisfactoriamente por el modelo.
4 Conclusiones
La desinfección fotocatalítica de agua se inhibe por la presencia de sales inorgánicas, la velocidad de inactivación del microorganismo está relacionada inversamente con la velocidad de reacción entre los aniones y las especies oxidantes, y directamente con el poder oxidante de los productos formados en estas reacciones (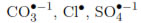 ). En efecto, el análisis cinético demostró que la presencia de NaCl y CaCO3 modifica los coeficientes de velocidad de reacción entre las especies oxidantes y la bacteria, y de interacción catalizadorbacteria. De las sales estudiadas, el NaCl a bajas concentraciones es la única capaz de evitar la desinfección efectiva del agua mediante la fotocatálisis de TiO2, mientras que el MgSO4 no tiene influencia considerable sobre este proceso. El TDE es influenciado fuertemente por el tipo de sal, y en especial, por aquellas cuyos iones pueden intervenir favorablemente en la mantención del equilibrio osmótico de la membrana celular del microorganismo.
). En efecto, el análisis cinético demostró que la presencia de NaCl y CaCO3 modifica los coeficientes de velocidad de reacción entre las especies oxidantes y la bacteria, y de interacción catalizadorbacteria. De las sales estudiadas, el NaCl a bajas concentraciones es la única capaz de evitar la desinfección efectiva del agua mediante la fotocatálisis de TiO2, mientras que el MgSO4 no tiene influencia considerable sobre este proceso. El TDE es influenciado fuertemente por el tipo de sal, y en especial, por aquellas cuyos iones pueden intervenir favorablemente en la mantención del equilibrio osmótico de la membrana celular del microorganismo.
5 Agradecimientos
En memoria del profesor Aristóbulo Centeno por su valiosa colaboración en el desarrollo de este trabajo y sus sabios consejos. Los autores agradecen a la Vicerrectoría de Investigación y Extensión de la Universidad Industrial de Santander (UIS) por la financiación del proyecto código: 5448.
Referencias
[1] S. Malato, P. Fernández-Ibáñez, M. I. Maldonado, J. Blanco, and W. Gernjak, ''Decontamination and disinfection of water by solar photocatalysis: Recent overview and trends,'' Catalysis Today, vol. 147, no. 1, pp. 1-59, 2009. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0920586109003344 194
[2] V. A. Nadtochenko, A. G. Rincon, S. E. Stanca, and J. Kiwi, ''Dynamics of E-coli membrane cell peroxidation during TiO2 photocatalysis studied by ATR-FTIR spectroscopy and AFM microscopy,'' Journal of Photochemistry and Photobiology A-Chemistry, vol. 169, no. 2, pp. 131-137, 2005. [ Links ] 194
[3] X. Yang and Y. Wang, ''Photocatalytic effect on plasmid DNA damage under different UV irradiation time,'' Building and Environment, vol. 43, no. 3, pp. 253-257, 2008. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0360132306003532 194
[4] J. Lonnen, S. Kilvington, S. C. Kehoe, F. Al-Touati, and K. G. McGuigan, ''Solar and photocatalytic disinfection of protozoan, fungal and bacterial microbes in drinking water,'' Water Research, vol. 39, no. 5, pp. 877-883, 2005. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0043135404005640 194
[5] A. Fujishima, X. Zhang, and D. A. Tryk, ''TiO2 photocatalysis and related surface phenomena,'' Surface Science Reports, vol. 63, no. 12, pp. 515-582, 2008. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0167572908000757 194
[6] M. Cho, H. Chung, W. Choi, and J. Yoon, ''Linear correlation between inactivation of E. coli and OH radical concentration in TiO2 photocatalytic disinfection,'' Water Research, vol. 38, no. 4, pp. 1069-1077, 2004. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S004313540300602X 194
[7] A. G. Rincón and C. Pulgarin, ''Photocatalytical inactivation of E. coli: effect of (continuous intermittent) light intensity and of (suspended-fixed) TiO2 concentration,'' Applied Catalysis B: Environmental, vol. 44, no. 3, pp. 263-284, 2003. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0926337303000766 195
[8] C. Sichel, J. Tello, M. de Cara, and P. Fernández-Ibáñez, ''Effect of UV solar intensity and dose on the photocatalytic disinfection of bacteria and fungi,'' Catalysis Today, vol. 129, no. 1-2, pp. 152-160, 2007. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S092058610700421X 195
[9] H. M. Coleman, C. P. Marquis, J. A. Scott, S.-S. Chin, and R. Amal, ''Bactericidal effects of titanium dioxide-based photocatalysts,'' Chemical Engineering Journal, vol. 113, no. 1, pp. 55-63, 2005. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S1385894705002494 195, 202
[10] M. Gourmelon, J. Cillard, and M. Pommepuy, ''Visible light damage to Escherichia coli in seawater: oxidative stress hypothesis,'' J Appl Bacteriol, vol. 77, no. 1, pp. 105-112, 1994. [ Links ] 195
[11] A. G. Rincon and C. Pulgarin, ''Effect of pH, inorganic ions, organic matter and H2O2 on E-coli K12 photocatalytic inactivation by TiO2 — Implications in solar water disinfection,'' Applied Catalysis B: Environmental, vol. 51, no. 4, pp. 283-302, 2004. [ Links ] 195, 199, 201
[12] C. Castro, C. Romero, O. Salazar, A. Centeno, and S. Giraldo, ''Efecto de la Composición Química del Agua Sobre su Desinfección Fotocatalítica,'' Act. y Div. Cient., vol. 14, no. 1, pp. 117-125, 2011. [ Links ] 195
[13] J. Marugán, R. van Grieken, C. Sordo, and C. Cruz, ''Kinetics of the photocatalytic disinfection of Escherichia coli suspensions,'' Applied Catalysis B: Environmental, vol. 82, no. 1-2, pp. 27-36, 2008. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0926337308000052 195, 197, 198, 201
[14] A. Moreno, C. Castro, A. Centeno, and S. Giraldo, ''Cinética de la Desinfección Fotocatalítica de Agua contaminada con E. coli: Efecto de la Concentración del Fotocatalizador y la Potencia de Irradiación,'' Inf. tecnol., vol. 22, no. 3, pp. 69-78, 2011. [ Links ] 195, 197
[15] O. K. Dalrymple, E. Stefanakos, M. A. Trotz, and D. Y. Goswami, ''A review of the mechanisms and modeling of photocatalytic disinfection,'' Applied Catalysis B: Environmental, vol. 98, no. 1-2, pp. 27-38, 2010. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0926337310001918 197
[16] M. Labas, C. Martin, and A. Cassano, ''Kinetics of Bacteria Disinfection with UV Radiation in an Absorbing and Nutritious Medium,'' Chemical Engineering Journal, vol. 114, no. 1-3, pp. 87-97, 2005. [ Links ] 198, 202
[17] K. V. Kumar, K. Porkodi, and F. Rocha, ''LangmuirHinshelwood kinetics: A theoretical study,'' Catalysis Communications, vol. 9, no. 1, pp. 82-84, 2008. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S1566736707002178 198
[18] G. Gogniat and S. Dukan, ''TiO2 photocatalysis causes DNA damage via Fenton reaction-generated hydroxyl radicals during the recovery period.'' Appl Environ Microbiol, vol. 73, no. 23, pp. 77-40-7743, 2007. [ Links ] 200
[19] M. Abdullah, G. K. C. Low, and R. W. Matthews, ''Effects of common inorganic anions on rates of photocatalytic oxidation of organic carbon over illuminated titanium dioxide,'' J. Phys. Chem., vol. 94, no. 17, pp. 6820-6825, 1990. [ Links ] [Online]. Available: http://pubs.acs.org/doi/abs/10.1021/j100380a051 200
[20] R. van Grieken, J. Marugán, C. Pablos, L. Furones, and A. López, ''Comparison between the photocatalytic inactivation of Gram-positive E. faecalis and Gramnegative E. coli faecal contamination indicator microorganisms,'' Applied Catalysis B: Environmental, vol. 100, no. 1-2, pp. 212-220, 2010. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0926337310003401 202
[21] M. N. Chong, B. Jin, H. Zhu, and C. Saint, ''Bacterial inactivation kinetics, regrowth and synergistic competition in a photocatalytic disinfection system using anatase titanate nanofiber catalyst,'' Journal of Photochemistry and Photobiology A: Chemistry, vol. 214, no. 1, pp. 1-9, 2010. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S1010603010001826 203
[22] A. G. Rincón, C. Pulgarin, N. Adler, and P. Peringer, ''Interaction between E. coli inactivation and DBP-precursors-dihydroxybenzene isomers in the photocatalytic process of drinking-water disinfection with TiO2,'' Journal of Photochemistry and Photobiology A: Chemistry, vol. 139, no. 2-3, pp. 233-241, 2001. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S1010603001003744 203
[23] J. J. Vélez-Colmenares, A. Acevedo, and E. Nebot, ''Effect of recirculation and initial concentration of microorganisms on the disinfection kinetics of Escherichia coli,'' Desalination, vol. 280, no. 1-3, pp. 20-26, 2011. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0011916411005698 203