Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Ciencia
Print version ISSN 1794-9165
ing.cienc. vol.9 no.18 Medellín July/Dec. 2013
ARTÍCULO ORIGINAL
Prototipo de un dispositivo para la investigación de los efectos del ultrasonido sobre procesos microbiológicos
Prototype of a Device to Research Ultrasound Effects on Microbiological Processes
Jorge-Andrés López-Castaño1, Yuri K. Murcia2 y Daniel Díaz,3
1 Ingeniero Biomédico, fxbiomed@gmail.com, Universidad Manuela Beltrán, Bogotá D.C., Colombia.
2 Ingeniera Biomédica, yurimurcia@gmail.com, Universidad Manuela Beltrán, Bogotá D.C., Colombia.
3 Máster en Física y Tecnología de los Láseres, dadiar1@gmail.com, Universidad Manuela Beltrán, Bogotá D.C., Colombia.
Recepción: 30-04-2013, Aceptación: 23-07-2013 Disponible en línea: 05-11-2013
MSC: 92-XX, PACS: *43.35.-c, 43.35.+d, *43.80.-n, 43.80.+p, 87.50.Y
Resumen
Este artículo describe el desarrollo de un prototipo multifuncional que suministra dosis de ultrasonido a una muestra contenida en una caja de Petri, en frecuencias comprendidas entre 18 y 30 KHz y con intensidades que van desde los 0,3 mW/m2 hasta los 1,5 mW/m2. Este dispositivo garantiza la supervivencia de la muestra mediante un sistema de micro-incubación, operado por un sistema de control y monitoreo de temperatura. Además, el prototipo puede detectar cambios, inherentes al proceso microbiológico estudiado, por medio de un sistema basado en nefelometría láser. El usuario puede escoger, para un experimento específico, el valor de los parámetros mencionados y analizar los datos generados a través de una aplicación computacional especialmente diseñada para presentarlos en tablas de datos, imágenes y estadísticas.
Palabras clave: biofísica del ultrasonido; micro-incubadora; nefelometría láser; procesos microbiológicos; sonicación; ultrasonido continuo; ultrasonido pulsado.
Aspectos relevantes• Se diseñó y se construyó un prototipo especializado para la investigacion de los efectos que ejerce el ultrasonido sobre los procesos microbiológicos. • El prototipo integra, en un solo dispositivo, tres sistemas diferentes que permiten la irradiacion ultrasónica de la muestra, su incubación y la detección de variaciones en su turbidez. • El prototipo opera a control remoto, lo cual facilita su uso en áreas que requieran altos niveles de bioseguridad y descontaminación.
Abstract
This article describes the development of a multifunctional prototype which supplies ultrasound to a sample in a Petri dish, between 18 KHz and 30 KHz frequencies, with intensities from 0.3 mW/m2 to 1.5 mW/m2. This device guarantees sample survival with a micro-incubating system, operated by a control system and temperature monitoring. In addition, the prototype detects changes regarding the microbiological process in question, with a self-based laser-nephelometry system. The user would be able to choose parameters values mentioned, for a certain experiment, and analyze output data tables, images and statistics generated by a computer application specially designed to present this data.
Key words: continuous ultrasound; laser nephelometry; microbiological processes; micro-incubator; pulsed ultrasound; sonication; ultrasound biophysics.
1 Introducción
Desde que el efecto piezoeléctrico fuera descubierto por los hermanos Paul y Pierre Curie en el siglo XIX, investigadores prominentes como Paul Langevin, Alfred Loomis y Wesley Nyborg se han preocupado por determinar los efectos que tienen las ondas ultrasónicas sobre el material biológico y establecer los límites de exposición y la dosimetría adecuada de esta energía [1]. Esto hizo posible la aparición de diversas aplicaciones ultrasónicas, tales como equipos médicos de diagnóstico y tratamiento y dispositivos de laboratorio [2].
No obstante, para el estudio específico de los efectos del ultrasonido sobre las células vivas y los procesos microbiológicos inherentes a las mismas, los investigadores han realizado experimentos que utilizan montajes implementados a partir de piezas de diferentes dispositivos, tanto ultrasónicos como de laboratorio. Algunos ejemplos notables se citan a continuación:
En sus estudios sobre los efectos del ultrasonido in vitro en la proliferación celular, síntesis de proteínas y producción de citoquinas por fibroblastos humanos, osteoblastos y monocitos, Doan [3], utilizó un modelo in vitro con transductores estándar para terapia, de 45 KHz y 1 MHz y usó un baño termostático con temperatura estable a 37°C, cubierto con un paño para absorber el sonido. La cubeta se llenó con agua destilada y desionizada para ubicar sobre ella una caja con 6 platos de cultivo, donde estaba insertada la punta del transductor. Todo este montaje se llevó a una cámara de esterilización y luego las muestras fueron cultivadas con CO2 al 5%.
En su investigación para demostrar la relación entre la permeabilidad transitoria de la membrana celular, producida por micro-burbujas ultrasónicas, y la formación de radicales libres, Juffermans [4] utilizó dos montajes. El primero usaba un transductor convencional para ecocardiografía de 3,7 MHz, ubicado en un baño de agua a 37°C a una distancia de 3 cm de la celda de cultivo. Un segundo arreglo empleaba un generador de señal y un transductor industrial de 1 MHz, montado en un baño de agua a 37°C sobre el portaobjetos de un microscopio.
Por su parte, Wei [5] utilizó un sistema ultrasónico que permitía la liberación de genes dentro del contenido celular, construido con un transductor cilíndrico de zirconato de titanio y plomo de 2,5 cm de diámetro y adherido a un montaje hecho con dos capas de acrílico. La capa exterior contenía agua con el fin de mantener la temperatura de la muestra a 24±1°C. Se adhirió una cubierta de absorción para el ultrasonido, con el fin de evitar reflexiones y mantener uniforme el campo ultrasónico.
El propósito de este trabajo fue el diseño y construcción de un prototipo multifuncional, basado en las técnicas y los arreglos implementados por los autores citados, integrados en un único dispositivo. Esto reduce la necesidad de usar equipos de sonicación, detección o incubación adicionales y evita el traslado de muestras entre los mismos, posibilitando la ejecución de tales funciones en el mismo lugar y al mismo tiempo y optimizando las variables de costo, espacio y tiempo. El modelo propuesto permitirá al investigador realizar estudios específicos de los efectos del ultrasonido sobre los procesos microbiológicos celulares (metabolismo, reproducción, comunicación, locomoción y morfogénesis) [6], en condiciones de temperatura adecuadas para el tratamiento de las muestras, y facilitará la detección de las variaciones en tales procesos evidenciadas por los cambios de turbidez en el medio de cultivo. Las investigaciones que se desarrollen apoyadas en este dispositivo y los métodos propuestos en este trabajo, conducirán a una mayor comprensión de tales efectos, al desarrollo de tecnologías ultrasónicas cada vez más confiables y al mejoramiento de las regulaciones normativas que en la actualidad existen sobre la materia.
2 Metodología
2.1 Etapa de diseño
Los primeros diseños se plasmaron en un software de diseño CAD (Diseño Asistido por Computadora, por sus siglas en Inglés). Inicialmente, durante la simulación y construcción de las primeras maquetas Figura 1, se consideraron aspectos ergonómicos y de manejo (forma, tamaño, peso, y distribución de controles y paneles).
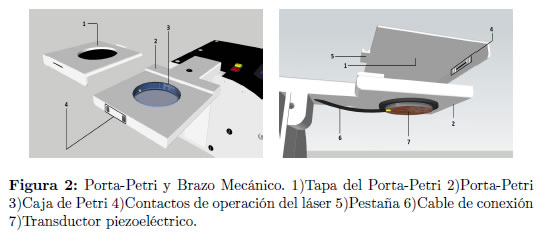
Después de seleccionar el modelo más apropiado para la construcción del prototipo, se procedió al diseño de los tres sistemas constitutivos del dispositivo: el sistema de generación de ultrasonido, el sistema de microincubación y monitoreo de temperatura y el sistema de detección de actividad biológica basado en nefelometría láser. Para el desarrollo de tales sistemas fue necesario considerar aspectos funcionales y de seguridad (selección de parámetros y control de variables, elección de sensores y actuadores, automatización, programabilidad y compatibilidad tecnológica, protección contra riesgos electromecánicos y biológicos, de acuerdo a los estándares y la normativa vigente [7] [8], y sistema de alarmas e indicadores de operación). El sistema de generación de ultrasonido está constituido por un generador de señal que controla un transductor piezoeléctrico. Este actuador transmite las ondas mecánicas que irradian al espécimen, objeto de estudio, a través de una pieza especialmente diseñada para ello, denominada Porta- Petri, adosada a un brazo mecánico Figura 2. Este último permite elevar el Porta-Petri a una altura adecuada, de manera que la muestra pueda ser examinada con un microscopio óptico estándar.
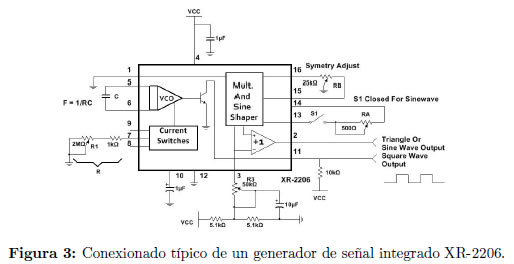
Durante el diseño del circuito electrónico del generador de señal se estableció que los componentes más adecuados para su desarrollo son los generadores de funciones integrados; puesto que, además de generar señales sinusoidales continuas, algunos permiten distintos tipos de modulación tanto en amplitud como en frecuencia [9] Figura 3.
Esta última característica es especialmente importante porque hace posible la generación del ultrasonido en el modo pulsado, emitiendo trenes de pulso ultrasónico a intervalos de tiempo regulares, que permiten reducir el incremento de la temperatura sobre la muestra de manera aproximadamente proporcional a la relación de pulsación on:off [10], determinada por el ciclo útil de la señal.
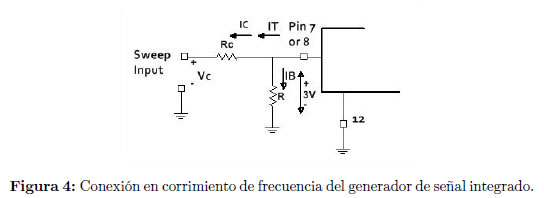
La frecuencia del dispositivo, en el modo de corrimiento de frecuencia, varía al aplicar un voltaje, Vc, sobre la resistencia de control Rc Figura 4, a partir de una frecuencia base, 1/RC Figura 3, lo cual se representa en la ecuación:

La ganancia, K, de la conversión voltaje-frecuencia del montaje anterior obedece a la siguiente relación:
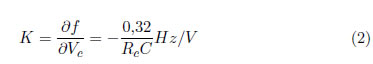
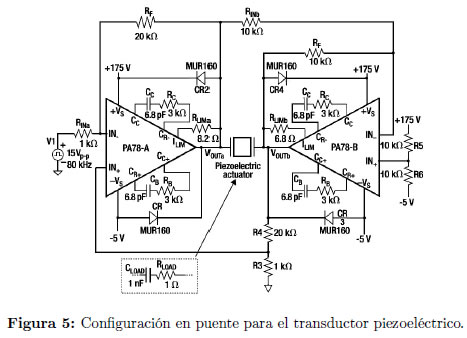
La etapa de potencia del sistema, responsable de suministrar la corriente para excitar el transductor, se basó en amplificadores operacionales de potencia con una configuración en puente [11] Figura 5. Esta etapa amplifica la señal proveniente del generador de funciones, que a su vez es transformada, por el actuador piezoeléctrico, en vibraciones mecánicas de la misma frecuencia y de intensidad proporcional a la onda generada.
En suma, se obtiene un sistema capaz de operar, tanto en modo pulsado como continuo, en un rango de frecuencia entre 18 y 30 KHz, intensidades entre 0,3 y 1,5 mW/m2 y períodos de sonicación en minutos que el usuario puede establecer y programar durante la experimentación. Así mismo, es posible seleccionar la frecuencia modulante y el ciclo útil de la señal, para el modo pulsado, en valores comprendidos entre 15 y 500Hz y 10 y 60%, respectivamente.
El sensor y los actuadores del sistema de micro-incubación y monitoreo de temperatura están ubicados en el interior del Porta-Petri Figura 6. Se trata de un termistor que registra la temperatura y dos lámparas halógenas que disipan el calor a través de una lámina de aluminio, de manera que sea distribuido de modo uniforme sobre la muestra contenida en la caja de Petri.
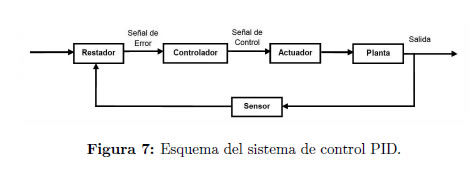
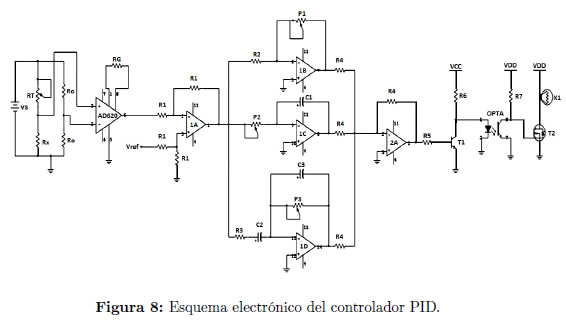
Todos estos elementos forman parte de un sistema de control analógico cuyo componente central es un controlador proporcional, integral y derivativo, PID, mostrado en el esquema de las Figuras 7 y 8, y que mantiene la muestra dentro de la caja de Petri (Planta) en el valor de temperatura requerido por el usuario, dentro de un rango que puede seleccionar, entre 25 y 45°C. Dicho valor se conserva estable y constante en el tiempo, con un rango de tolerancia de ± 0.5°C.
Considerando los efectos térmicos inducidos por la radiación ultrasónica en el material biológico, especialmente en el modo continuo, el dispositivo fue programado para emitir una alerta cuando se registra una lectura superior a 1°C, sobre el valor de temperatura especificado, y para desactivar automáticamente el generador ultrasónico de ser necesario. No obstante, el modelo esférico propuesto por Nyborg [12] y los estudios realizados por Love y Kremkau [13] sugieren que a escala celular (10 a 50μm) el incremento de temperatura no es muy apreciable en la práctica [14].
La ecuación que describe el comportamiento de la señal del PID, de acuerdo al algoritmo descrito en los apuntes de Åström [15], es la siguiente:

Donde K es la ganancia proporcional, 1/Ti es la ganancia integral, Td la ganancia derivativa y e(t) la senal de error.
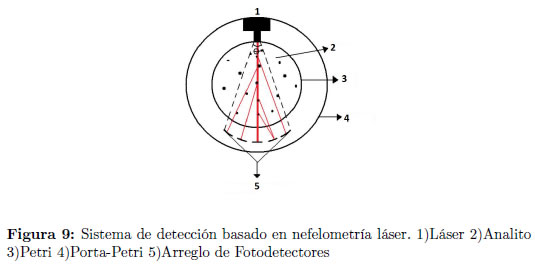
El sistema de detección de actividad biológica está basado en los sistemas de nefelometría láser que se utilizan, entre otras cosas, para determinar el nivel de solubilidad de las muestras en el laboratorio y la detección de proteinas globulares [16]. Está compuesto por cinco foto-detectores ubicados alrededor de la caja de Petri y distribuidos de tal modo que forman un arco de circunferencia de ángulo de θ 20,2° Figura 9, dentro del cual es posible registrar el nivel de refracción de un láser que atraviesa la muestra y que se traduce, para cada sensor, en un rango de amplitudes de voltaje que varian alrededor de una substancia de concentración conocida (suero fisiológico al 0,9%), elegida de manera arbitraria como patrón experimental1 Este haz es emitido por un diodo láser ubicado en el diámetro posterior de la caja de Petri.
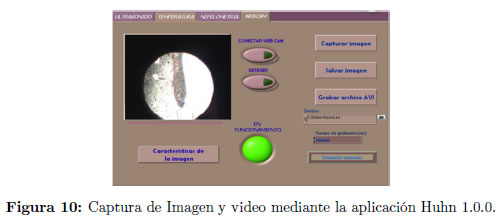
Los datos registrados por los sensores, son procesados por una aplicación computacional, diseñada en LabView, denominada HUNH 1.0.0, con el fin de realizar un tratamiento estadístico de las lecturas nefelométricas, adquiridas a través de una tarjeta de sonido estándar. Esta aplicación detecta el tipo de onda ultrasónica, frecuencia, amplitud y períodos de sonicación y puede capturar imágenes y videos de la muestra por medio de una webcam adaptada a un microscopio óptico Figura 10; todos estos datos los envía en forma de gráficos como archivos tipo imagen (.jpg) o en tablas de datos como archivos tipo hoja de cálculo (.xls). El software permite visualizar una interfaz para el usuario y en caso de ser requerido se puede seleccionar la interfaz para el servicio técnico Figura 11, que esta oculta para el usuario regular.
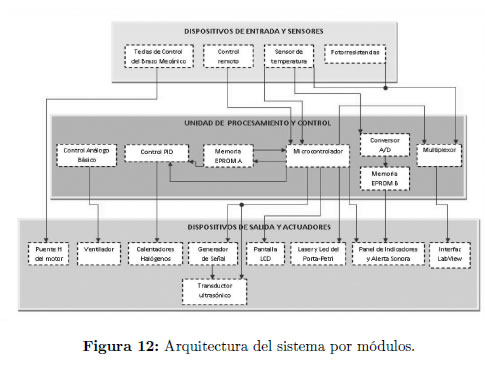
Una vez diseñados todos los sistemas principales y complementarios, se estableció la arquitectura de interconexión de todas las funciones que el prototipo es capaz de ejecutar.
Esta arquitectura encierra tres clases de elementos básicos: dispositivos de entrada y sensores, elementos de procesamiento y control y dispositivos de salida y actuadores Figura 12.
2.2 Etapa de construcción
El diseño de todos los sistemas mencionados anteriormente se sintetiza en la construcción del prototipo final. Para este propósito, se tuvieron en cuenta aspectos económicos y de fabricación (costo de materiales, ensamblaje y mantenimiento, y disponibilidad de suministros y componentes).
La pieza fundamental del equipo, el Porta-Petri, previamente modelada con estudio de elementos finitos por CAD, fue prototipada en una impresora 3D utilizando el polímero ABS para su construcción Figura 13.
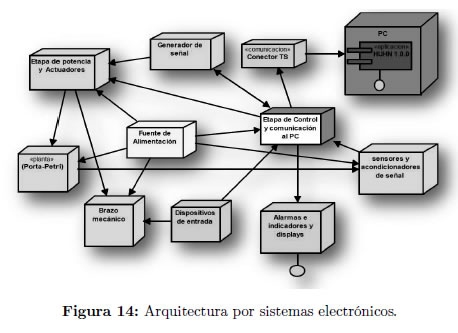
Los circuitos electrónicos correspondientes a todos los sistemas y subsistemas, se implementaron en varias tarjetas o circuitos impresos, PCBs, a manera de etapas. Estas etapas se interconectan entre sí y funcionan de forma coordinada, como se muestra en la Figura 14.
Al ensamblar e integrar todas las etapas y componentes anteriores, se obtuvo finalmente el prototipo definitivo que se observa en la Figura 15.
2.3 Etapa de validación y resultados finales
Con el fin de validar el prototipo final, se diseñó un protocolo de pruebas para verificar el cumplimiento de las métricas y parámetros, establecidos en la etapa de diseño, para cada uno de los sistemas y funciones del dispositivo.
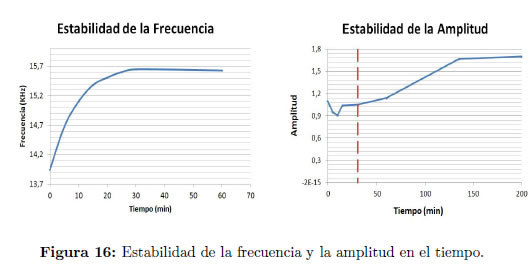
El sistema de generación del ultrasonido mostró estabilidad en el tiempo, tanto en frecuencia como en intensidad. La estabilidad de la frecuencia con respecto al tiempo se logra en los primeros 30 minutos de operación (Figura 16 izquierda) y permanece constante; por otra parte, después de un tiempo aproximado de 140 minutos, la amplitud se estabiliza y continúa también constante en el tiempo (Figura 16 derecha).
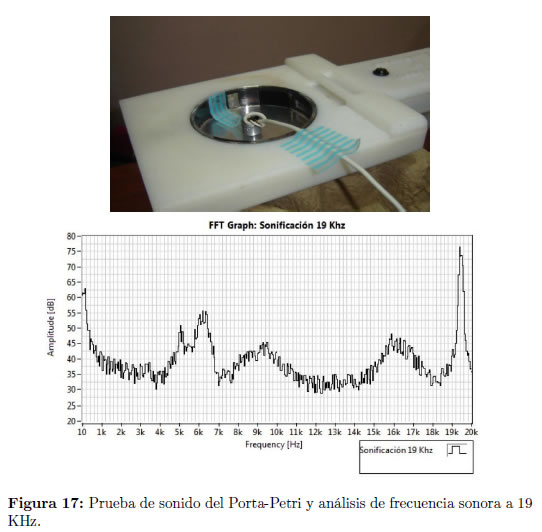
Utilizando un micrófono adaptado al Porta-Petri (Figura ?? izquierda) y mediante un software de análisis de sonido, se determina que el transductor piezoeléctrico emite ondas ultrasónicas a la frecuencia e intensidad (proporcional a la amplitud de la señal electrónica), elegidas por el usuario (Figura ?? derecha). Fue posible establecer los valores de intensidad, I, tomando los niveles de presión sonora, NPS, en decibeles, detectados por el software y despejando dicha variable en la siguiente ecuación [18]:
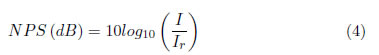
Donde Ir = 10-12 W/m2, es la intensidad de referencia.
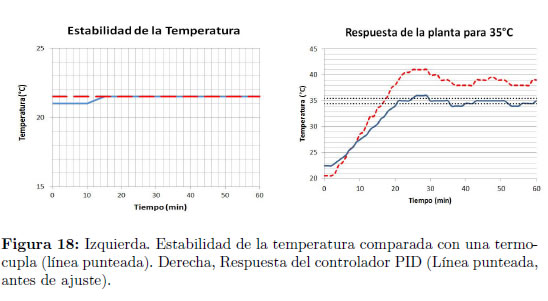
En el sistema de micro-incubación y monitoreo de temperatura, las pruebas mostraron estabilidad en el tiempo durante el registro de esta última, con respecto a una termocupla utilizada como patrón de medición. Los efectos del autocalentamiento del termistor son despreciables (Figura 18 izquierda). Así mismo, la respuesta del sistema de control, previamente ajustado el controlador PID, se estabilizó en un lapso aproximado de 20 min en el valor de temperatura requerido por el usuario, con una tolerancia de ± 0,5°C (Figura 18 derecha).
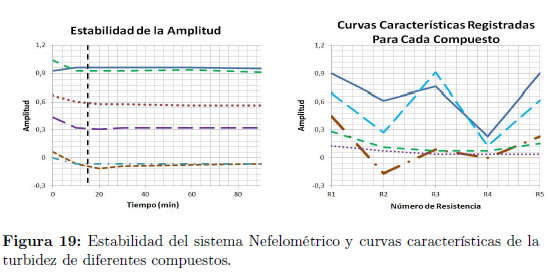
Las pruebas del sistema de detección basado en nefelometría láser mostraron estabilidad en las lecturas después de 15 minutos de operación y revelaron, para diferentes sustancias con distintos grados de turbidez, variaciones en la amplitud de las señales registradas Figura 19.
Para evaluar el desempeño de todos los sistemas del prototipo en el tratamiento de muestras biológicas, se realizaron pruebas sobre un proceso típico de digestión celular utilizado en la industria láctea para la fabricación del queso, la coagulación de la leche mediante la enzima rennina (cuajo). Este proceso debe efectuarse en un rango de temperatura entre los 35 y los 38°C. El procedimiento realizado se describe a continuación:
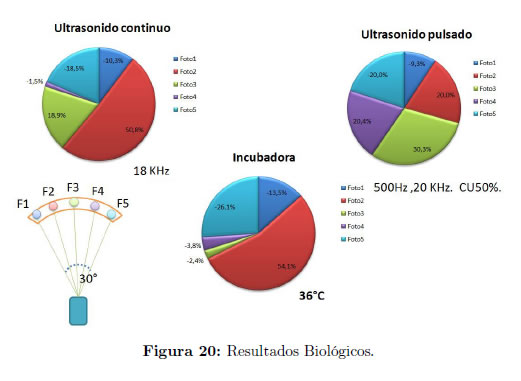
Se prepararon tres muestras con una dilución de 1 mL de leche en 17 mL de agua y 1 mg de rennina. La primera fue sometida a ciclos de ultrasonido continuo, la segunda a ultrasonido pulsado y la tercera fue incubada a 36°C. Durante la experimentación se observaron diferencias en el registro nefelométrico, sobre todo en los registros de los fotosensores F2, F3 y F4 y principalmente durante el ultrasonido pulsado Figura 20. El indicador de atenuación o absorción de la luz sobre cada fotosensor se presenta como un porcentaje negativo o positivo, con un color distintivo, con respecto a una muestra de control que no fue irradiada por ultrasonido y se mantuvo a una temperatura ambiental inferior a los 25°C. Las lecturas indican cambios durante la reacción bioquímica, influenciados por el ultrasonido y la temperatura.
Finalmente, se verificó la capacidad del prototipo de funcionar, de manera remota, en ambientes donde existan riesgos biológicos, o sea necesario evitar la contaminación. Para ello, el dispositivo es conectado dentro de una cabina de flujo laminar y operado por medio de un control remoto infrarrojo. El alcance máximo de este control se estimó alrededor de los 3,5 metros.
3 Conclusiones
El sistema de ultrasonificación del prototipo, mostró la capacidad de operar a diferentes rangos de frecuencia ultrasónica e intensidad, presentando estabilidad en el tiempo. El análisis de sonido, permite concluir que las frecuencias e intensidades sonoras emitidas por el transductor piezoeléctrico se corresponden con las que produce el generador de señal y las que el usuario requiere.
El sistema de micro-incubación y monitoreo de la temperatura presenta una respuesta rápida para diferentes temperaturas, estable en el tiempo y con un mínimo de oscilaciones.
El sistema de detección basado en nefelometría láser, demostró ser funcional y estable en el tiempo. Esta función fue capaz de detectar cambios en los niveles de turbidez, en diferentes etapas del estudio, para diferentes substancias y el grado de transmitancia y absorbancia sobre la muestra, para una verificación posterior por microscopía óptica.
La aplicación Huhn 1.0.0, con su interfaz de usuario, hizo posible el tratamiento de los datos generados por cada sistema, permitiendo la elección de los parámetros, la medición y procesamiento de las variables más relevantes y la visualización final de las mismas.
Un control remoto, permite operar el dispositivo en entornos de laboratorio que requieran cierto grado de aislamiento y manejo de riesgos biológicos.
Finalmente, se obtiene un prototipo viable y funcional que sienta las bases y modelos reproducibles para la construcción y desarrollo futuro, a escala industrial, de un producto que integra tres aspectos fundamentales para la investigación de los efectos del ultrasonido sobre los procesos microbiológicos: generación de ultrasonido, temperatura de la muestra y detección de actividad biológica. Este prototipo, también permitirá el diseño y la construcción de versiones alternativas para aplicaciones específicas en diversas áreas de investigación biotecnológica, que incluyen: sonoporación celular, estudio de los efectos microbiológicos en la membrana celular, permeabilidad de la membrana celular, efectos sobre los organelos celulares, crecimiento tisular, estudios con células madre y estudios de biocompatibilidad, entre otros.
Notas al pie
1 Para propósitos de calibración y trazabilidad se utilizarán, en pruebas posteriores, estándares primarios de calibración y secundarios de verificación, en base a preparaciones de formazina, cuyas unidades de Turbidez de Formazina FTU (por sus siglas en inglés) son ampliamente utilizadas [17].
4 Agradecimientos
El desarrollo de este proyecto no hubiera sido posible sin la colaboración logística del Servicio Nacional de Aprendizaje(SENA), por medio de las líneas de Electrónica, Ingeniería y Biotecnología de Tecnoparque, Nodo Bogotá, cuyas puertas siempre estuvieron abiertas y sus asesores atentos para el logro de este objetivo.
Referencias
[1] W. O'brien Jr, ''Thermal and other non-cavitational mechanisms,'' vol. 7, pp. 1–29, 2011. [ Links ] [Online]. Available: http://www.brl.uiuc.edu/Publications/2011 12
[2] V. Frenkel, Therapeutic ultrasound: Mechanisms to applications. New York: Nova Science Publishers, 2011. [ Links ] 12
[3] N. Doan, P. Rehem, S. Meghji, and M. Harris, ''In vitro effects of therapeutic ultrasound on cell proliferation, protein synthesis, and cytokine production by human fibroblasts, osteoblasts, and monocytes,'' J Oral Maxillofac Surg, vol. 57, pp. 409–419, 1999. [ Links ] 13
[4] L. J. M. Juffermans, P. A. Dijkmans, R. J. P. Musters, C. A. Visser, and O. Kamp, ''Transient permeabilization of cell membranes by ultrasound-exposed microbubbles is related to formation of hydrogen peroxide,'' American Journal of Physiology - Heart and Circulatory Physiology, vol. 291, no. 4, pp. H1595–H1601, 2006. [ Links ] [Online]. Available: http://ajpheart.physiology.org/content/291/4/H1595 13
[5] W. Wei, B. Zheng-zhong, W. Yong-jie, Z. Qing-wu, and M. Yalin, ''Bioeffects of low-frequency ultrasonic gene delivery and safety on cell membrane permeability control,'' Journal of Ultrasound in Medicine, vol. 23, no. 12, pp. 1569–1582, 2004. [ Links ] [Online]. Available: http://www.jultrasoundmed.org/content/23/12/1569.abstract 13
[6] M. Madigan, J. Martinko, J. Parker, and T. Brock, Biología de los microorganismos. Madrid: Pearson, Prentice Hall, 2004. [ Links ] 14
[7] WHO, Laboratory safety manual. Geneva: WHO library, 2004. [ Links ] 15
[8] I. E. Commission, 61010-1 Safety Requirements for Electrical Equipment for Measurement, Control and Laboratory Use-Part 1: General Requirements, Geneva, 2010. [ Links ] 15
[9] E. Corporation, XR-2206 Monolithic Function Generator Application Note, Kato Road, Fremont, CA, 1997. [ Links ] 15
[10] K. G. Baker, V. J. Robertson, and F. A. Duck, ''A review of therapeutic ultrasound: Biophysical effects,'' Physical Therapy, vol. 81, no. 7, pp. 1351–1358, 2001. [ Links ] [Online]. Available: http://ptjournal.apta.org/content/81/7/1351.abstract 16
[11] S. Robinson, Driving Piezoelectric actuators, Tuczon, Ariz, 2006. [ Links ] 17
[12] W. L. Nyborg, ''Biological effects of ultrasound: Development of safety guidelines. part ii: General review,'' Ultrasound in Medicine and Biology, vol. 27, no. 3, pp. 301–333, 2001, [ Links ] cited By (since 1996):112. [Online]. Available: www.scopus.com 18
[13] L. A. Love and F. W. Kremkau, ''Intracellular temperature distribution produced by ultrasound,'' The Journal of the Acoustical Society of America, vol. 67, no. 3, pp. 1045–1050, 1980. [ Links ] [Online]. Available: http://link.aip.org/link/?JAS/67/1045/1 18
[14] WHO, Environmental Health Criteria. Geneva: WHO library, 1982. [ Links ] 18
[15] K. J. Astrom, ''Contro system design lecture notes for me 155a,'' pp. 217–237, 2002. [ Links ] 19
[16] S. Angersbach, B. Hipler, S. Brand, and C. Ruckert, ''Monitoring of microbial growth curves by laser nephelometry,'' GOR-TOKYO-, vol. 7, no. 4, p. 35, 2005. [ Links ] 20
[17] M. Sadar, Introduction to laser nephelometry: an alternative to conventional particulate analysis methods, Loveland, CO, 1999-2005. [ Links ] 20
[18] B. H. Brown, R. H. Smallwood, D. C. Barber, P. V. Lawford, and D. R. Hose, ''Medical physics and biomedical engineering,'' Measurement Science and Technology, vol. 12, no. 10, p. 1744, 2001. [ Links ] [Online]. Available: http://stacks.iop.org/0957-0233/12/i=10/a=703 24