Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Ingeniería y Ciencia
versión impresa ISSN 1794-9165
ing.cienc. vol.9 no.18 Medellín jul./dic. 2013
ARTÍCULO ORIGINAL
Análisis del efecto de la porosidad y forma de un stent en un aneurisma sacular intracraneal utilizando el método Lattice Boltzmann
Analysis of the effect of stent porosity and shape on saccular intracranial aneurysm using the Lattice Boltzmann method
D. S. Ayala1 y D. A. Madero2
1 Mg. en Física médica, santiago.ayala@oncologosdeloccidente.co, Oncólogos del Occidente, Armenia, Colombia.
2 MSc. Física médica, damaderor@unal.edu.co, Clínica de Occidente S.A., Armenia, Colombia.
Recepción: 19-11-2012, Aceptación: 02-10-2013 Disponible en línea: 05-11-2013
PACS: 87.15.hj, 47.15.G-, 47.11.-j
Resumen
En este artículo se presenta un analísis de los patrones de flujo sanguíneo en un aneurisma sacular intracraneal y los efectos de la forma y la porosidad de los stents empleados en tratamientos endovasculares. En este estudio se empleará el criterio de reducción del flujo para caracterizar la eficiencia del stent. Se evaluarán las propiedades hemodinámicas de un flujo sanguíneo newtoniano dentro del aneurisma a partir del método de Lattice Boltzmann (LBM). Se proponen algunos valores de porosidad y forma de stent para el análisis. En todos los casos de stent analizados se observa una reducción de velocidades y presiones y un aumento de viscosidad. Se observa además que el stent de contorno rectangular es el caso óptimo y reduce la magnitud de la velocidad del flujo en el interior del aneurisma hasta en un 76 %. Los resultados obtenidos ayudan a entender el papel de la forma y porosidad en el diseño de un stent.
Palabras clave: aneurisma sacular intracraneal; stent; método lattice boltzmann. Aspectos relevantes
• Se empleó el método Lattice Boltzmann en la solución de un modelo de flujo sanguíneo bidimensional en un aneurisma sacular intracraneal. • Se realizaron mediciones de presiones y velocidades en un aneurisma con y sin stent y para diferentes formas y porosidades de stent.
Abstract
This article presents an analysis of blood flow patterns in intracranial saccular aneurysm and the effects of the shape and porosity of the stents used in endovascular treatments. In this study will be used the flow reduction criteria for characterizing the efficiency of the stent. The hemodynamic properties of a newtonian blood flow into the aneurysm will be evaluated using the Lattice Boltzmann method (LBM). Porosity values and stent forms are proposed for analysis. In all stent cases analyzed is observed a reduction of velocity and pressure and an increase in viscosity. It is further noted that the rectangular contour stent is the optimal case and reduces the magnitude of the flow velocity inside the aneurysm much as 76%. The results help to understand the role of porosity in the form and design of a stent.
Key words: saccular intracranial aneurysm; stent; lattice boltzmann method.
1 Introducción
Los aneurismas son enfermedades vasculares que se caracterizan por un debilitamiento y abultamiento de una porción de una arteria. Los aneurismas intracraneales son particularmente peligrosos puesto que su ruptura presenta altas tasas de mortalidad y morbilidad [1]. Para tratar aneurismas, se han empleado técnicas endovasculares. Los estudios de modelos de aneurismas han mostrado cambios hemodinámicos complejos en el aneurisma luego de la colocación de un stent a lo largo del cuello del mismo [2], [3], [4], [5], [6].
Se cree que la hemodinámica juega un papel importante no sólo en la formación y crecimiento de un aneurisma sino también en la formación de trombos durante el proceso de embolización. Se han propuesto varios factores hemodinámicos para explicar la formación y crecimiento de los aneurismas; entre estos se ha incluído la presión arterial, los esfuerzos cortantes hemodinámicos y la velocidad [7]. Estos factores se han estudiado a partir de modelos in vitro, in vivo y en simulación computacional [8], [9], [10]. Se ha determinado que altos esfuerzos cortantes y velocidades contribuyen en los daños vasculares.
Se ha propuesto la implantación de un stent poroso en un vaso dañado como un método de prevenir el crecimiento del aneurisma y su posible ruptura. Es de esperarse que la capacidad de un stent para disminuir el flujo en el aneurisma dependa de su diseño. Se han realizado estudios del efecto de la forma del enmallado de un stent [11], [12], [13]. Kim et al. han realizado también un estudio comparativo de los efectos del diseño de stent en la hemodinámica de un aneurisma [14]. En este trabajo se realiza un estudio similar al de Kim et al.
Se pretende realizar un modelo 2D de un aneurisma sacular utilizando el método Lattice Boltzmann (LBM, por sus siglas en inglés) para flujo sanguíneo, con el fin de evaluar el efecto hemodinámico de la forma y porosidad de los stents. Se realizarán cálculos de presiones y velocidades en el aneurisma con y sin el stent y para diferentes formas y porosidades de stent.
1.1 Aneurisma
Un aneurisma es un abultamiento en forma de balón en una arteria. Se generan a raíz de la fuerza ejercida por la sangre sobre las paredes de las arterias que han sido debilitadas o dañadas por diversos problemas médicos, condiciones genéticas o trauma.
Un aneurisma puede crecer hasta el punto de romperse o generar fisuras en las paredes de la arteria, lo que conlleva a una hemorragia que en la gran mayoría de los casos resulta fatal.
Entre los diferentes tipos de aneurismas se encuentran los aneurismas aórticos, los intracraneales y los periféricos. Los aneurismas aórticos son los más comunes y se dividen a su vez en aneurismas aórticos abdominales (AAA) y aneurismas aórticos torácicos (TAA), según la región de incidencia. Los aneurismas intracraneales suelen ser saculares, debido a la forma en que se presentan. Los aneurismas que no se presentan en la aorta o en las arterias cerebrales se denominan periféricos y se ubican, comúnmente, en las arterias carótidas, femorales y poplíteas [15].
1.2 Aneurisma intracraneal
Los aneurismas intracraneales se clasifican según la morfología, tamaño, ubicación o etiología. Usualmente, los aneurismas intracraneales se dividen en tres tipos básicos: sacular, fusiforme y disecante, y pueden aparecer solitarios (70-75 %) o en lesiones vasculares múltiples (25-30 %), generalmente en el círculo de Willis1. La mayoría de los aneurismas ocurren de manera espontánea, aunque rara vez se generan a causa de un trauma, una infección o un tumor [16].
En la gran mayoría de los casos, la ocurrencia de un aneurisma cerebral está asociada a factores endógenos como la presión sanguínea arterial elevada y condiciones alteradas de flujo y factores exógenos como el cigarrillo, el alto consumo de alcohol y el uso de medicamentos anticoagulantes o anticonceptivos [17], [18]. Las causas más comunes en el desarrollo de un aneurisma son los daños vasculares hemodinámicamente inducidos, la aterosclerosis, la vasculopatía subyacente y estados de flujo elevado. Las etiologías menos comunes son el trauma, la infección, el abuso de drogas y neoplasias [16].
2 Aneurisma sacular
Los aneurismas saculares son conglomerados de sangre con forma de cereza que se forman en las paredes de las arterias, y constituyen un 66-98% de los aneurismas intracraneales [19]. Estos se forman a partir del engrosamiento de la capa interna de la pared arterial. Como la capa interna de la pared es inelástica en estos lugares, se aumenta el estrés en las porciones más elásticas provocando una invaginación. También puede influir la presencia de anormalidades en las proteínas estructurales de la matriz extracelular [20].
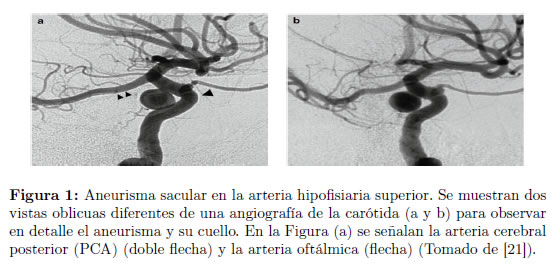
Existen diferentes métodos imaginológicos para el estudio de los aneurismas intracraneales, entre los que se encuentra la tomografía computarizada (CT), la resonancia magnética (MR), la angiografía cerebral y el ultrasonido transcraneal. La Figura 1 muestra una angiografía de un aneurisma sacular en la arteria carótida.
3 Tratamiento
El objetivo primario de los tratamientos de aneurismas cerebrales es evitar la ruptura.
Existen dos tipos básicos de tratamiento: la cirugía y los tratamientos endovasculares. Durante varias décadas se ha seleccionado la cirugía como la herramienta principal de tratamiento de estas patologías y se ha restringido la terapia endovascular a casos muy específicos en los que la cirugía se dificulta, ya sea por la ubicación anatómica del aneurisma o por condiciones médicas que la contraindiquen. Sin embargo, con la aparición de nuevas tecnologías se ha incrementado el uso de la terapia endovascular, hasta el punto de convertirse en la principal técnica de tratamiento de aneurismas intracraneales (con más de un 85% de los casos)[22], [23].
3.1 Tratamiento endovascular
El tratamiento endovascular de aneurismas consiste en la inserción de diversos materiales embólicos a través de la arteria afectada con la intención de obstruír el flujo de sangre al interior del saco del aneurisma por medio de una embolización2 en su interior.
Para la implantación de estos materiales en las arterias es necesario el uso de dispositivos complementarios, entre los que se encuentran los catéteres guía, los cuales tienen una punta suave revestida hidrofílicamente que alcanza grandes distancias en la arteria sin causar ruptura. A través de estos catéteres guía puede introducirse un microcatéter (0.010-0.016in de calibre), a través del cual se llevará el embobinado hasta el aneurisma. En la mayoría de los casos, estos microcatéteres son puestos en el sitio indicado a través de un microalambre (0.010-0.016in de calibre) que se inserta en el catéter guía. El uso de uno de estos dispositivos médicos es una elección subjetiva y puede variar de una institución a otra.
En cuanto a los materiales embolícos empleados, inicialmente se utilizaban balones de látex o silicona que se introducían a través de la arteria, pero estos dispositivos presentaron varios efectos secundarios perjudiciales, restringiéndose su uso a oclusiones cardiovasculares de vasos mayores, como la carótida interna o la arteria vertebral. Posteriormente se comienzan a usar embobinados de alambre, los cuales se constituyen hoy en día como el dispositivo endovascular de mayor uso para tratamientos de aneurismas. Estos alambres pueden ser de acero inoxidable o titanio, sin embargo, para tratamientos endovasculares intracraneales se prefiere el empleo de alambres de titanio porque son menos rígidos. Los alambres utilizados hoy en día tienen un recubrimiento o proveen sustancias bioactivas que facilitan el crecimiento endotelial y sana la entrada del aneurisma. Pueden tener también recubrimientos de materiales de hidrogel expandible a condiciones de pH específicas como la de la sangre, que permiten aumentar hasta siete veces el volumen del embobinado [16].
En algunas ocasiones, se encuentran aneurismas con cuello amplio en los que la cirugía o la terapia endovascular convencional se dificulta o es imposible de realizar, además de que la oclusión total de la arteria afectada no es una opción viable. En tales casos se requiere el uso de un dispositivo médico denominado stent [24], [25].
3.2 Stents
Los stents son tubos pequeños y flexibles hechos de una malla plástica o de alamabre, que se utilizan para tratar una variedad de situaciones médicas, entre las que se encuentra la de mantener abiertos vasos sanguíneos o cualquier otra ruta que se encuentre obstruída.
Se han desarrollado stents con el fin de ayudar en el tratamiento endovascular de aneurismas de cuello amplio que no pueden ser tratados directamente con cirugía o terapias endovasculares convencionales.
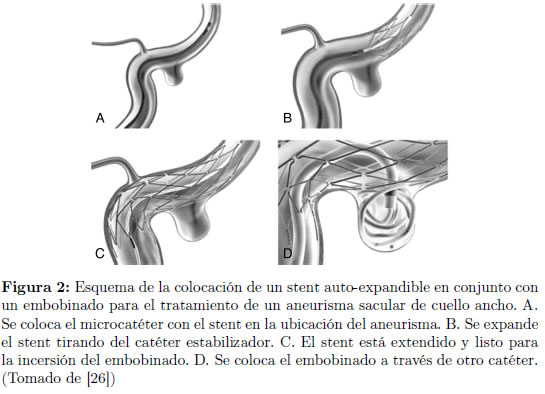
Los stents son desplegados en el sitio de interés por la expansión de un balón o la liberación de nitinol auto-expandible o un stent de acero de un stent estabilizador que lo mantiene en posición comprimida hasta que se ubica en el lugar adecuado. Sin embargo, por razones de rigidez, la expansión con el balón es muy restringida para tratamientos intracraneales, por lo que se prefiere utilizar stents auto-expandibles muy elásticos. La Figura 2 muestra un esquema de un stent auto-expandible utilizado en conjunto con un sistema de embobinado para la embolización de un aneurisma sacular de cuello ancho.
Dependiendo del diseño del stent, puede que no sea necesario el uso complementario de un embobinado de alambre, pues un stent de enmallado denso puede promover la trombosis en el aneurisma [16].
4 Métodos Lattice Boltzmann
Los métodos Lattice Boltzmann (LBM) son una clase de simulación de mecánica de fluidos computacional (CFD)3. Estos solucionan la ecuación de Boltzmann discreta4, en lugar de las ecuaciones de Navier-Stokes5, para simular el flujo de un fluido newtoniano6 con modelos de colisión como el Bhatnagar-Gross-Krook (BGK), como se describirá más adelante en este artículo. Estos métodos se basan en el hecho de que las interacciones de partículas intrínsecas en procesos de flujo y colisiones en un número limitado de partículas muestran un comportamiento de fluido viscoso que se extrapola a la masa total de interés [27].
4.1 Algoritmo
LBM es una técnica de simulación de sistemas de fluidos complejos relativamente nueva. A diferencia de los modelos convencionales de simulación de fluidos, los cuales resuelven numéricamente las ecuaciones de conservación de las propiedades macroscópicas (masa, moméntum y energía), LBM modela el fluido como un conjunto de partículas ficticias que experimentan procesos consecutivos de propagación y colisión sobre una malla reticular o lattice. La naturaleza particular y la dinámica local de LBM ofrece ciertas ventajas sobre los CFD convencionales, especialmente al tratar fronteras complejas, interacciones microscópicas y paralelización del algoritmo. Los métodos numéricos para la solución de ecuaciones diferenciales parciales dan lugar a un mapa discretizado, el cual puede interpretarse como la propagación y colisión de partículas ficticias.
En el algoritmo computacional, los pasos de colisión y flujo se definen así:
Paso de colisión:
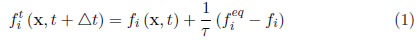
Paso de flujo:
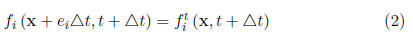
4.2 Desarrollo desde el método LGA
El método LBM se originó a partir del método del lattice de autómatas de gas (LGA), el cual puede ser considerado un modelo de dinámica molecular ficticio simplificado en el cual el espacio, el tiempo y las velocidades de la partícula son discretos. En este modelo puede haber 0 o 1 partícula en un nodo del lattice moviéndose con una velocidad determinada del lattice. Luego de un intervalo de tiempo, cada partícula se moverá a un nodo vecino en la dirección de su velocidad; este proceso es llamado paso de propagación o de flujo. Cuando más de una partícula llegan al mismo nodo al mismo tiempo desde diferentes direcciones, estas colisionan y cambian sus direcciones de acuerdo a un conjunto de normas de colisión. Los procesos de colisión y flujo se alternan. En las normas de colisión se encuentra la conservación del número de partículas (masa), moméntum y energía antes y después de la colisión. El modelo LGA presenta ciertos defectos para la simulación de hidrodinámica, tales como la falta de invarianza Galileana7 para fluidos rápidos, el ruido estadístico y dificultades para escalar el número de Reynolds8 con el tamaño del lattice.
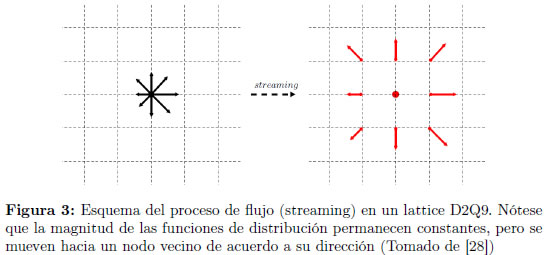
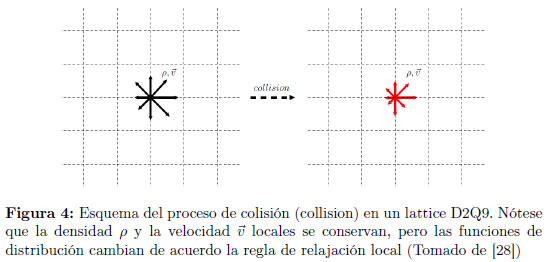
El paso de flujo, en el cual las funciones de distribución se trasladan a las celdas vecinas de acuerdo a la dirección discretizada de la velocidad, se muestra en la Figura 3, en el modelo D2Q9 por simplicidad. El paso de colisión (que se ilustra en la Figura 4 consiste en una redistribución de las funciones de distribución a partir de las funciones de distribución de equilibrio discretizadas locales, pero de tal manera que se mantengan invariantes la masa y el moméntum locales.
La principal razón para la transición de LGA a LBM fue el intento de evitar el ruido estadístico reemplazando el número booleano de la partícula en una dirección del lattice con su promedio de grupo o función de distribución de densidad. Junto con este cambio, la regla de colisión discreta se reemplaza por su función contínua llamada operador colisión. En el desarrollo del LBM, se tiene una simplificación importante que consiste en la aproximación del operador colisión con el término de relajación de Bhatnagar–Gross–Krook (BGK). Este modelo de lattice (LBGK) hace que las simulaciones sean más eficientes y permite cierta flexibilidad en los coeficientes de transporte. Por otro lado, se ha mostrado que el esquema LBM puede considerarse como una forma discretizada de la ecuación contínua de Boltzmann. Es posible obtener las ecuaciones de continuidad y de Navier- Stokes a partir del algoritmo LBM utilizando la teoría de Chapman-Enskog [29]. Es posible también obtener los perfiles de presión de manera directa desde las distribuciones de densidad.
4.3 Lattices y clasificación DnQm
Los modelos de Lattice Boltzmann se pueden trabajar en distintos tipos de lattices, tanto cúbicos como triangulares, y con o sin partículas en reposo en la función de distribución discreta.
Una manera típica de clasificación de los diferentes métodos de lattices es el esquema DnQm. En este esquema ''Dn'' quiere decir ''n dimensiones'' y ''Qm'' representa ''m velocidades''. Por ejemplo, D3Q15 es un modelo de Lattice Boltzmann tridimensional en una red cúbica con partículas en reposo presentes. Cada nodo tiene una forma cristalina, y puede entregar partículas a cada uno de los seis nodos vecinos que comparten una cara, los ocho nodos vecinos que comparten una esquina, y así mismo. Si se incluyera además la posibilidad de entregar partículas a los doce vecinos que comparten un borde, se tendría el modelo D3Q27.
Las cantidades reales como espacio y tiempo deben convertirse a unidades del lattice antes de la simulación. Las cantidades no dimensionales como el número de Reynolds no varían.
4.4 Conversión a unidades del lattice
En la simulación con Lattice Boltzmann se asignan cantidades Δx y Δt, siendo Δx la unidad espacial básica del lattice y Δt el intervalo de tiempo.
Por tanto, si se tiene un lattice de dominio espacial L con N unidades de lattice a lo largo de la longitud total, la unidad espacial se definirá como Δx = L/N. Las velocidades en las simulaciones de Lattice Boltzmann se suelen expresar en términos de la velocidad del sonido, por tanto, la unidad temporal se define como Δt = Δx/cs, donde cs es la velocidad del sonido.
5 Implementación del método
5.1 Descripción del modelo
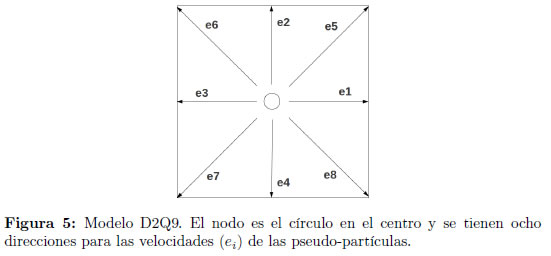
Se utiliza una estructura de vórtices para analizar los patrones de flujo en un aneurisma y un vaso sanguíneo. LBM resuelve el movimiento del fluido basado en la dinámica microscópica de pseudo-partículas de fluido que evoluciona en un lattice. El LBM empleado en este estudio es el lattice incompresible de nueve velocidades de Bhatnagar–Gross– Krook (BGK) para dos dimensiones (D2Q9), como se observa en la Figura 5.
En el modelo LBM, la función de distribución, fi (x, t), en el punto x y tiempo t, interactúa con el lattice respetando la conservación de masa, moméntum, isotropía e invarianza Galileana. La evolución de la función de distribución en un lattice está dada por
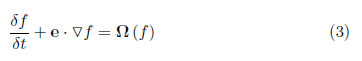
donde e es la velocidad local de la partícula y Ω es el operador de colisión.
La densidad del fluido, ρ, y su velocidad, u, se evalúan a partir de la función de evolución por
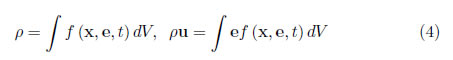
La evolución de la función de distribución en el lattice (eq. 3 se discretiza de la siguiente manera:
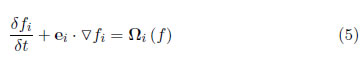
siendo i = 0, 1, 2, ..., 8 para el modelo D2Q9 empleado.
Para la densidad y velocidad del fluido (eq. 4 se obtiene entonces
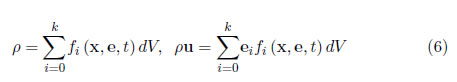
donde k es 8 para el modelo D2Q9 empleado.
La evolución de la función de distribución de la partícula que resulta de los procesos de colisión y el movimiento de la partícula está determinado por el LBM empleando el modelo BGK, a partir de las ecuaciones (1 y (2:
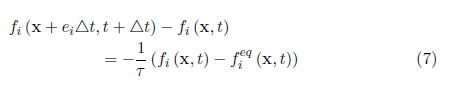
donde fi (x + eiΔt, t + Δt) − fi (x, t) es también llamado el operador colisión (Ωi); τ es el tiempo de relajación adimensional.
La función de equilibrio está dada por
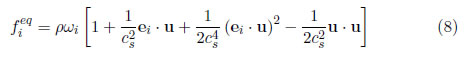
donde cs = c/√3 es la velocidad del sonido, c = Δx/Δt es la velocidad de la partícula, Δx y Δt son el espaciamiento del lattice y el intervalo de tiempo, respectivamente, y ωi es el factor de peso.
La viscosidad cinemática, ν, está dada por
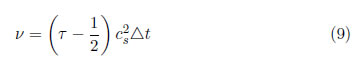
La ecuación 9 permite ajustar la viscosidad del modelo de manera directa. Se observa que se requiere que τ ≥ 0,5 para garantizar una viscosidad positiva. El límite τ → 0,5 corresponde a un fluido no viscoso, mientras que el límite τ → ∞ representa al flujo de Stokes (de arrastre). Mientras que el último caso no genera ninguna dificultad para el modelo, el primero es problemático debido a temas de inestabilidad si se selecciona una resolución inadecuada del lattice. Esto se debe a que los gradientes de velocidad pueden hacerce muy grandes (especialmente en geometrías complejas, con altas variaciones topográficas) y el modelo no puede disipar la energía debido a la viscosidad tan baja [28].
La velocidad local de la partícula empleada en el modelo está dada por
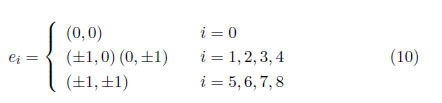
Los factores de peso para la función de equilibrio están dados por

Bajo la condición de bajas velocidades y al hacer Δx, Δt → 0, este modelo retorna a las ecuaciones de Navier-Stokes [28]:
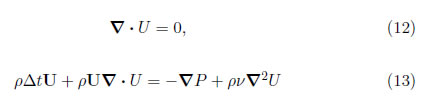
con una ecuación isotérmica de estado:

donde P es la presión.
La prueba de este resultado sigue el análisis de Chapman-Enskog [29].
5.2 Parámetros numéricos
La simulación del comportamiento hemodinámico en el aneurisma se llevó a cabo en c++ bajo la programación orientada a objetos (POO), el cual ofrece un código claro y fácil de manipular. El lattice se dividió en los objetos fluido, stent, fuente y vacío.
Se ha considerado un flujo sanguíneo newtoniano. Se han tomado diferentes valores para el número de Reynolds (Re = UL/ν, siendo U la velocidad en el centro del canal y L el ancho del canal) entre 1 y 1000, basado en estudios previos [11]. El máximo número de Reynolds es Remax = 331, el cual es característico de la circulación en condiciones de reposo de la arteria cerebral [30]. Se ha seleccionado el número Reynolds de 200 como el valor que mejor aproximación ofrece para el flujo estudiado, con una densidad ρ = 1,0g/cm3. Se ha empleado un lattice con 800x200 celdas con un ancho del canal (arteria) de 80 celdas.
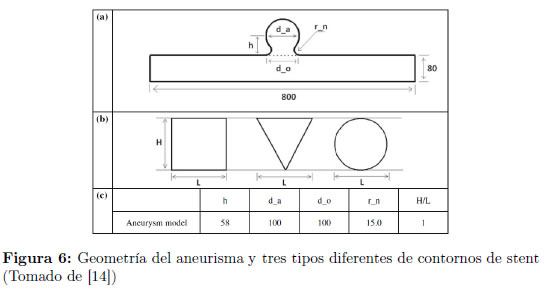
La geometría empleada es la descrita por [14] para el modelo 2D y se muestra en la Figura 6a. La arteria principal es de 4mm de diámetro y el diámetro del saco aneurismal es de 5mm. Se considera que la pared arterial es rígida. En este estudio se han considerado tres tipos diferentes de contornos del stent, como se muestra en la Figura 6b. Se tiene que H/L = 1, donde H y L son el alto y ancho del contorno, respectivamente.
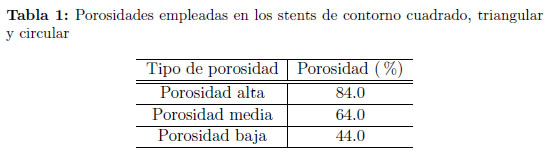
Se analizan los efectos en el flujo dentro del aneurisma a partir de tres valores diferentes de porosidad para cada uno de los tres tipos de contorno. Los valores de porosidad empleados se muestran en la Tabla 1.
La simulación se hace correr durante 103 pasos de tiempo.
6 Resultados y discusión
Se realizaron diferentes mediciones del módulo de la velocidad y presión del flujo sanguíneo en el saco del aneurisma con stent y se realizaron comparaciones con el modelo sin stent. Se emplearon diferentes valores de porosidad y distintos contornos de stent para realizar comparaciones. Finalmente se discute sobre la eficacia de un stent como tratamiento endovascular de aneurismas saculares y se realizan consideraciones acerca del diseño apropiado para un stent.
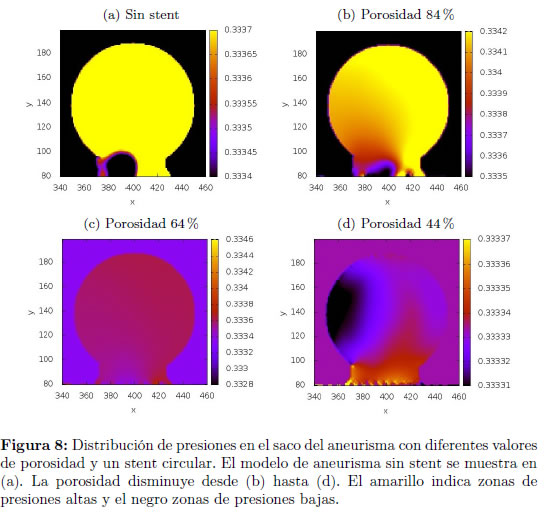
6.1 Efecto de la porosidad del stent
Se emplearon tres diferentes porosidades para observar los cambios en los patrones de flujo dentro del aneurisma con respecto al flujo que se presenta en el aneurisma sin stent.
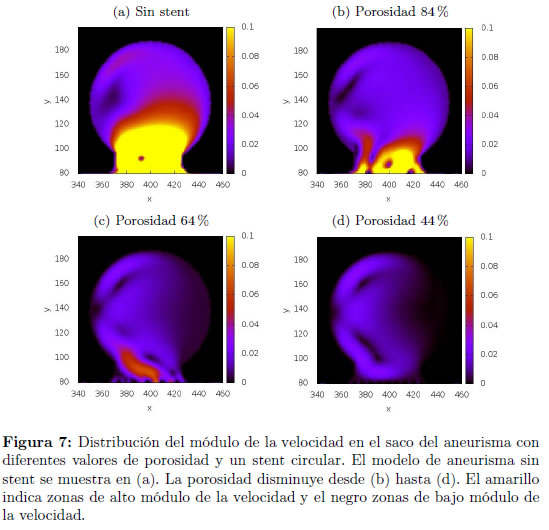
En las Figuras 7 y 8 se muestra el efecto del stent de contorno circular en la rapidez y presión del flujo en el saco del aneurisma para los tres diferentes valores de porosidad. Se hace evidente la disminución del flujo en el saco aneurismal cuando se utiliza el stent. Se observa además que la disminución en la porosidad del stent disminuye el flujo obtenido, lo que disminuye también la tasa de esfuerzos cortantes en las paredes del vaso y aumenta entonces la tendencia a formar trombos y lograr la embólisis requerida [31].
6.2 Efecto de la forma del stent
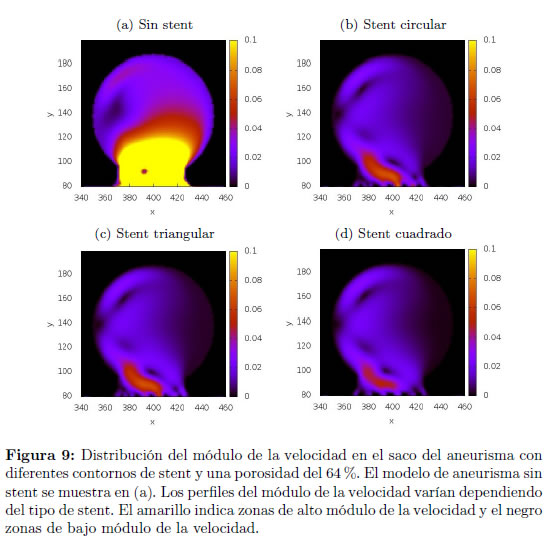
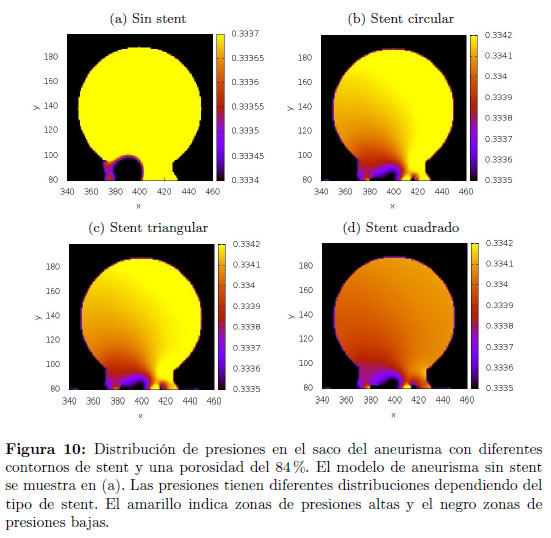
Se analizaron los perfiles de distribución de presiones y módulo de la velocidad del flujo sanguíneo en el aneurisma al variar el tipo de stent. Se emplearon tres tipos diferentes de stent.
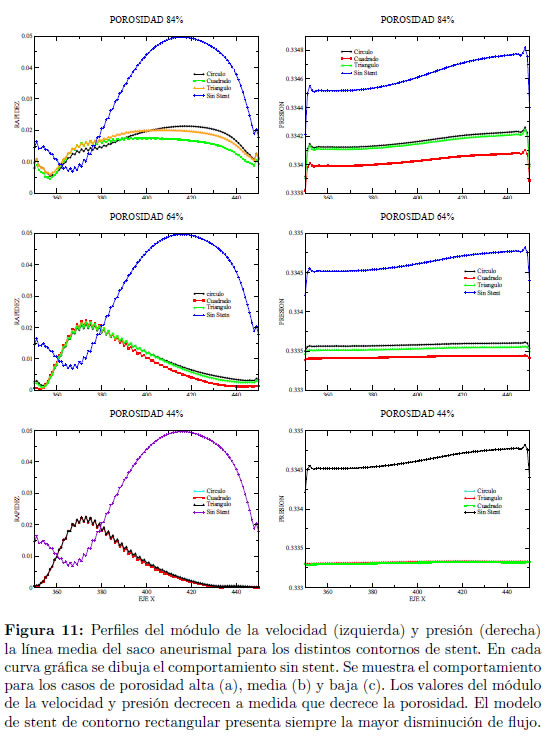
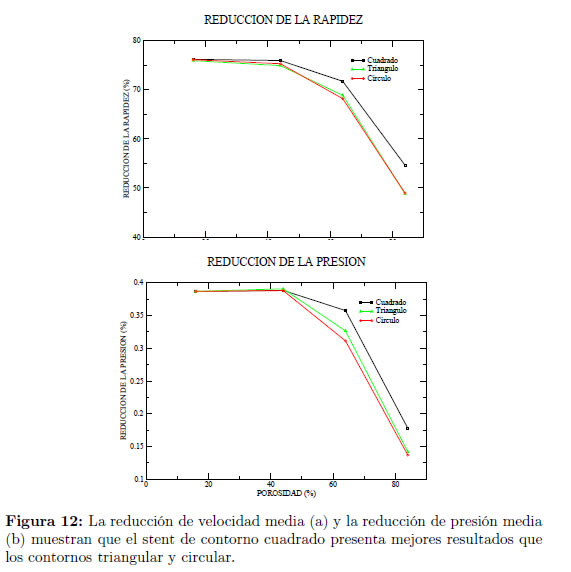
En las Figuras 9 y 10 se muestran las distribuciones del módulo de la velocidad y presión, respectivamente, que se obtienen con los diferentes tipos de stent y se comparan con la distribución obtenida en el aneurisma sin stent. Los perfiles del módulo de la velocidad y presión sobre una línea media en el saco del aneurisma se muestran en la Figura 9, en donde se realizan comparaciones para los distintos contornos de stent, cuadrado, circular y triangular, y el modelo sin stent para los diferentes valores de porosidad estudiados. Puede notarse que el stent de contorno cuadrado logra una mayor disminución del flujo en el aneurisma, comparado con los stents de contorno triangular y circular. Esto puede deberse a que el contorno cuadrado es de mayor área en la sección transversal que los contornos circular y triangular.
La Figura 12 muestra que la reducción en la velocidad media y la reducción en la presión media en el stent de contorno cuadrado son mayores que en los otros contornos. Se observa que para una porosidad de 44% se logra obtener una reducción en el módulo de la velocidad de al menos 76% y una reducción en las presiones de al menos 0.38% en todos los modelos de stent respecto al modelo sin stent.
7 Conclusiones
Se ha empleado el método Lattice Boltzmann en la solución de un modelo de flujo sanguíneo bidimensional en un aneurisma sacular intracraneal. Los resultados de la simulación permiten analizar los efectos hemodinámicos en el aneurisma al colocar un stent de diferentes formas y porosidades.
Los resultados muestran que la colocación del stent causa una disminución de los valores del módulo de la velocidad media y presión media en el interior del saco del aneurisma. Se han estudiado tres modelos de stent (cuadrado, circular y triangular) y tres valores de porosidad (44 %, 64% y 84 %).
Para valores determinados de porosidad y con el empleo del contorno de stent adecuado se logró una mayor disminución del flujo en el aneurisma. Se observó que el flujo disminuye a medida que se reduce el valor de la porosidad de stent. También se obtuvo que al colocar el stent de contorno cuadrado se obtienen los mejores resultados en la disminución del flujo, alcanzando una reducción de hasta 76% en la velocidad media de flujo en el saco del aneurisma, para una porosidad de 44 %, con respecto al modelo sin stent.
La reducción en las velocidades y presiones medias de flujo dentro del aneurisma aumentan la generación de trombos y disminuyen las tasas de esfuerzos cortantes en las paredes del vaso, lo cual es la principal razón de ruptura de aneurismas.
Notas al pie
1 El círculo de Willis (también llamado círculo arterial cerebral, círculo arterial de Willis, y polígono de Willis) es un círculo de arterias que suministran sangre al cerebro.
2 La embolización es un proceso no quirúrgico y poco invasivo en la que se ocluyen vasos sanguíneos específicos, por medio de la coagulación, para evitar o disminuir el flujo de sangre.
3 La mecánica de fluidos computacional (CFD) es una de las ramas de la mecánica de fluidos que utiliza métodos numéricos y algoritmos para resolver y analizar problemas sobre el flujo de sustancias.
4 La ecuación de Boltzmann, también conocida como ecuación de transporte de Boltzmann, describe la distribución estadística de una partícula en un fluido. Es una de las ecuaciones más importantes de la mecánica estadística de no equilibrio, específicamente en el tratamiento de sistemas lejos del equilibrio termodinámico. La ecuación de Boltzmann se utiliza en el estudio de la manera como un gas o un fluido transporta cantidades físicas como calor y moméntum, y por tanto, permite obtener propiedades de transporte como viscosidad y conductividad térmica.
5 Las ecuaciones de Navier-Stokes son un conjunto de ecuaciones en derivadas parciales no lineales que describen el movimiento de un fluido newtoniano. Estas ecuaciones se obtienen aplicando los principios de conservación de la mecánica y la termodinámica a un volumen fluido. Haciendo esto se obtiene la llamada formulación integral de las ecuaciones. Para llegar a su formulación diferencial se manipulan aplicando ciertas consideraciones, principalmente aquella en la que los esfuerzos tangenciales guardan una relación lineal con el gradiente de velocidad (ley de viscosidad de Newton), obteniendo de esta manera la formulación diferencial que generalmente es más útil para la resolución de los problemas que se plantean en la mecánica de fluidos.
6 Un fluido newtoniano es un fluido cuya viscosidad puede considerarse constante en el tiempo. La curva que muestra la relación entre el esfuerzo o cizalla contra su tasa de deformación es lineal y pasa por el origen, es decir, el punto [0,0]. El mejor ejemplo de este tipo de fluidos es el agua en contraposición al pegamento, la miel o los geles que son ejemplos de fluido no newtoniano.
7 La invarianza Galileana o relatividad Galileana es un principio de relatividad el cual establece que las leyes fundamentales de física son las mismas en todos los marcos inerciales.
8 En mecánica de fluidos, el número de Reynolds Re es un número adimensional que da una medida de la razón entre las fuerzas inerciales y las fuerzas viscosas y, por tanto, cuantifica la importancia relativa de estos dos tipos de fuerzas para determinadas condiciones de flujo.
El número de Reynolds se utiliza para caracterizar diferentes regímenes de flujo, tales como flujo laminar o turbulento: el flujo laminar ocurre para valores bajos del número de Reynolds, donde las fuerzas viscosas son dominantes, y se caracteriza por un movimiento suave y constante del fluido; el flujo turbulento ocurre para valores altos del número de Reynolds y es dominado por las fuerzas inerciales, las cuales tienden a generar remolinos caóticos, vórtices, entre otras inestabilidades del flujo.
Agradecimientos
Agradecemos a la Universidad Nacional de Colombia por su aporte significativo a este trabajo; específicamente al profesor Jose Daniel Muñoz Castaño quien nos enseñó el método Lattice Boltzmann en el curso de Métodos de Simulación de Sistemas Físicos. Agradecemos también la contribución de la Universidad Eafit en revisiones, redacción y edición del artículo.
Referencias
[1] J. B. Bederson, E. S. Connolly, H. H. Batjer, R. G. Dacey, J. E. Dion, M. N. Diringer, J. E. Duldner, R. E. Harbaugh, A. B. Patel, and R. H. Rosenwasser, ''Guidelines for the management of aneurysmal subarachnoid hemorrhage: A statement for healthcare professionals from a special writing group of the stroke council, american heart association,'' Stroke, vol. 40, no. 3, pp. 994–1025, 2009. [ Links ] [Online]. Available: http://stroke.ahajournals.org/content/40/3/994.short 34
[2] G. Geremia, M. Haklin, and L. Brennecke, ''Embolization of experimentally created aneurysms with intravascular stent devices,'' AJNR Am J Neuroradiol, vol. 15, no. 7, pp. 1223–1231, 1994. [ Links ] 35
[3] B. Lieber, A. Stancampiano, and A. Wakhloo, ''Alteration of hemodynamics in aneurysm models by stenting: Influence of stent porosity,'' Annals of Biomedical Engineering, vol. 25, pp. 460–469, 1997, [ Links ] 10.1007/BF02684187. 35
[4] F. Turjman, T. Massoud, C. Ji, G. Guglielmi, F. Vinuela, and J. Robert, ''Combined stent implantation and endosaccular coil placement for treatment of experimental wide-necked aneurysms: a feasibility study in swine,'' AJNR Am J Neuroradiol, vol. 15, no. 6, pp. 1087–1090, 1994. [ Links ] 35
[5] A. Wakhloo, F. Schellhammer, J. de Vries, J. Haberstroh, and M. Schumacher, ''Self-expanding and balloon-expandable stents in the treatment of carotid aneurysms: an experimental study in a canine model,'' AJNR Am J Neuroradiol, vol. 15, no. 3, pp. 493–502, 1994. [ Links ] 35
[6] A. Wakhloo, F. Tio, B. Lieber, F. Schellhammer, M. Graf, and L. Hopkins, ''Self-expanding nitinol stents in canine vertebral arteries: hemodynamics and tissue response,'' AJNR Am J Neuroradiol, vol. 16, no. 5, pp. 1043–1051, 1995. [ Links ] 35
[7] H. Steiger, Pathophysiology of development and rupture of cerebral aneurysms, ser. Acta neurochirurgica: Supplementum. Springer-Verlag, 1990. [ Links ] 35
[8] A. C. Burleson, C. M. Strother, and V. T. Turitto, ''Computer modeling of intracranial saccular and lateral aneurysms for the study of their hemodynamics,'' Neurosurgery, vol. 37, no. 4, pp.–, 1995. [ Links ] 35
[9] G. N. Foutrakis, H. Yonas, and R. J. Sclabassi, ''Saccular aneurysm formation in curved and bifurcating arteries,'' AJNR Am J Neuroradiol, vol. 20, no. 7, pp. 1309–1317, 1999. [ Links ] 35
[10] C. Gonzalez, Y. Cho, H. Ortega, and J. Moret, ''Intracranial aneurysms: flow analysis of their origin and progression,'' AJNR Am J Neuroradiol, vol. 13, no. 1, pp. 181–188, 1992. [ Links ] 35
[11] M. Aenis, A. P. Stancampiano, A. K.Wakhloo, and B. B. Lieber, ''Modeling of flow in a straight stented and nonstented side wall aneurysm model,'' Journal of Biomechanical Engineering, vol. 119, no. 2, pp. 206–212, 1997. [ Links ] 35, 48
[12] J. Cebral and R. Lohner, ''Efficient simulation of blood flow past complex endovascular devices using an adaptive embedding technique,'' Medical Imaging, IEEE Transactions on, vol. 24, no. 4, pp. 468 –476, april 2005. [ Links ] 35
[13] G. R. Stuhne and D. A. Steinman, ''Finite-element modeling of the hemodynamics of stented aneurysms,'' Journal of Biomechanical Engineering, vol. 126, no. 3, pp. 382–387, 2004. [ Links ] 35
[14] Y. Kim, X. Xu, and J. Lee, ''The effect of stent porosity and strut shape on saccular aneurysm and its numerical analysis with lattice boltzmann method,'' Annals of Biomedical Engineering, vol. 38, no. 7, pp. 2274–2292, 2010. [ Links ] 35, 48, 49
[15] A. Sutton, Cardiovascular Disorders Sourcebook, ser. Health Reference Series. Omnigraphics Inc, 2010. [ Links ] 36
[16] M. e. a. Forsting, Intracranial Vascular Malformations and Aneurysms: From Diagnostic Work-up to Endovascular Therapy, ser. Medical Radiology. Springer, 2010. [ Links ] 36, 39
[17] S. Juvela, K. Poussa, and M. Porras, ''Factors affecting formation and growth of intracranial aneurysms : A long-term follow-up study,'' Stroke, vol. 32, no. 2, pp. 485–491, 2001. [ Links ] 36
[18] W. E. Stehbens, ''Etiology of intracranial berry aneurysms,'' Journal of Neurosurgery, vol. 70, no. 6, pp. 823–831, Jun. 1989. [ Links ] 36
[19] V. A. H. Yong-Zhong G, ''Pathogenesis and histo-pathology of saccular aneurysms: review of the literature,'' Neurol Res, vol. 12, pp. 249–255, 1990. [ Links ] 37
[20] T. M. Chyatte D, Reilly J, ''Morphometric analysis of reticular and elastin fibers in the cerebral arteries of patients with intracranial aneurysms,'' Neurosurgery, vol. 26, pp. 939–943, 1990. [ Links ] 37
[21] G. Bradac, Cerebral Angiography: Normal Anatomy and Vascular Pathology. Springer, 2011. [ Links ] 37
[22] A. I. Qureshi, V. Janardhan, R. A. Hanel, and G. Lanzino, ''Comparison of endovascular and surgical treatments for intracranial aneurysms: an evidencebased review,'' Lancet Neurol., vol. 6, no. 9, pp. 816–825, Sep. 2007. [ Links ] 38
[23] A. J. Molyneux, R. S. Kerr, L.-M. Yu, M. Clarke, M. Sneade, J. A. Yarnold, and P. Sandercock, ''International subarachnoid aneurysm trial (isat) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion,'' Lancet, vol. 366, no. 9488, pp. 809–817, Sep. 2005. [ Links ] 38
[24] J. V. Byrne, M. Bashiri, A. Pasco, and J. H. Morris, ''A novel flexible endovascular stent for use in small and tortuous vessels,'' Neuroradiology, vol. 42, pp. 56–61, 2000, [ Links ] 10.1007/s002340050015. 39
[25] G. Lanzino, A. K. Wakhloo, R. D. Fessler, M. L. Hartney, L. R. Guterman, and L. N. Hopkins, ''Efficacy and current limitations of intravascular stents for intracranial internal carotid, vertebral, and basilar artery aneurysms,'' Journal of Neurosurgery, vol. 91, no. 4, pp. 538–546, Oct. 1999. [ Links ] 39
[26] S. Akpek, A. Arat, H. Morsi, R. P. Klucznick, C. M. Strother, and M. E. Mawad, ''Self expandable stent assisted coiling of wide necked intracranial aneurysms: A single center experience,'' AJNR Am J Neuroradiol, vol. 26, no. 5, pp. 1223–1231, 2005. [ Links ] 40
[27] S. Succi, The lattice Boltzmann equation for fluid dynamics and beyond, ser. Numerical mathematics and scientific computation. Clarendon Press, 2001. [ Links ] 41
[28] D. B. Chirila, introduction to lattice boltzmann method, 2010. [ Links ] 43, 47
[29] S. Chapman and T. Cowling, The mathematical theory of non-uniform gases: an account of the kinetic theory of viscosity, thermal conduction, and diffusion in gases, ser. Cambridge Mathematical Library. Cambridge University Press, 1991. [ Links ] 44, 48
[30] W. Milnor, Hemodynamics. Williams & Wilkins, 1982. [ Links ] 48
[31] T. Liou and S. Liou, ''Pulsatile flows in a lateral aneurysm anchored on a stented and curved parent vessel,'' Experimental Mechanics, vol. 44, no. 3, pp. 253–260, 2004-06-01. [ Links ] 51