1 Introducción
Las Bacterias Ácido Lácticas (BAL) han sido ampliamente utilizadas en el sector alimenticio, por sus propiedades como cultivos iniciadores o starter en la elaboración de alimentos fermentados como yogurt, queso, mantequilla y carnes maduradas entre otros [1],[2],[3],[4]. Además, ciertas especies de estas bacterias se les han denominado probióticas, por ser microorganismos vivos que al administrarse a un huésped en cantidades adecuadas le confieren beneficios a la salud [5]. La dosis recomendada es mínimo 1x107 células probióticas vivas por gramo o mililitro en el producto al momento de su consumo [6],[7],[8]. En Colombia, según la resolución 333 de 2011 en su artículo 22, los alimentos deben contener un número mayor o igual de bacterias viables de origen probiótico a 1x106 UFC/g en el producto terminado hasta el final de la vida útil [9].
Una de las problemáticas en la elaboración de cultivos iniciadores o probióticos está relacionada con el modo de preservación que ayude a mantener la viabilidad y la actividad de las células bacterianas durante su uso, almacenamiento, transporte y manejo a largo plazo, debido a que las células después de ser bioaumentadas generalmente en un biorreactor, están expuestas a varias condiciones de estrés ambiental, por ejemplo ya no se encuentran los nutrientes en las cantidades necesarias para su crecimiento, además la producción de diferentes ácidos (dependiendo si son homofermentativas o heterofermentativas) según los metabolitos producidos puede llegar a inhibir las células [10],[11],[12],[13],[14]. Las técnicas convencionales de preservación que han sido utilizadas son la congelación y la deshidratación de los cultivos. La principal desventaja en los cultivos congelados son los costos relacionados con el transporte y almacenamiento [15],[16], mientras que las preparaciones deshidratadas tienen la ventaja de su preservación a largo plazo y la facilidad de manejo y almacenamiento.
La técnica comúnmente utilizada para la deshidratación de bacterias ha sido la liofilización, en donde se puede lograr un alto nivel de células viables conservando sus propiedades [10],[15],[17],[18]; sin embargo, este proceso requiere una elevado costo de inversión de las instalaciones y equipos, además, de sus altos costos energéticos y baja productividad [19],[20],[21],[22],[23],[24]. Por lo tanto existe un interés en generar nuevos desarrollos tecnológicos más competitivos, que permitan ofrecer productos con calidad a menores costos, dentro de las cuales se encuentra el secado por atomización o pulverización [23],[25],[26],[27].
El secado por atomización es un proceso continuo que consiste en la pulverización de una alimentación fluida en gotas finas (10-150 um) dentro de una cámara de secado, las cuales entran en contacto con aire caliente (120-200 ºC) provocando la evaporación rápida del agua. Los diseños de estos equipos presentan este contacto con sistemas en co-corrientre, contracorriente o una mezcla de ambos [28],[29],[30]. Una de las desventajas del secado por atomización a pesar de los bajos tiempos de residencia es la exposición de las células a altas temperaturas en la cámara de secado, lo cual puede afectar la viabilidad de las BAL [31]; por lo que, se debe implementar un sistema de enfriamiento con aire seco antes de descargar el producto.
Para mejorar la viabilidad celular, las propiedades del producto y el rendimiento del proceso, algunos investigadores han utilizado diversos agentes protectores en la formulación de la alimentación al secador por atomización, los cuales han sido principalmente carbohidratos y proteínas [6],[12].
Esta revisión sistemática tiene como objetivo identificar los avances recientes en el proceso de secado por atomización de las BAL, se incluyen los microorganismos más estudiados y sus condiciones de crecimiento; además, se listan las condiciones de operación que se han utilizado, agentes protectores y finalmente características de los productos secos obtenidos.
2 Metodología
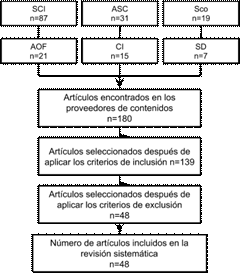
Se realizó una revisión sistemática de literatura entre los años 2009 y 2019, con los siguientes proveedores de contenidos Science Citation Index (SCI), Academic Search Complete (ASC), Academic OneFile (AOF), Scopus (Sco), Complementary Index (CI) y Science Direct (SD). La ecuación de búsqueda fue Lactic acid bacteria, probiotic (s), starter culture, spray dryer y spray drying. Las repeticiones exactas se eliminaron de los resultados.
La revisión sistemática se realizó mediante la lógica booleana, la cual permite combinar la ecuación de búsqueda mediante tres operadores lógicos and, or y not [32]. Se seleccionó como criterios de inclusión artículos en inglés, publicados en los últimos 10 años (2009-2019) y originales que incluyeran las siguientes temáticas: BAL como cultivos iniciadores o probióticos, medio de cultivo y temperatura de crecimiento, agentes protectores para el secado y sus concentraciones, condiciones de operación en el equipo de secado, supervivencia después del secado y características del producto seco.
Los criterios de exclusión empleados fueron: microorganismos probióticos diferentes a las BAL (levaduras, algunos géneros de Bacillus sp.), artículos de revisión, estudios clínicos e inmunológicos de bacterias probióticas, estudios biológicos de bacterias probióticas en animales.
3 Pruebas y resultados
3.1 Aplicación de lógica booleana y criterios de inclusión y exclusión
Después de la búsqueda en los proveedores de contenidos aplicando la lógica booleana, se obtuvieron 180 artículos. Posteriormente, al aplicar los criterios de inclusión y exclusión quedaron 48 artículos [Figura 1].
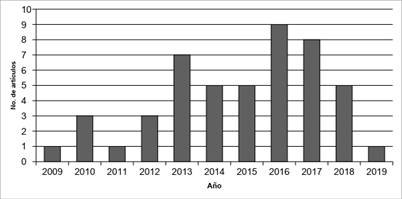
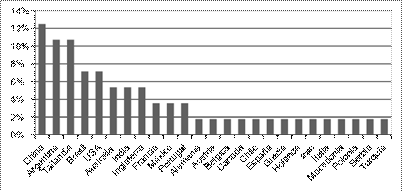
De los artículos seleccionados, el número de artículos publicados por año, los países con mayor número de artículos publicados y las revistas con mayor número de artículos se presentan en las Figuras 2, 3 y 4 respectivamente.
En la Figura 2, se puede observar que los años 2013, 2016 y 2017 representan el 50 % del total de las publicaciones realizadas durante la ventana de estudio (10 años). Por otro lado, los 5 primeros países con mayor número de artículos publicados son China (12,7 %), Argentina (10,9 %), Tailandia (10,9 %), Brasil (7,3 %) y USA (7,3 %) [Figura 3]. Respecto a las revistas donde están publicados los artículos, el mayor número de artículos publicados fue en la revista LWT Food Science and Technology (16,7 %), esta revista publica artículos relacionados con el campo de bioquímica, química de alimentos, microbiología y nutrición. La revista Drying Technology (14,6 %) ocupa el segundo lugar en publicación de artículos de esta revisión. Las revistas donde se encuentran los artículos seleccionados están categorizadas en los cuartiles Q 1 y Q 2 [Figura 4], [33]
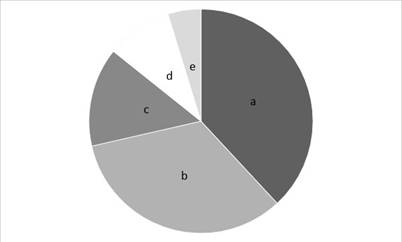
Figura 4 Revistas donde se publicaron los artículos incluidos.a) LWT-Food Science and Technology, b) Drying Technology, c) Food Research International, Journal of Functional Foods, d)Food and Bioprocess Technology, International Journal of Food Microbiology, Journal of Applied Microbiology, Journal of Dairy Science y e) otras.
3.2 Análisis de información
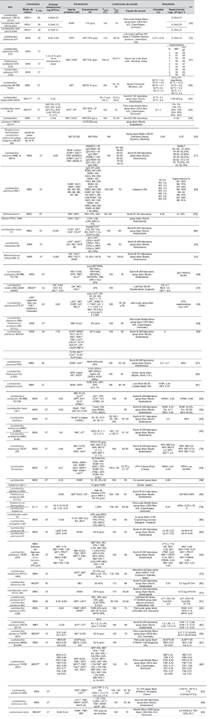
El análisis de los datos obtenidos de los artículos que cumplieron con los diferentes criterios de selección, fueron integrados y analizados en cuatro temáticas específicas: Microorganismos (Bacterias ácido lácticas-BAL), agentes protectores, condiciones del proceso de secado por aspersión y productos secos obtenidos. Los resultados se presentan en la sección de Anexos.
3.3 Microorganismos
Los microorganismos reportados en los artículos seleccionados pertenecen a los géneros Lactobacillus, Lactococcus, Pediococcus, Streptococcus y Bifidobacterium. De estos géneros, Lactobacillus fue el género más investigado, representando el 87 % de los artículos encontrados, a su vez, las especies de Lactobacillus más estudiadas fueron L. plantarum, L. acidophilus, L. rhamnosus y L. casei con un porcentaje de 31 %, 13 %, 11 % y 10 % respectivamente (Ver tabla en la sección Anexos).
El medio de cultivo que más se ha utilizado para el crecimiento de las BAL fue el Man Rogosa y Sharpe-MRS, dado que es específico para las BAL; sin embargo, el MRS es un medio de cultivo costoso y su uso se limita al trabajo en escala de laboratorio. Como alternativas, algunos autores proponen el uso de lactosuero [34],[35],[36], extractos de jugos de fruta [37],[38],[39],[40],[41], leche descremada [42] y agua de coco [7].
Según (34), utilizaron lactosuero concentrado (20 % p/v) suplementado con extracto de levadura (0,5 %) para el crecimiento de Lactobacillus reuteri DSM 20016 en un biorreactor a escala de laboratorio (Biostat A, Sartorius Ltd., Melsungen, Germany) y encontraron que después de 72 horas de cultivo hubo un aumento de 5 unidades logarítmicas con el suplemento empleado [34].
En estudios realizados como los de [35], utilizaron lactosuero dulce a diferentes concentraciones (5 40 % p/p) y evaluaron la peptona de caseína (0,5 % p/p) como suplemento del medio de cultivo. Encontraron que la concentración final de L. casei BL23 en el medio de cultivo suplementado fue mayor que sin suplemento. Sin embargo, en la concentración de lactosuero al 40 % no se encontraron diferencias estadísticamente significativas respecto a la concentración del 30 % de lactosuero [35].
En [39], utilizaron como medio de cultivo para el crecimiento de L. plantarum TISTR 2075 glucosa a diferentes concentraciones (1, 5, 10, 15 y 20 % p/v) y extracto de lágrimas de Job (Coix lacryma-jobi). Los autores encontraron diferencias estadísticamente significativas en el recuento celular del extracto de lágrimas de Job con y sin glucosa. Además no encontraron diferencias en los recuentos de L. plantarum TISTR 2075 entre las concentración de glucosa de 10, 15 y 20 % [39].
Con relación a la temperatura de crecimiento, las BAL se consideran mesófilas. La Tabla, que se encuentra en la sección Anexos, presenta los rangos de las temperaturas de crecimiento empleadas en los artículos seleccionados, las cuales se encontraron entre 25 y 43 ºC [36],[43]. Sin embargo, las temperaturas más frecuentes fueron de 37, y 30 ºC con 77 % y 17 % de hallazgos, respectivamente.
Otra condición importante para la producción de biomasa de BAL es la composición de la atmósfera de cultivo, la cual puede ser aeróbica, anaeróbica o microaerofílica; el 15 % de los artículos seleccionados reportan las condiciones de la atmósfera de cultivo. El crecimiento de las BAL puede darse en condiciones anaeróbicas o microaerofílicas.. Sin embargo, algunos autores han estudiado el crecimiento de las BAL en condiciones aeróbicas [44],[45].
En [44], se desarrolla un jugo de zanahoria funcional al adicionarle L. casei-01, El crecimiento de L. casei-01antes del proceso de secado por atomización fue obtenido en caldo MRS a 37 ºC en condiciones aeróbicas durante 24 horas, el cultivo alcanzó una concentración de 10,5 ± 0,2 log10 UFC/mL [44], esta concentración celular fue similar a la reportado por Chaikham y colaboradores en condiciones anaeróbicas [46].
El efecto del crecimiento en condiciones aeróbicas o anaeróbicas ha sido reportado en [45], allí se evaluó el crecimiento de L. rhamnosus 64, en un medio de cultivo optimizado, compuesto por lactosuero suplementado con extracto de levadura (2,5 g/L), triptona (2,5 g/L), MgSO 4 (2 % p/v) y MnSO 4 (0,4 % p/v), en condiciones anaeróbicas- AN (N 2 0.1 volumen de aire por volumen de medio por tiempo- vvm) y aeróbicas- AE (0.1 vvm). Las condiciones aeróbicas dieron como resultado una disminución significativa (p < 0,001) del rendimiento de la velocidad máxima de crecimiento- u max (0.355 AN y 0.292 AE), biomasa (3.05 AN y 2.82 AE) y conteo final de células (10.1 AN y 9.7 AE log10 UFC/mL). El tiempo de duplicación en la fase de crecimiento exponencial fue de 1.95 h y 2.37 h en condiciones anaeróbicas y aeróbicas, respectivamente [45]. Estos resultados muestran que existen diferencias en el crecimiento dada la transferencia de gases a las cuales estén sometidos los microorganismos.
En [47], se evaluó el lactosuero concentrado para aumentar la biomasa y la viabilidad celular en el proceso de secado por atomización de L. plantarum CIDCA 83114. Los microorganismos se cultivaron en caldo MRS a 37 ºC en condiciones aeróbicas, la fase estacionaria alcanzó un recuento de aproximadamente 13 log10 UFC/mL. Esta concentración celular fue la más alta encontrada en la revisión sistemática [47].
Finalmente, la etapa de crecimiento en la cual se encuentra el microorganismo es importante antes de llevar a cabo el proceso de secado por atomización. Comúnmente los microorganismos que se encuentran en la fase estacionaria temprana son utilizados para comenzar los procesos de down stream (etapas después de la producción de biomasa en el biorreactor). Cuando las bacterias están en la fase estacionaria desarrollan una resistencia al estrés, que perdura hasta el procesamiento y almacenamiento, probablemente debido al agotamiento de los alimentos disponibles se pueden desencadenar respuestas ante el estrés para permitir la supervivencia de la población celular [12].
En [48] se comparó la supervivencia de L. acidophilus NCIMB 70225 en el proceso de secado por atomización utilizando la etapa de crecimiento exponencial (mid-log phase) y estacionaria temprana. Ellos encontraron que las células de L. acidophilus NCIMB 70225 en fase estacionaria temprana presentaron tasas de supervivencia significativamente mayores que las células en fase exponencial, incluso durante el almacenamiento [48]. El 38 % de los artículos seleccionados utilizaron la etapa estacionaria de crecimiento (stationary phase) en los procesos de secado por atomización, el resto de artículos seleccionados no reportan la etapa de crecimiento en la cual se llevó a cabo los experimentos [31],[34],[49],[50],[51].
3.4 Agentes protectores
Las BAL pueden perder viabilidad en los procesos de secado, dadas las condiciones de estrés a las cuales son expuestas. Con el fin de reducir la pérdida de viabilidad, se pueden adicionar agentes protectores antes del proceso de secado [27], donde sus principales características son: i- ser inocuos, ii- ser de bajo costo, iii- estar a una concentración adecuada, iv- mejorar la supervivencia y además conservar las características del microorganismo (probiótico o cultivo iniciador), durante el proceso de secado y posterior almacenamiento [26].
Se han establecido dos hipótesis para explicar el efecto del agente protector para preservar la viabilidad de las células durante el proceso de secado: la vitrificación y reemplazo del agua [52]. En la vitrificación, a medida que se elimina el agua de las células, los agentes protectores que se encuentran en suspensión se concentran favoreciendo el cambio de estado de las células encapsuladas, es decir la evaporación rápida del agua de la microgota confiere o favorece la formación del material en estado vítreo. El estado vítreo se caracteriza por una alta viscosidad y los procesos de difusión y movilidad se ralentizan; por lo tanto, las células microbianas presentan una mayor estabilidad física y química [53].
La hipótesis de reemplazo de agua establece que en condiciones de hidratación, la integridad de las membranas y proteínas, se estabilizan por la interacción con el agua, principalmente en los puentes de hidrógeno que se establecen entre los compuestos; tras la eliminación del agua, los grupos polares de los agentes protectores pueden sustituir a las moléculas de agua favoreciendo su conservación [54].
La revisión identificó una amplia variedad de agentes protectores para el proceso de secado por atomización (Ver tabla en la sección Anexos), encontrándose con mayor frecuencia la leche en polvo descremada (RSM), el lactosuero en polvo (WPI) y la maltodextrina (MD) con diferentes equivalentes de dextrosa (entre 10 y 20) [26],[27].
Por otro lado, la revisión identificó que los carbohidratos simples que preferiblemente se utilizan como agentes protectores son: lactosa (leche en polvo descremada o lactosuero), sacarosa, fructo-oligosacáridos, galacto-oligosacáridos, glucosa, sorbitol, manitol, xilosa, trehalosa, dextrano y maltodextrina [55].
La leche en polvo descremada está compuesta de lactosa y proteínas de la leche; estos dos compuestos pueden prevenir la lesión celular al estabilizar los constituyentes de la membrana celular [36],[56],[57],[58],[59]. Además, pueden formar un recubrimiento protector en la pared celular bacteriana cuanto interactúan con el calcio. En [60], investigaron el efecto del calcio sobre la lactosa en la viabilidad de tres cepas de Lactobacillus y una de Streptococcus thermophilus. Los resultados mostraron que entre 5 y 10 mM de calcio aumentaban la resistencia al calor de las cepas de BAL y se producía una mayor supervivencia y reducción en el tiempo de adaptación de las células de BAL, dado que el calcio en la leche puede causar agregación de la proteína de la leche durante el tratamiento térmico [60].
Por otro lado, El lactosuero obtenido como un subproducto de la fabricación del queso, tiene un efecto potencial sobre las características del polvo obtenido (ejemplo. solubilidad, fluidez, dispersabilidad, etcétera.). Probablemente, el lactosuero protege las bacterias mediante el acoplamiento a la proteína de suero de leche, lo cual provoca que las células se incrusten dentro de las paredes de las cápsulas que se forman [61].
Otros agentes protectores utilizados son los solutos u osmolitos compatibles [49],[55],[62],[63]; que son considerados pequeños compuestos orgánicos que no interfieren con las funciones celulares y se usan para el ajuste osmótico. Estos compuestos juegan un papel más allá del ajuste osmótico, ya que actúan en la protección de la membrana celular y proteínas durante los procesos de secado [26]. Los solutos compatibles incluyen aminoácidos (glutamato, prolina), aminas cuaternarias (betaína, carnitina) y algunos azúcares (sacarosa, trehalosa). La presencia de solutos compatibles en BAL puede ayudar a las células a adaptarse al estrés hiperosmótico que se produce durante el proceso de secado. Como el tiempo de permanencia dentro de la cámara de secado es corto, los solutos compatibles deben ser acumulados por las BAL durante su crecimiento celular para que las células capten el soluto deseado.
Además de agentes protectores mencionados previamente, se encontró el uso de gelatina [31], goma arábiga [36],[37],(64), jugo de fruta [65], almidón [45],[66], etcétera. (Ver tabla en la sección Anexos).
Otro aspecto importante en los agentes protectores es el porcentaje de sólidos totales en la formulación. Los artículos seleccionados reportan que entre el 20 % y 30 % (p/v) es un valor adecuado para asegurar la alta viabilidad postsecado de diferentes cepas de BAL (Ver tabla en la sección Anexos).
En [36], evaluaron diferentes concentraciones de sólidos en la formulación de alimentación del secado por atomización de Lactobacillus plantarum LPS 47 y concluyeron que el uso de 20 % o 30 % (p/v) en el contenido sólido no produjo diferencias significativas en el rendimiento (36,1 % y 36,8 %, respectivamente) o humedad (3,9 % y 4,0 %, respectivamente). En contraste, con el uso de 40-50 % (p/p) que resultó en un efecto negativo en ambos casos [36].
3.5 Secado por atomización
Durante el secado por atomización las células están expuestas a diferentes tipos de estrés. El estrés térmico, el estrés de esfuerzo cortante, el estrés osmótico y el estrés oxidativo que causan la inactivación celular durante el secado por atomización [45],[67],[68],[69].
Durante el secado de la formulación, el daño a los microorganismos se da por la afectación de la membrana citoplasmática al cambiar su fluidez, el cambio en el potencial electroquímico o en el estado físico, la peroxidación de los lípidos o, en el caso de las macromoléculas se puede provocar un daño en las unidades monoméricas, destruyendo estructuras celulares esenciales como el ADN, el ARN y los ribosomas [37],[56].
Un estudio presentado en [16] expuso con detalles los daños producidos durante el proceso de secado por atomización, los cuales se dan en varias estructuras de la célula. La remoción de agua debido al rompimiento de los puentes de hidrógeno en la cabeza de la bicapa fosfolipídica de la membrana citoplasmática incrementa el empaquetamiento de los grupos de cabeza y obliga a las cadenas de alquilo a invertirse. Como consecuencia, el componente lipídico puede experimentar una transición de fase laminar a una fase de gel o hexagonal y las cadenas de fosfolípidos pueden volverse rígidas y completamente extendidas [16].
Otras estructuras celulares que se afectan durante el secado por atomización son los ácidos nucleicos y los ribosomas, los cuales probablemente se dañan como resultado de una liberación de magnesio (Mg +2), que afecta la actividad metabólica [12].
Una estrategia utilizada para mejorar la supervivencia durante el secado por atomización es la exposición de las células de BAL a condiciones subletales desde la etapa de crecimiento; así de esta forma, los microorganismos pueden adaptarse a las condiciones de estrés, dando como resultado, una mejora en su viabilidad [31],[65],[68],[70],[71],[72].
En [71], evaluaron el efecto de los agentes protectores utilizados en la formulación, adaptación al calor y la temperatura de salida (entre 70 y 100 ºC) para el secado por atomización de L. salivarius NRRL B-30514. Ellos concluyeron que 50 ºC es la temperatura sub-letal de los agentes protectores durante 15 minutos para los tratamientos de adaptación al calor [71].
Las condiciones de operación que se deben tener en cuenta durante el proceso de secado por atomización son: temperatura de entrada y salida de la cámara de secado, temperatura de alimentación a la cámara de secado, flujo de alimentación, flujo de aire, presión del aire atomizador, tipo de atomización, velocidad del disco rotatorio atomizador, presión de la boquilla de atomización, tiempo de retención en la cámara de secado, entre los más mencionados [28].
De las condiciones de operación mencionadas anteriormente, la temperatura de entrada y salida de la cámara de secado son las más estudiadas. El rango de la temperatura de entrada de los artículos revisados estuvo entre 80 y 180 ºC [25],[70],[73],[74], mientras que los rangos de la temperatura de salida fueron entre 40 y 100 ºC [51],[71]. El aumento de la temperatura de salida disminuye la viabilidad celular, dado que esta temperatura se encuentra por encima de la temperatura que los microorganismos pueden soportar [16],[24].
En [70], encontraron que las condiciones óptimas de proceso, durante el secado por atomización para Bifidobacterium bifidum PTCC 1644 fueron temperatura del aire de entrada (111.15 ºC), presión de aire (4.5 bar) y concentración de maltodextrina (6 %) (Ver tabla en la sección Anexos). Ellos concluyeron que, la temperatura del aire en la cámara de secado, presenta mayor efecto sobre la humedad residual y la supervivencia de los productos secos de Bifidobacterium bifidum PTCC 1644 obtenidos. Además, concluyen que la temperatura de salida de la cámara de secado no debe superar los 75 ºC ni tampoco debe bajar de 60 ºC, ya que los el producto seco de BAL podría terminar con un alto contenido de humedad (hasta un 7 %) [70].
De igual modo, Koc y colaboradores (2010), evaluaron el efecto de la temperatura de entrada (150-180 ºC), la temperatura de salida (60-90 ºC) y la temperatura de alimentación (4-30 ºC) durante el secado por atomización de S. thermophilus y L. bulgaricus. Ellos encontraron que las condiciones óptimas de operación fueron de 171 ºC, 60,5 ºC y 15 ºC para las temperaturas de entrada, salida y alimentación, respectivamente; además concluyen que sólo la temperatura de salida de la cámara de secado tuvo diferencias estadísticamente significativas en su proceso [74].
Con relación a la presión de atomización, en [36], encontraron que la presión ejerce un efecto directo sobre el diámetro y la cohesión de las partículas, lo cual tiene un impacto en el rendimiento del proceso de secado por atomización. Ellos evaluaron para el secado de Lactobacillus plantarum LPS 473, tres presiones de atomización (1, 2 y 3 bar) y encontraron que esta no afecta la humedad de los polvos bacterianos ( 4,6 %), pero sí afecta el rendimiento del producto. Cuando el sistema opera a baja presión (1 bar), las gotas generadas fueron de mayor tamaño y mayor humedad, provocando mayor adhesión en las paredes de la cámara y una disminución significativa en el rendimiento (4,4 %). Por otro lado, a presión alta (3 bar), las partículas fueron más pequeñas, mejorando su rendimiento (18,9 %). La viabilidad del microorganismo no se vio afectada con una presión entre 2 y 3 bar [36].
Respecto al flujo de alimentación, en [65], evaluaron el efecto de la temperatura de entrada (100, 115 y 130 S), la relación sólidos maltodextrina: sólidos totales (1:1, 1:1,5 y 1:2) y el flujo de alimentación (10, 15 y 20 mL/min) durante el proceso de secado por atomización de Lactobacillus acidophilus NRRL B-4495 y Lactobacillus rhamnosus NRRL B-442 (Ver tabla en la sección Anexos). La recuperación del producto varió entre el 25 y 55 %, dependiendo de la relación sólidos maltodextrina: sólidos totales y de la velocidad del flujo de alimentación. Las condiciones óptimas obtenidas fueron temperatura de entrada de 100 ºC, relación de sólidos maltodextrina: sólidos totales 1:1 y una velocidad de alimentación de entrada de 40 mL/min, siendo los criterios de optimización maximizar la recuperación (48,79 %) y la supervivencia (81,17 %). Los autores concluyen que una velocidad de alimentación más rápida no es suficiente para el secado completo, lo que reduce el % de recuperación [65].
Por otra parte, en estudios como [63], se evaluó el efecto del flujo de aire caliente de entrada a la cámara de secado (275 y 367 m 3 /h), lo cual está asociado con el tiempo de residencia de la partícula, concluyendo que la disminución del tiempo de residencia (mayor flujo de aire), no influyó sobre la supervivencia de L. fermentum a una temperatura de aire de 170 ºC [63].
Con relación a la escala de los equipos utilizados en las investigaciones, se resalta que el 67 % de los artículos trabajaron con equipos a escala de laboratorio y el 19 % con equipos a escala de planta piloto.
Respecto a la atomización en el equipo de secado por aspersión, esta puede ser por boquilla atomizadora o por disco rotatorio, según el tipo de atomización a utilizar, se cambia la geometría de la cámara de secado [28]. En los artículos seleccionados y revisados no todos reportan el tipo de atomización y solo se evidenció el uso de boquilla atomizadora.
3.6 Características de los productos deshidratados de BAL obtenidos
El objetivo del secado por atomización es la disminución de la actividad de agua (a w ), lo cual implica una disminución del contenido de humedad, haciendo que las células se encuentren en un estado de anhidrobiosis [12]. Una adecuada a w es necesaria para la estructura celular y estabilización de las reacciones bioquímicas en las células [72],[75]. El contenido de agua requerido por las BAL es de aproximadamente 0.5 g H 2 O/g de peso seco, para un normal desarrollo fisiológico, mientras que un valor debajo de 0.1 g H 2 O/g de peso seco, es el contenido de agua que se necesita para el almacenamiento a largo plazo [24].
Los autores del estudio expuesto en [71], obtuvieron durante el secado por atomización de L. salivarius NRRL B-30514, un producto con una a w entre 0,109 0,246, y concluyen que por debajo de 0,250 se mantiene la viabilidad de las bacterias secas durante el almacenamiento [71]. Similar a este resultado, Estudios recientes [76], concluyeron que todas las formulaciones de Lactobacillus rhamnosus CETC 275 fueron estables a una a w < 0,430; adicionalmente, las formulaciones con a w de 0,110 presentaron el mejor recuento celular [76]. La a w se puede controlar con la temperatura de entrada de la cámara de secado, una temperatura de entrada más alta resulta en una menor a w [61],[77].
Así como la a w en el producto seco es importante para la estabilidad fisicoquímica, la humedad también juega un papel importante en el estado de la materia. En la revisión sistemática se encontró que la humedad de los productos secos obtenidos de las BAL estuvo por debajo del 10 % (Ver tabla en la sección Anexos); mientras que, una humedad inferior al 2 %, puede aumentar el riesgo de oxidación de los ácidos grasos insaturados en la membrana celular de las bacterias y puede destruir las unidades de hidratación alrededor de estos ácidos grasos [67]. En [25], evaluaron el efecto del secado por atomización y liofilización en células de Lactobacillus plantarum UFV-Lb26; encontrando que, contenidos de humedad entre 4 y 7 % favorece al producto seco [25].
Otro factor a tener en cuenta en los estudios de estabilidad de los microorganismos secos es la temperatura de almacenamiento. Las temperaturas de almacenamiento encontradas oscilan entre 4 y 25 ºC [40],[47],[61],[63]. En [40], evaluaron la estabilidad y propiedades probióticas de L. plantarum TISTR 2075 después del secado por atomización. Ellos concluyeron que las temperaturas de almacenamiento más altas indujeron una mayor pérdida de la viabilidad del microorganismo en todos los agentes protectores evaluados. Además, el aumento de la humedad relativa (HR) fue proporcional a la pérdida de viabilidad. Los resultados sugieren que el uso de agentes protectores como maltodextrina con la adición de proteína o trehalosa podrían considerarse adecuados para el almacenamiento de los productos secos de BAL por debajo de 23 y 33 % de HR a 25 ºC [40].
En otro estudio de almacenamiento presentado en [49], encontraron la mayor supervivencia para L. rhamnosus GG después de 28 semanas a 4 ºC, condición que se alcanzó en Buffer fosfato alkalino- PBS con 1,25 % de lactosa o trehalosa. Ellos sugieren que la temperatura de almacenamiento debe estar entre 10-20 ºC menos que la temperatura de transición vítrea (Tg). Si no se cumple esta condición la matriz experimenta un cambio del estado vítreo al fluido, donde la movilidad molecular es menos restringida, lo que es perjudicial para la viabilidad de las células de BAL [49].
Finalmente, la supervivencia medida en términos de recuento celular o porcentaje de supervivencia, depende de diversos factores, los cuales han sido expuestos en esta revisión, destacándose principalmente las condiciones de operación del secado por atomización y los agentes protectores. La supervivencia al proceso de secado ha sido considerada como cepa dependiente; es decir, se debe posiblemente al origen de su aislamiento, presencia de genes específicos, interacciones con el agente protector, o la capacidad de acumular polifosfatos y la producción de exopolisacáridos, etcétera [6].1
4 Conclusiones
En esta revisión sistemática se trataron cuatro temas relacionados con el proceso de secado por atomización de BAL. El primer tema se relacionó con los microorganismos y sus condiciones de crecimiento en donde se encontró que el género Lactobacillus es el más estudiado y el medio MRS el más utilizado a escala de laboratorio; el segundo tema se relacionó con los agentes protectores utilizados en donde se evidenció que se han estudiado solos o en mezcla y que una concentración entre el 20 30 % de sólidos totales fue la que mayor supervivencia se reportó en los artículos; el tercer tema abarcó el secado por atomización donde se concluye que las temperaturas de entrada y salida han sido las más estudiadas, sin embargo, otras condiciones de operación se pueden establecer para mejorar la viabilidad durante el proceso de secado; finalmente el cuarto tema abarcó las características de los productos en polvo obtenidos, donde se recopiló la información sobre los resultados físico-químicos y microbiológicos, entre los cuales se encuentra la humedad final, la a w , la temperatura de transición vítrea y el % de supervivencia.
El secado por atomización aunque expone a las células a diferentes tipos de estrés, es una alternativa para el secado de BAL, ya que se encontraron porcentajes de supervivencia de hasta el 99 % [51]. Es importante considerar la influencia de las condiciones del proceso o variables independientes; así como también, se deben optimizar las condiciones del crecimiento del microorganismo y si es necesario una adaptación de las BAL al estrés antes del secado, puede mejorar la supervivencia del microorganismo.
Con esta revisión se evidencia que los estudios de secado por atomización se han realizado principalmente a nivel de laboratorio; son escasos los artículos de secado por atomización en planta piloto o industrial los cuales son importantes para la evaluación de la factibilidad del escalado de procesos y no se profundiza en los modelos matemáticos cinéticos de muerte celular que podrían ayudar a proponer estrategias de diseño y control en el proceso de secado.