Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Diversitas: Perspectivas en Psicología
Print version ISSN 1794-9998
Divers.: Perspect. Psicol. vol.12 no.2 Bogotá July/Dec. 2016
https://doi.org/10.15332/s1794-9998.2016.0002.08
Efectos de la exposición prenatal a cocaína en la conducta emocional en ratones*
Effects of prenatal cocaine administration on emotional behavior in mice
María del Pilar Santacruz Ortega**, Rosario J. Marrero Quevedo***, Juan Manuel Bethencourth Pérez***, Miguel Ángel Castellano Gil***, Wenceslao Peñate Castro***
* Artículo de investigación financiado por la Universidad Católica de Colombia.
http://dx.doi.org/10.15332/s1794-9998.2016.0002.08
** Universidad Católica de Colombia.
Correspondencia: María del Pilar Santacruz Ortega, Facultad de Psicología, Universidad Católica de Colombia. Dirección postal: avenida Caracas # 46-72, Bogotá, Colombia.
Correo electrónico: mpsantacruz@ucatolica.edu.co.
*** Universidad de La Laguna, España
Recibido: 20 de mayo de 2016 / Revisado: 3 de junio de 2016 / Aceptado: 13 de junio de 2016
Resumen
El objetivo de este estudio fue analizar los efectos de la Exposición Prenatal a Cocaína (EPC) (0,25 o 50 mg/kg/día) en la conducta emocional de ratones hembras y machos en la adolescencia y la adultez temprana. Se asignaron 27 ratones CD1 hembras gestantes a 3 condiciones experimentales: un grupo control que se le administró solución salina y 2 experimentales a los que se le administró cocaína 25 mg/ kg/día y 50 mg/kg/día, desde el día octavo al veintiunavo de gestación. La conducta emocional de los hijos de estas madres se evaluó en la adolescencia y en la adultez temprana (5.a y 7.a semana de edad, respetivamente) por medio del tablero de agujeros y el laberinto en cruz a través de diferentes índices de actividad exploratoria. Los datos se analizaron por medio de MANOVAS y ANOVAS con un valor a de 0.05. La EPC alteró de forma dosis-relacionada la conducta emocional; los sujetos sometidos a EPC 50 mg/kg/día exhibieron mayor ansiedad y temor, en cambio los tratados con EPC 25 mg/kg/día exploraron más, mostrando conductas de alto riesgo, características de la impulsividad e hiperactividad. Los efectos encontrados se mantuvieron en el tiempo, por lo que se concluye que la EPC perturbó permanente y significativamente la emoción.
Palabras clave: Exposición Prenatal a Cocaína, conducta emocional, ansiedad-exploración.
Abstract
In order to study the effects of prenatal cocaine exposure (0, 25 or 50 mg/kg/day), on the emotional behavior of young and adult mice of both sexes, 27 CD1 pregnant female mice were assigned to one of three experimental conditions: a control group was given saline solution, a first experimental group that was given 25 mg/kg/day of cocaine and another experimental group with 50 mg/kg/day of cocaine, all between gestational days 8-21. Emotional behavior was evaluated in the offspring (both males and females) of the females at five and seven weeks of age, via the hole board followed by the plus maze with different rates of exploratory activity. Data were analyzed with MANOVAS and ANOVAS with and a of 0.05. Prenatal Cocaine Exposure (PCE) altered dose-related emotional behavior; subjects with PCE of 50 mg/kg/day exhibited more anxiety and fear, in contrast to the 25 mg/kg/day group that explored more and showed greater high-risk behaviors, which are features of impulsivity and hyperactivity. The effects found were maintained over time, so it is concluded that PCE permanently and significantly perturbed emotion.
Keywords: Prenatal Exposure to cocaine, emotional behavior, anxiety-exploration.
Introducción
La tendencia al incremento del consumo de cocaína durante la gestación observada en la última década, ha alertado al personal de la salud por las numerosas malformaciones congénitas asociadas a la Exposición Prenatal a Cocaína (EPC) o a los efectos teratogénicos (UNODC, 2005). Estas malformaciones son producto de las perturbaciones biológicas causadas por la cocaína en interacción con el ambiente adverso en el que se desarrolla el infante (Ackerman, Riggins y Black, 2010). Este ambiente se produce por la droga (intrauterino) y por el entorno disfuncional que caracteriza a una madre adicta, con familias desestructuradas, ambientes conflictivos, violentos, pobreza, entre otros, que hacen que el infante se desarrolle en condiciones ambientales negativas desde épocas pre y posnatales (Golbach, 2005; Morrow et al., 2009; Lewis, 2015).
Las numerosas malformaciones encontradas se podrían agrupar en estructurales, bioquímicas y funcionales (Eiden, Schuetze y Coles, 2011; Golbach, 2005; Linares et al., 2006; Loredo-Abdala et al., 2014; Nnadi et al., 2005) que a su vez se podrían concentrar en los dominios motores, cognoscitivos, emocionales y conductuales (Eiden, Schuetze y Coles, 2011; Finger, Schuetze y Eiden, 2015; Lester y Padbury, 2009; Sithisarn, Bada, Dai, Randall y Legan, 2011). Aunque muchas de estas pueden pertenecer a más de un dominio como el déficit atencional con y sin hiperactividad que presenta alternaciones motoras, cognoscitivas, emocionales y conductuales.
Las alteraciones en la emoción a consecuencia de la EPC podrían explicarse por la inadecuada modulación neuroendocrina que se manifiesta en la respuesta al estrés; revelando una deficiente capacidad de controlar la conducta y regular la emoción como respuesta a las demandas ambientales (Ackerman et al., 2010; Chaplin et al., 2014; Chrousos y Kino, 2009; Eyler et al., 2009; Morrow et al., 2009). Es así como se puede encontrar deficiencias en la función ejecutiva, agresión, conductas de alto riesgo, impulsividad, temperamento difícil, déficit atencional con/sin hiperactividad, desorden desafiante oposicional, alta reactividad al estrés, diversos trastornos de ansiedad y una alta comorbilidad con la drogodependencia (Ackerman, Riggins y Black, 2010; Chaplin et al., 2014; Lester y Padbury, 2009; Sinha, 2008). Sin embargo, la concurrencia de numerosos factores de riesgos biológicos y ambientales impide aclarar las consecuencias de la EPC en el neurodesarrollo humano. Una herramienta muy útil para salvar estas dificultades es el estudio con modelos animales, ya que permiten controlar las variables esenciales en la teratogenia de la cocaína y proporcionan información sobre los mecanismos y las consecuencias de la EPC en el neurodesarrollo.
Existen numerosos modelos animales que evalúan la ansiedad, donde se confronta al animal con una situación ansiogénica (de variada intensidad) para analizar cómo responde a dicha situación (Costa-Goes, Dias-Antunes y Teixeira-Silva, 2009). Una de las formas más leves de estrés es la exposición a un conflicto que se realiza con los modelos de conducta exploratoria. Estos se basan en la tendencia natural de los roedores a explorar los ambientes novedosos. La exploración al ambiente les facilita la localización de los recursos (alimentación, refugio, oportunidades de apareamiento...) y les previene de los peligros (riesgo de predación, agresión de sus coespecíficos...). De esta forma la exploración refleja cómo el animal maneja su ambiente y por ende su capacidad de adaptación (Brown y Nemes, 2008; Konsolaki y Skaliora, 2015; Laarakker, Ohl y Van Lith, 2008).
La conducta exploratoria es el producto del balance entre dos tendencias contrapuestas: las neofílicas, o sea la exploración basada en la curiosidad; y las neofóbicas, es decir, la evitación de la exploración por miedo (Hughes, 2007; Salomons et al., 2010). La mayor exploración en áreas abiertas e iluminadas se relaciona inversamente con la ansiedad (Laarakker, Ohl, y Van Lith, 2008) y con una mayor capacidad de asumir riesgos (Bailey y Crawley, 2009; Crawley, 1985, Konsolaki y Skaliora, 2015; Mechan et al., 2002, 2007; Walf y Frye, 2007).
El tablero de agujeros, el laberinto en cruz y el test de campo abierto evalúan la ansiedad a partir de la conducta exploratoria en un ambiente novedoso. En el test de campo abierto y el tablero de agujeros se analiza la exploración, la ansiedad, la evaluación del riesgo, la locomoción, la búsqueda de novedad y la activación (Hughes, 2007; Peña-Oliver, 2007). Y en el laberinto en cruz se valora separadamente la actividad locomotora y la exploratoria-ansiedad (Brunton, 2015; Korte y de Boerd, 2003; Mechan et al., 2007; Mechan et al., 2002).
Se ha estudiado el impacto de diferentes dosis de EPC sobre la conducta emocional en modelos animales. La EPC (6 mg/kg/día) en conejos adultos no alteró la conducta emocional evaluado mediante el test de campo abierto (Thompson, Levitt y Stanwood, 2005). Sin embargo, la EPC (2 mg/kg/día, por vía intravenosa i.v.), durante todo el periodo de gestación y la primera semana de lactancia, produjo en ratas hembras y machos prepúberes mayor ansiedad con el test de campo abierto, y únicamente los machos mostraron alta reactividad emocional en respuesta al estrés (Sithisarn et al., 2011). Hay que tener en cuenta que la administración i.v. supone implantar un catéter para la administración de cocaína durante todo el desarrollo pre y neonatal temprano. Este procedimiento no solo aumenta el estrés de la madre sino que las crías continúan recibiendo la droga durante el periodo neonatal temprano. Estos factores podrían confundir los efectos negativos de la droga sobre la ansiedad, aun en esta pequeña dosis de cocaína.
Dosis más altas de EPC (30 mg/kg/día subcutánea s.c.) produjeron ratas adultas más ansiosas, permanecieron menor tiempo en los brazos abiertos y exploraron en menor medida el área central abierta e iluminada del laberinto en cruz. Frecuentemente se apoyaron en las paredes del test de campo abierto prefiriendo la oscuridad-protección (Salas-Ramírez, Frankfurt, Alexander, Luine y Friedman, 2010). Los machos fueron más ansiosos que las hembras tratadas con la misma dosis de EPC, lo que implica mayor sensibilidad de los machos al tratamiento prenatal. Del mismo modo, Overstreet et al. (2000) encontraron una elevada reactividad al estrés evaluada en la magnificada respuesta de sobresalto a los estímulos acústicos en ratas prepúberes y adultas, expuestas durante toda la gestación a dosis de 30 mg/kg/día s.c. En este estudio no se encontraron efectos de la EPC en la ansiedad evaluada mediante el laberinto en cruz, lo que indica que la cocaína no afecta a las formas de ansiedad que se miden en este test.
Sobrian, Marr y Ressman (2003) encontraron que la EPC 40 mg/kg aumentó la exploración de las ratas en el laberinto en cruz, incrementó significativamente el porcentaje de tiempo de permanencia y de entradas en los brazos abiertos, al igual que con las tratadas prenatalmente con nicotina (5.0 mg/kg/día). Esta mayor exploración en los brazos abiertos unida a la permanencia y a la alta frecuencia de entradas a esa zona, se interpreta como impulsividad y conductas de alto riesgo. Estos efectos fueron más notables en las ratas hembras viejas, lo que hace suponer que la exposición prenatal a la cocaína afecta permanentemente la emoción. Sin embargo, la combinación de la EPC 40 mg/kg y nicotina 2.5 mg/kg no alteró la conducta emocional.
Huber, Darling, Park y Soliman (2001) con la misma dosis de EPC 40 mg/kg, encontraron alta ansiedad en ratas adultas y menor tolerancia al estrés, elevados niveles de corticoesterona en el plasma como respuesta al estrés y lento retorno a los niveles basales de esta hormona con el test de nado en agua helada, lo que indica una respuesta altamente desadaptativa. A los sujetos con EPC 40 mg/kg les inyectaron agonistas de los N-Metil-D-Aspartato (NMDA), que son los receptores del glutamato, neurotransmisor involucrado en el aprendizaje/memoria, el dolor y la atención, entre otros. Las ratas respondieron con hipoalgesia al test de retirada de la cola cuando se le aplicaba calor, e hiperalgesia en el test del plato caliente, medido en la latencia del retiro de las patas cuando se ponen en contacto con una superficie caliente. Estos resultados indicaron que la EPC alteró los receptores NMDA y aumentó la densidad de estos receptores en el hipotálamo y en el hipocampo (estructuras involucradas en la emoción y la cognición), por lo que la EPC causó numerosos daños neuroconductuales.
Las dosis mayores de EPC (60 mg/kg s.c.) trastornan fuertemente la conducta emocional de las ratas adultas. Estas tuvieron mayor latencia para explorar en la prueba del campo abierto y una alta reactividad emocional, como indicadores de elevados niveles de ansiedad (Magalhães et al., 2005).
Los estudios previos, por tanto, muestran los efectos tóxicos de la EPC en la conducta emocional con diferentes dosis. Sin embargo, aunque se supondría que estas perturbaciones se relacionan directamente con la dosis, en algunos casos estas producen resultados diferentes (efectos ansiolíticos o ansiogénicos). De modo que posiblemente el tiempo de exposición prenatal o posnatal a cocaína en combinación con la dosis, vía de administración y el tipo de modelo animal utilizado para evaluar la ansiedad, podrían estar incidiendo en los resultados encontrados. Además hay que apreciar que los estudios que utilizan más de una prueba conductual permiten determinar con mayor claridad los trastornos que la cocaína podría causar en el desarrollo emocional de los ratones hembra y de los macho.
De esta forma, en el presente estudio el objetivo fue determinar el impacto de la exposición crónica prenatal de cocaína (25 mg/kg/día y 50 mg/kg/ día s.c.), administrada a las madres desde el día 8 al 21 de gestación, en la conducta emocional-ansiedad de ratones CD1 hembras y machos adolescentes (5 semanas de edad) y adultos jóvenes (7 semanas de edad), evaluada mediante el tablero de agujeros y el laberinto en cruz.
Método
Diseño
Se utilizó un diseño experimental factorial de 3x2x2. Tres grupos con EPC (0,25 y 50 mg/kg/día); dos sexos, hembras y machos; y dos evaluaciones en la adolescencia y la adultez temprana.
Sujetos
Se contó con 27 ratones hembras gestantes de la cepa CD1 obtenidas en el Instituto Nacional de Salud, Bogotá D. C. Se asignaron 8 ratones hembra al grupo control, 9 al grupo de 25 mg/kg/día de cocaína y 10 al de 50 mg/kg/día de cocaína. Se mantuvieron individualmente en el Laboratorio de Psicología de la Universidad Católica de Colombia (LAPSUCC), en un ciclo 12/12 de luz/oscuridad, a una temperatura de 23° ± 2 °C y con libre acceso a agua y alimentación.
Para evaluar la conducta emocional de la descendencia de estas madres se utilizaron 20 ratones hembra y 20 ratones macho en cada grupo de EPC (0 mg/kg/día, 25 mg/kg/día, 50 mg/kg/día), con una muestra total de 120 sujetos. Los ratones se mantuvieron en condiciones gregarias desde el destete realizado a los 21 días de edad, cinco por caja-hogar, camada y sexo. Y en las mismas condiciones ambientales que las madres durante todo el tiempo del experimento.
Materiales e instrumentos
Soluciones: la cocaína fue donada por el laboratorio de análisis farmacéutico de la Universidad Nacional de Colombia. Las soluciones se administraron vía subcutánea (s.c.) en un volumen de 0.1 ml. Al grupo control se le administró solución salina al 0.9 % y a los grupos experimentales cocaína 25 mg/ kg y 50 mg/kg, disueltas en solución salina al 0.9 %.
Instrumentos
Tablero de agujeros: consiste en una caja de 40x40x30 cm con cuatro agujeros de 3 cm de diámetro en el área central. Se determinan los siguientes índices de actividad exploratoria-ansiedad: a) Locomoción periférica es el desplazamiento del ratón por los doce cuadros laterales del tablero; b) Locomoción central es el desplazamiento del ratón por los cuatro cuadros centrales del tablero; c) Autoaseo cuando el ratón se limpia su cuerpo mediante sus patas delanteras y su lengua; d) Erguidas cuando el ratón levanta sus patas delanteras sosteniéndose en sus patas traseras; e) Entradas a los agujeros cuando el ratón introduce la cabeza en algún agujero ubicados en el centro del tablero de agujeros; f) Tiempo en los agujeros se refiere al tiempo que el ratón permanece con su cabeza introducida en los agujeros; g) Excretas o número de bolos fecales.
Laberinto en cruz: es un laberinto formado por dos brazos abiertos de 5x30 cm y dos cerrados de 5x30x30 cm conectados en cruz por una zona de 5x5 cm y que se eleva del piso 38 cm. En esta prueba se observan: a) Entradas a los brazos abiertos y a los brazos cerrados, medida por la frecuencia de ingreso a los brazos sin paredes y a los brazos con paredes del laberinto, respectivamente; b) Tiempo en los brazos abiertos y en los brazos cerrados, que consiste en la permanencia (mlseg.) en los brazos sin paredes y en los brazos con paredes del laberinto; c) Porcentaje de permanencia en los brazos abiertos, que es el porcentaje del tiempo total (300 segundos) en que permanece en los brazos sin paredes.
Procedimiento
El experimento se llevó a cabo en el LAPSUCC. Después de distribuir a los ratones hembras gestantes en los tres grupos, se comenzó a administrar vía subcutánea (s.c.) cocaína 25 mg/kg/día, 50 mg/kg/día y solución salina/día, desde el 8.° hasta el 21.° día de gestación, mediante el método doble-ciego. Después del parto los hijos se criaron con su madre hasta el destete (a los 21 días de edad). Luego se separaron de cada camada las hembras y los machos y se mantuvieron en cada jaula 5 sujetos del mismo sexo y camada, con libre agua y alimentación. A las 5 semanas de edad se evaluaron individualmente, comenzando por el tablero de agujeros donde se colocaba el sujeto en el centro del tablero durante 5 minutos. Posteriormente, se le situaba en el centro del laberinto en cruz durante el mismo tiempo, el cual al igual que el otro instrumento estaba iluminado con una luz intensa. Se grababan en video los 5 minutos de cada prueba y después se limpiaba con agua y jabón inodoro el instrumento para el siguiente sujeto. Una vez realizadas las pruebas se les devolvía a la caja-hogar junto con sus congéneres. A las 7 semanas de edad, en la adultez temprana, se evaluó de la misma forma que la primera vez.
Resultados
Medidas de gestación
Mediante el ANOVA no se encontraron diferencias significativas entre las madres de las tres condiciones (0,25 y 50 mg/kg/día) ni en el peso antes [F(2,24)= 0.21; p= 0.811] y después del parto [F(2,24)= 0.181; p= 0.832], tampoco en el número de crías [F(2,24)= 2.64; p= 0.091], ni en el peso promedio de cada cría [F(2,24)= 1.22; p=0.312].
Conducta emocional
Para los diferentes índices de la conducta emocional evaluados en el tablero de agujeros y en el laberinto en cruz se usó el MANOVA, seguido del ANOVA y el post hoc se analizó con HDS Tukey, con un a =0.05, mediante el SSPS versión 20. El MANOVA (tomando como factores la EPC, el sexo y la edad y sus interacciones) resultó significativo para los diferentes grupos con EPC, los diferentes factores y también las interacciones (tabla 1). Por lo que posteriormente se realizaron distintos ANOVAS y el análisis post Hoc para identificar entre qué grupos se producían estas diferencias. En las figuras se presentan las diferencias significativas con la p<0.05* las comparaciones con el grupo control y con la p<0.05p o p<0.001AA las realizadas con el EPC 25 mg/kg/día.
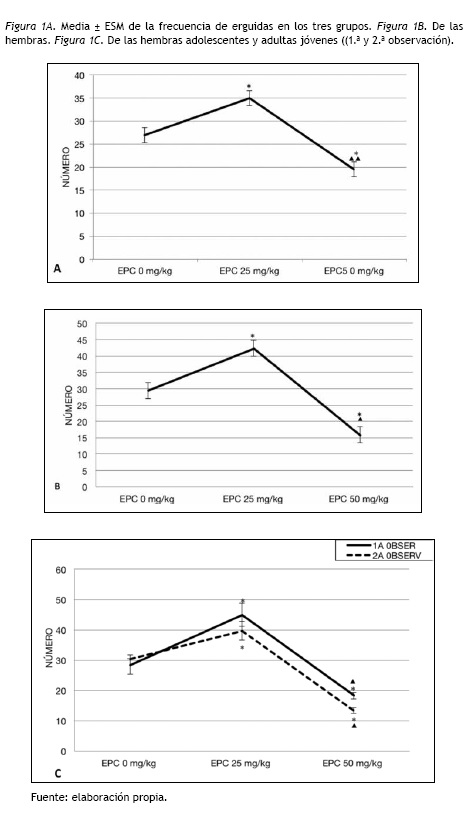
Erguidas
Se encontraron efectos principales significativos de EPC [F(2,114)= 23.89; p= 0.000]. El grupo EPC 25 mg/kg/día exhibió significativamente más erguidas que el control (p= 0.002) y que el EPC 50 mg/kg/día (p= 0.000). Este último grupo presentó significativamente menos erguidas que el control (p= 0.003), como se presenta en la figura 1A.
Dado que la interacción EPC y Sexo fue significativa, por medio del ANOVA se compararon las erguidas de los ratones hembras y machos. Solo en las hembras se encontraron diferencias significativas en función de la EPC [F(2,57)= 29.24; p= 0.000] (Fig. 1B). Los análisis post hoc indicaron que las hembras con EPC 25mg/kg/día mostraron significativamente más erguidas (p= 0.001) que las del grupo control y que las de EPC 50 mg/kg/día (p= 0.000). A su vez este último grupo presentó significativamente menos erguidas (p= 0.001) que el control (figura 1B).
También resultó significativa la interacción EPC y Edad, por tanto se realizaron ANOVAS en las erguidas de las hembras en las dos edades. Tanto en la adolescencia como en la adultez temprana, las hembras con EPC 25 mg/kg/día mostraron significativamente mayores erguidas [F(2,57)= 21.33; p= 0.000] que el grupo control (p= 0.001) y que el EPC 50 mg/kg/día (p= 0.000). Este grupo presentó menos erguidas que el control (p= 0.043) como se presenta en la figura 1C. Al igual que en la adultez temprana, las diferencias significativas de la EPC [F(2,57)= 34.36; p= 0.000] fueron por los altos niveles de erguidas de las hembras del grupo con EPC 25 mg/kg/día en comparación al control (p= 0.014) y al EPC 50 mg/kg/día (p= 0.000). Este último mostró significativamente menores erguidas (p= 0.000) que el control (figura 1C).
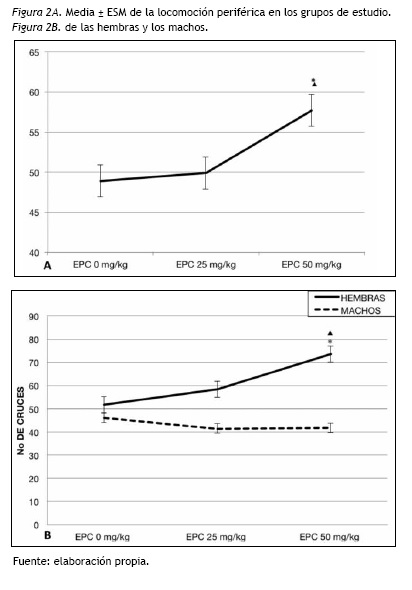
Locomoción periférica
Se encontraron diferencias significativas entre los EPC [F(2,114)= 5.89; p= 0.004]. El post hoc mostró que el grupo de EPC 50 mg/kg/día exhibió mayor locomoción periférica comparado con el de EPC 25 mg/kg/día (p= 0.017) y con el control (p=0.006). No aparecieron diferencias significativas entre el grupo control y el EPC 25 mg/kg/día (ver figura 2A).
Se encontró una interacción significativa entre EPC y Sexo [F(2,114)=10.81; p=0.000]. Al analizar la locomoción periférica en las hembras y en los machos se encontró que el efecto de EPC se limitó a las hembras [F(2,57)= 10.56; p= 0.000]. Las hembras del grupo de EPC 50 mg/kg/día mostraron mayor locomoción periférica que las del control (p= 0.000) y que las del EPC 25 mg/kg/día (p= 0.008), como se presenta en la figura 2B.
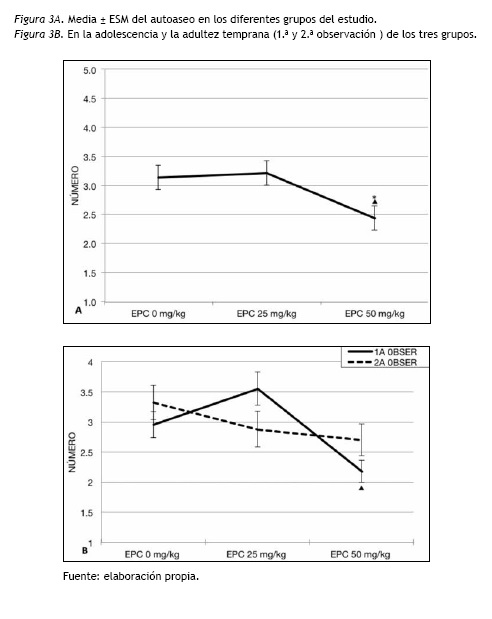
Autoaseo
Los resultados mostraron diferencias significativas entre los EPC [F(2,114)= 4.32; p= 0.015]. En los análisis post hoc se encontró que el grupo de EPC 50 mg/kg/día tenía menor autoaseo (p= 0.046) comparado con el grupo control y con el de EPC 25 mg/kg/día (p= 0.024). El grupo control y el tratado con EPC 25 mg/kg/día presentaron frecuencias similares de autoaseo (ver figura 3A).
Como la interacción EPC y la edad resultó significativa [F(2,114)= 4.56; p= 0.012), al analizarse mediante ANOVAS cada edad, únicamente en la adolescencia (1.a observación) se encontraron diferencias significativas entre los grupos de el EPC [F(2,114)= 5.87; p= 0.004). Los sujetos con EPC 50 mg/kg/día realizaron menor autoaseo que el grupo EPC 25 mg/kg (p= 0.003) pero no se encontraron diferencias con el grupo control (figura 3B).
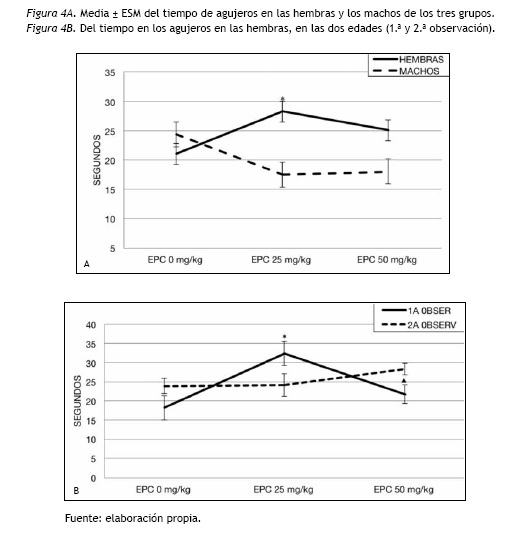
Tiempo en agujeros
Los resultados mostraron una interacción significativa EPC y Sexo [F(2,114)= 7.20; p= 0.001), al analizarse este índice separadamente en las hembras y los machos, el ANOVA mostró que en los machos se encontraron diferencias significativas entre los grupos de EPC [F(2,57)= 3.38; p= 0.041], aunque en el contraste post hoc no alcanzaron el nivel de significación preestablecido. En las hembras se observó un efecto significativo entre los grupos de EPC [F(2,57)= 4.23; p= 0.019]. Las hembras tratadas con EPC 25 mg/kg/día exploraron más tiempo los agujeros que las del grupo control (p= 0.014). Tal y como puede observarse en la figura 4A.
También se encontraron diferencias significativas en la interacción EPC y edad [F(2,57)= 4.88; p= 0.011] y al analizar separadamente cada edad, se encontraron diferencias significativas únicamente en la adolescencia entre los grupos de EPC [F(2,57)= 6.42; p= 0.003]. El de EPC 25 mg/kg/día exploró mayor tiempo los agujeros (p= 0.003) comparado con el control y con el EPC 50 mg/kg/día (p=0.038), como puede observarse en la figura 4B.
Entradas a los agujeros
Los resultados mostraron interacciones significativas de EPC y edad [F(2,114)= 5.52; p= 0.005] y EPC y Sexo [F(2,114)= 6.64; p= 0.002], por lo que se aplicaron ANOVAS separados para cada factor.
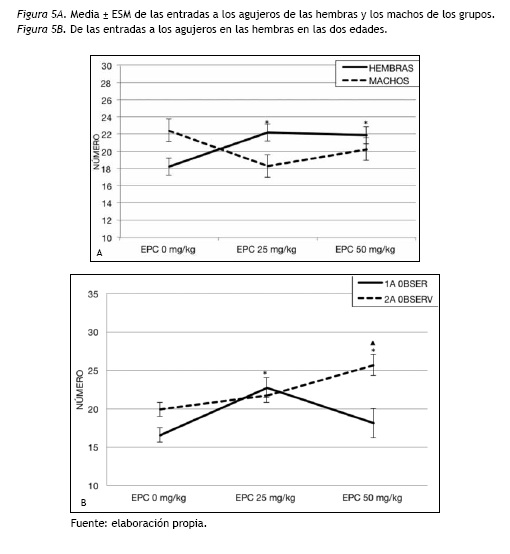
Al analizar las entradas a los agujeros de las hembras y de los machos, solo se encontraron diferencias significativas entre las hembras de los grupos con EPC [F(2,57)= 5.12; p= 0.009]. Concretamente las de EPC 25 y 50 mg/kg/día fueron las que entraron más a los agujeros (p= 0.015) y (p= 0.028) respectivamente, en comparación a las del grupo control (ver figura 5A).
En el caso de la interacción EPC y edad solo se encontraron diferencias significativas en las hembras [F(2,57)=7.36; p=0.001]. En la adolescencia, aparecieron diferencias significativas entre los grupos [F(2,57)= 5.06; p= 0.009] en las entradas a los agujeros. Las hembras adolescentes del EPC 25 mg/kg/día entraron más a los agujeros (p= 0.010) que las del grupo control (figura 5B). En la adultez temprana, se encontraron efectos significativos de la EPC [F(2,57)= 7.71; p= 0.001], las hembras de la EPC 50 mg/kg/día entraron más a los agujeros que las del control (p= 0.001) y que las EPC 25 mg/kg/día (p= 0.032), no aparecieron diferencias entre estos dos últimos grupos (figura 5B).
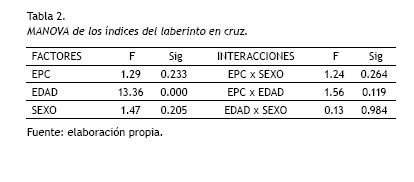
Laberinto en cruz
Tal y como se puede observar en la tabla 2, el MANOVA solo mostró diferencias significativas en la edad [F(5,111)= 13.36; p=0.000] (tabla 2). Los análisis posteriores se llevaron a cabo exclusivamente en las mediciones realizadas en la adolescencia y la adultez temprana; encontrando diferencias significativas en tres indicadores: tiempo en brazos cerrados, tiempo en brazos abiertos y porcentaje de tiempo en brazos abiertos.
Tiempo en brazos cerrados
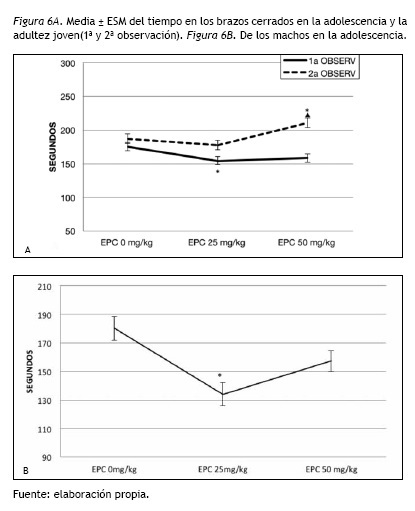
En la adolescencia se encontraron diferencias significativas entre los grupos de EPC [F(2,115)= 3.59; p= 0.031], el EPC 25 mg/kg/día permaneció menor tiempo en los brazos cerrados (p= 0.037) en comparación al control. En la adultez temprana las diferencias significativas entre los grupos de EPC [F(2,115)= 6.00; p= 0.003], se debieron a que el EPC 50 mg/kg/día permaneció mayor tiempo en los brazos cerrados (p= 0.047) en comparación al control y al de EPC 25 mg/kg/día (p=0.003) (figura 6A).
Como en el grupo de adolescentes la interacción EPC y Sexo fue significativa [F(2,115)= 4.98; p= 0.008], se analizó separadamente el tiempo en los brazos cerrados en las hembras y en los machos. Los ANOVAS indicaron que solamente en los ratones machos presentaron diferencias significativas [F(2,58)= 8.72; p= 0.000]. Los machos del grupo de EPC 25 mg/kg/día mostró menor tiempo en comparacion al control (p= 0.000), sin diferencias entre los grupos de EPC 25 y 50 mg/kg/día (figura 6B).
Después que en el grupo de adolescentes se encontrara la interacción EPC y Sexo significativa [F(2,115)= 4.98; p= 0.008], los ANOVAS indicaron que solamente los machos exhibieron diferencias significativas en el tiempo en los brazos cerrados [F(2,58)= 8.72; p= 0.000]. El grupo de EPC 25 mg/kg/día mostró menor tiempo en comparación al control (p= 0.000), sin diferencias entre los grupos de EPC 25 y 50 mg/kg/día (figura 6B).
Tiempo en brazos abiertos
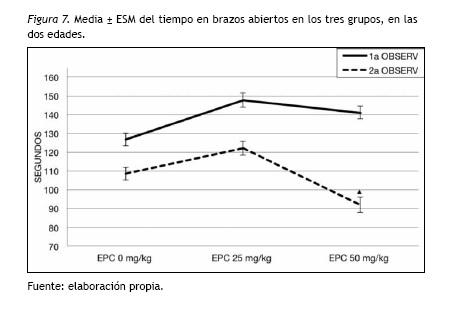
Solo en la adultez temprana se presentaron diferencias significativas [F(2,115)=4.56; p=0.012]. El EPC 50 mg/kg/día (p=0.010) permaneció menor tiempo en los brazos abiertos en comparación al EPC 25 mg/kg/día (figura 7).
Porcentaje de tiempo en los brazos abiertos
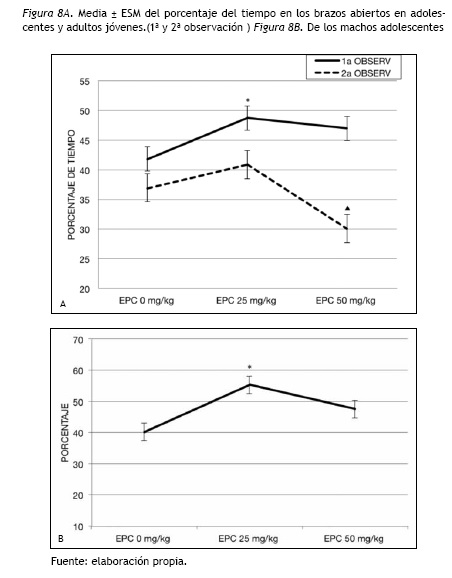
En la adolescencia se encontraron diferencias significativas entre los EPC [F(2,115)= 3.16; p= 0.046] siendo el grupo con EPC 25 mg/kg el que mostró mayor porcentaje de tiempo en los brazos abiertos (p= 0.050) en comparación al control (figura 8A).
En la adultez temprana aparecieron diferencias significativas entre los grupos de EPC [F(2,115)= 5.39; p= 0.006]. El EPC 25 mg/kg/día duró mayor porcentaje de tiempo en los brazos abiertos que el EPC 50 mg/kg/día (p= 0.005), sin diferencias con el control.
En la adolescencia, la interacción EPC y Sexo fue significativa, [F(2,115)= 4.39; p= 0.014]. Se encontraron diferencias significativas entre los grupos de EPC [F(2,58)= 7.62; p= 0.001] exclusivamente en los machos. Los tratados con 25 mg/kg/día duraron mayor porcentaje de tiempo en los brazos abiertos (p=0.001) que el control (figura 8B).
Discusión
El objetivo de este estudio fue evaluar los efectos de la administración prenatal de cocaína (25 y 50 mg/kg/día) en la conducta emocional de ratones hembras y machos a través de dos modelos secuenciados, el tablero de agujeros y el laberinto en cruz.
Estos modelos secuenciados arrojan diferentes índices conductuales que son útiles para obtener una amplia perspectiva del impacto de la cocaína prenatal en la conducta emocional-ansiedad; se basan en que la mayor exploración, la búsqueda de novedad y activación en áreas abiertas e iluminadas se relaciona inversamente con la ansiedad y con la mayor capacidad de tomar riesgo (Bailey y Crawley, 2009; Laarakker, Ohl y van Lith, 2008; Mechan et al., 2002).
Los índices evaluados mediante el tablero de agujeros, mostraron efectos diferentes dependiendo de la dosis. La exposición EPC 50 mg/kg/día perturbó la conducta emocional, los ratones tratados con esta dosis fueron más ansiosos, menos exploradores y con menor capacidad de tomar riesgo, reflejándose en que presentaron mayor locomoción periférica exhibiendo mayor preferencia por permanecer cercanos a las paredes oscuras y protegidas, más que explorar las áreas abiertas e iluminadas (Hansen-Trench y Barron, 2005), mostraron menores erguidas o exploración vertical y menor autoaseo (activación).
Estos efectos fueron consistentes en las dos evaluaciones realizadas, tanto en la adolescencia como en la adultez temprana, por lo que se puede decir que esta dosis afectó permanentemente la conducta emocional. Además estos detrimentos fueron más intensos en las hembras, ellas presentaron menores erguidas, menor autoaseo y mayor locomoción periférica que los machos tratados con la misma dosis.
La mayor frecuencia de entradas a los agujeros, de los ratones hembra no se puede considerar un índice de exploración, ya que no se acompaña de mayor tiempo en los agujeros. Aunque sí podría reflejar mayor hiperactividad e impulsividad expresado en la mayor deambulación por las áreas abiertas. Resultados similares obtuvieron Sobrian, Marr y Ressman (2003) con una dosis de EPC 40 mg/kg/día encontrando un incremento de la locomoción de las ratas por las áreas abiertas e iluminadas, e interpretándolo como un indicador de mayor impulsividad.
Por otra parte, la EPC 25 mg/kg/día produjo mayor exploración (ansiólisis), con efectos persistentes a lo largo de las dos mediciones. Este grupo mostró más erguidas, menor locomoción periférica y permanecieron mayor tiempo en los agujeros. Nuevamente, en las hembras estos efectos fueron más potentes, observados en la mayor exploración en los agujeros que están situados en el área central abierta e iluminada. La mayor exploración de las hembras puede interpretarse como que estas asumieron más riesgos y buscaban la novedad en mayor medida que los machos de la misma dosis.
Cuando se empleó el laberinto en cruz, los sujetos que se sometieron a EPC 50 mg/kg/día se encontraron más ansiosos permaneciendo mayor tiempo en los brazos cerrados y un menor porcentaje de tiempo en los brazos abiertos. Estos efectos fueron más intensos en los machos comparados con las hembras en las mismas dosis.
Sin embargo, los sujetos sometidos a EPC 25 mg/ kg/día estuvieron un mayor porcentaje de tiempo en los brazos abiertos y menor tiempo en los brazos cerrados. Estos efectos no fueron permanentes porque solo aparecieron en la adolescencia, de tal forma que esta dosis causó ansiólisis, sobre todo en los machos adolescentes.
Los resultados obtenidos a partir de los dos modelos indican que la EPC alteró la conducta emocional de forma bifásica: así la EPC 50 mg/kg/día lesionó permanentemente la conducta emocional, ya que produjo sujetos ansiosos con mucho temor para explorar y con una baja capacidad de asumir riesgos. Estos efectos fueron más notables en las hembras en el tablero de agujeros y más intensos en los machos en el laberinto en cruz.
La diferencia encontrada en cada instrumento podría sugerir que la EPC pudo haber dañado selectivamente unos índices de conducta emocional-exploratoria en las hembras y otros en los machos. La investigación previa señala diferencias en la respuesta al estrés entre hembras y machos (Bailey y Crawley, 2009; Chaplin, Freiburger, Mayes y Sinha, 2010). Además, se ha encontrado una respuesta diferencial dependiendo del test de ansiedad que se utilice (Laarakker, Ohl y van Lith, 2008; Lynch et al., 2002; Simpson, 2011).
El deterioro encontrado en la conducta emocional con la EPC 50 mg/kg también se ha encontrado con EPC 60 mg/kg (Magalhães et al., 2005) evaluado en alta reactividad al estrés, larga latencia para explorar y lenta habituación al ambiente, lo que manifiesta daños en la conducta emocional y en la cognición por la lenta habituación. De igual forma en los estudios de Salas-Ramírez et al. (2010) con EPC 30 y 40 mg/kg, encontraron alta ansiedad, menor tolerancia al estrés, hiperreactividad a los estímulos y trastornos de la sensibilidad al dolor (Huber, Darling, Park y Soliman, 2001). Aunque Sobrian, Marr y Ressman (2003) utilizando EPC 40 mg/kg/día encontraron mayor exploración explicada como impulsividad y conductas de alto riesgo; con una dosis de 20 mg/kg/día observaron leves efectos ansiolíticos por el mayor tiempo en los brazos abiertos.
Este trabajo estudió los efectos de la EPC en la conducta emocional en diferentes edades, por lo que se pudo identificar efectos de la EPC en dos etapas de gran importancia, como son la adolescencia y la adultez temprana, algunos de ellos no se evidencian en la adolescencia y otros no permanecen en la adultez temprana, lo que se conoce como efectos letárgicos (Singer et al., 2004).
Como limitación se puede pensar que únicamente se tienen dos mediciones en la adolescencia y la adultez temprana, por lo que en posteriores estudios sería importante medir en la adultez tardía y en la vejez, para evaluar la permanencia de los efectos del tratamiento prenatal.
En suma, podríamos decir que la EPC en las dos dosis evaluadas altera la conducta emocional, solo que los efectos son diferenciales en relación a la dosis. Los sujetos tratados prenatalmente con la dosis mayor son ansiosos, temerosos y con baja capacidad de asumir riesgos, en cambio los tratados prenatalmente con la dosis menor son impulsivos, hiperactivos y exhiben conductas de alto riesgo sin evaluar las consecuencias
Referencias
Ackerman, J. P., Riggins, T. & Black, M. M. (2010). A review of the effects of prenatal cocaine exposure among school-aged children. Pediatrics, 125, 554-565. doi: 10.1542/peds.2009-0637. [ Links ]
Bailey, K. R. & Crawley, J. N. (2009). Anxiety-related behaviors in mice. In J. J. Buccafusco (ed.). Methods of behavior analysis in neuroscience, (2). Boca Raton (Florida): CRC Press. Retrieved from http://www.ncbi.nlm.nih.gov/books/NBK5221/. [ Links ]
Brown, G. R. & Nemes, C. (2008). The exploratory behaviour of rats in the hole-board apparatus: is head-dipping a valid measure of neophilia? Behavior Processes, 78, 442-448. doi: 10.1016/j.beproc.2008.02.019. [ Links ]
Brunton, P. J. (2015). Programming the brain and behaviour by early life stress: A focus on neuroactive steroids. Journal of Neuroendocrinology. doi: 10.1111/jne.12265. Retrieved from http://onlinelibrary.wiley.com/doi/10.1111/jne.12265/pdf. [ Links ]
Butler, T. R., Ariwodola, O. J. & Weiner, J. L. (2014). The impact of social isolation on HPA axis function, anxiety-like behaviors and ethanol drinking. Frontiers in Integrative Neuroscience, 2, 1-11. doi: 10.3389/fnint.2013.00102. [ Links ]
Crawley, J. N. (2009). Chaplin, T. M., Freiburger, M. B., Mayes, L. C. & Sinha, R. (2010). Prenatal cocaine exposure gender and adolescent stress response: A prospective longitudinal study. Neurotoxicology Teratology, 32, 595-604. doi: 10.1016/j.ntt.2010.08.007. [ Links ]
Chaplin, T. M, Visconti K. J., Molfese, P. J., Susman, E. J., Klein, L. C., Sinha, R. & Mayes, L. C. (2014). Prenatal cocaine exposure differentially affects stress responses in girls and boys: Associations with future substance use. Development and Psychopathology, 18, 1-8. doi: 10.1017/S0954579414000716. [ Links ]
Chrousos, G. P. & Kino, T. (2009). Glucocorticoid signaling in the cell. Expanding clinical implications to complex human behavioral and somatic disorders glucocorticoids and mood. Annals of the New York Academy of Sciences, 1179, 153-166. doi: 10.1111/j.1749-6632.2009.04988. [ Links ]
Costa-Goes, T., Dias-Antunes,F. & Teixeira-Silva, F. (2009). Trait and state anxiety in animal models: Is there correlation? Neuroscience Letters, 450, 26-269. doi: 10.1016/j.neulet.2008.11.037. [ Links ]
Crawley, J. N. (1985). Exploratory behavior models of anxiety in mice. Neuroscience and Biobe-havioral Reviews, 9, 37-44. doi: 10.1016/0149-7634(85)90030-2. [ Links ]
Dow-Edwards, D., Iijima, M., Stephenson, S., Jackson, A. & Weedon, J. (2014). The effects of prenatal cocaine, post-weaning housing and sex on conditioned place preference in adolescent rats. Psychopharmacology, 231, 1543-1555. doi: 10.1007/s00213-013-3418-9. [ Links ]
Eiden, R. D., Schuetze, P. & Coles, C. D. (2011). Maternal cocaine use and mother-infant interactions: direct and moderated associations. Neurotoxicology and Teratology, 33, 120-128. doi: 10.1016/j.ntt.2010.08.005. [ Links ]
Eyler, F. D., Warner, T. D., Behnke, M., Hou, W., Wobie, K. & Garvan, C. W. (2009). Executive functioning at ages 5 and 7 years in children with prenatal cocaine exposure. Devopmental Neuroscience, 31, 121-136. doi:10.1159/000207500. [ Links ]
Finger, B., Schuetze, P. & Eiden, R. (2015). Behavior problems among cocaine-exposed children: Role of physiological regulation and parenting. Drug & Alcohol Dependence, 146, 278. doi: 10.1016/j.ntt.2014.01.001. [ Links ]
Golbach, T. (2005). The effects of prenatal cocaine exposure on the mutual regulation of attention in mother-infant dyads. Georgia State University. ProQuest issertations and Theses, 106. Retrieved from http://scholarworks.gsu.edu/psych_diss/5 [ Links ]
Hansen-Trench, L. S. & Barron, S. (2005). Effects of neonatal alcohol and/or cocaine exposure on stress in juvenile and adult female rats. Neurotoxicology and Teratology, 27, 55-63. doi: 10.1016/j.ntt.2004.10.001. [ Links ]
Huber, J., Darling S., Park, K. & Soliman, K.F. (2001). Altered responsiveness to stress and NMDA following prenatal exposure to cocaine. Physiology & Behavior, 72, 181-188. doi: 10.1016/s0031-9384(00)00410-8. [ Links ]
Hughes, R. N. (2007). Neotic preferences in laboratory rodents: issues, assessment and substrates. Neuroscience Biobehavior Review, 31, 441-464. doi: 10.1016/j.neubio-rev.2006.11.004. [ Links ]
Konsolaki, E. & Skaliora, I. (2015). Motor vs. cognitive elements of apparent "hyperlocomotion": A conceptual and experimental clarification. Proceedings of the National Academy of Sciences, 112, E3-E4. doi: 10.1073/pnas.1413820112. [ Links ]
Korte, M. & de Boerd, S. (2003). A robust animal model of state anxiety: fear-potentiated behaviour in the elevated plus-maze. European Journal of Pharmacology, 463, 163-75. doi: 10.1016/S0014-2999(03)01279-2. [ Links ]
Laarakker, M. C., Ohl, F. & Van Lith, H. A. (2008). Chromosomal assignment of quantitative trait loci influencing modified hole board behavior in laboratory mice using consomic strains, with special reference to anxiety-related behavior and mouse chromosome 19. Behavior Genetics, 38, 159-184. doi:10.1007/s10519-007-9188-6. [ Links ]
Lambert, B. L. & Bauer, C. R. (2012). Developmental and behavioral consequences of prenatal cocaine exposure: A review. Journal of Perinatology, 32, 819-828. doi: 10.1038/jp.2012.90. [ Links ]
Lester, B. M. & Padbury, J. F. (2009). Third pathophysiology of prenatal cocaine exposure. Developmental Neuroscience, 31, 23-35. doi: 10.1159/000207491. [ Links ]
Lewis, M. W. (2015). Cocaine-exposed toddler caregiver dyads during free play at 24 months. In Society for social work and research 19th annual conference: The social and behavioral importance of increased longevity. Sswr. [ Links ]
Li, Z., Coles, C. D., Lynch, M. E., Hamann, S., Peltier, S., LaConte, S. & Hu, X. (2009). Prenatal cocaine exposure alters emotional arousal regulation and its effects on working memory. Neurotoxicology and Teratology, 31, 342-348. doi: 10.1016/j.ntt.2009.08.005. [ Links ]
Linares, T. J., Singer, L. T., Kirchner, H. L., Short, E. J., Min, M. Y., Hussey, P. & Minnes, S. (2006). Mental health outcomes of cocaine exposed children at 6 years of age. Journal of Pediatric Psychology, 31, 85-97. doi: 10.1093/ jpepsy/jsj020. [ Links ]
Loredo-Abdala, A. Casas-Muñoz, A. y Monroy-Llaguno, D. A. (2014). La cocaína: sus efectos en la mujer embarazada y en el producto de la gestación. Revista de la Facultad de Medicina de la UNAM, 57, 5-8. [ Links ]
Lynch, W. J., Roth, M. E. & Carroll, M. E. (2002). Biological basis of sex differences in drug abuse: Preclinical and clinical studies. Psychopharmacology, 164, 121-137. doi:10.1007/s00213-002-1183-2. [ Links ]
Magalhães, A., Summavielle, T., Melo, P., Tavares, M. A. & Sousa, L. D. (2005). Prenatal cocaine exposure: effects on locomotor activity in rat offspring. Environmental Toxicology and Pharmacology, 19, 767-773. doi: doi.org/10.1016/j. etap.2004.12.043. [ Links ]
Mechan, A. O., Moran, P. M., Elliott, M. J., Walf, F. Young, A. M., Joseph, M. H., Green, R. A. & Frye, D. (2007). A study of the effect of a single neurotoxic dose of 3, 4-methylene-dioxy-methamphetamine (MDMA; "ecstasy") on the subsequent long-term behaviour of rats in the plus maze and open field. Psychopharmacology, 159, 167-75. doi: 10.1007/s002130100900. [ Links ]
Mechan, A. O., Moran, P. M., Elliott, M. J., Young, A. M., Joseph, M. H. & Green, R. A. (2002). A comparison between dark agouti and sprague-dawley rats in their behaviour on the elevated plus-maze, open-field apparatus and activity meters, and their response to diazepam. Psychopharmacology, 1 59, 188-95. doi: 10.1007/s002130100902. [ Links ]
Morrow, C. E., Accornero, V. H., Xue, L., Manjunath, S., Culbertson, J. L., Anthony, J. C. & Bandstra, E. S. (2009). Estimated risk of developing selected DSM-IV disorders among 5-year-old children with prenatal cocaine exposure. Journal of Child and Family Studies, 18(3), 356-364. doi: 10.1007/s10826-008-9238-6. [ Links ]
Nnadi, C. U., Mimiko, O. A., McCurtis, H. L. & Cadet, J. L. (2005). Neuropsychiatric effects of cocaine use disorders. Journal of the National Medical Association, 97, 1504-1515. [ Links ]
Overstreet, D. H., Moy, S. S., Lubin, D. A., Gause, L. R., Lieberman, J. A. & Johns, J. M. (2000). Enduring effects of prenatal cocaine administration on emotional behavior in rats. Physiology & Behavior, 70, 149-156. doi: 10.1016/s0031-9384(00)00245-6. [ Links ]
Peña-Oliver, Y. (2007). El enriquecimiento ambiental en ratas: efectos diferenciales en función del sexo. Tesis doctoral. España: Universidad de Barcelona. Departamento de Biología Celular. Recuperado de http://ddd.uab.cat/pub/tesis/2007/tdx-1031107-64745/ypo1de1.pdf [ Links ]
Salas-Ramírez, K. Y., Frankfurt, M., Alexander, A., Luine, V. N. & Friedman, E. (2010). Prenatal cocaine exposure increases anxiety, impairs Cognitive function and increases dendritic spine density in adult rats: influence of sex. Neuroscience, 169, 1287-1295. doi: 10.1016/j.neuroscience.2010.04.067. [ Links ]
Salomons, A., Van Luijk, J., Reinders, N., Kirchhoff, S., Arndt, S. & Oh, F. (2010). Identifying emotional adaptation: behavioural habituation to novelty and immediate early gene expression in two inbred mouse strains. Genes, Brain and Behavior, 9, 1-10. doi:10.1111/j.1601-183X.2009.00527.x. [ Links ]
Simpson, J. (2011). The influence of housing, sex and strain on baseline and drug-induced behavioural and neurochemical parameters in the rat. Doctoral thesis. Galway, Ireland: School of Medicine, Department of Pharmacology and Therapeutics, National University of Ireland. Retrieved from http://aran.library.nuigalway.ie/xmlui/bitstream/handle/10379/3876/the-sis%20resubmission_new%20appendix%20OCT%202013-1.pdf?sequence=5 [ Links ]
Singer, L. T., Minnes, S., Short, E., Arendt, R., Farkas, K., Lewis, B., Klein, N., Russ, S. & Min, M. (2004). Cognitive outcomes of preschool children with prenatal cocaine exposure. The JAMA Network, 291, 2448-2456. doi: 10.1001/jama.291.20.2448. [ Links ]
Sinha, R. (2008). Chronic stress, drug use and vulnerability to addiction. Annals of the New York Academy of Sciences, 1141, 105-130. doi: 10.1196/annals.1441.030. [ Links ]
Sithisarn, T., Bada, H. S., Dai, H., Randall, D. C. & Legan, S. J. (2011). Effects of perinatal cocaine exposure on open field behavior and the response to corticotropin releasing hormone (CRH) in rat offspring. Brain Research, 1370, 136-144. doi: 10.1016/j.brainres.2010.11.024. [ Links ]
Sobrian, S. K., Johnston, M., Wright, J., Kuhn, D. & Ameis, K. (2008). Prenatal nicotine or cocaine differentially alters nicotine-induced sensitization in aging offspring. Annals New York Academy of Sciences, 1139, 466-77. doi: 10.1196/annals.1432.045. [ Links ]
Sobrian, S. K., Marr, L. & Ressman, K. (2003). Prenatal cocaine or nicotine exposure produces depression and anxiety in aging rats. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 27, 501-18. doi: 10.1016/S0278-5846(03)00042-3. [ Links ]
Thompson, B. L., Levitt, P. & Stanwood, G. (2005). Prenatal cocaine exposure specifically alters spontaneous alternation behavior. Behavioural Brain Research, 164, 107-116. doi: 10.1016/j.bbr.2005.06.010. [ Links ]
UNODC. (2005). United Nations office on drugs and crime global; Illicit drug trends. Retrieved from https://www.unodc.org/unodc/en/data-and-analysis/WDR-2005.html. [ Links ]
Walf, A. & Frye, Ch. (2007). The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nature Protocols, 2, 322-328. doi: 10.1038/nprot.2007.44. [ Links ]