Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Entramado
Print version ISSN 1900-3803
Entramado vol.11 no.2 Cali July/Dec. 2015
https://doi.org/10.18041/entramado.2015v11n2.22239
http://dx.doi.org/10.18041/entramado.2015v11n2.22239
Diversidad genética del jengibre (Zingiber officinale Roscoe.) A nivel molecular: Avances de la última década*
Genetic diversity of ginger (Zingiber officinale Roscoe.) At the molecular level: progress of the last decade
Diversidade genética do gengibre (Zingiber officinale Roscoe.) a nível molecular: avanços da última década
Eleonora Zambrano-Blanco**
* Artículo de revisión de tema sobre la diversidad genética del jengibre a nivel mundial, basada en marcadores moleculares.
** Doctora en Genética y Mejoramiento de Plantas. Grupos de Investigación Tecnogénesis y Agropecunad. Docente Centro de Investigación Agrícola y Biotecnología (CIAB). Universidad Nacional Abierta y a Distancia (UNAD). Dosquebradas, Risaralda - Colombia. ezambranob@yahoo.es
Este es un artículo Open Access bajo la licencia BY-NC-SA (http://creativecommons.org/licenses/by-nc-sa/4.0/.)
Cómo citar este artículo: ZAMBRANO-BLANCO, Eleonora. Diversidad genética del jengibre (zingiberofficinale Roscoe.) A nivel molecular: Avances de la última década. En: Entramado. Julio - Diciembre, 2015 vol. 11, no. 2, p. 190-199, http://dx.doi.org/10.18041/entramado.2015v11n2.22239
Recibido: 30/04/2015 Aceptado: 20/06/2015
Resumen
El jengibre (Zingiber officinale) es una especie medicinal, aromática y condimentaria que se cultiva principalmente en regiones tropicales y subtropicales del mundo. Por tratarse de una especie de propagación vegetativa, su variabilidad genética tiende a ser baja; sin embargo es posible hallar una amplia variabilidad genética principalmente en la China e India, considerándose actualmente como el principal centro de origen y diversidad de esta especie. Conocer y caracterizar la diversidad genética del jengibre es una tarea de vital importancia para fomentar programas de conservación ex situo in vitroque ayuden a evitar la erosión genética de esta especie, así como para direccionar correctamente estrategias de mejoramiento genético. Marcadores moleculares han sido ampliamente usados en los últimos años con la finalidad de estudiar la variabilidad genética del jengibre, directamente a nivel del ADN. En este artículo, los avances en la investigación en diversidad genética del jengibre, usando marcadores moleculares, son revisados. Esto con la finalidad de hacer un análisis sobre sus implicaciones para la conservación y el mejoramiento genético de la especie.
Palabras clave: Marcadores moleculares, recursos fitogenéticos, mejoramiento genético, relaciones filogenéticas, Zingiber officinale.
Abstract
Ginger (Zingiber officinale) is a medicinal, aromatic and spice species grown in tropical and subtropical regions, mainly. Being a vegetatively propagated species, their genetic diversity tends to be low; however wide genetic variability is possible to found it in China and India, especially. Actually, these countries are considered as the center of origin and diversity of ginger To know and to characterize the genetic diversity of ginger is an activity of vital importance to promote ex situ and in vitro conservation programs, to help prevent genetic erosion of this species as well address breeding strategies properly. Molecular markers have been widely used in recent years in order to study the genetic variability of ginger directly at the DNA level. In this paper the research advances in genetic diversity of ginger using molecular markers, are reviewed. This in order to analyze their implications for the conservation and breeding of the species.
Keywords: Molecular markers, phytogenetic resources, breeding, phylogenetic relationships, Zingiber officinale.
Resumo
O gengibre (Zingiber officinale) é uma espécie medicinal, aromática e condimentar que é cultivada principalmente nas regiões tropicais e subtropicais do mundo. Por tratarse de uma espécie de propagação vegetativa, sua variabilidade genética tende a ser baixa; no entanto, é possível encontrar uma grande variabilidade genética principalmente na China e na Índia, sendo atualmente o principal centro de origem e diversidade dessa espécie. Conhecer e caracterizar a diversidade genética do gengibre é uma tarefa de importância vital para fomentar programas de conservação ex situ ou in vitroque ajudem a evitar a erosão genética desta espécie, bem como para direcionar corretamente as estratégias de melhoramento genético. Marcadores moleculares têm sido amplamente usados nos últimos anos a fim de estudar a variabilidade genética do gengibre, diretamente a nível do ADN. Nesse artigo são revisados os avanços na pesquisa da diversidade genética do gengibre, usando marcadores moleculares. Isto com o fim de fazer uma análise sobre suas implicações para a conservação e o melhoramento genético da espécie.
Palavras-chave: Marcadores moleculares, recursos fitogenéticos, melhoramento genético, relações filogenéticas, Zingiber officinale.
Introducción
El jengibre es una especie diploide (2n=22) que se conoce botánicamente como Zingiber officinale Roscoe (Ravindran et al., 2005) y que se destaca por su importancia medicinal, aromática y condimentaria en muchas partes del mundo. Diferentes informaciones sobre su origen y domesticación revelan que las distintas especies del género Zingiber son originarias del Sudeste asiático y desde ahí se dispersaron por las regiones tropicales y subtropicales del mundo (Kizhakkayil y Sasikumar, 2011). Actualmente, es una de las especies más relevantes y usadas en la medicina tradicional de países como India, Japón, China, Grecia, Roma y el Mediterráneo (Baliga et al., 2011), en virtud de ciertos constituyentes químicos como el gingerol y el shogaol, que le confieren propiedades antioxidantes, anti-inflamatorias, antieméticas y anticancerígenas, entre otras (Ali et al., 2008; Baliga et al., 2011; Butt y Sultan, 2011; Geiger, 2005; Shirin y Jamuna, 2010; Shukla y Singh, 2007; Stoilova et al., 2007). Adicionalmente, el aceite esencial es ampliamente usado en la industria de alimentos y bebidas, en la industria farmacéutica, cosmética y perfumería (Sasidharan et al., 2012; Sharma et al., 2011). Durante los últimos años, el área mundial ocupada con jengibre registró un leve crecimiento de 23,11% entre 2010 e 2014, pasando de 261.689 ha para 322.157 ha. El volumen producido en ese mismo periodo, con promedio de 1.864.099.47 toneladas, mostró una variación menor que el área (18,4%), siendo China e India los mayores productores de jengibre fresco, con 50% de la producción global, seguido por Indonesia, Nepal, Nigeria, Bangladesh, Japón, Tailandia, Filipinas y Corea (Faostat, 2015).
El jengibre cultivado es una especie completamente estéril y que además exhibe una autoincompatibilidad gametofítica que dificulta la producción de semillas (Dhamayanthi et al., 2003). Hay un consenso en la literatura que dice que la naturaleza de la esterilidad del jengibre es específicamente de origen cromosómica, producto de translocaciones e inversiones (Ramachandran, 1982), o producto de la formación de bivalentes no homólogos, con una segregación irregular de complementos genómicos que llevan a la formación de gametos estériles (Das et al., 1999). El jengibre es probablemente un híbrido estéril que resultó del cruzamiento entre dos especies distantes y que logró sobrevivir en razón de que la propagación vegetativa es una estrategia evolutiva que ha sido exitosa para perpetuar la especie (Peter et al., 2007). Así, sin posibilidad de eventos de recombinación genética, el mejoramiento genético de la especie por hibridación sexual es inviable, siendo la selección clonal de variedades (Sasikumar et al., 2003, 1996), la poliploidia (Adaniya, 2001; Kun-Huai et al., 2011; Smith et al., 2004; Wohlmuth et al., 2006, 2005) y la inducción de mutaciones (Pawar et al., 2010; Rashid et al., 2013; Rene et al., 2014), algunas de las técnicas más utilizadas para el mejoramiento de la especie.
Por tratarse de una especie de propagación vegetativa, la variabilidad genética en jengibre tiende a ser limitada; sin embargo, una amplia variabilidad ha sido encontrada en China e India, la cual ha sido aprovechada para la obtención de las variedades mejoradas (Prasath et al., 2011). La mayoría de estas variedades han sido nombradas de acuerdo con el lugar de domesticación y/o el color de sus rizomas. La variabilidad genética de Z officinale y otras especies relacionadas ha sido ampliamente estudiada a nivel internacional. Esto es soportado por un sinnúmero de estudios de caracterización molecular, morfológica y química, que han aportado al mejoramiento genético de esta especie en los últimos años y a programas de conservación en bancos de germoplasma.A diferencia de los descriptores morfológicos y químicos, que son altamente influenciados por el ambiente, marcadores moleculares han sido ideales para el análisis de la diversidad genética en jengibre, una vez que detectan polimorfismo directamente a nivel del ADN. Existe una gran variedad de marcadores moleculares disponibles para los estudios en vegetales, tales como RAPD ("Random Amplified Polymorphic DNA");SCAR ("Sequence Characterized Amplified Regions") Microsatélites o SSR ("Simple Sequence Repeats"); AFLP ("Amplified Fragment Length Polymorphism"); SNPs ("Single Nucleotide Polymorphism"), isoenzimas, entre otros (Agarwal et al., 2008; Kalia et al., 2011; Schlõtterer, 2004). Estos marcadores moleculares son herramientas útiles y varían en su poder de resolución para el análisis genético de las plantas y en su potencial de aplicabilidad (Nayak et al., 2005).
En este artículo, los avances en la investigación en diversidad genética del jengibre (Z. officinale), en la última década, son revisados. Por tanto, los hallazgos de la caracterización molecular son abordados con la finalidad de discutir sus implicaciones en el mejoramiento genético del cultivo.
Recursos genéticos de Z. officinale y su conservación
La caracterización de los recursos fitogenéticos es una tarea de vital importancia para la conservación y uso racional de las especies vegetales. Es una actividad esencial para el trabajo de los mejoradores genéticos de plantas, los cuales buscan conocer el nível de variabilidad existente en poblaciones naturales o bancos de germoplasma para alcanzar progresos genéticos durante la selección de genotipos.
En jengibre ha sido reportado que alto nivel de variabilidad genética existe en poblaciones naturales y silvestres crecidas en el noreste de Asia, en la región de Kerala al sureste de la India (Ravindran et al., 2005) y en la región noroeste del Himalaya (Pandotra et al., 2015, 2013a, 2013b). Una gran diversidad de variedades abundan en la India, China y Nepal (Kizhakkayil y Sasikumar, 2011), en tanto que en otros países como Jamaica, Japón, Nigeria, entre otros, el número de cultivares es menor (Tabla 1, pág. 193). China se destaca como el país que tiene la mayor riqueza genética (Prasath et al., 2011). Entre tanto, diez variedades mejoradas han sido liberadas en la India ( Varada, Mahima, Rejatha, Suruchi, Suravi, Suprabha, Himagiri, Athira, Karthika y Nadia) (Sasikumar et al., 2003, 1996; Singh et al., 2013) y una en Australia (Buderim Gold) (Smith et al., 2004). Estas variedades se destacan por sus atributos de calidad, altos rendimientos y tolerancia a enfermedades, posibilitando la producción comercial del jengibre en la India.
Colecciones ex situ de germoplasma de jengibre son mantenidas en India e Indonesia por el Indian Institute of Spices Research(IISR) y por el Research Institute for Spices and Medicinal Crops (RISMC), respectivamente (Ravindran et al., 2005). Se estima que un total de 475 accesiones de Z officinale y 975 accesiones de especies relacionados, son mantenidas en el ISSR (Ravindran et al., 1994), en tanto que el RISMC posee 645 accesiones de Z. officinale. Estas colecciones engloban materiales genéticos nativos e introducidos de otros países, comprendiendo variedades tradicionales, variedades mejoradas, mutantes, poliplóides, variedades silvestres y especies relacionadas. Gran parte de estos materiales han sido caracterizados y evaluados para caracteres de rendimiento y calidad (Ravindran et al., 2005), tales como altura de la planta, número de macollas, número de hojas, rendimiento por planta, contenido de gingerol, de aceite esencial, shogaol, entre otros. Hay un consenso en la literatura de que la altura de la planta, el área foliar, el largo y el ancho de las hojas, el número de hojas y el número de macollas por planta, se correlacionan directamente con el rendimiento de los rizomas (Aragaw et al., 2011). Además, heredabilidades superiores al 90% aunadas a relaciones de coeficiente de variación genético/ambiental mayor que 1, sugieren que la expresión de caracteres asociados al rendimiento de las plantas están bajo el control de genes aditivos (Aragaw et al., 2011; Islam et al., 2008), indicando que es viable el mejoramiento genético por selección clonal.
Diversidad genética a nivel molecular
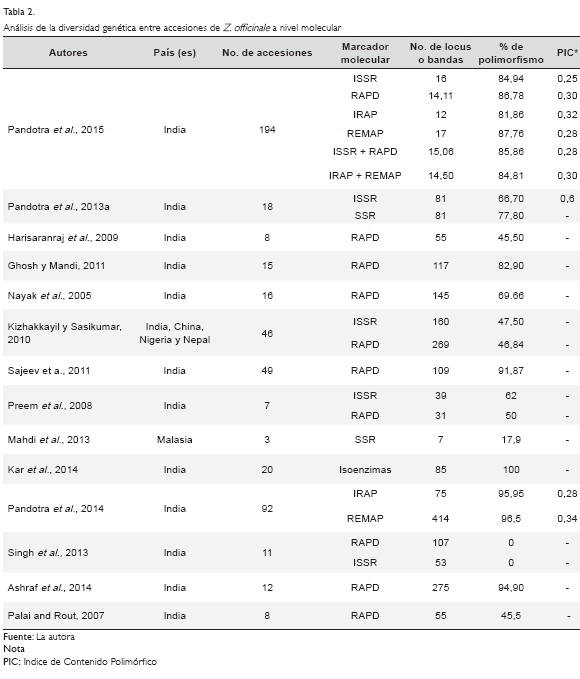
Una revisión de estudios de diversidad genética en Z. officinale permiten concluir que, a nivel molecular, pueden encontrarse distintos niveles de variación genética, dependiendo principalmente del marcador utilizado, de las poblaciones analizadas, su área geográfica de procedencia y el tamaño poblacional (Tabla 2, pág. 194). La mayoría de estos estudios de variabilidad genética han sido conducidos en la India, un país donde el jengibre es ampliamente cultivado por su valor económico y medicinal.
Marcadores moleculares SNPs, SCAR y SSR, altamente polimórficos, han sido identificados para la caracterización molecular y autenticación del jengibre (Chandrasekar et al., 2009; Chavan et al., 2008; Lee et al., 2007). En varios casos, se ha verificado que la variabilidad genética es moderada a baja, siendo que hay mayor similaridad entre genotipos cultivados en regiones geográficas próximas, en comparación con aquellos que son cultivados en áreas más distantes (Harisaranraj et al., 2009; Jatoi et al., 2008, 2006; Jiang et al., 2006; Kizhakkayil y Sasikumar, 2010; Palai y Rout, 2007; Pandotra et al., 2013a). A pesar de ser una especie que se propaga asexualmente, la expectativa es que existe amplia diferenciación genética entre genotipos que se cultivan en áreas geográficas distantes y con condiciones ambientales contrastantes, por estar sobre diferentes presiones de selección (Bosseti et al., 2011), tal como ocurrió entre 12 genotipos de Z. officinale cultivados en zonas ecológicamente contrastantes de la India, los cuales fueron analizados usando marcadores RAPD (Ashraf et al., 2014). La heterogeneidad de hábitats, juega un papel muy importante en la preservación de la diversidad, especialmente en especies clonales, en contraste con la homogeneidad de hábitats que resulta en una reducción gradual (Hangelbroek et al., 2002).
En algunos casos, una clara diferenciación genética se observó entre variedades comerciales o mejoradas y variedades tradicionales o locales (Kizhakkayil y Sasikumar, 2010; Pandotra et al., 2014; Prem et al., 2008), indicándose como materiales potenciales para programas de mejoramiento por su alta calidad (Sajeev et al., 2011). La variabilidad en cultivares de Z. officinale tiene una connotación evolutiva. Una posible explicación es que esta diferenciación genética se debe posiblemente a mutaciones aleatorias ocurridas en poblaciones adaptadas localmente durante el proceso de expansión geográfica (Ravindran et al., 1994). Esto habría resultado en varios hábitats de domesticación y, consecuentemente, en las variedades locales o tradicionales que se cultivan en la actualidad. En China, existe una amplia diversidad genética entre variedades cultivadas, dando origen a muchos ecotipos en razón de las grandes variaciones geográficas (Wang et al., 2014). La variabilidad en el ADN puede ser atribuida a pérdidas o adiciones de muchas secuencias repetidas en el genoma de los cultivares, tales como AT o GC, en razón de las alteraciones macro o micro ambientales durante la evolución y selección gradual de nuevos cultivares (Price et al., 1980; Martel et al., 1997; Das et al, 1998 citados por Nayak et al., 2005).
Además de diferencias a nivel molecular, variedades mejoradas y tradicionales de jengibre también difieren en características morfoagronómicas (Islam et al., 2008; Lincy et al., 2008; Aragaw et al., 2011; Chaves et al., 2012; Chongtham et al., 2013; Jatoi y Watanabe, 2013), de oleoresinas (Jiang et al., 2005; Pandotra et al., 2013b; Sanwal et al., 2010; Singh et al., 2008; Wohlmuth et al., 2005) y de composición química del aceite esencial (Wohlmuth et al., 2006; Menon, 2007; Kizhakkayil y Sasikumar, 2009; Hassanpouraghdam et al., 2011; Padalia et al.,2011;Verma et al., 2011; Ding et al., 2012; Kubra y Rao, 2012; Nampoothiri et al., 2012; Salmon et al., 2012; Singh et al., 2013). Algunas veces hay congruencia entre el perfil químico y el molecular de las variedades. Al ser analizadas con marcadores RAPD, Ghosh y Mandi (2011) reportaron que 16 cultivares tradicionales de Z.officinale provenientes de la región de Bengala en la India formaron tres grupos de diversidad genética en función de su potencial antioxidante. No obstante, en otro estudio también conducido con materiales genéticos de la India, la comparación de los grupos formados con base en la diversidad del aceite esencial y la diversidad a nivel molecular, mostró un patrón diferente de agrupamiento, indicando así que las diferencias a nivel químico no podían correlacionarse con el perfil molecular de aquellas variedades (Pandotra et al., 2013a). Según los autores, los marcadores moleculares ISSR y SSR estudiados, fueron insuficientes en discernir informaciones del genoma relacionadas con la biosíntesis de los compuestos químicos del aceite esencial.
La mayoría de estudios moleculares en jengibre, en la última década, han sido conducidos con marcadores moleculares RAPD e ISSR (Tabla 2). No obstante, dos técnicas basadas en el uso de retrotransposones (IRAP:""Inter Retrotransposons Amplified Polymorphism' " y REMAP: "Retrotransposon Microsatellite Amplified Polymorphism"), han sido usadas recientemente para el análisis de la diversidad genética en jengibre (Pandotra et al., 2015). IRAP y REMAP fueron eficientes en el análisis genético de Z. officinale, revelando más de 90% de polimorfismo entre 92 variedades locales colectadas en la India, en el noroeste de la región del Himalaya (Pandotra et al., 2014). De acuerdo con los autores, la alta amplificación de locus REMAP e IRAP, con gran polimorfismo, es un indicativo de variaciones ocurridas en los sitios de inserción de los retrotrasnposones y la presencia de elementos altamente repetitivos en zonas adyacentes. Esto podría explicar la gran variabilidad genética de las variedades analizadas.
Estudios filogenéticos basados en marcadores moleculares
Las secuencias de ADN han sido ampliamente usadas en estudios filogenéticos para investigar las relaciones genéticas entre especies del género Zingiber y para la identificación o autenticación de Z. officinale. De acuerdo con Ghosh et al. (2011), distintas especies del genero Zingiber, aunque presentan algunas semejanzas morfológicas, difieren grandemente en cuanto a sus propiedades medicinales. Por lo tanto, es indispensable la identificación correcta de las especies para asegurar la calidad de los suplementos dietéticos y/o de las medicinas naturales que tienen como principio activo a Z. officinale (Chavan et al., 2008; Jiang et al., 2006). En pro de la autenticación de Z. officinale, Ghosh et al. (2011) usaron marcadores moleculares AFLP para estudiar las relaciones genéticas entre Z. officinale, Z. zerumbet y Z montanum, identificando marcadores específicos que posibilitaron la separación de las tres especies en el dendrograma, observando también que había una relación filogenética más estrecha entre Z. zerumbet y Z. montanum, que con Z. officinale. Los resultados de la investigación sugieren que marcas AFLP podían ser usadas para la autenticación de medicamentos derivados de Zingiber spp. y, por tanto, resolver problemas asociados con la adulteración de estos vegetales.
En otro estudio, un análisis filogenético y de perfil químico y farmacológico, fue conducido por Jiang et al. (2006) para investigar la variabilidad genética de materiales genéticos de jengibre procedentes de diferentes lugares y las relaciones genéticas entre Z. officinale y otras especies estrechamente relacionadas, tales como Z. mioga, Z. montanum, Z. zerumbet Z. spectabile y Alpinia galanga. Estos análisis demostraron que todas las variedades de jengibre fueron genéticamente similares entre ellas, independientemente de su local geográfico de origen, en tanto que las otras especies fueron ampliamente divergentes y distinguibles, cuando comparadas entre ellas y con Z. officinale, a nivel químico y genético. El patrón de los arboles filogenéticos químicos y genéticos fueron altamente congruentes entre sí, soportando la hipótesis de que características químicas de las especies investigadas pueden ser usadas para identificar relaciones genéticas entre plantas. Variabilidad interespecífica en la familia Zingiberaceae también fue constatada por Ahmad et al. (2009) mediante un análisis PCR-RFLP (PCR- Restriction Fragment length Polymorphism) del ADN de los cloroplas-tos (cpDNA). Este análisis permitió identificar regiones altamente conservadas y regiones altamente variables dentro del cpDNA de 22 accesiones analizadas, las cuales representaban II especies de 4 géneros diferentes.
De forma general, la revisión de estudios filogenéticos en jengibre permiten concluir que en el género Zingiber hay una amplia variabilidad interespecífica, en tanto que la base genética de Z.officinale es estrecha y, por tanto, su variabilidad genética tiende a ser baja (Ahmad et al., 2009; Ghosh et al., 2011; Jatoi et al., 2008, 2006; Jiang et al., 2006). Esto es de hecho esperado por tratarse de una especie que ha sido perpetuada asexualmente a lo largo de las generaciones por su imposibilidad de recombinación genética. Bajo ese escenario, la conservación y caracterización de la diversidad en los bancos de germoplasma, tanto ex situ como in vitro, es indispensable para evitar la erosión genética de la especie. Es importante también generar diversidad genética. Recursos genéticos de distintas de Zingiber especialmente aquellas variedades clonales manejadas por pequeños agricultores, pueden ser una fuente útil para capturar y utilizar diversidad tanto para conservación, como para futuro mejoramiento genético de la especie (Jatoi et al., 2008).
Diversidad genética en especies relacionadas
Algunas especies estrechamente relacionadas a Z. officinale también son importantes por sus propiedades medicinales y resistencia a enfermedades limitantes. Una de estas es Z. moran, una especie silvestre que se encuentra exclusivamente en algunos lugares del Noreste de la India y que es morfológicamente semejante al jengibre común. Esta especie es intensamente usada por sus propiedades medicinales y eficiencia en el tratamiento de varias enfermedades. En un estudio reciente, alto nivel de polimorfismo entre ecotipos indianos de Z. moran, fue revelado por marcadores moleculares AFLP e ISSR. Estos resultados son útiles para la conservación de esta especie y mitigar así su riesgo de extinción (Das et al., 2013). Otra especie que merece destaque es Z. zerumbet. Investigaciones recientes han revelado su alto potencial para el tratamiento de varios tipos de cáncer y leucemia en virtud del compuesto llamado zerumbone, obtenido del aceite esencial (Mohanty et al., 2012; Singh et al., 2011). Esta especie presenta alta diversidad genética en la India cuando analizada con marcadores AFLP, además de ser fuente de resistencia al patógeno Pythium aphanidermatu, una de las enfermedades más limitantes en el cultivo del jengibre a nivel mundial (Kavitha y Thomas, 2008). Z. zerumbet, fue descrita por Sharma et al. (2011) como una planta bienal de rizomas tuberosos y de color amarillo pálido en el interior, con hojas oblongolanceoladas y glabras por el envés y espiga en forma de cono muy densa, con un pedúnculo muy largo, entre otras características, la cual se distribuye ampliamente en países asiáticos, tales como Camboya, China, India, Malasia, Tailandia y Vietnam.
Alta diversidad genética intraespecífica, a nivel molecular y morfológico, también fue revelada en accesiones de Z. barbatum procedentes de 5 regiones de Birmania (Wicaksana et al., 2011). De forma similar a este estudio, alta diversidad genética también ha sido encontrada en Z. montanum de Tailandia (Buain y Paisooksantivatana, 2010), Curcuma amada de Birmania (Jatoi et al., 2010), C. longa de Paquistán (Jan et al., 2011) y en Z. neesanum y Z. nimmoni de la India (Kavitha et al., 2010). A diferencia de estos estudios, baja diferenciación genética fue encontrada en Z. cassumunar de Tailandia, cuando analizada con marcadores AFLP (Kladmook et al., 2010).
Conclusión
El jengibre es una de las especies medicinales más importantes en el mundo; sin embargo, la revisión de estudios de diversidad genética a nivel molecular permite concluir que en el género Zingiberhay una amplia variabilidad interespecífica, mientras que la variabilidad genética dentro de Z.offi-cinale es moderada o baja, limitando así su mejoramiento genético. Esto se debe, entre otras cosas, a que el jengibre es un cultivo estéril que no produce semillas. Por tal razón, variedades clonales con la misma constitución genética han sido perpetuadas asexualmente a lo largo de las generaciones, favorecidas por el flujo o intercambio continuo de rizomas-semillas entre los agricultores de diferentes regiones. La erosión genética de esta especie es inevitable, a menos que nuevos mecanismos para generar o capturar diversidad genética sean empleados. En ese escenario, la biotecnología y conservación de los recursos genéticos en bancos de germoplasma, aunado a la introducción de nuevos materiales genéticos, es indispensable para ampliar la base genética de esta especie y de ese modo garantizar progresos genéticos durante la selección de genotipos superiores en programas de mejoramiento
Agradecimientos
La autora agradece a la Universidad Nacional Abierta y a Distancia por el apoyo a la labor investigativa del CIAB y para la preparación de este manuscrito.
Conflicto de intereses
La autora declara no tener ningún conflicto de intereses.
Referencias bibliográficas
1. ADANIYA, Shinichi. Optimal pollination environment of tetraploid ginger (Zingiber officinale Roscoe) evaluated by in vitro pollen germination and pollen tube growth in styles. In: Scientia Horticulturae. November, 2001. vol. 90, no. 3, p. 219-226. [ Links ]
2. AGARWAL, Milee; SHRIVASTAVA, Neeta; PADH, Harish. Advances in molecular marker techniques and their applications in plant sciences. En Plant Cell Reports. April, 2008. vol. 27, no. 4, p. 617-31. [ Links ]
3. AHMAD, Dawood; KIKUCHI, Akira; JATOI, Shakeel Ahmad; MIMURA, M; WATANABE, Kasuo N. Genetic variation of chloroplast DNA in Zingiberaceae taxa from Myanmar assessed by PCR-restriction fragment length polymorphism analysis. In: Annals of Applied Biology. April, 2009. vol. 155, no. 1, p. 91-101. [ Links ]
4. ALI, Badreldin H; BLUNDEN, Gerald; TANIRA, Musbah O; NEMMAR, Abderrahim. Some phytochemical, pharmacological and toxicological properties of ginger (Zingiber officinale Roscoe): a review of recent research. In: Food and Chemical Toxicology. September, 2008, vol. 46, no. 2, p. 409-20. [ Links ]
5. ARAGAW, Momina; ALAMEREW Sentayehu; MICHAEL, Girma; TES-FAYE, Abush. Variability of ginger (Zingiber officinale Rosc.) accesions for morphological and some quality traits in Etiopia. In: International Journal of Agricultural Research. 2011. vol. 6, no. 6 p. 444-457. [ Links ]
6. ASHRAF, Kamran; AHMAD, Altaf; CHAUDHARY, Anis; MUJEEB, Mohd; AHMAD, Sayeed; AMIR, Mohd; MALLICK, N. Genetic diversity analysis of Zingiber officinale Roscoe by RAPD collected from subcontinent of India. In: Saudi Journal of Biological Sciences. April 2014. vol. 21, no. 2, p. 159-165. [ Links ]
7. BALIGA, Manheshwar S; HANIADKA, Raghavendra; PEREIRA, Mani-sha M; D'SOUZA, Jason J; PALLATY, Princy L; BHAT, Harshith P; PO-PURI, Sandhya. Update on the chemopreventive effects of ginger and its phytochemicals. In: Critical Reviews in Food Science and Nutrition. June, 2011. vol. 51, no. 6, p. 499-523. [ Links ]
8. BOSSETI, Fátima; ZUCCHI, Maria I; PINHEIRO, Jose B. Molecular and morphological diversity in Japanese rice germplasm. In: Plant Genetic Resources: characterization and utilization. July, 2011. vol. 9, no. 2, p. 229-232. [ Links ]
9. BUA-IN, Saowaluck; PAISOOKSANTIVATANA, Yingyong. Study of clonally propagated cassumunar ginger (Zingiber montanum (Koenig) Link ex Dietr.) and its relation of wild Zingiber species from Thailand revealed by RAPD markers. In: Genetic Resources and Crop Evolution. March, 2010. vol. 57, no. 3, p. 405-414. [ Links ]
10. BUTT, Masood S; SULTAN, M. Tauseef. Ginger and its health claims: molecular aspects. In: Critical Reviews in Food Science and Nutrition. April, 2011. vol. 51, no. 5, p. 383-393. [ Links ]
11. CHANDRASEKAR, Arumugam; RIJU, Aikkal; SITHARA, Kandiyl; ANOOP, Sahadevan; EAPEN, Santhosh J. Identification of single nucleotide polymorphism in ginger using expressed sequence tags. In: Bioinformation. September, 2009. vol.4, no. 3, p. 119-122. [ Links ]
12. CHAVAN, Preeti; WARUDE, Dnyaneshwar; JOSHI, Kalpana; PA-TWARDHAN, Bhushan. Development of SCAR (sequence-characterized amplified region) markers as a complementary tool for identification of ginger (Zingiber officinale Roscoe) from crude drugs and multicomponent formulations. In: Biotechnology and Applied Biochemistry. December, 2010. vol. 50, no.1, p.61-69. [ Links ]
13. CHAVES, Francisco Celio M; FIGUEIRA, Glyn M; PRAL,Yves M; CRAVEIRO, Esmeraldino R;VAZ, Ana Paula A. Avaliação agronômica e caracterização química de acessos de gengibre (Zingiber officinale) nas condições de Manaus, AM. En: Horticultura Brasileira. Julio, 2012 vol. 30, no. 2, p. 5805-5809. [ Links ]
14. CHONGTHAM, T; CHATTERJEE, R; HNAMTE, V; CHATTOPADH-YAY P.K; KHAN, S.A. Ginger (Zingiber officinale Rosc) germplasm evaluation for yield and quality in south-ern West Bengal. In: Journal of Spices and Aromatic Crops. January, 2013. vol. 22, no. 1, p. 88-90. [ Links ]
15. DAS, Abhijit; KESARI, V; SATYANARAYANA, V. Madurai; PARIDA, Ajay; MITRA, Susmita; RANGAN, Latha. Genetic diversity in ecotypes of 30. the scarce wild medicinal crop Zingiber moran revealed by ISSR and AFLP marker analysis and chromosome number assessment. In: Plant Biosystems. June, 2013.Vol. 149, no. 1, p. 111-120. [ Links ]
16. DAS, Premananda; RAI, S; DAS, A.B. Cytomorphological barriers in seed set of cultivated ginger (Zingiber officinale Rosc.). In: Iranian Journal of Botany. 1999. vol. 8, no.1, p.119-129. [ Links ]
17. DHAMAYANTHI, K.P.M; SASIKUMAR, Bhaskaran; REMASHREE, Azhimala B. Reproductive biology and incompatibility studies in ginger (Zingiber officinale Rosc). In: Phytomorphology. April, 2003. vol. 32, no. 2, p. 123-131. [ Links ]
18. DING, S.H; AN, K.J; ZHAO, C.P; LI, Y; GUO, Yingjie H; WANG, Z.F. Effect of drying methods on volatiles of Chinese ginger (Zingiber officinale Roscoe). In: Food and Bioproducts Processing. July, 2012. vol. 90, no. 3, p. 515-524. [ Links ]
19. FAOSTAT, 2015. Estadísticas agrícolas mundiales. (Citado 16 de Abril de 2015). Disponible en internet: <http://www.faostat.fao.org> [ Links ].
20. GEIGER, James L. The essential oil of ginger and anaesthesia. In: International Journal of Aromatherapy. September, 2005. vol. 15, no. 1, p. 7-14. [ Links ]
21. GHOSH, Subhabrata; MAJUMDER, P.B; MANDI, Swati S. Species-specific AFLP markers for identification of Zingiber officinale, Z. montanum and Z zerumbet (Zingiberaceae). In: Genetics and Molecular Research. February, 2011. vol. 10, no.1, p. 218-229. [ Links ]
22. GHOSH, Subhabrata; MANDI, Swati S. Study of Genetic Variation among Some Wild Landraces of Zingiber officinale Roscoe Correlated with Their Antioxidant Potential Status. In: Journal of Molecular Biology Research. December, 2011. vol.1, no.1, p. 77-87. [ Links ]
23. HANGELBROEK, H.H; OUBORG, N.J; SANTAMARIA, Luis; SCHWENK, S. Clonal diversity and structure within a population of the pondweed Potamogeton pectinatus foraged by Bewick's swans. In: Molecular Ecology. October, 2002. vol. 11, no. 10, p. 2137-2150. [ Links ]
24. HARISARANRAJ, R; SURESH, K; SARAVANABABU, S. DNA Finger Printing Analysis among eight varieties of Zingiber officinale Rosc. By Using RAPD Markers. In Global Journal of Molecular Sciences. June, 2009. vol. 4, no. 2, p. 103-107. [ Links ]
25. HASSANPOURAGHDAM, Mohammad Bagher; AAZAMI, Mohammad Ali; SHALAMZARI, Mohammad Saf; BANEH, H. Doulati. Essential oil composition of Zingiber officinale Rosc. rhizome from the Iranian herb market. In Chemija. 2011. vol. 22, no. 1, p. 56-59. [ Links ]
26. ISLAM, K.M; ISLAM, Aminul K.M.A; RASUL, Mohammad G; SULTANA, N; MIAN, M.A.K. Genetic variability and character association in ginger (Zingiber officinale Rosc.). In: Annal of Bangladesh Agriculture. 2008. vol. 12, no.1, p. 69-76. [ Links ]
27. JAN, Hikmat Ullah; RABBANI, Malik Ashiq; SHINWARI, Zabta Khan. Assessment of genetic diversity of indigenous turmeric (Curcuma longa L.) germplasm from Pakistan using RAPD markers. In: Journal of Medicinal Plants. March, 2011.vol. 5, no. p. 823-830. [ Links ]
28. JATOI, Shakeel Ahmad; KIKUCHI, Akira; MIMURA, Makiko; SAN-SAN-Yi; WATANABE, Kazuo N. Relationships of Zingiber species, and genetic variability assessment in ginger (Zingiber officinale) accessions from ex-situ genebank, on-farm and rural markets. In: Breeding Science. June, 2008. vol. 58, no. 3, p. 261-270. [ Links ]
29. JATOI, Shakeel Ahmad; KIKUCHI, Akira; SAN-SAN-Yi; NAING, Khau Wai; YAMANAKA, Shinsuke.; WATANABE, Junko A; WATANABE, Kazuo N. Use of Rice SSR Markers as RAPD Markers for Genetic Diversity Analysis in Zingiberaceae. In: Breeding Science. June, 2006. vol. 56, no. 2, p. 107-111. [ Links ]
30. JATOI, Shakeel Ahmad; KIKUCHI, Akira; AHMAD, Dawood; WATA-NABE, Kazuo N. Characterization of the genetic structure of mango ginger (Curcuma amada Roxb.) from Myanmar in farm and gene-bank collection by the neutral and functional genomic markers. In: Electronic Journal of Biotechnology. November, 2010. vol. 13, no. 6, p. 1- 11. [ Links ]
31. JATOI, Shakeel Ahmad; WATANABE, Kazuo N. Diversity analysis and relationships among ginger landraces. In Pakistan Journal of Botany. 2013. vol. 45, no. 4, p. 1203-1214. [ Links ]
32. JIANG, Hongliag; SÓLYOM, Aniko M; TIMMERMANN, Barbara N; GANG, David R. Characterization of gingerol-related compounds in ginger rhizome (Zingiber officinale Rosc.) by high-performance liquid chromatography/electrospray ionization mass spectrometry. In Rapid Communications in Mass Spectrometry. October, 2005. vol. 19, no. 20, p. 2957-2964. [ Links ]
33. JIANG, Hongliag; XIE, Zhengzhi; KOO, Hyun Jo; McLAUGHLIN, Steven P; TIMMERMANN Barbara N; GANG, David R. Metabolic profiling and phylogenetic analysis of medicinal Zingiber species: Tools for authentication of ginger (Zingiber officinale Rosc.). In: Phytochemistry. August, 2006. vol. 67, no. 15, p. 1673-1685. [ Links ]
34. KALIA, Rajwant K; RAI, Manoj K; KALIA Sanjay; SINGH, Rohtas; DHAWAN, A. K. Microsatellite markers: an overview of the recent progress in plants. In: Euphytica.February, 2011. vol. 177, no. 3, p. 309-334. [ Links ]
35. KAR, Dattatreya; PATTANAIK, Pratap Keshari; ACHARYA, Laxmikan-ta; PANDA, Manoj Kumar; SATHAPATHY, Kamalakanta; KUANAR, Ananya; MISHRA, Budahdeva. Assessment of genetic diversity among some elite cultivars of ginger (Zingiber officinale Rosc.) using isozyme and protein markers. In: Brazilian Journal of Botany. December, 2014. vol. 37, no. 4, p. 469-479. [ Links ]
36. KAVITHA, P.G; KIRAN, A.G; DINESH, Raj R; SABU, M; THOMAS, George. Amplified fragment length polymorphism analyses unravel a striking difference in the intraspecific genetic diversity of four species of genus Zingiber Boehm. From the Western Ghats, South India. In: Current Science. January, 2010. vol. 98, no. 2, p. 242-247. [ Links ]
37. KAVITHA, P.G; THOMAS, George. Population genetic structure of the clonal plant Zingiber zerumbet (L.) Smith (Zingiberaceae), a wild relative of cultivated ginger, and its response to Pythium. In: Euphytica. March, 2008. vol. 160, no. 1, p. 89-100. [ Links ]
38. KIZHAKKAYIL, Jaleel; SASIKUMAR, Bhaskaran. Variabilty for quality traits in a global germplasm collection of ginger (Zingiber officinale R). In: Current Trends Biotechnology and Pharmacy. July, 2009. vol. 3, no. 3, p. 254-257. [ Links ]
39. KIZHAKKAYIL, Jaleel; SASIKUMAR, Bhaskaran. Genetic diversity analysis of ginger (Zingiber officinale Rosc.) germplasm based on RAPD and ISSR markers. In: Scientia Horticulturae. May, 2010. vol. 125, no. 1, p. 73-76. [ Links ]
40. KIZHAKKAYIL, Jaleel; SASIKUMAR, Bhaskaran. Diversity, characterization and utilization of ginger: a review. In Plant Genetic Resources. August, 2011. vol. 9, no. 3, p. 464-477. [ Links ]
41. KLADMOOK, Maytinee; CHIDCHENCHEY, Sopida; KEERATINI-JAKAL, Vichien. Assessment of genetic diversity in cassumunar ginger (Zingiber cassumunarRoxb.) in Thailand using AFLP markers. In: Breeding Science. December, 2010. vol. 60, no. 4, p. 412-418. [ Links ]
42. KUBRA, I. Rahath; MOHAN RAO, L. Jagan. M. An Impression on Current Developments in the Technology, Chemistry, and Biological Activities of Ginger (Zingiber officinale Roscoe). In: Critical Reviews in Food Science and Nutrition. July, 2012. vol. 52, no. 8, p. 651-688. [ Links ]
43. KUN-HUAI, Wei; JIAN-HUA, Miao; HE-PING, Huang; SHAN-LI, Gao. Generation of autotetraploid plant of ginger (Zingiber officinale Rosc.) and its quality evaluation. In: Pharmacognozy Magazine. Jul-Sep, 2011. vol.7, no. 27, p. 200-206. [ Links ]
44. LEE, Sok-Young; FAI, Wan Kah; ZAKARIA, Myriana; IBRAHIM, Halijah; OTHMAN, RofinaYasmin; GWAG, Jae-Gyun; RAO, V. Ramanatha; PARK, Yong-Jin. Characterization of polymorphic microsatellite markers, isolated from ginger (Zingiber officinale Rosc.). In: Molecular Ecology Notes. November, 2007. vol.7, no.6, p.1009-1011. [ Links ]
45. LINCY, Adinkudikuyya; JAYARAJAN, K; SASIKUMAR, Bhaskaran. Relationship between vegetative and rhizome characters and final rhizome yield in micropropagated ginger plants (Zingiber officinale Rosc.) over two generations. In: Scientia Horticulturae. September, 2008. vol. 118, no. 1, p. 70-73. [ Links ]
46. MAHDI, Harith Jameel; ANDAYANI, Retno; AZIZ, Ishak. Determination of phylogenetic and molecular characteristics of three Malaysian Ginger Cultivars (Zingiber officinale Roscoe) usinng microsatellite DNA. In: Tropical Life Sciences Research. December, 2013. vol. 24, no. 2, p. 65-76. [ Links ]
47. MENON, A. Nirmala. Chemical composition of the essential oil from leaves and roots of ginger (Zingiber officinale) from Kerala. In: Journal of Medicinal and Aromatic Plant Sciences. April-Jun, 2007. vol. 29, no. 2, p. 78-80. [ Links ]
48. MOHANTY, Sujata; PARIDA, Reena; KUANAR, Ananya; SAHOO, S; NAYAK, Sanghamitra. Evaluation of genetic fidelity of in vitro propagated shampoo ginger (Zingiber zerumbet Smith) using DNA based markers. In: Journal of Medicinal Plants Research.April, 2012. vol. 6, no. 16, p. 3143-3147. [ Links ]
49. NAMPOOTHIRI, Suresh V; VENUGOPALAN, V.V; JOY, Baena; SREE-KUMAR, M.M; MENON, A. Nirmala. Comparison of Essential oil Composition of Three Ginger Cultivars from Sub Himalayan Region. In: Asian Pacific Journal of Tropical Biomedicine. December, 2012. vol. 2, no. 3, p. S1347-S1350. [ Links ]
50. NAYAK, Sanghamitra; NAIK, Pradeep K; ACHARYA, Laxmikanta; Mukherjee, Arup K; Panda, Pratap C; Das, Premananda. Assessment of Genetic Diversity among 16 Promising Cultivars of Ginger Using Cytological and Molecular Markers. In: Zeitschrift fur Naturforschung. June, 2005. vol. 60c, no. 5-6, p. 485-492. [ Links ]
51. PADALIA, Rajendra Chandra; VERMA, Ram Swarop; SAH, A.N; KARKI, N; SUNDARESAN, V; SAKIA, D. Leaf and rhizome oil composition of Zingiber officinale Roscoe and their antibacterial and antioxidant activities. In: Asian Journal of traditional medicines. 2011. vol. 6, no. 2, 65 p. 73-82. [ Links ]
52. PALAI, Siddharth Kumar; ROUT, Gyana Ranjat. Identification and genetic variation among eight varieties of ginger by using random amplified polymorphic DNA markers. In: Plant Biotechnology. December, 2007. vol. 24, no. 4, p. 417-420. [ Links ]
53. PANDOTRA, Pankaj; GUPTA, Ajai P; GHANDIRAM; HUSIAN, Mohd K; GUPTA, Suphla. Genetic and chemo-divergence in eighteen core collection of Zingiber officinale from North-West Himalayas. In: Scientia Horticulturae. August, 2013. vol. 160, p. 283-291. [ Links ]
54. PANDOTRA, Pankaj; GUPTA, Ajai P; HUSAIN, Mohd K; GHANDIRAM; GUPTA, Suphla. Evaluation of genetic diversity and chemical profile of ginger cultivars in north-western Himalayas. In: Biochemical Systematics and Ecology. June, 2013. vol. 48, p. 281-287. [ Links ]
55. PANDOTRA, Pankaj; GUPTA, Ajai P; KHAN, Saima; RAM, Gandhi; GUPTA, Suphla. A comparative assessment of ISSR, RAPD, IRAP, & REMAP molecular markers in Zingiber officinale germplasm characterization. In: Scientia Horticulturae. October, 2015. vol. 194, p. 201-207. [ Links ]
56. PANDOTRA, Pankaj; HUSAIN, Mohd Kashif; RAM, Gandhi; GUPTA, Suphla.; GUPTA, Ajai Prakash. Retrotransposon based genetic status of North-West Himalayan Zingiber officinale revealed high heterogeneity. In: Journal of Plant Biochemistry and Biotechnology.April, 2014. vol. 23, no. 2, p. 211-216. [ Links ]
57. PAWAR, Nilesh; PAI, Sandeep; NIMBALKAR, Mansingraj; KOLAR, Fir-dose; DIXIT, Ghansham. Induction of chlorophyll mutants in Zingiber officinale roscoe by Gamma Rays and EMS. In: Emirates Journal of Food and Agriculture. October, 2010. vol. 22, no. 5, p. 406-411. [ Links ]
58. PETER, K.V; RAVINDRAN, P; NIRMAL BABU, K; DIVAKARAN, M. HORTICULTURE (Vegetables , Tubers & Spice Crops ). Kerala (India), Octubre, 2007. (Citado 16 de Abril de 2015). Disponible en internet en: http://nsdl.niscair.res.in/jspui/bitstream/123456789/471/I/revised%20Breeding%20of%20spices.pdf. [ Links ]
59. PRASATH, D; SAJI, K; SASIKUMAR, Bhaskaran; KRISHNAMOORTHY B; ANANDARAJ, M. Genetic diversity and conservation in major spices. In: National Symposium on Spices and Aromatic: exploting spices production potential of the Deccan region (4: 8-10, December: Dharwad, Karnataka). Souvenir and Abstracts. Kerala, India.: Indian Society for Spices, 2011. p.41-57. [ Links ]
60. PREM, Jithin; KIZHAKKAYIL, Jaleel; THOMAS, Elizabeth; DHANYA, K; SYAMKUMAR, S; SASIKUMAR, Bhaskaran. Molecular characterization of primitive, elite and exotic ginger genotypes to protect the biowealth of elite ginger accessions. In: Journal of Spices and Aromatic Crops. 2008. vol.17, no. 2, p. 85-90, 2008. [ Links ]
61. RAMACHANDRAN, Kishore. Poliploidy induced in ginger by colchicine treatment. In: Current Science. March, 1982. Vol. 5, no. 6, p.288-289. [ Links ]
62. RASHID, Kamaludin; DARAN, Abu Bakar; NEZHADAHMADI, Arash; ZAINOLDIN, Khairul Hazmi; AZHAR, Shamrul; EFZUENI, Shahril. The effect of using gamma rays on morphological characteristics of ginger (Zingiber officinale) plants. In: Life Science Journal. February, 2013. vol. 10, no. 1, p. 1538-1544. [ Links ]
63. RAVINDRAN, P. N; NIRMAL BABU, K; SHIVA, K.N. Botany and Crop Improvement of Ginger. In: Ginger The Genus Zingiber. I ed. Washington: P.N. Ravindran; K. Nirmal Babu. 2005. p.15-33. [ Links ]
64. RAVINDRAN, P.N; SASIKUMAR, Bhaskaran; GEORGE, Johnson K; RATNAMBAL, M.J; NIRMAL BABU, K; ZACHARIAH, John T; NAIR, R.R. Genetic resources of ginger (Zingiber ofticinale Rose.) and its conservation in India. In: Plant Genetic Resources Newsletter. 1994. no. 98, p. 1-5. [ Links ]
65. RENE, Yonn Ai; RASHID, Kamaludin; TAJUDIN, Anas; ZAINOLDIN, Khairul Hazmi; DARAN, Abu Bakar; NEZHADAHMADI, Arash; GO-LAM, Faruq. The contribution of muslim scientists in botanical science: studies on the using of gamma rays for ginger plants (Zingiber officinale). In: Stem Cell. December, 2014. vol. 5, no. 4, p. 88-94. [ Links ]
66. SAJEEV, S; ROY, A. R; IANGRAI, B; PATTANAYAK, A; DEKA, B.C. Genetic diversity analysis in the traditional and improved ginger (Zingi-ber officinale Rosc.) clones cultivated in North-East India. In: Scientia Horticulturae. April, 2011. vol.128, no. 3, p. 182-188. [ Links ]
67. SALMON, Collen N.A; BAILEY-SHAW Yvonne A; HIBBERT, Sheridan; GREEN, Cheryl; SMITH, Ann M; WILLIAMS, Lawrence A.D. Characterisation of cultivars of Jamaican ginger (Zingiber officinale Roscoe) by HPTLC and HPLC. In: Food Chemistry. April, 2012. vol. 131, no. 4, p. 1517–1522. [ Links ]
68. SANWAL, Satish K; RAI, N; SINGH, Jagdish; BURAGOHAIN, Juri. Antioxidant phytochemicals and gingerol content in diploid and tetraploid clones of ginger (Zingiber officinale Roscoe). In: Scientia Horticulturae. March, 2010. vol. 124, no. 2, p. 280–285. [ Links ]
69. SASIDHARAN, Indu; VENUGOPAL, V.V; MENON, Nirmala A. Essential oil composition of two unique ginger (Zingiber officinale Roscoe) cultivars from Sikkim. In: Natural Product Research. October, 2012. vol. 26, no. 19, p. 1759–1764. [ Links ]
70. SASIKUMAR, Bhascaran; GEORGE, Johnson K; RAVINDRAN, P.N. IISR varada- a new high yielding ginger (Zingiber officinale Rosc.) variety. In: Journal of Spices and Aromatic Crops. June, 1996. vol. 5, no. 1, p. 34–40. [ Links ]
71. SASIKUMAR, Bhascaran; SAJI, K.V; ANTONY, A; GEORGE, Johnson K; ZACHARIAH, T. J; EAPEN, S. J. IISR Mahima and IISR Rejatha - two high yielding and high quality ginger (Zingiber officinale Rosc.) varieties. In: Journal of Spices and Aromatic Crops. June, 2003. vol. 12, no. 1, p. 34–37. [ Links ]
72. SCHLÕTTERER, Christian. The evolution of molecular markers - just a matter of fashion?. In Nature reviews Genetics. January, 2004. vol. 5, p. 63-69. [ Links ]
73. SHARMA, Gurumayum Jitendra; PUKHRAMBAM, Chirangini; KI-SHOR, Rajkumar. Gingers of Manipur: diversity and potentials as bio-resources. In: Genetic Resources and Crop Evolution. June, 2011. vol. 58, no. 5, p. 753-767. [ Links ]
74. SHIRIN, Adel; Prakash, Jamuna. Chemical composition and antioxidant properties of ginger root (Zingiber officinale). In: Journal of Medicinal Plants Research. December, 2010. vol. 4, no. 24, p. 2674-2679. [ Links ]
75. SHUKLA, Yogeshwer; SINGH, Madhulika. Cancer preventive properties of ginger: a brief review. In Food and chemical toxicology. May, 2007. vol. 45, no. 5, p. 683-690. [ Links ]
76. SINGH, Chingakham B; NONGALLEIMA, K; BROJENDROSINGH, S; NINGOMBAM, Swapana; LOKENDRAJIT, N; SINGH, L. W. Biological and chemical properties of Zingiber zerumbet Smith: a review. In: Phytochemistry Reviews. March, 2012. vol. 11, no. 1, p. 113-125. [ Links ]
77. SINGH, Gurdip; KAPOOR, I.P. S; SINGH, Prathiba; HELUANI, Carola S; LAMPASONA, Marina P; CATALAN, Cesar A.N. Chemistry, antioxidant and antimicrobial investigations on essential oil and oleore-sins of Zingiber officinale. In: Food and Chemical Toxicology. October, 2008. vol. 46, no. 10, p. 3295-3302. [ Links ]
78. SINGH, Thingbaijam Dikash; DEVI, Khumallambal Devala; SHAGOL-SEM, Brojendro Singh; SINGH, Chingakham Brajakishor; DEVI, Huin-drom Sunitibila. Assessment of Genetic Stability in Traditional Ginger Cultivated in Manipur, India Based on Molecular and Chemical Markers. In: Analytical Letters. November, 2013. vol. 46, no. 18, p. 2941-2953. [ Links ]
79. SMITH, M.K; HAMILL, S.D; GOGEL, B. J; SEVERN-ELLIS, A. A. Ginger (Zingiber officinale) autotetraploids with improved processing quality produced by an in vitro colchicine treatment. In: Australian Journal of Experimental Agriculture. November, 2004. vol. 44, no. 10, p. 1065-1072. [ Links ]
80. STOILOVA, I; KRASTANOV, Albert; STOYANOVA, A; DENEV, P; GARGOVA, S.Antioxidant activity of a ginger extract (Zingiber officinale). In Food Chemistry. 2007. vol. 102, no. 3, p. 764-770. [ Links ]
81. VERMA, Ram S;VERMA, Rajesh K; PADALIA, Rajendra C; CHAUHAN, Amit; SINGH, Anand; SINGH, Hermendra P. Chemical Diversity in the Essential Oil of Indian Valerian (Valeriana jatamansiJones). In: Chemistry & Biodiversity. October, 2011. vol. 8, no. 10, p. 1921-1929. [ Links ]
82. WANG, Lei; GAO, Fan-sheng; XU, Kun; LI, Xiu. Natural occurrence of mixploid ginger (Zingiber officinale Rosc.) in China and its mormorphological variations. In: Scientia Horticulturae. June, 2014. vol. 172, p. 54–60. [ Links ]
83. WICAKSANA, Noladhi; GILANI, Syed Abdullah; AHMAD, Dawood; KIKUCHI, Akira; WATANABE, Kazuo N. Morphological and molecular characterization of underutilized medicinal wild ginger (Zingiber barbatum Wall.) from Myanmar. In: Plant Genetic Resources. December, 2011. vol. 9, no. 4, p. 531–542. [ Links ]
84. WOHLMUTH, Hans; LEACH, David N; SMITH, Mike M; MYERS, Stephen P. Gingerol Content of Diploid and Tetraploid Clones of Ginger (Zingiber officinale Roscoe). In: Journal Of Agricultural and Food Chemistry. June, 2005. vol. 53, no. 14, p. 5772–5778. [ Links ]
85. WOHLMUTH, Hans; SMITH, Mike M; BROOKS Lyndon O; MYERS, Sthepen P; LEACH, David N. Essential Oil Composition of Diploid and Tetraploid Clones of Ginger (Zingiber officinale Roscoe) Grown in Australia. In: Journal Of Agricultural and Food Chemistry. January, 2006. vol. 54, no. 4, p. 1414–1419. [ Links ]