Introducción
La medición y el monitoreo de carbono en ecosistemas de alta montaña se ha tornado un importante tópico de investigación en los años recientes, como resultado del cambio climático. Particularmente, es importante su cuantificación para disponer de datos empíricos en las negociaciones para reducir las emisiones de gases efecto invernadero asociadas a deforestación y degradación forestal (REED) (Goetz & Dubayah, 2011). Así mismo, los registros de carbono en páramo contribuyen a conocer y mejorar la cuantificación de sumideros y flujos de carbono en estos entornos (Hall et al., 2011; Houghton, 2007; Herold & Skutsch, 2011). Aunque los ecosistemas tropicales de alta montaña se distinguen por su provisión de servicios hidrológicos (Martínez et al., 2009) y la protección de la biodiversidad (Martínez et al., 2009; Gentry, 1992) su rol en almacenamiento de carbono es menos conocido. Así que disponer de una síntesis del carbono almacenado en el páramo podría contribuir a destacar la función de este ecosistema en la política internacional de cambio climático, por lo que puede ayudar a fundamentar la adopción de incentivos económicos para apoyar un mejor manejo de los recursos naturales en estos ecosistemas (Ward et al., 2015).
El presente estudio pretende integrar los aspectos fundamentales que determinan el carbono almacenado en el ecosistema de páramo. Para ello se busca responder a dos preguntas que inquietan a los tomadores de decisiones para definir la gestión del territorio en este ecosistema: 1) ¿Cuál de los componentes del páramo es más eficaz en el almacenamiento de carbono? y 2) ¿Qué implicaciones tienen las actividades agropecuarias en el carbono almacenado en páramo?. El documento inicia presentando las mayores reservas del carbono en el planeta; a continuación se mencionan las características generales del páramo; posteriormente se sintetizan los avances en estimaciones de carbono almacenado en biomasa aérea y en suelo de este ecosistema; seguidamente se describe la forma en que las actividades agropecuarias afectan el carbono en el páramo, así como prácticas agrícolas que pueden mitigar sus pérdidas. Finalmente, para responder a incertidumbres sobre carbono almacenado se proponen algunas líneas futuras de investigación en este ecosistema.
1. Mayores reservas de carbono en el planeta
Las cuatro mayores reservas son la atmósfera, los océanos, existencias de combustibles fósiles y ecosistemas terrestres, incluyendo vegetación y suelos. Las cantidades anuales de carbono intercambiadas por procesos como erosión, vulcanismo y formación de rocas sedimentarias durante milenios, han sido pequeñas y generalmente ignoradas en las existencias de carbono cuantificadas (Sundquist & Visser 2004).
La atmósfera. En el 2005, el promedio global de concentración de CO2 estuvo cercano a 0,0380% ppmv (partes por millón por volumen), equivalente a aproximadamente 805 PgC (1 Pg= 1 pentagramo = 1015 g= 109 toneladas métricas). El metano (~1,7 ppm), monóxido de carbono (~0,I ppm), e hidrocarburos no metánicos son otros gases que contienen carbono pero que desde el punto de vista del equilibrio de carbono global pueden ser ignorados (Houghton, 2007).
Los océanos. La cantidad total de carbono en los océanos del mundo es de aproximadamente 38000 pentagramos de carbono (PgC). Es decir, cerca de 50 veces más carbono que en la atmósfera. La mayoría del carbono del océano se encuentra en aguas intermedias y profundas. Únicamente entre 700-1000 PgC están en la superficie del océano en contacto directo con la atmósfera. También 6000 PgC de carbono reactivo se hallan en los sedimentos del océano. Aunque este último es importante en la determinación de concentración de CO2 a largo plazo en la atmosfera y océanos, es menos importante en el ciclo del carbono en el corto plazo (Houghton, 2007).
La mayoría de los gases no son solubles en agua, por lo cual predominan en la atmósfera. Por ejemplo, solo cerca del 1% del oxígeno del planeta está en el océano y el 99% está en la atmósfera. Sin embargo, la distribución de carbono entre el aire y el mar está invertida: 98.5% del carbono del sistema océano-atmósfera está en el mar, debido a la química del agua de mar. Casi todo el carbono existe como carbono inorgánico disuelto (CID) y la mayoría del CID se halla en forma de bicarbonato y iones de carbonato. Menos del I% del CID está en forma de CO2 disuelto (Sarmiento et al., 1993). Aproximadamente 1000 PgC del CID es orgánico. La mayoría de este último se encuentra en forma disuelta y aproximadamente 3 PgC está en los organismos vivientes (Houghton, 2007).
Ecosistemas terrestres: Vegetación y suelo. El carbono integra cerca de 0.27% de la masa de los elementos de la corteza terrestre (Kempe 1979), aun cuando representa aproximadamente el 50% de la materia seca. La cantidad de carbono contenida en la vegetación terrestre es del orden de 550±100 Pg. La materia orgánica en suelos es 2 a 3 veces esta cantidad (1500-2000 PgC en el primer metro del suelo y 2300 Pg en los primeros 3 metros (Jobággy & Jackson, 2000). Los bosques son particularmente importantes como reservorios de carbono porque los árboles almacenan más carbono por unidad de área que otros tipos de vegetación (Houghton, 2007).
Los combustibles fósiles. El carbono, el petróleo y el gas natural son los residuos de materia orgánica formada hace millones de años por las plantas verdes. La cantidad de carbono almacenado en combustibles fósiles se estima entre 5000-10000 PgC. Mayor que cualquier otro reservorio, excepto a la profundidad del mar y aproximadamente 10 veces el contenido de carbono de la atmósfera (Houghton, 2007).
2. Métodos de cuantificación de carbono en biomasa aérea y suelo
2.1. Métodos empleados para estimar biomasa
La biomasa forestal, definida como la cantidad total de materia orgánica viva de árboles, expresada en toneladas secas por unidad de área, permite estimar el carbono almacenado en los bosques, dado que el 50% de ella está integrada por carbono (Brown, 1997). Incluye la biomasa aérea y subterránea de la masa viva, como árboles, arbustos, hierbas, raíces y la masa muerta de la hojarasca y residuos gruesos y finos asociados con el suelo (Lu, 2006). En el bosque húmedo tropical el estudio de la biomasa es dispendioso debido a su complejidad, expresada en su estructura y variada composición de especies (Lu et al., 2005). Sin embargo, cada día son más los estudios en estos temas, especialmente de biomasa aérea, que utilizan metodologías variadas, por lo que se genera una gran incertidumbre respecto a cuál es la mejor, en precisión.
Hay dos formas de abordar las estimaciones de biomasa, de acuerdo con el tipo de método utilizado: Métodos de mediciones directas en parcelas y métodos indirectos. Los primeros implican medir por parcela el diámetro, la altura y la densidad de la madera. A partir de allí hay dos opciones: la extracción y fraccionamiento del árbol para tomar el peso húmedo de tronco, ramas, flores y frutos (Klinge et al., 1975) o el desarrollo de ecuaciones alométricas con los valores obtenidos en campo (Nelson et al., 1999). Para el primer caso, una vez seccionado el árbol se registra in situ el peso húmedo de sus partes, se lleva al laboratorio para deshidratarlas y obtener su peso seco. Esta información se utiliza posteriormente para predecir la biomasa por árbol, mediante regresiones que generan un modelo.
Un método indirecto consiste en utilizar la información de volumen de madera obtenida a partir de inventarios de bosque para convertirlos a biomasa (Brown & Lugo, 1992). Este método es preciso para zonas específicas, aunque tiene como desventajas el ocupar mucho tiempo, alto costo y ser poco práctico para niveles de análisis de país (Feldspausch et al., 2012).
De manera directa o indirecta, con los datos de campo se construyen modelos mediante el uso de programas estadísticos. Para seleccionar la ecuación de mejor ajuste se comprueban los supuestos de análisis de regresión (normalidad, independencia y homogeneidad de varianzas). Aquellos que no cumplen los supuestos son eliminados. Seguidamente se calculan indicadores de ajuste como coeficiente de determinación ajustado (R2) el error estándar de la estimación y la suma de los cuadrados de los residuos de los predichos. También se calcula la capacidad predictiva de los modelos mediante el error cuadrático medio y la diferencia agregada. Para modelos con transformaciones logarítmicas se aplica un factor de corrección (Fonseca et al., 2009). En otros casos, el mejor modelo se elige mediante la aplicación del criterio de información Akike, el error residual estándar y el error relativo estimado (Álvarez et al., 2012).
2.2. Métodos para estimar carbono en suelo
El carbono orgánico del suelo (COS) es una medida de la cantidad total de carbono orgánico en el suelo. El interés en COS se fundamenta en que esta medida es un indicador de calidad de suelo. En consecuencia, su variación puede tener implicaciones en procesos ambientales como fertilidad de suelo, erosión y flujos de gases efecto invernadero (Stolbovoy et al., 2007).
Determinar el carbono en el suelo con alta precisión es esencial para cuantificar el secuestro de carbono. Se han desarrollado métodos ex situ e in situ que incrementan la precisión y la costo-efectividad. Los métodos ex situ involucran colectar muestras representativas de suelo para medir la concentración de carbono mediante técnicas de combustión seca o húmeda. Este último proceso involucra la oxidación de material orgánico mediante una mezcla de ácidos y la medición del CO2 por métodos gravimétricos o manométricos (Chatterjee et al., 2009). En la actualidad se utilizan métodos automatizados denominados analizadores de carbono total. Estos se fundamentan en la medición de conductividad térmica de los gases emitidos (Tabatabai et al., 1991).
Los métodos in situ plantean alta precisión sin ocupar mucho tiempo en el procesamiento y análisis de muestras. Están basados en sensores remotos y mediciones espectros-cópicas en campo. Los métodos espectroscópicos incluyen reluctancia infrarroja cercana (NIR, por sus siglas en inglés) e intermedia y espectroscopia de plasma inducida por láser (LIBS, por sus siglas en inglés). El potencial de estos métodos se evalúa al comparar los resultados con los obtenidos mediante análisis de las muestras de suelo por el método de combustión seca. (Chatterjee et al., 2009).
3. El ecosistema de páramo
Los páramos son paisajes bioclimáticos desarbolados y fríos, localizados entre los 3.200 y 3.800 m de altitud (Cua-trecasas, 1989). Son propios de las montañas neotropicales de Costa Rica, Panamá y los Andes de Venezuela, Colombia, Ecuador y el norte del Perú (Luteyn, 1999). Los páramos de la cordillera de los Andes son ecosistemas de la parte alta de la montaña, con una gran variedad de lagos y turberas. La vegetación está integrada mayoritariamente por vastas áreas de gramíneas naturales como Calamagrostis effusa, grandes plantas arrocetadas como el frailejón (Espeletia, sp.) (Hofstede, 1995), mezcladas con matorrales, donde predominan arbustos de los géneros Castilleja, Diplos-tephium, Hypericum y Pentacalia y parches de bosque que pueden alcanzar hasta los 10 m de altura como el Polylepis quadrijuga, Escallonia myrtelloides y Hesperomeles obtusifolia (Pedraza et al., 2005).
Los páramos cubren las partes altas de los Andes, entre los 11° N y 8° latitud S, formando una banda discontinua entre la Cordillera de Mérida, en Venezuela, y la depresión de Huancambaba, en el norte del Perú. Además, existen dos páramos complejos separados. Uno en Costa Rica y el otro en la Sierra Nevada de Santa Marta, Colombia (Hofstede et al., 2003). Ecosistemas similares se encuentran en otros continentes. Vegetación herbácea dominada por macollas de gramíneas o pajonales naturales, semejantes a la del páramo están presentes en el cinturón afroalpino, desde Etiopía y Uganda hasta Kenya, Tanzania y Suráfrica (Hedberg, 1992). Una pequeña extensión ocurre en Nueva Guinea e Indonesia (Hofstede et al., 2003). Los páramos de Suramérica cubren entre 35.000 km2 y 77.000 km2. Esta discrepancia se debe a incertidumbres relacionadas con el límite inferior del páramo, el cual estaría situado sobre los 3.800 m de altitud (Dinerstein et al., 1995; (Hofstede et al., 2003).
La ocurrencia aislada y fragmentada de páramo en el altiplano andino promueve alta especialización y gran endemismo. Alberga cerca de 5.000 especies diferentes de plantas. Cerca del 60% son endémicas, adaptadas a las condiciones físico-químicas de suelo y a las climáticas, tales como baja presión atmosférica, intensa radiación ultravioleta y los efectos de secamiento del viento (Hofstede, 1995).
El clima del páramo es típico de trópico de alta montaña. En general, es frío y húmedo, acompañado de súbita niebla, llovizna y cambios rápidos de temperatura y radiación solar en el transcurso del día. Por su cercanía a la línea del Ecuador la radiación solar es casi permanente durante todo el año. Esta constancia contrasta con el ciclo diario. Durante el día, las variaciones de temperatura son mayores a 20°C presentándose "un verano durante el día e invierno en la noche" (Hedberg, 1964). La variación local de la temperatura depende del gradiente altitudinal y de la humedad del aire. La tasa altitudinal a la cual cambia la temperatura promedio es de 0,65°C por cada 100 metros (van der Hammen & Hooghiemstra, 2000). La humedad del aire también afecta a la temperatura diaria. En temporadas con alta nubosidad, la radiación solar total a nivel del suelo es baja durante el día; mientras que la humedad relativa alta en la noche hace que la temperatura no baje tanto, debido a la salida de radiación de calor desde el suelo y la vegetación (Buytaert et al., 2006).
La precipitación en el páramo es variable, desde 700 mm a 3.000 mm/año (Luteyn, 1992), con algunos extremos en áreas que alcanzan los 6.000 mm (Rangel, 2000). Su variabilidad a pequeña escala está determinada por cambios en la dirección y la velocidad del viento, que a su vez están controladas por la pendiente y la topografía. A gran escala, el patrón de precipitación está afectado por las cuencas Pacífica y Amazónica. En los Andes del norte de Venezuela, Colombia y Costa Rica, los vientos del noreste causan una marcada estación seca. Las laderas occidentales de Colombia y norte del Ecuador están afectadas por la zona de convergencia intertropical (ZCIT) sobre el Pacífico Este (Vuille et al., 2000). La ZCIT es responsable de humedad continua en forma de lluvia, nubes y niebla, producto de la elevación orográfica. Finalmente los páramos de la ladera occidental del sur del Ecuador y norte de Perú están afectados por las masas frías y secas de la corriente de Humboldt y por lo tanto son más secas, excepto durante el fenómeno del Niño (Luteyn, 1999). En general, el clima del páramo es frío y húmedo, acompañado de súbita niebla, llovizna y cambios rápidos de temperatura y radiación solar en el transcurso del día.
A pesar de la compleja geología y topografía de los Andes, los suelos del páramo son bastante homogéneos (Buytaert et al., 2006). Muchos suelos de páramo son de origen volcánico. Ellos forman una capa uniforme que cubre el lecho de roca terciaria en las cordilleras andinas. Dependiendo de la ubicación, el espesor del suelo oscila de unos pocos centímetros a varios metros. Los suelos más comunes son los Andisoles, Entisoles e Inceptisoles en la clasificación de taxonomía de suelos (Soil Survey Staff, 1998) o Andosoles e Histosoles en la base de recursos del suelo de la FAO (1998). En los Andes, los suelos localizados a elevaciones mayores a 2.700m son catalogados como Andisoles. Mientras que los ubicados por debajo de 2.700m pueden ser clasificados como Entisoles o Inceptisoles (Zehetner et al., 2003), dependiendo del contenido de arcilla (Zehetner et al., 2006). El Entisol no muestra desarrollo de perfiles, está expuesto a menor precipitación y alta evapotranspiración. Como resultado los materiales amorfos están ausentes y la fracción coloidal está dominada por haloisita, o mineral de arcilla con aluminosilicatos (Zehetner et al., 2006). El Incep-tisol, más desarrollado que el Entisol, está expuesto a altas precipitaciones y baja evapotranspiración, tiende también a ser más lixiviado. Esto favorece la formación de materiales amorfos como la alófana en el suelo superficial (Wada,1980).
El clima frío y húmedo y la baja presión atmosférica favorecen la acumulación de materia orgánica en el suelo. Esta acumulación se mejora por la formación de complejos organometálicos, entendidos como una asociación entre materia orgánica y partículas minerales de suelo (Al3+; Fe3+) (Wagai et al., 2015). Esta asociación tiende a ser estable y resistente a la descomposición microbiana. El aluminio y hierro de estos complejos proviene de la descomposición de la ceniza volcánica y roca. Los suelos resultantes son oscuros y húmicos y tienen una estructura porosa (Nanzyo I et al., 1993).
Desde el punto de vista físico, los suelos de páramo tienen características comunes con los de turba en zonas altas. Contienen cantidades elevadas de materia orgánica, la cual está cerca de 100 g/kg. En sitios húmedos (>900 mm/año), es frecuente el contenido de carbono orgánico mayor a 40%. (Buytaert et al., 2006). Lugares con depósitos de cenizas se caracterizan por presentar suelos jóvenes con contenido de carbono orgánico de 4-10% (Zehetner et al., 2003).
4. Carbono almacenado en la biomasa aérea del páramo
Los bosques cubren globalmente 4.03 billones de hectáreas. Es decir, aproximadamente el 30% de la superficie total de la Tierra (FAO, 2010). Estos cuentan con el 80% del total de biomasa vegetal del planeta (Kindermann et al., 2008). Los bosques se distribuyen a lo largo del globo. En Asia, incluyendo el área rusa, se encuentra el 31% del total de bosques del planeta, seguido por el 21% en Sudamérica, 17% en África, 17% en Norte y Centroamérica, 9% en Europa y 5% en Oceanía (FAO, 2010).
En bosques naturales no alterados de alta montaña tropical (entre 1.000 m y 3.600 m de altitud) la biomasa aérea está entre 77t/ha y 785t/ha. Esta variación puede deberse en parte a los cambios de altitud, topografía, temperatura y precipitación (Spracklen et al., 2014).
En páramos, el carbono en biomasa varía entre 13,21 y 183 t/ha. (Tabla 1). Algunos estudios sugieren que esta diferencia puede deberse a variaciones ambientales. Por ejemplo, se reportan correlaciones positivas y débiles entre biomasa aérea con la temperatura media anual, precipitación media anual, altitud y ángulo de pendiente (Spracklen et al., 2014). Sin embargo, otros estudios indican ausencia de correlación de biomasa aérea con variables climáticas y topográficas (Slik et al., 2010).
Tabla 1 Carbono orgánico almacenado en biomasa aérea en paramos de Suramérica
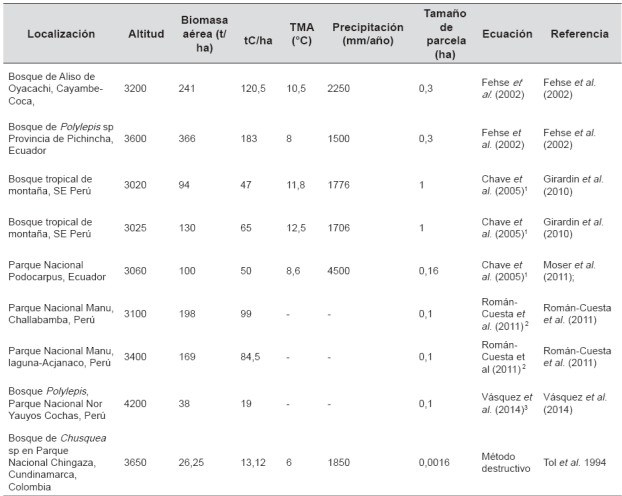
Fuente: Los autores
Abreviaciones:
TMA: Temperatura media anual
1 BA = 0,0776 (pD2H)0.94
2 BA = 0,07D2.417
3 BA = -16.51 + 40.26 9 *H (log10) +9.30 9 * D (log10)
BA: biomasa aérea
p: densidad de la madera
D: diámetro a la altura del pecho
H: altura del árbol
Parámetros ambientales como disponibilidad de nutrientes, propiedades del suelo, exposición a luz ultravioleta, exposición a la luz, nubosidad o velocidad del viento pueden ser importantes en el carbono almacenado en la biomasa. Incremento en la limitación de nitrógeno y disminución en las limitaciones de fósforo frente al aumento de rango altitudinal en los Andes peruanos podrían incidir en la cantidad de biomasa aérea del páramo (Fischer et al. 2013). Estudios de productividad primaria neta a lo largo de transectos altitudinales arrojaron cambios abruptos a elevaciones específicas. Estos cambios pueden estar relacionados con la frecuencia de nubosidad que a su vez controla la cantidad de luz y la humedad del sitio (Girardin et al., 2010, 2014a). Por ejemplo, la productividad primaria neta en dos sitios montañosos de los Andes estuvo asociada a radiación solar y nubosidad (Girardin et al., 2014b). Lo que podría indicar que estas variables son importantes en el almacenamiento de carbono en la biomasa aérea. También cambios en la riqueza de especies maderables, que con frecuencia disminuye con el incremento de elevación, tiene potenciales implicaciones en el almacenamiento de carbono (Girardin et al., 2014a).
5. Carbono almacenado en suelo
El suelo global, en los primeros tres metros, contiene aproximadamente 2.344 Gt (Gt: gigatonelada. 1 gigatonelada = 1 billón de toneladas) de carbono orgánico, Es el mayor reservorio terrestre de carbono orgánico. Del total, en el primer metro se acumula el 54% (1.500 Gt), y cerca de 615 Gt en los primeros 20 cm (Jobbágy and Jackson, 2000; Guo and Gifford, 2002). En regiones tropicales se estima que el carbono almacenado en suelo entre 0 y I metro de profundidad está entre 354 y 403 Gt (Batjes, 1996).
En el ecosistema de páramo, entre 0 y 40 cm de profundidad el carbono almacenado en el suelo puede variar entre 119 y 397 t/ha, bajo vegetación natural (Tabla 2). En turberas (bo-fedales o peatland, en inglés) a profundidad de 6 metros se alcanzan en promedio 1.573 t/ha (Tabla 2). Posiblemente los valores más elevados de COS bajo vegetación natural se deban a la mayor protección de la superficie del suelo propiciada por el tipo de cobertura vegetal. Por ejemplo, sitios con densas coberturas como las briofitas y especies arbustivas que aíslan el suelo de factores como precipitación e incidencia directa de radiación solar, pueden presentar mayor cantidad de carbono orgánico, porque hay menor descomposición de materia orgánica. Así mismo, la mayor densidad de raíces característica de estos vegetales puede influir en los valores altos de COS. Mientras que suelos bajo coberturas más dispersas, como pastos naturales de las familias Asteraceae, Poaceae, Pterydophyta posiblemente aporten menor cantidad de biomasa subterránea al suelo y faciliten una mayor descomposición de materia orgánica (Zimmermann, 2010, Tonneijck et al., 2010).
Tabla 2 Carbono orgánico del suelo, bajo vegetación natural y bajo cultivos en trópico suramericano
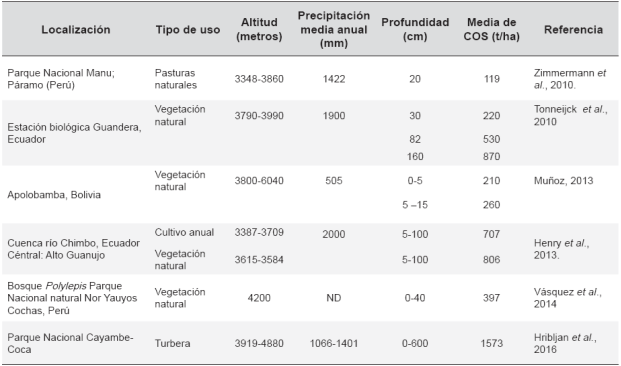
Fuente: Los autores
Abreviación
ND: no disponible
En turberas, la alta acumulación de carbono puede deberse a dos factores: la vegetación adaptada al ambiente alpino y las condiciones de suelo saturado disminuyen la descomposición de la materia orgánica. A pesar de las bajas temperaturas del páramo, las plantas permanecen fotosin-téticamente activas durante todo el año (Beck 1994). En I consecuencia, la vegetación está en capacidad de proveer materia orgánica de manera continua, lo que incrementa los contenidos de carbono (Squeo et al., 2006).
De otro lado, los valores de carbono en suelos de páramo son altos comparados, por ejemplo, con oxisoles bajo vegetación natural de sabana tropical denominada Cerrado, donde se almacenan 53 t C/ha a 30 cm de profundidad (Maia et al., 2010). Las bajas tasas de mineralización y de ciclaje de nutrientes en el páramo, ocasionadas por bajas temperaturas y alta humedad pueden favorecer una lenta descomposición de materia orgánica y la presencia de suelos negros y húmedos que almacenan altas tasas de carbono (Hofstede, 1999).
No obstante, la actividad antrópica en los ecosistemas andinos, cultivos y pastizales disminuye la cobertura natural y/o protección física del suelo y puede reducir significativamente los niveles de carbono orgánico en los mismos (Post & Known, 2000). Terrenos actualmente ocupados con pastos dedicados a ganadería extensiva y minifundios poseen menor contenido de COS, respecto a suelos con vegetación natural, debido a la ausencia de fertilización, combinada con altos niveles de erosión de los mismos (Dercon et al., 2007).
6. Actividades agropecuarias que afectan el carbono del suelo almacenado en el páramo
En el trópico, el cambio en el uso de la tierra es responsable de 12-20% de las emisiones de gases efecto invernadero (IPCC, 2007, Van der Werf et al., 2009). La conversión de coberturas naturales a sistemas agrícolas alcanza tasas de deforestación de 13 millones de ha por año (FAO, 2006). La destrucción de bosques primarios causa una rápida pérdida de carbono de la biomasa y está acompañada por pérdida de carbono del suelo (Don et al., 2011). Si el suelo es usado para propósitos agrícolas, las prácticas de preparación del suelo para la siembra determinarán la cantidad de carbono secuestrado (Figura 1).
Respecto a la actividad pecuaria en páramo, en suelos del páramo de Anaime, Tolima, Colombia, (entre 0 y 30 cm de profundidad) las pasturas en uso almacenaron COS de 34,4 tC/ha; mientras que pasturas sin uso durante 20 años almacenaron 22 t/ha (Castañeda et al., 2014). Una explicación a la mayor presencia de carbono en suelo de pasturas es el posible incremento de biomasa en las raíces finas que al descomponerse proporcionan mayor contenido de carbono al suelo (Andrade et al., 2008; Maia et al., 2009). Mientras que para las pasturas sin uso, el carbono es menor. Probablemente la falta de renovación de los pastizales disminuye la contribución de las raíces senescentes (Castañeda et al., 2014). Sin embargo, este aspecto requiere mayor estudio para alcanzar conclusiones generales.
El COS es bajo en la mayoría de agrosistemas (Lal, 2004) debido a procesos de degradación del suelo (Lal, 2011) y a prácticas de manejo como deforestación, quema y labranza (Searchinger et al., 2008). La erosión afecta al contenido de COS debido al rompimiento de la estructura del suelo que facilita la liberación de CO2. Este hecho produce la pérdida de la capacidad del suelo para garantizar el crecimiento de la planta (Van de Koppel, et al., 1997).
7. Recomendaciones para gestión del carbono en páramos
En esta revisión se encontró que en el ecosistema de páramo las reservas de carbono disminuyen cuando se cambia el uso de suelo de cobertura natural a cultivos. Probablemente la eliminación de la vegetación natural que protege el suelo disminuye el ingreso de materia orgánica al suelo e incrementa la tasa de descomposición de los residuos vegetales. Por lo tanto, esta transformación suele causar una rápida pérdida de carbono de la biomasa, acompañada de pérdida de carbono del suelo (Don et al., 2011).
Ante tal situación, la primera recomendación es aplicar prácticas agrícolas que reduzcan el laboreo, mantener el suelo permanentemente cubierto y realizar rotación de cultivos. Se sugiere el uso de agricultura sin labranza, en la cual las semillas son sembradas directamente en los residuos de cosecha, sin realizar arado del terreno. Con este tipo de manejo del suelo se busca disminuir la intensidad de su alteración y ayudar a evitar la erosión, pues mantiene la fertilidad y la materia orgánica del suelo (Horowitz et al., 2010). Así mismo, proteger el suelo con cultivos de leguminosas, como trébol, entre periodos de cultivo, aporta orgánica fresca al suelo e incrementa los niveles de COS (Post et al., 2012). Finalmente, rotar cultivos implica cambiar de especie producida, una vez se recoge una cosecha. Para este caso sería necesario identificar cuál es la combinación ideal de cultivos, tanto para disminuir pérdidas de carbono en el suelo (Yang et al., 2014) como para responder a las demandas del mercado.
La segunda alternativa para mantener e incrementar el carbono almacenado en páramos es realizar programas de restauración del ecosistema de páramo. La alteración de los ecosistemas con frecuencia disminuye su capacidad de mantener la biota nativa o entregar servicios ecosistémicos (Seastedt et al., 2008) como almacenamiento de carbono o regulación hídrica. En este contexto, la restauración ecológica intenta llevar el ecosistema afectado desde una condición de degradación hacia una condición totalmente funcional (Hobbs & Cramer, 2008). En consecuencia, para que el páramo recupere y mantenga el servicio de secuestro de carbono en el suelo y en la biomasa aérea se recomienda adelantar un programa de restauración. Para lograrlo, serían necesarias investigaciones previas de propagación de especies vegetales que integran diferentes estados sucesio-nales en este ecosistema. Una vez se reproduzcan varias de las especies autóctonas se procederá a establecerlas en sitios donde se desarrollaron cultivos intensivos, como el de papa. Sería necesario hacer un seguimiento y una evaluación quinquenal para determinar la respuesta del sitio degradado ante el restablecimiento de las especies nativas. Según el resultado obtenido, será necesario definir nuevas estrategias para continuar con el proceso de recuperación del ecosistema.
Cualquiera de estas dos opciones tiene probabilidad de alcanzarse, siempre y cuando se superen barreras económicas, institucionales, educativas y sociales (Eglin et al., 2010). Se requiere un programa de gobierno a un plazo de por lo menos diez años, que informe y asesore técnicamente al agricultor sobre los beneficios y métodos para trabajar el suelo con agricultura de conservación y en procesos de restauración de ecosistemas. El mismo programa debe incorporar una financiación para respaldar los costos por incremento de mano de obra al proceso productivo, debido a que se remplaza el uso de maquinaria por obreros cualificados. Por otro lado, la rotación de cultivos es factible cuando las instituciones del Estado garantizan al agricultor un mercado para sus variados productos con volúmenes y precios que le permitan recuperar la inversión y obtener excedentes. En síntesis, las perspectivas del suelo como reservorio de carbono pueden ser alentadoras, en la medida en que los estados fomenten técnica y económicamente estrategias de conservación de suelos. Al mismo tiempo, los gobiernos deben apoyar el mercadeo de carbono de productos agropecuarios de pequeños y medianos productores, para que el agricultor tenga la posibilidad de aplicar prácticas agrícolas que disminuyan la pérdida de carbono del suelo.
8. Líneas futuras de investigación
Los ecosistemas de alta montaña mantienen servicios eco-sistémicos que benefician a las poblaciones humanas. Por ejemplo, el ecosistema de páramo andino almacena carbono orgánico en el suelo, también abastece y regula el agua. Estas funciones ecológicas mancomunadas propician la irrigación de cultivos, procesos industriales, generación de energía y agua para consumo doméstico de centros urbanos de Colombia, Venezuela, Perú y Ecuador (Buytaert et al., 2006). En Colombia se han identificado 48 páramos en la cordillera de los Andes (Montes, 2001). Sin estos ecosistemas, la supervivencia de millones de habitantes estará en riesgo. Sin embargo, este ecosistema se está degradando debido a la influencia de factores antrópicos. La intensificación agrícola, la explotación minera, la urbanización y el cambio climático (Buytaert et al., 2006; Marquis et al., 2012). La alteración del suelo por cambio de uso trae serias consecuencias socioeconómicas, incluyendo la desertificación, incremento de la pobreza y de conflictos (Ariza et al., 2013; Korner et al., 2005) . Esta transformación tiene impacto significante sobre el carbono secuestrado. Así que cuantificar carbono en páramos colombianos puede contribuir a definir prioridades de manejo de recursos naturales en este ecosistema y a soportar proyectos que incentiven la mitigación de carbono en ecosistemas de alta montaña.
Futuros estudios pueden evaluar factores que controlan la distribución regional y vertical del COS. Por ejemplo, identificar y analizar posibles relaciones entre el COS, su distribución vertical y factores ambientales y pedológicos en diversos páramos del país. Se propone analizar el contenido de COS entre 0-100 cm de profundidad, en relación con factores abióticos (clima, tipos de material parental, pendiente); factores bióticos (cantidad de carbono en raíces y hojarasca) y características pedológicas (tipo de suelo y sus propiedades, textura y pH). Con esta información es factible modelar y predecir la distribución vertical de COS bajo diferentes tipos de suelo y para los ecosistemas de páramo colombianos.
Un segundo estudio puede responder a las incertidumbres que se tienen sobre el almacenamiento de carbono por turberas. Se sabe que las turberas almacenan la mayor cantidad de carbono en su biomasa subterránea y su dinámica tiene importantes implicaciones para el ciclo global del carbono (Yu, 2012). Estimaciones de reservas de carbono se disponen para regiones como Norteamérica, Finlandia y Rusia (Botch et al., 1995; Turunen et al., 2002; Bridgham et al., 2006) . Sin embargo, para ecosistemas de páramo son escasos y se puede convertir en un campo de investigación. Para estimar carbono en las turberas se tienen tres aproximaciones: volumen de turba, densidad del carbono y comportamiento en el tiempo. El volumen de turba busca conocer la profundidad media de la turbera, la densidad aparente y la concentración de carbono para finalmente estimar el carbono en el suelo (Gorham, 1991).
La aproximación de densidad de carbono requiere datos similares pero se enfoca en la estimación del contenido total de carbono por unidad de área, conocido como densidad de carbono del suelo. Luego deriva la existencia total de carbono multiplicando el área de la turbera por la densidad del carbono (Armentano & Menges, 1986). La aproximación de tiempo utiliza múltiples edades de turberas individuales. Analiza tasas de acumulación y la variación del área de la turbera con el fin de estimar cambios en el tiempo de las reservas de carbono (Yu et al., 2010). Así mismo, es importante entender los procesos de la turbera y establecer relaciones empíricas entre sus propiedades (área, profundidad y edad) para generar estimaciones más robustas de las existencias de carbono (Yu, 2012).
Conclusiones
La literatura disponible en bases de datos indica que en el páramo el suelo es el componente que almacena mayor cantidad de carbono, respecto a la biomasa aérea. A profundidades entre 0 y 40 cm, bajo vegetación natural se almacenan entre 119 y 397 t/ha. Estas diferencias pueden deberse tanto a la densidad de la cobertura natural como a la cantidad de raíces por unidad de área.
Las actividades agrícolas disminuyen el contenido de carbono almacenado en el páramo. Por un lado, la eliminación de la vegetación nativa reduce el ingreso de materia orgánica al suelo e incrementa la tasa de descomposición de residuos vegetales. Por otro, la labranza propicia desintegración y emisión de carbono almacenado en el suelo. También la adición de enmiendas como cal agrícola y dolomita liberan CO2 a la atmósfera, por lo cual, prácticas como reducción de laboreo, mantener entre periodos de cultivo el suelo cubierto con leguminosas y rotar los cultivos ayuda a retener el carbono almacenado en el suelo.
En general, los estudios de carbono en páramo son escasos, a pesar de su gran importancia en la dinámica del carbono del planeta. Sería interesante explorar la distribución vertical de carbono en la profundidad, así como realizar estimaciones de carbono en las turberas para abrir posibilidades de que este ecosistema se tenga en cuenta en los programas de reducción de emisiones de gases efecto invernadero asociadas a deforestación y degradación forestal.















