Introducción
Las abejas son los mayores polinizadores de muchas plantas silvestres y monocultivos (Kremen et al., 2002). Por lo tanto, su nicho es fundamental para la productividad agrícola mundial y es evidente que las alteraciones en sus poblaciones podrían derivar en significativas pérdidas económicas (Garibaldi et al., 2013; Cutler et al., 2014).
La situación actual de las abejas es preocupante, debido a que el censo poblacional ha disminuido drásticamente por el uso extensivo de pesticidas y agroquímicos en monocultivos tecnificados que buscan potenciar el rendimiento de la producción (Goulson et al., 2015; Kovács-Hostyánszki et al., 2017). En Estados Unidos, el número de colonias se ha reducido en un 45%, de tal modo que se estimó un descenso de 42 millones a 24 millones de colmenas de abejas en el transcurso de 60 años (Johnson et al., 2010). No obstante, cifras recientes del Departamento de Agricultura de Estados Unidos (USDA) muestran un leve aumento en el número de colonias comerciales de abejas de aproximadamente un 3% en el año 2017 (USDA, 2017).
El impacto a gran escala en la reducción en las poblaciones de abejas nativas tendría un efecto negativo notable sobre la producción de alimentos y la biodiversidad vegetal. Así, productivamente se ha determinado que las abejas polinizan 52 de los 115 principales productos alimentarios cultivados en Norteamérica y se estimó que, para el año 2010, las utilidades económicas alcanzaron los 212 mil millones de dólares (Meixner et al., 2010). Adicionalmente, la producción apícola está representada por diversos productos de alta demanda comercial en varios países como son la miel, el propóleo, el polen y la cera (Brown y Paxton, 2009).
En Colombia se ha reportado contaminación en la miel con residuos de pesticidas, los cuales corresponden principal mente a organofosforados (47,5%) y organoclorados (9,8%) en los departamentos de Boyacá, Cundinamarca, Magdale na y Santander (Rodriguez, 2011). Lo anterior sugiere que durante las prácticas agrícolas se aplican pesticidas como organofosforados en exceso, especialmente de clorpirifós, que se encontró de forma residual en el 36,1% de las mieles analizadas. La presencia de estos compuestos, además de afectar la inocuidad del alimento, presenta un riesgo para la salud del consumidor y para la colmena (Rodríguez, 2011). Incluso el hecho de que se presenten intoxicaciones hu manas por plaguicidas evidencia la alta residualidad y bioacumulación de dichos tóxicos en zonas tropicales (Varona et al., 2009; Varona et al., 2016; Ruiz-Guzmán et al., 2017). Actualmente, en el país algunas decisiones gubernamenta les para aumentar la producción agrícola, acciones militares para erradicar cultivos ilícitos por aspersión y la expansión de la frontera agrícola han afectado particularmente a las abejas (Nates-Parra, G., et al., 2008; DNP, 2014; Cortina, et al., 2017). Por lo tanto, el propósito de esta revisión fue describir los efectos nocivos asociados a la toxicidad de los pesticidas sobre las poblaciones de abejas y el impacto en la producción agrícola.
Materiales y métodos
La presente revisión se basó en la declaración Prisma (Urrutia y Bonfill, 2010). Se seleccionaron reportes, incluyendo artículos científicos, revisión, tesis de posgrado e informes técnicos que describieran el efecto letal y subletal de los pesticidas en las abejas. El periodo de observación fue de 15 años, comprendido entre los años 2002-2017, sin restricción de área de estudio. Se realizó una búsqueda en las siguientes bases de datos: Science-Direct, JSTOR, Springerlink, Scielo y Google académico. Se incluyeron las siguientes palabras clave en español e inglés: abejas ("bees"), AND/OR efectos de los pesticidas ("effect of pesticides") AND/OR toxicidad de pesticidas ("toxicity of pesticides") AND/OR valor de la polinización ("value of the pollinization") AND/OR efecto subletal de pesticidas ("subletal effect of pesticides"). Se excluyeron proyectos de pregrado y resúmenes de conferencias porque se requerían análisis completos y que representaran nuevos aportes en el área. La información se sistematizó en una base de datos documentando los efectos de acuerdo con el sistema comprometido o daño a nivel individual o de la colmena y el tipo de plaguicida.
El problema de los pesticidas en el ambiente
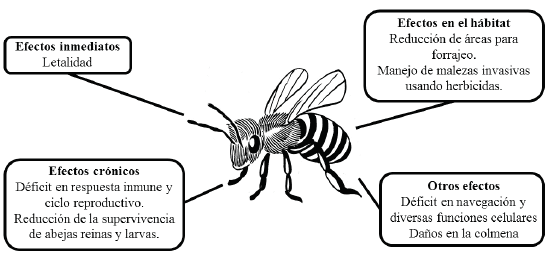
Los pesticidas son sustancias producidas de forma natural o industrial para destruir organismos potencialmente perjudiciales para las plantas cultivadas y/o animales de producción (Schaaf, 2015). Así mismo, se clasifican de acuerdo con el tipo de peste que controlan en: insecticidas (contra insectos), herbicidas (flora arvense), rodenticidas (roedores), bactericidas (bacterias), fungicidas (hongos) y larvicidas (larvas) (Damalas, 2009). Estas sustancias pueden ser tóxicas a su vez para las especies que comparten el sitio de fumigación y, dependiendo de la dosificación, pueden tener una acción letal o subletal; a la par, permanecer residualmente en el medio ambiente (Desneux, Decourtye y Delpuech, 2007). La alteración en las poblaciones de abejas es un claro daño colateral derivado del uso de pesticidas y, en consecuencia, podrían ser indicadores biológicos de su efecto nocivo a nivel ecológico y ambiental (Johnson et al., 2010; De Oliveira et al., 2016; Simon-Delso et al., 2017). De modo que la interacción de las abejas con el pesticida no solo ocasiona su muerte, sino que cantidades traza pueden producir efectos subletales capaces de deteriorar la salud de la colmena entera (Gill et al., 2012) (Figura 1).
En general, para los artrópodos, los pesticidas inducen alteraciones fisiológicas a nivel social reflejadas en cambios en el comportamiento, dificultades en la localización del alimento, comunicación y regreso al lugar en el que habitan (Desneux et al., 2007). Específicamente en los insectos los cambios fisiológicos se han reportado en el desarrollo embrionario y la aparición de mutaciones. Por ejemplo, se ha demostrado que la acetamiprida afecta el desarrollo embrionario del cucarrón depredador Eriopis connexa, reduciendo la eclosión de huevos hasta en un 100% (Fogel et al., 2013). Igualmente, se ha reportado que el glifosato ocasiona mutaciones en la descendencia y se asocia a pérdida de peso en Chrysoperla externa (Schneider et al., 2009). El uso de dichos agroquímicos afecta la navegación y el comportamiento de los insectos, debido a que estas funciones dependen por completo de las transmisiones nerviosas (CONICET, 2009). Los pesticidas tipo clorpirifós pueden limitar la capacidad inmune de insectos como Drosophila melanogaster para responder a ciertas infecciones parasitarias (Desneux et al.,2007). En todos los casos el uso extensivo de insecticidas altamente tóxicos, y con diferentes blancos de acción en monocultivos, podría generar daños alternos en las poblaciones benéficas de insectos.
Valoración económica de la pérdida de los polinizadores
La polinización puede ocurrir por acción del viento, la gra vedad y los animales. No obstante, la mayoría de los casos ocurre debido a los animales (80%), dentro de los cuales se encuentran: los pájaros, murciélagos e insectos princi palmente (Klatt et al., 2013). Entre los insectos que más contribuyen al aumento de la rentabilidad de los cultivos agrícolas se destacan las abejas nativas, abejas de la miel (Apis mellifera), los abejorros, megachílidos, entre otros (Hanley et al., 2015; Klein et al., 2003). Un estudio en fresas indica que el valor agregado de la polinización mediada por abejas se estima en 0,32 billones de dólares. Además, en términos productivos, los frutos fueron más abundantes y mejores en términos de calidad, peso, dulzura y forma (Klatt et al., 2014).
Diferentes estudios económicos realizados en Estados Uni dos desde el año de 1976 estimaron que entre el 15 al 30% de los alimentos cultivados resultaban directa e indirecta mente de la polinización de las especies nativas. Posterior mente, en el año de 1989, se calculó económicamente el servicio de polinización por abejas en 8,3 billones de dóla res anuales, en 1992, se estimó una ganancia de 5,2 billones de dólares y en el año 2000 se estimó la polinización abejas en un valor de 14,6 billones de dólares (Losey y Vaughan, 2006).
En la Unión Europea la polinización proporcionada por las abejas en los cultivos de fresa, para el año 2009, se cuantificó en 2.9 billones de dólares y, a nivel mundial, el valor de la polinización por insectos ha sido estimado en 212 mil millones de dólares; esta cifra representaba alrededor del 9,5% del valor total de la producción agrícola global (Meixner et al., 2010). La contribución por parte de la poli nización realizada por abejas nativas varía según la localiza ción geográfica, la disponibilidad de hábitat natural y el uso de plaguicidas (Losey y Vaughan, 2006). Estimaciones más recientes calculan un servicio global de aproximadamente 215 billones de dólares en producción de alimentos, por lo que la situación ha sido definida como la "crisis de la polini zación" (Goulson, 2015). Los estudios citados previamente evidencian los devastadores efectos de los pesticidas en la polinización y su consecuente alto costo económico en los sistemas agrícolas intensivos.
A nivel nacional no se encontraron estudios económicos, pero se conoce que países como Colombia, Ecuador y Sudáfrica emplean grandes cantidades de organofosforados y organoclorados en la producción agrícola (Schreinema chers y Tipraqsa, 2012). Adicionalmente, las pérdidas no cuantificadas en las especies de abejas podrían continuar silenciosamente debido a la falta de sinergias en la política para la gestión de la biodiversidad y los servicios ecosistémicos (Rojas, 2015).
Pesticidas y su efecto en las abejas
Los pesticidas se clasifican, de acuerdo con el compuesto activo, en organofosforados, piretrinas, carbamatos (que son inhibidores de la enzima acetilcolinesterasa) y los piretroides sintéticos y organoclorados, que bloquean los cana les iónicos neuronales (Rocha y Garcia, 2008).
La utilización de dichos productos impacta inespecíficamente a diferentes especies de insectos, incluyendo las abejas, cuyos procesos de desintoxicación no son efectivos para tolerar la exposición a dichos agroquímicos (Calatayud-Vernich et al., 2016; Mao et al., 2017).
Los pesticidas afectan la actividad celular normal a lo largo del ciclo de vida de la abeja en funciones celulares como la síntesis, el transporte, producción de energía y la acción o la eliminación de hormonas u enzimas (Chauzat et al., 2009; Meixner et al., 2010; Mao et al., 2017).
Como consecuencia, la hipersensibilidad de las abejas a pes ticidas podría aumentar la letalidad a efectos subletales en la etapa larval, debido a la exposición prolongada. Así, la in toxicación en larvas de abejas por los pesticidas clorpirifós, imidacloprid, miclobutanil, simazina, glifosato y fluvalinato se ha relacionado con una alta tasa de mortalidad (Riaño-Jimenez y Cure, 2016; Gomes, 2017). A nivel sistémico, nume rosos estudios han documentado el efecto en procesos de funcionalidad del sistema nervioso, respuesta inmune y del ciclo reproductivo.
En cuanto a la funcionalidad de las células nerviosas, el uso de pesticidas como el clorpirifós tiene un efecto neuro-oxidativo, aumentando la formación de malondialdehido, que es indicador de estrés oxidativo como resultado del daño celular (Rehman et al., 2012). Por otro lado, la utilización de piretroides como el esfenvalerato, lambda cihalotrin, permetrina y fluvalinato están relacionados con la pérdida de movimiento y coordinación de las abejas, ocasionando pa rálisis y convulsiones (Ingram et al., 2015).
Los pesticidas contaminantes en los recursos florales afectan los procesos de aprendizaje fundamentales para la orientación y reconocimiento del entorno (Andrione et al., 2016; Desneux et al., 2007; Wang et al., 2017). Ello ocurre debido a que los pesticidas alcanzan las principales vías neuronales de las abejas e interrumpen procesos de aprendizaje, la memoria, la navegación y ciertas funciones cognitivas (Klein v, 2017). En el caso de las abejas forra jeras los pesticidas ocasionan desorientación tal como se ha reportado con trazas de imidacloprid y el uso de otros neonicotinoides como clotianidin y tiacloprid que generan desorientación en abejas forrajeras, dificultando su regreso a la colmena (Bortolotti et al., 2003; Pareja et al., 2011; Fis cher et al., 2014). La exposición a pesticidas también puede interferir en otras interacciones de abejas, tal como se ha demostrado mediante el uso de altas dosis de permetrina y imidacloprid, que disminuye entre un 10,5 y 4,5 veces la danza de la abeja respectivamente (Ingram et al., 2015). Las abejas obreras pueden sufrir trastornos en la comunicación del lugar donde encuentran el alimento y en la detección del olor a néctar y la sensibilidad a la sacarosa (Mc Cabe, 2010; Eiri y Nieh, 2012; Herbert et al., 2014). Estos hallazgos son consistentes con estudios que evidencian el efecto del glifosato en el aumento de los umbrales de respuesta al azú car, además que se han relacionado las combinaciones de pesticidas cumafós con la reducción de la memoria olfativa, generando desórdenes alimentarios (Williamson y Wright 2013; Herbert et al., 2014).
Como se mencionó previamente sobre los insectos, los pesticidas alteran los mecanismos de respuesta inmune en las abejas (Chauzat et al., 2009; Sánchez-Bayo et al., 2016) El imidacroprid tiene como efecto adverso la supresión del sistema inmune, aumentando la incidencia del patógeno microsporidío Nosema ceranae en el intestino medio de la abeja. Dicha infección causa desnutrición, lo que conlleva a la abeja a un déficit energético, debilitamiento e incluso puede producir muertes prematuras (Alaux et al., 2010). Igualmente, el uso de neocotinoides y diferentes fungicidas inhibidores de la biosíntesis de ergosterol incrementan las infecciones causadas por N. ceranaeen diferentes especies de abejas en el ámbito mundial (Goulson, 2015). La influen cia de muchos pesticidas en concentraciones superiores al 60% durante el periodo larval puede favorecer la infestación de parásitos como el ácaro Varroa destructor (Gregorc y Ellis, 2011; Rehman et al., 2012,Wu et al., 2011).
Por último, otro efecto corresponde a alteraciones a nivel reproductivo, que se evidencia en las tasas de fecundidad y en la forma directa de los ovarios de las hembras (Gregorc y Ellis, 2011; Sánchez et al., 2016). A nivel físico se ha demos trado que el uso de neocotinoides reduce el desarrollo en abejas adultas y el uso de tiametoxam, en dosis de 0,2, 1 y 2 ng/abeja, afecta la termorregulación en las abejas, disminuye la actividad de forrajeo y deteriora la fortaleza de la colonia (Whitehorn et al., 2012; Tosi et al., 2016). En abejas nativas la utilización de tiametoxam y clotianidina se relacionó con un número menor total de descendientes, así como una dis minución de la densidad de la colonia y anidación. Las abejas cortadoras de alfalfa (Megachile rotundata) y las abejas de las orquídeas azules (Osmia lingnaria), son más susceptibles a los insecticidas neonicotinóides (clotianidina e imidacloprid) que las abejas melíferas (Rundlöf, et al., 2015). También se ha evidenciado una reducción en la densidad de abejas nativas, anidación de abejas solitarias y crecimiento de co lonias de abejorros. Por ejemplo, el fungicida clorotalonil afecta al abejorro oriental (Bombus impatiens) reduciendo el tamaño de su cuerpo (Hladik et al., 2016).
Residuos de pesticidas en los productos y subproductos de las abejas
Estudios en cinco tipos de mieles multiflorares comercia lizadas en España evidenciaron la presencia de residuos de cumafós en el 63% de las muestras (Juan-Borrás, Domenech y Escriche, 2016). Otro pesticida comúnmente encontrado en la miel es el clorpirifós, no sólo por el número 236l de muestras positivas como por sus altas concentraciones (Calatayud-Vernich et al., 2016). A su vez, se ha reportado la presencia de forato y pesticidas organoclorados en distintas muestras de miel (Balayiannis y Balayiannis, 2008; Choudhary y Sharma, 2008).
En productos como el polen se ha encontrado, en más de la mitad de los casos analizados, contaminación con residuos de cumafós (Chauzat et al., 2006). También en la cera se han detectado diferentes pesticidas, principalmente piretroides y organofosforados (Johnson et al., 2010; Chauzat et al., 2009). Otros tipos de pesticidas que se han encontrado en productos y subproductos alimenticios provenientes del propóleo de las abejas son neocotinoides y altas concentra ciones de cumafós (Gérez et al., 2015; Silvina et al., 2017).
Debido a este problema de contaminación, se han desa rrollado técnicas basadas en extracción en fase solida dis persiva (d-SPE) para la remoción de pesticidas en frutas y verduras. La técnica más exitosa se denomina QuEChERS (Del inglés: Quick, Easy, Cheap, Effective, Rugged and Safe) y que, acoplada con métodos cromatográficos y de espectrometría de masas, permite la caracterización de pesticidas en la miel e incluso hacer inferencias ecológicas respecto al estado de la colmena (Porrini et al., 2003; Calatayud-Vernich et al., 2016; Zamudio et al., 2017).
En Colombia, los pesticidas aprobados se encuentran en los registros nacionales del Instituto Colombiano Agrope cuario (ICA, 2018) y sus efectos nocivos sobre los polinizadores (incluyendo abejas) se especifican en la Tabla 1. Recientemente, el ICA prohibió el uso del betaciflurin y el dimetoato, los cuales son altamente tóxicos en abejas.
Tabla 1 Compuestos activos de los insecticidas comúnmente usados en Colombia y sus efectos adversos en las abejas. Abreviaturas: ia: Ingrediente activo; TR: Toxicidad Residual; TRE: Toxicidad Residual Extendida; *Pesticidas recientemente prohibidos en Colombia (Fuente: Riedl et al. 2006; ICA 2018).
| Nombre comercial o ingrediente activo | Toxicidad (I, II o III) | Residualidad | Efecto en las abejas |
|---|---|---|---|
| Abamectina | II | Altamente tóxico para abejas. TR: 8 horas TRE: 1-3 días | TRE en abejorros, TR corto en abejas de la hoja de alfalfa y abejas alcalinas en 0,025lb ia/acre |
| Acefato | III | Altamente tóxico para abejas. | Incompatible con abejorros, TRE en abejas de la alfalfa |
| TRE: < 3 días | cortadoras de hojas y en abejas alcalinas | ||
| •Betaciflurin | III | Altamente tóxico para abejas. TR: | Posiblemente reducción en la oviposición diaria y la viabilidad |
| >1 día | de los huevos. | ||
| Bifentrin | IB | Altamente tóxico para abejas. | TRE en abejas cortadoras de alfalfa y TR de 4-6 horas |
| TRE: >1 día. TR: 4-6 horas | Incompatible con abejorros | ||
| Altamente tóxico para abejas. | TRE de 7 días para abejas cortadoras de alfalfa | ||
| Clorpirifós | II | TRE: 4-6 días en concentraciones | |
| emulsificadas TR: <2 horas | TRE de 6 día para la abeja alcalina. Contaminante común de la cera de abejas. Incompatible con abejorros | ||
| Altamente tóxico para abejas. TRE: < 3 días | TRE en las abejas cortadoras de hojas de alfalfa. No colocar | ||
| *Dimetoato | II | las abejas al menos 1 semana después. Incompatible con abejorros | |
| Dinotefuran | III | Altamente tóxico para abejas. | Posible toxicidad en abejas de la miel. Incompatible con |
| TRE 39 horas | abejorros | ||
| Benzoato de | III | Altamente tóxico para abejas. | TRE de 1 día para abejorros |
| emamectina | TRE: < 24 horas | ||
| Fipronil | II | Altamente tóxico para abejas. TRE: 7- 28 días. | TRE > 1 a un día para abejas cortadoras de la alfalfa. |
| TR: < 8 horas. | Incompatible con abejorros. | ||
| Gamma cihalotrina | II | Altamente tóxico para abejas. TRE: >1 día | TRE > 1 día para abejas cortadoras de alfalfa |
| Altamente tóxico para abejas. | Es usualmente utilizado como un insecticida sistemático, | ||
| Imidacloprid | II | TRE: > 1 día TR: < 8 horas | encontrado en polen y néctar de plantas. Los abejorros son más sensibles que abejas de la miel. |
| Altamente tóxico para abejas. | TRE superior a 1 día en abejas cortadoras de alfalfa. Puede ser | ||
| Lambdacihalotrina | II | TRE: > 1 días TRE: > 7 días (encapsulado) | tóxico cuando se mezcla con propiconazol. Incompatible con abejorros |
| Altamente tóxico para abejas. | |||
| TRE: 5.5 días en concentraciones | |||
| Malation | II | < 8 fl oz ia/ acre. TRE: 2 días en un estado finamente molido combinado con agentes humectantes. TR: 3 horas en compuesto emulsificado | TRE superior a 7 días en abejas cortadoras de alfalfa y abejas |
| alcalinas. Incompatible con abejorros | |||
| Permetrina | II | Altamente tóxico para abejas. TRE: 0.5 a 2 días TRE: > 5 días | TRE de 3 días para abejas cortadoras de alfalfa. Incompatible con abejorros |
| Sulfoxaflor | III | Altamente tóxico para abejas. TR: | Actúa similar a insecticidas neonicotinoides inhibiendo los |
| 3 horas | receptores de acetilcolina. | ||
| Altamente tóxico para abejas. TRE: 7-14 días | Ha sido encontrado en polen y néctar. Los abejorros son | ||
| Tiametoxam | II | más sensibles a los neocotinoides que las abejas de la miel. | |
| Incompatible con abejorros | |||
| Cipermetrina | II | Altamente tóxico para abejas. TRE: > 1día | Rápidamente afecta el sistema nervioso central de los insectos. |
Fuente: Este estudio, a partir de iedl et al. 2006; ICA 2018
Perspectivas respecto al uso de pesticidas que afectan polinizadores
Dada la oferta de pesticidas en el mercado, es necesario estimar el impacto en su uso, no sólo en especies de abejas (ya sean Apis mellifera, de las tribus Meliponini o Bombini, andrénidos, colétidos, halíctidos, megachílidos y melítidos) sino en otras especies polinizadoras. Pese a esto, es impor tante señalar que la polinización también puede ser pertur bada por la utilización de cultivos genéticamente modifica dos (ejemplo, plantas resistentes al glifosato), la pérdida de biodiversidad genética, reinas débiles, la variación climática extrema y por la residualidad de acaricidas en la colmena (Chauzat et al., 2006).
Las estrategias que podrían contribuir a solucionar el pro blema incluyen: primero, concienciar a los consumidores y productores respecto al riesgo de usar pesticidas; segundo, mayor investigación acerca del manejo integral de cosechas enfocado en el manejo de pestes; tercero, racionalizar el uso de pesticidas a través de regulaciones económicas e incentivos; cuarto, certificación para los consumidores en prácticas para asegurar y recompensar a los productores orgánicos; quinto, la estimación del impacto ambiental por pesticidas y, por último, el uso sostenible de biopesticidas que no afecten a las especies polinizadoras (Schreinema chers y Tipraqsa, 2012; Schaaf, 2015; Ondarza-Benéitez, 2017). Se requieren estudios que identifiquen los niveles de contaminación de pesticidas en los subproductos de las abejas, ya que esta situación podría ser aún más crítica en el ámbito de la salud pública por las trazas de pesticidas que pueden llegar al consumidor de productos apícolas.
Conclusiones
El uso desmedido de pesticidas puede afectar drásticamen te la productividad de las cosechas debido al daño colateral en las abejas (uno de sus principales polinizadores). La ex posición a dichos agroquímicos podría resultar en diversas consecuencias incluyendo la muerte inmediata a múltiples efectos adversos a nivel fisiológico en las abejas. Además, a nivel ecológico el daño se puede extender al debilitamien to de las colmenas, reducción de las áreas de forrajeo y deterioro del hábitat. Los diferentes estudios recopilados en este artículo evidencian los efectos letales y subletales de los pesticidas usados en la producción agrícola colom biana, muchos de los cuales presentan una alta residualidad, bioacumulación y efecto adverso para otras especies. La situación es aún más preocupante debido a la falta de restricciones y una normatividad que permitan controlar el uso de pesticidas, sumado a una escasa información acerca de los servicios ecosistémicos por polinización.