Introducción
La obesidad se define como la acumulación excesiva de grasa en el organismo que conlleva a un aumento del peso corporal con respecto al que correspondería según la estatura, el sexo y la edad de la persona. Con base en el índice de masa corporal (IMC), la Organización Mundial de la Salud (OMS) define la siguiente categorización: peso normal, 18,5-24,9 kg/m2, sobrepeso, 25-29,9 kg/m2, obesidad tipo I, entre 30-34,9 kg/m2; obesidad tipo II, entre 35-39,9 kg/m2 y obesidad tipo III, 40 kg/m2 o más (Moreno, 2012).
Actualmente la obesidad y el sobrepeso, son considerados un problema de salud pública, es así que para el año 2000 la OMS le dio estatus de epidemia global categorizándola como la principal causa de comorbilidades, al igual que la diabetes tipo II, enfermedades cardiovasculares, varios tipos de cáncer y otros problemas de salud (Gutiérrez, 2010), con una mayor prevalencia en las mujeres que en los hombres (OMS, 2015) y (Chan y Woo, 2010).
En la actualidad, las dietas altas en grasas e hipercalóricas, con ingesta de alimentos procesados de alto consumo y en ocasiones más económicos que las comidas frescas y compuestas de ingredientes ricos en nutrientes elementales han provocado un aumento en la tasa de obesidad (Afman y Müller, 2006) y se han convertido en factores que contribuyen a la creciente tasa de obesidad entre las mujeres en edad reproductiva y su descendencia (Chan y Woo, 2010) y (Klenov y Jungheim, 2014). Por otro lado, diferentes estudios clínicos y epidemiológicos, reportan que la obesidad y el sobrepeso previo al embarazo, así como la ganancia excesiva de peso durante la gestación son factores negativos que implican complicaciones para la embarazada, su feto y neonato (Tamara, 2007).
1. Marco teórico
La obesidad materna provoca complicaciones durante el embarazo, entre ellas, diabetes gestacional, hipertensión y pre-eclampsia. A partir de modelos animales y estudios en humanos se ha sugerido que la obesidad materna también crea un efecto adverso en el medio ambiente intrauterino, alterando el desarrollo embrio/fetal; por lo tanto, los hijos de madres obesas están sujetos a un mayor riesgo de presentar muerte fetal, alteración en el patrón de crecimiento, anomalías congénitas y desarrollar enfermedades metabólicas a largo plazo (Tenenbaum, 2013). Entre las anomalías más frecuentes, se presentan defectos del tubo neural, orofaciales y defectos del corazón; en particular a nivel cardíaco se ha reportado hipoplasia izquierda del corazón, transposición de grandes vasos, defectos de cojines endocardiacos, Tetralogía de Fallot, defectos del septum ventricular, septum atrial y coartación de la aorta (Cedergren y Kallén 2003).
El corazón es el primer órgano funcional cuya morfogénesis requiere del re-arreglo y la proliferación celular, cambios en la interacción célula-célula, célula-matriz extracelular y remodelación tisular. Durante su re-estructuración es necesario la supresión de estructuras vestigiales y el control del número de células, procesos dirigidos por la muerte celular programada; eventos regulados finamente en tiempo y espacio (Poelmann et al 2000).
Con base en estos antecedentes se planteó como objetivo, determinar el efecto de la obesidad materna sobre el patrón de apoptosis en la cardiogénesis tardía de fetos de rata Wistar.
2. Materiales y Métodos
Se emplearon 12 Ratas hembras de 60 días de edad, con un peso aproximado entre 190 a 210 gramos y seis machos adultos de dos meses de edad, con un peso aproximado de 300 gramos, pertenecientes a la especie rattus norvegicus albinus, cepa Wistar. Los animales fueron mantenidos en el bioterio de la Universidad del Valle, bajo condiciones controladas de luz-oscuridad (12-12 horas), temperatura (22-23°C) y humedad relativa (38%-66%).
El presente trabajo contó con el aval del Comité de Ética Animal de la Universidad del Valle, que cumple con la ley 84 de 1989 del Estatuto Nacional de Protección de los Animales y sigue la resolución N° 008430 de 1993. El bienestar de los biomodelos fue revisado de manera continua por los investigadores y los procedimientos se realizaron de acuerdo a la normatividad de bioseguridad del bioterio de la Universidad del Valle. ACTA de aprobación N° 01-2012.
2.1. Establecimiento del modelo de obesidad adquirida por dieta
Doce (12) hembras adultas, fueron divididas en dos grupos; un grupo control y un grupo obeso; el grupo control (n=6), se alimentó con dieta estándar, correspondiente a la dieta comercial LAB DIET 5001 (LabChow Rodentia Purina; Estados Unidos). En su composición nutricional contiene: proteína cruda mínima 23,0%; grasa cruda mínima 4,5%; fibra cruda máxima 6,0%; ceniza máximo 8,0%, minerales agregados máximos 3,0%. El grupo obeso (n=6), fue alimentado con una dieta estándar complementada con una dieta hiper-calórica altamente palatable, denominada dieta de cafetería, compuesta por 20 alimentos tipo snack debidamente codificados y con contenido nutricional establecido (Hidalgo, Pustovrh y Salazar, 2014). (Tabla 1).
Tabla 1 Alimentos suministrados a los biomodelos maternos durante la dieta de cafetería
| Alimento | K calorías | |
|---|---|---|
| 1 | Maíz inflado | 50 |
| 2 | Queso | 300 |
| 3 | Tocineta | 70 |
| 4 | Maíz tostado | 120 |
| 5 | Papas fritas | 547,2 |
| 6 | Panecillos de mantequilla | 380 |
| 7 | Galletas | 200 |
| 8 | Chocolatina | 200 |
| 9 | Pastel de chocolate | 300 |
| 10 | Rosquillas | 65 |
| 11 | Cereal dulce | 391,1 |
| 12 | Maíz inflado sabor queso | 220 |
| 13 | Sandwich | 146,5 |
| 14 | Galletas Saladas | 180 |
| 15 | Brownie | 100 |
| 16 | Galletas de trigo | 419 |
| 17 | Palomitas de maíz | 90 |
| 18 | Jamón | 60 |
| 19 | Caramelos | 240 |
| 20 | Salchichas | 130 |
Fuente: Elaboración de los autores
Durante un periodo de seis semanas, el alimento y el agua fueron ofrecidos en exceso a ambos grupos. La ingesta de alimento fue supervisada diariamente; los parámetros murinomorfométricos (peso, talla y circunferencia abdominal) fueron registrados semanalmente.
Para obtener el estadio gestacional de interés en el desarrollo cardíaco (EI6.5), a partir de la sexta semana de alimentación, se realizó diariamente entre las 7:00 AM y 9:00 AM la toma de citología vaginal y visualización en fresco del extendido vaginal, para establecer el momento del celo y realizar el apareo con el macho; la presencia de espermatozoides en el extendido vaginal, se determinó como el día 0,5 de preñez (Pustovrh, 2017).
2.2. Obtención de las muestras
Finalizado el tiempo de gestación establecido, se procedió a la interrupción de la preñez de los biomodelos maternos y la obtención de los fetos en el estadio EI6.5; bajo este-reomicroscopio (Meiji RZT Techno) con cámara fotográfica acoplada (Infinity I), se explantaron los corazones fetales. La morfología cardíaca externa, fue evaluada en 40 corazones procedentes del grupo control y 24 corazones procedentes del grupo obeso.
Posteriormente, los corazones fetales fueron fijados por inmersión en PLP (Paraformaldehído) al 4% durante dos horas, seguido de un cambio a alcohol al 70%; hasta el momento de procesarlos para detección de apoptosis.
2.3. Procesamiento histoquímico e inmunohistoquímico
Los corazones fetales fueron deshidratados con alcohol etílico en concentraciones crecientes, 70o, 80o, 95o, 100o, aclarados con xilol e incluidos en parafina. Se realizaron cortes histológicos seriados de 4|jm de espesor utilizando un micrótomo de rotación (Leica RM 2245). Seguidamente los cortes fueron montados en portaobjetos cargados (Color Frost Plus Slide Export cat # 695Iplus 006E).
2.4. Técnica de TUNEL (dUTP nick end labeling)
La técnica de TUNEL permite evaluar la fragmentación del ADN nuclear, producto de la activación de los programas de muerte celular programada o apoptosis (Negoescu et al. 1997). El procedimiento requiere desparafinización, hidratación y desenmascaramiento antigénico por medio de calor, utilizando microondas a potencia de 10 Watts y Buffer Citrato (pH 6.0), por un tiempo de 25 minutos. Para aplicar la técnica, se siguieron las indicaciones del proveedor del kit (ApopTag Fluorescein in Situ), con un protocolo que se inicia con el bloqueo de la actividad de la peroxidasa endógena, continúa con una incubación en soluciones del kit, revelado final con diaminobencidina y contra tinción con hematoxilina, deshidratación y montaje de la muestra.
2.5. Cuantificación de células apoptóticas
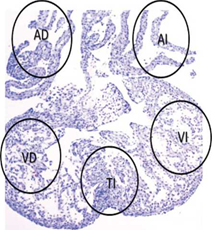
Las células apoptóticas fueron evaluadas y cuantificadas con magnificación de I00X en los cortes de los corazones fetales en cinco (5) regiones: atrio derecho, ventrículo derecho, tabique interventricular, ventrículo izquierdo, atrio izquierdo (Figura 1), siguiendo el procedimiento previamente establecido por el autor (Tejada, 2017).
Fuente: Tejada, (2017).
Figura 1 Regiones evaluadas en el corazón fetal. Se indican mediante círculos las regiones evaluadas para la detección de células TUNEL positivas en un corazón fetal en el día E16.5. AD = atrio derecho. AI = atrio izquierdo. VD = ventrículo derecho. VI = ventrículo izquierdo. TI = tabique interventricular
En cada una de las regiones, se seleccionó un área al azar en la que se realizó la cuantificación por triplicado. La visualización se realizó con microscopio óptico (Leica DM 750) adaptado a su respectiva cámara Leica DFC 295.
2.6. Análisis estadístico
Todos los valores se presentan como media ± error estándar. Los análisis estadísticos fueron realizados con el programa GraphPad Prism 5.0 (GraphPAD software, San Diego, CA, USA). Se empleó la prueba de D'Agostino-Pearson para confirmar la normalidad de las poblaciones de datos.
Las comparaciones entre los grupos se realizaron empleando la prueba t de Student. Las diferencias entre los grupos experimentales se consideraron significativas cuando p < 0.05. Los resultados se presentan como la media ± el error estándar.
3. Resultados
3.1. Evaluación de la morfología cardíaca
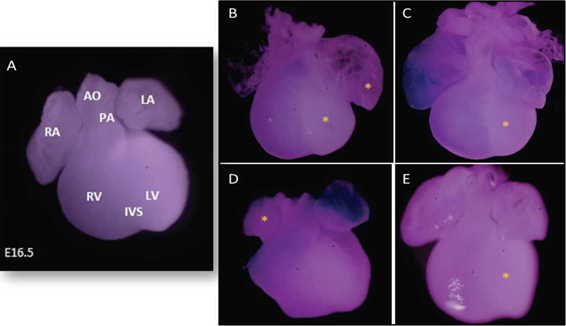
La evaluación morfológica de los corazones fetales correspondió a la observación detallada del tamaño de las cámaras: atrio derecho e izquierdo, ventrículo derecho e izquierdo y tracto de salida (OFT), tamaño, bordes externos y diferenciación de la tabicación ventricular. Estos parámetros, se visualizaron completamente definidos en los corazones de los fetos procedentes del grupo control (Figura 2A). Sin embargo, el 25% de los corazones procedentes de madres obesas presentaron aumento en el tamaño de los atrios, ventrículos y mayor longitud del tracto de salida (Figura 2 B-E).
Fuente: Elaboración de los autores
Figura 2 Corazones fetales de rata Wistar estadio E16.5. (0.55X) A. Corazón fetal proveniente del grupo control con características externas normales. RA: atrio derecho. RV: ventrículo derecho. IVS: septum interventricular LV: ventrículo izquierdo. LA: atrio izquierdo AO: arteria aorta. PA: arteria pulmonar B-E. Corazones fetales procedentes del grupo obesos con alteraciones marcadas mediante asterisco. B-C-E. Alteraciones en el tamaño del ventrículo izquierdo (hipoplasia ventricular izquierda). B. Hiperplasia del atrio izquierdo. D. Hipoplasia del atrio derecho.
3.2. Evaluación de células apoptóticas
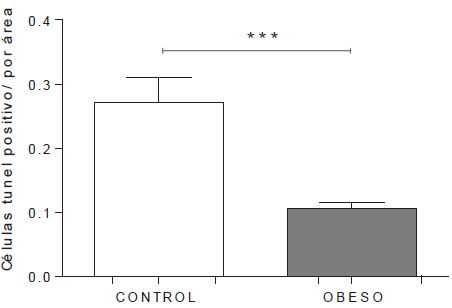
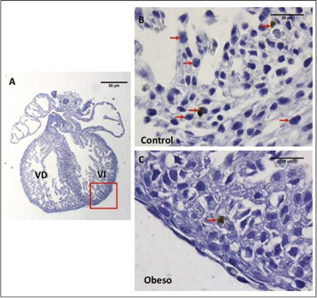
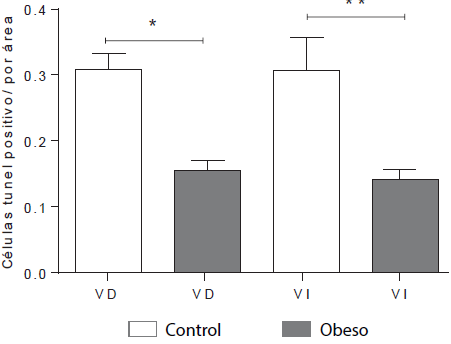
La cuantificación de la fragmentación del ADN (apoptosis) en el ventrículo derecho, fue mayor en los corazones procedentes del grupo control, comparado con los del grupo obeso, siendo estas diferencias estadísticamente significativas (p<0,05). A su vez, la cuantificación de las células apoptóticas a nivel del ventrículo izquierdo mostró un patrón similar, siendo mayor para los corazones procedentes del grupo control en comparación con el grupo obeso (P<0,00I). (Figuras 3 y 4).
Fuente: Elaboración de los autores.
Figura 3 Microfotografías de cortes histológicos de corazón fetal E16.5 a nivel de los ventrículos técnica TUNEL a (100X) A. Corte completo de corazón fetal, con recuadro rojo se indica la región evaluada para la detección de células apoptóticas. Escala de la barra 50 micras. B. Células inmunomarcadas TUNEL positivas, en ventrículo derecho de un corazón fetal del grupo control. C. Células inmunomarcadas TUNEL positivas, en ventrículo derecho de un corazón fetal del grupo obeso. Las células TUNEL positivas con núcleo color marrón, indicativo del proceso de apoptosis, son señaladas con flechas rojas. VD = ventrículo derecho; VI=Ventrículo izquierdo. Escala de la barra 20 micras.
Fuente: Elaboración de los autores.
Figura 4 Cuantificación de células apoptóticas en los ventrículos de corazones fetales VD=ventrículo derecho; VI= ventrículo izquierdo. Los datos representan la media ± el error estándar: *p<0,05 y **p<0,001
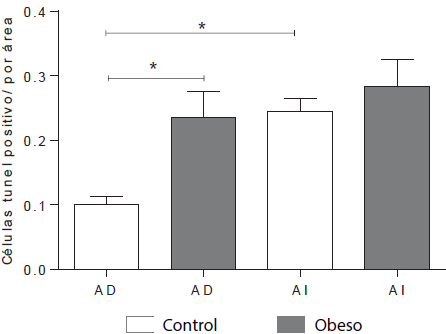
El número de células en apoptosis fue mayor en los atrios izquierdos, comparado con los atrios derechos de los corazones fetales del grupo control (p<0,05). De manera importante se observó un aumento significativo en la cantidad de células en apoptosis presentes en los atrios derechos de los corazones procedentes de madres obesas comparados con sus respectivos controles (p<0,05), sin cambios evidentes en el número de células TUNEL positivas por área cuando se comparó el atrio izquierdo de los corazones fetales entre ambos grupos. (Figura 5).
Fuente: Elaboración de los autores.
Figura 5 Cuantificación de células apoptóticas en los atrios de corazones fetales AD=atrio derecho; AI=atrio izquierdo. Los datos representan la media ± el error estándar. *p<0,05
En la región del tabique interventricular para el día EI6.5 la cantidad de células TUNEL positivas detectadas fue menor en los corazones procedentes del grupo control vs los del grupo obeso, siendo estas diferencias estadísticamente significativas (p <0.000I). (Figura 6).
4. Discusión
La correlación entre sobrepeso y obesidad con las alteraciones cardíacas congénitas han sido demostradas por diversos autores como Cerdergren y Kallen (2003), Stothard, Tennan y Bell (2009) y Mills et al. (20I0), quienes referenciaron y sugirieron que el sobrepeso y la obesidad contribuyen a una mayor incidencia de daños congénitos del corazón a nivel de los ventrículos, atrios, tabique, anomalías septales e hipertrofia ventricular, entre otros. Mills en 20I0, mediante un estudio de base poblacional de casos y controles de I.536.828 recién nacidos en Nueva York entre I993-2003, analizaron aquellos niños nacidos con defectos cardíacos congénitos y determinaron como controles los niños no afectados nacidos en el mismo periodo de tiempo; con los datos del IMC de las madres y definieron como peso normal a las madres cuyo IMC estuvo entre I9,8 a 26 kg/m2 y como madres obesas aquellas que presentaron un IMC igual o mayor a 30 kg/m2, encontraron que el mayor porcentaje de malformaciones cardíacas correspondieron a la descendencia proveniente del grupo de madres obesas; entre las anomalías evidenciaron Síndrome de hipoplasia de corazón izquierdo, presencia de ventrículo solo, atresia de la válvula tricúspide, atresia pulmonar, doble salida del ventrículo derecho, defectos de los cojines endocardiacos, Tetralogía de Fallot, defectos de septación ventricular y defectos septales a nivel atrial.
El estudio de Cedergren y Kallen (2003) compara la descendencia de mujeres obesas vs la descendencia de mujeres con peso normal. Los datos analizados incluyeron 6.80I mujeres que tuvieron hijos con defectos cardiovasculares. Este estudio concluyó que la sobrenutrición materna, incrementa el riesgo de malformaciones cardíacas en su descendencia, siendo significativamente importantes los defectos de tracto de salida, septación ventricular y atrial.
Estos estudios epidemiológicos demuestran que la obesidad materna se asocia con un mayor riesgo de defectos congénitos del corazón; sin embargo, se debe tener en cuenta que la etiología de la obesidad es multifactorial e involucra interacciones complejas entre los antecedentes genéticos, hormonales, factores sociales y ambientales, como el sedentarismo y los hábitos alimenticios inadecuados.
Para dar apoyo a los resultados obtenidos en los estudios epidemiológicos, las ciencias biomédicas han incorporado la utilización de los animales de laboratorio como biomodelos naturales o inducidos con diversas enfermedades o procesos mórbidos, los cuales semejan lo sucedido en los humanos, con el fin de orientar y esclarecer los estados iniciales de diferentes enfermedades, ayudando así al estudio ! y a la comprensión de la patogenia, fisiología y posibilidades de nuevos tratamientos (Hernandorena, Hugues y Rodríguez, 2001).
Arias-Díaz y Balibrea (2007), en una investigación sobre Diabetes mellitus tipo 2, clasificaron los principales biomodelos en espontáneos e inducidos, según su mecanismo de producción y distinguió dos categorías en cada uno de ellos: modelos análogos, que intentan imitar a la enfermedad humana, y modelos intrínsecos, con los que se pretende contestar preguntas concretas de aspectos específicos de la misma. En este sentido, el estudio se estableció un modelo murino de obesidad inducido y análogo en el que se utilizó una dieta de cafetería. Este modelo fue seleccionado dentro de un variado grupo de modelos de obesidad establecidos en roedores, entre los que se destacan: I) Los modelos genéticos, que presentan defectos en el camino de señalización de la leptina, como son los ratones ob/ob y db/db y las ratas Zucker, que heredan la obesidad como una enfermedad autosómica presente en el gen "fatty" en el cromosoma 5; y 2) Los modelos de obesidad inducida por dieta, entre las cuales existen, las dietas altas en grasa, las dietas altas en carbohidratos y la dieta de cafetería (Kanasaki y Koya, 200I; Lutz, 20I2).
La dieta de cafetería, se basa en la oferta de alimentos procesados de tipo "snack", e imita la llamada dieta occidental de los seres humanos. Bajo esta dieta los animales se vuelven obesos por comer en exceso alimentos de alto contenido calórico (Lutz, 20I2). La ventaja de establecer y utilizar este biomodelo, es la obtención de animales obesos en corto tiempo, que semeja lo sucedido en los humanos que adquieren un aumento de peso corporal por el consumo dietario de alimentos procesados e hipercalóricos de fácil adquisición.
El biomodelo utilizado en la presente investigación, se orientó al estudio del impacto de la obesidad sobre la reproducción y el desarrollo embrio-fetal; las hembras iniciaron su gestación con valores normales de colesterol, triglicéridos, glucosa y proteína C reactiva (Muñoz et al. 2012) y (Bazzano et al. 20I5). Los hallazgos que se presentan corresponden a la determinación de alteraciones cardíacas en un biomodelo de obesidad materna adquirida por dieta, después del análisis de las características macroscópicas de corazones fetales en estadio EI6,5 de desarrollo, momento en el cual el corazón de la rata presenta completo desarrollo estructural (Salazar et al. 2012). Las alteraciones encontradas en los corazones fetales de ratas obesas se relacionan con lo reportado en los estudios epidemiológicos antes descritos (Cedergren y Kallen 2003), (Mills et al. 2010) y (Stothard, Tennan y Bell, 2009). En los biomodelos prevalecieron las alteraciones en el tamaño de los atrios, ventrículos y formación del tracto de salida. Estos hallazgos cobran importancia al momento de relacionar la obesidad materna pre-gestacional y la presencia de alteraciones cardíacas, demostrando que el biomodelo de obesidad establecido es una buena herramienta para el estudio de los efectos de la obesidad sobre la formación del corazón.
La apoptosis o muerte celular programada, modula tempo-ro-espacialmente los diferentes procesos relacionados con la homeostasis tisular por medio de la eliminación de células no deseadas; igualmente regula interacciones célula-célula y célula-matriz extracelular, las cuales rigen la formación y remodelado de las diferentes estructuras en desarrollo (Fisher, Langille, Srivastava, 2000), (Elmore, 2007) y (Rienks et al. 2014), de ahí que el grupo de investigación consideró importante evaluar este proceso en los corazones de los biomodelos obtenidos, con el objetivo de contribuir a dilucidar algunos de los mecanismos involucrados en el establecimiento de alteraciones cardíacas producto de la obesidad materna.
En el sistema cardiovascular, como en otros sistemas del organismo, este tipo de muerte es un fenómeno fisiológico durante el desarrollo embrionario y fisiopatológico en la vida adulta. En el primer caso permite la eliminación de estructuras vestigiales y en el segundo caso, su desregulación es un factor importante en la fisiopatología de diversas enfermedades cardíacas (Cheng, Wessels y Gourdie, 2002) y (Barbosky et al. 2006).
Estudios previos realizados en biomodelos obesos adultos mostraron que el incremento en la fibrosis cardíaca y fallas en la contractilidad del corazón sería producto de cambios en el proceso de apoptosis (Wang et al. 20I0), (Kalpana y Wilson, 2010) y (Barouch et al. 2006).
Según Bialostozky y colaboradores, durante la cardiogénesis el proceso de apoptosis puede sufrir modificaciones por acción del medio ambiente uterino de la madre obesa, predisponiendo así a la presencia de alteraciones en las vías de señalización que pueden resultar en su desregulación, conduciendo a desordenes en la formación y maduración de las diferentes estructuras cardíacas (Bialostozky, Rodríguez y Zazueta, 2008).
La estimación de la apoptosis celular se puede realizar por la técnica de TUNEL o mediante técnica de Caspasa-3 activada.
La evaluación de la apoptosis por medio de la técnica de TUNEL, mostró un aumento del proceso en el atrio derecho y una disminución en los ventrículos y el tabique interventricular en los corazones fetales del grupo obeso. En estudio previo, el grupo evaluó las mismas regiones cardíacas utilizando la técnica de caspasa-3 activada, donde no se evidenciaron diferencias entre los grupos experimentales (Tejada, 2017). Estas diferencias en los resultados se pueden explicar básicamente en el fundamento de las técnicas utilizadas; la caspasa-3 activada detecta el proceso en etapas iniciales mientras que TUNEL detecta la fase final (Bialostozky, et al. 2008) y (Gown, 2002).
Los trabajos realizados durante el desarrollo normal en murinos indican que los compartimentos ventriculares y atriales del corazón se agrandan sin mostrar altos niveles de apoptosis en los cardiomicitos de estas cámaras, donde primarían los mecanismos de proliferación celular (Fisher, et al. 2000). Abdelwahid et al. I999 identificaron con microscopía electrónica de transmisión y técnica de TUNEL algunos cardiomiocitos apoptóticos en la zona trabecular del ventrículo en el corazón de ratón en el día EII a EI6 (Abdelwahid et al. 1999); contrario a lo detectado en el crecimiento de las cámaras cardíacas, el proceso de apoptosis sería fundamental en el acortamiento y re-estructuración del tracto de salida, evento que se origina temprano en el desarrollo del corazón (Ya et al. 1998) y (Goor, Dische y Lillehei, 1972).
Con base en estos antecedentes, es claro que el proceso de apoptosis se encuentra alterado en los corazones fetales expuestos a condiciones obesogénicas maternas y que dicho proceso está regulado de forma espacio-temporal en el desarrollo cardíaco. Estos eventos cobran importancia dado que, la re-estructuración de las cámaras y de manera específica del septum interventricular es un proceso complicado que implica la división del ventrículo común en dos cámaras, una derecha y otra izquierda, y la separación de la parte distal del bulbo cardíaco para formar la aorta y la arteria pulmonar (Morris, 1957). Por lo tanto, defectos en estas estructuras se relacionan con Tetralogía de Fallot, defectos completos de la comunicación atrio ventricular y transposición de grandes vasos (Mills et al. 2010) y (Rascusin et al. 2012). En este biomodelo, la obesidad materna generó alteraciones en el proceso de apoptosis en los corazones fetales que son compatibles con malformaciones cardíacas descritas para los seres humanos.