Introducción
El fósforo (P) es un elemento significativo para los seres vivos, principalmente para las plantas que lo necesitan para su crecimiento y desarrollo (Moreno, González, Cecena y Grimaldo, 2015; Munera y Meza, 2012; Redel, Rubio, Rouanet y Borie, 2007). Sin embargo, en los suelos, especialmente los procedentes de cenizas volcánicas, principalmente los Andisoles, el P se encuentra poco disponible para las plantas (Bobadilla y Rincón, 2008), debido a su fijación, dada a través de reacciones químicas que involucran procesos de adsorción sobre la superficie de arcillas, precipitación con cationes de la solución del suelo y acomplejamiento con la materia orgánica (Sánchez y Rubiano, 2015).
De acuerdo con lo anterior, el P es un nutriente restrictivo en estos suelos y dados los altos requerimientos de las plantas para su crecimiento y desarrollo, se usan fertilizantes de síntesis química industrial para obtener mejores rendimientos. Después de su aplicación, hace tránsito a formas menos disponibles para las plantas al formar fosfatos con aluminio (Al) o hierro (Fe) en suelos ácidos y con calcio (Ca) en suelos alcalinos o calcáreos. Los elevados costos y el impacto ambiental negativo causados por su aplicación, exigen investigar opciones para satisfacer los requerimientos de P de las plantas, a través del uso de materias primas menos costosas y ambientalmente amigables (Mardad, et al. 2013).
En los últimos años se ha investigado y propuesto el uso de microorganismos solubilizadores de fosfato (MSF), ya que biosintetizan ácidos orgánicos capaces de inducir la liberación de P dejándolo en su estado disponible. Una ventaja que presentan frente a fertilizantes químicos, es la contribución a la preservación del medio ambiente, ya que no implican sustancias tóxicas que afecten el sistema, generando de esta manera una agricultura sostenible (Abbasi, Musa, y Manzoor, 2015; Luna, Márquez y Alejo-Iturvide, 2017).
En Colombia, especialmente en la región andina, se han realizado varios estudios sobre MSF, especialmente bacterias y hongos (Pérez, De la Ossa y Montes, 2012; Cisneros y Sánchez de P, 2015), siendo estos últimos los que poseen mayor capacidad de solubilizar fosfatos, debido a sus características morfológicas y metabólicas que los hacen organismos promisorios en suelos ácidos o de origen volcánico (Mujica y Molina, 2017; Vera, Pérez y Valencia, 2002).
Los hongos con capacidad solubilizadora de fosfatos pertenecientes a los géneros Rhizoctonia, Talaromyces, Eupenicillium, Trichoderma, Mycelia sterilia y Penicillium han sido aislados de diferentes suelos (Jacobs, et al. 2002; Barroso, et al. 2006; Scervino, et al. 2010; Paiva Coutinho, et al 2011). La comprensión del papel que juegan estos microorganismos en el ciclo del fósforo permite plantear como alternativa viable, la introducción de MSF como biofertilizantes (Sharma, Sayyed, Trivedi y Gobiet, 2011; Sheraz, et al. 2011; Cisneros R., Sánchez de P. y Menjívar F., 2016). Estos microorganismos se concentran en alta proporción en la rizósfera de las plantas, y son metabólicamente más activos que los que provienen de otras fuentes (Singh, et al. 2017).
Con el fin de contribuir a la generación de nuevo conocimiento sobre los hongos solubilizadores de fosfatos, el presente estudio evaluó la capacidad solubilizadora de fosfato de aluminio de dos hongos rizosféricos (Mycelia sterilia y Penicillium sp), aislados de un Typic Melanudands (Andisol) del Departamento del Cauca (Colombia), utilizando dos metodologías en medio líquido (Pikovskaya), en reposo con agitación (método A) o con aireación (método B). El análisis de varianza (ANOVA) y prueba de comparación de medias de Tukey, permitió constatar que la eficiencia solubilizadora de fósforo (ESF) fue mayor con el método A con Mycelia sterilia y el incremento en la cantidad de biomasa con el método B, con Penicillium sp. El pH no mostró diferencias significativas en los métodos utilizados. Los resultados obtenidos son promisorios, debido a que ambos hongos solubilizaron un alto porcentaje de fósforo.
1. Marco teórico
1.1 Andisoles
Los Andisoles son suelos de origen volcánico, considerados los más productivos a nivel mundial. Se localizan en un extenso rango de climas, latitudes y altitudes. Ocupan aproximadamente 120 millones de hectáreas o 0.84% de la superficie terrestre, mientras que en Colombia, abarcan aproximadamente el 4.5% del territorio (Jaramillo, 2009; Sánchez y Rubiano, 2015), incluyendo tierras con uso agrícola situadas en la región andina, especialmente en la cordillera central y en menor proporción en las cordilleras occidental y oriental, en los departamentos de Antioquia, Caldas, Risaralda, Quindío, Tolima, Cauca, Valle del Cauca y Nariño (Lizcano, Herrera y Santamaria, 2006), siendo los más representativos los Hapludands y Melanudands. Estos suelos constituyen la base de la producción de sistemas tan diversos como los cultivos de papa, café y la mayoría de las hortalizas (Auxtero, Madeira y Sousa, 2004).
Estos suelos se caracterizan por poseer materia orgánica altamente estabilizada, elevada retención de humedad, baja densidad aparente, carga variable coloidal, alta friabilidad y alta fijación de fósforo, P (Satti, Mazzarino, Roselli y Crego, 2007); Bayuelo y Ochoa, 2014). La retención de P en estos suelos, puede alcanzar el 85%, y se atribuye a la existencia de minerales de tipo aluminosilicatos no cristalinos en la fracción arcilla, principalmente alófano, imogolita, ferrihidrita y complejos humus-aluminio (Satti, et al. 2007; Sánchez y Rubiano, 2015), que se forman en el curso del desarrollo del suelo.
1.2. El fósforo como nutriente esencial para las plantas
El fósforo (P) es el segundo macronutriente esencial para el crecimiento y desarrollo de los organismos vivos. Es componente de muchos minerales inorgánicos (apatitas) y biomoléculas como Adenosin Difosfato (ADP), Adenosin Trifosfato (ATP), Ácido Desoxirribonucleico (ADN), Ácido Ribonucleico (ARN), Fosfolípidos, entre otros. Ayuda a la construcción de biomasa, obtención de micronutrientes, participa en varios procesos fisiológicos de las plantas (Gleason, 2007).
La insuficiencia de este elemento, provoca tardanzas en el crecimiento vegetal y una coloración púrpura en las hojas. Además, las plantas presentan muy baja eficiencia fotosintética lo que conlleva a un retraso en los procesos de maduración (Gleason, 2007; Sharma, et al. 2013; Kruse, et al 2015).
Frente a los elementos principales de nutrición, las plantas requieren al P en promedio entre 0,2 y 0,4% de su peso seco. A pesar de que el P es abundante, sólo el 0,1% del fósforo total está disponible. Las plantas lo adquieren de la solución del suelo como aniones de fosfato, procedentes de la mineralización de materiales orgánicos y solubilización de fuentes minerales (Mullen, 2005). En la solución del suelo se encuentra disponible en muy baja concentración (Sharma, et al 2013; Kruse, et al 2015).
Por lo tanto, la fracción de P disponible para la planta y su concentración en la solución del suelo puede ser insuficiente para satisfacer las necesidades de las plantas (Rengel y Marschner, 2005; Jorquera, Hernández, Rengel, Marschner y Mora, 2008), por lo cual debe suministrarse por medio de fertilizantes minerales elaborados a partir de roca fosfórica y/o fuentes altamente solubles (Patiño y Sánchez de P., 2014). Sin embargo, éstos tienden a acumularse en forma de compuestos insolubles cuando entran en contacto con los coloides del suelo (Richardson y Simpson, 2011; Agrawal y Pathak, 2012).
1.3. Papel de los microorganismos solubilizadores de fosfatos en la disponibilidad del fósforo
Así como las plantas, los microorganismos también poseen un importante rol en el ecosistema del suelo, ya que son fuente considerable de P y participan en las transformaciones de ese elemento.
Los microorganismos solubilizadores de fosfatos (MSF) se concentran en alta proporción en la rizósfera de las plantas (Singh, et al. 2017), por lo cual se han estudiado varias especies de bacterias y hongos (Sharma, et al. 2013). Durante los últimos años el conocimiento sobre los MSF se desarrolló significativamente (Sharma, et al. 2013). Entre estos se encuentran las Bacterias Promotoras del Crecimiento Vegetal o PGPR, Plant Growth Promotion Rhizobacteria, y hongos solubilizadores de fosfato, HSF (Paredes y Espinosa, 2010; Sharma, et al. 2013). Por lo general, ellos son aislados del suelo rizosférico, no rizosférico, rizoplano, filosfera y de depósitos de roca fosfórica usando el método de dilución serial o una técnica de cultivo enriquecido (Zaidi, et al. 2009).
Son varios los mecanismos en los cuales los MSF se encargan de liberar el P, dejándolo disponible para las plantas (Paredes y Espinosa, 2010; Sharma, et al. 2013). Entre ellos se encuentra la acidificación del medio causada por la biosíntesis de ácidos orgánicos (glucónico, 2-cetoglucónico, oxálico, cítrico, láctico, tartárico, aspártico, succínico, isobutírico, isovalerico, entre otros), el cual constituye el mecanismo más importante de liberación de P a través de la solubilización de fosfatos inorgánicos por parte de los MSF. Dicha solubilización se manifiesta así: (i) disminución de pH, (ii) quelación de cationes unidos al P, (iii) competencia del P por los sitios de adsorción en el suelo, o (IV) formación de complejos solubles con iones metálicos asociados al P insoluble (Ca, Al, Fe), con lo anterior, el P es liberado (Paredes y Espinosa, 2010; Sharma, et al. 2013). De otro lado, la temperatura, la concentración de las fuentes de P, C y de N influyen en la actividad solubilizadora de estos microorganismos (Ahuja, Ghosh y D'souza, 2007).
1.4. Métodos y medios de cultivo para el estudio de microorganismos solubilizadores de fosfatos
Desde 1948, cuando Pikovskaya sugirió que los microorganismos podrían disolver formas no disponibles de fósforo en el suelo para proporcionarlo a las plantas, numerosos métodos y medios de cultivo, como Pikovskaya (Pikovskaya, 1948), azul de bromofenol (Gupta, Singal, Shanker, Kuhad y Saxena, 1994) y NBRIP, National Botanical Research Institute's Phosphate growth medium (Nautiyal, 1999) han sido propuestos. Comúnmente, se utiliza como fuente de P insoluble el fosfato tricálcico (Ca-P), para aislar y evaluar la solubilización de este elemento por parte de los microorganismos aislados del suelo. También han sido probados los fosfatos de hierro, de aluminio y varios de calcio considerados menos solubles que el Ca-P en agua (Bashan, et al. 2013a, b; Sharma, et al. 2013). La selección de la fuente de P depende del tipo de suelo.
La actividad solubilizadora de P de MSF se detecta por la formación de un halo claro alrededor de sus colonias en medio sólido. Lo anterior no cuantifica la concentración de fósforo liberado al medio de cultivo procedente de fosfatos insolubles. Para ello se evalúa la solubilización del elemento en medio líquido por espectrofotometría o colorimetría al igual que la producción de ácidos orgánicos por cromatografía líquida de alta eficiencia (HPLC), después, se identifican los microorganismos con mejor capacidad solubilizadora de P y por último las colonias son probadas en una planta indicadora usándolos como biofertilizantes con el fin de evaluar su efecto en el crecimiento y desarrollo de éstas (Bashan, et al. 2013a; Cisneros, et al. 2016; Cisneros R., Sánchez de P. y Menjívar F., 2017).
2. Materiales y Métodos
Los MSF, especialmente hongos solubilizadores de fosfatos (HSF), fueron seleccionados a partir del trabajo realizado por Cisneros y Sánchez de P, (2015).
Los análisis realizados a los aislamientos fúngicos, tuvieron lugar en los laboratorios de Microbiología de la Universidad Nacional de Colombia (Palmira, Colombia) y Universidad Santiago de Cali (Cali, Colombia).
Identificación de hongos solubilizadores de fosfatos. Este trabajo se inició con los dos aislamientos fúngicos más eficientes (UNHI y UNH2) en la solubilización de fósforo a partir de fosfatos tricálcico, de aluminio y de hierro, en agar Pikovskaya, PVK (Cisneros y Sánchez de P, 2015). Dichos hongos fueron identificados morfológicamente como Mycelia sterilia y Penicillium sp, con claves dicotómicas, de acuerdo con sus características macroscópica y microscópicas (De Hoog, Guarro, Gené, Figueras, 2000).
Evaluación in vitro de la eficiencia solubilizadora de fosfato de aluminio de los hongos seleccionados en medio líquido (PVK sin agar). Los microorganismos seleccionados fueron evaluados en PVK utilizando como fuente de fósforo, fosfato de aluminio, sustancia presente en suelos ácidos o de origen volcánico. (Bashan, Kamnev y D-Basham, 2013a; Bashan, et al 2013 b; Sharma, 2011).
La capacidad solubilizadora de fosfato de aluminio de los microorganismos se llevó a cabo bajo dos condiciones, con agitación (Método A) y en reposo con aireación (Método B), manteniendo todas las medidas de esterilidad.
Se tomó con un sacabocado 10 mm2 de cada hongo previamente crecido en PDA y se transfirió a un erlenmeyer con 100 ml del medio de cultivo glucosa-peptona (2:1) y se dejó con agitación constante, durante una semana. De cada suspensión, se tomó 2 ml de medio, el cual se depositó en un erlenmeyer que contenía 200 ml de PVK líquido con púrpura de bromocresol al 1%. Se utilizaron tres repeticiones por cada microorganismo. Los testigos fueron los mismos medios de cultivo a los cuales se adicionó 2 ml de agua destilada estéril. Los cultivos se mantuvieron en agitación a 100 rpm (Método A, Figura 1a), y aireación (Método B, Figura 1b), a temperatura ambiente (28-30oC) por 15 días.

Fuente: Elaboración propia.
Figura 1 Ensayo en medio líquido a) Método con agitación constante; b) Método en reposo con aireación.
Las evaluaciones de porcentaje de fósforo (% P soluble) se llevaron a cabo los días 0, 3, 6, 9, 12 y 15. Para estas mediciones, se tomó 10 ml de cada erlenmeyer el cual se filtró a través de membranas Millipore de 0,45 Lim. Al filtrado se le midió el pH por Potenciometría y el P soluble empleando el Método Amarillo de Molibdovanadato (APHA-AWWA-WPCF, 1992). Para la determinación de Biomasa fúngica, se realizó por diferencia de peso utilizando la membrana Millipore de 0,45 Lm previamente pesado, luego se sometió a una temperatura de 100 °C durante 40 minutos hasta que el peso fuera constante.
Análisis estadístico. Para la evaluación de la eficiencia solubilizadora de fosfato con los métodos A y B, se formuló un diseño completamente al azar, con variables de respuesta, % P soluble, biomasa y pH, con tres repeticiones por ensayo. Se utilizó análisis de varianza (ANOVA) y prueba de comparación de medias de Tukey, con una significancia del 95%. Los análisis se corrieron utilizando el programa PSPP v.0.8.1.
3. Resultados
Análisis preliminar. Los microorganismos son procedentes de un Typic Melanudands del Departamento del Cauca, del cual se conocen sus propiedades químicas (Cisneros y Sánchez de P, 2015; Montagut, 2014), siendo consistentes con las características químicas de este tipo de suelos: pH ácido (5,01), baja disponibilidad de P (entre 0,84 y 2,20 ppm), y alto contenido de materia orgánica (superiores a 10%).
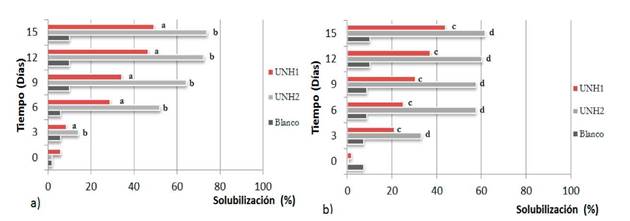
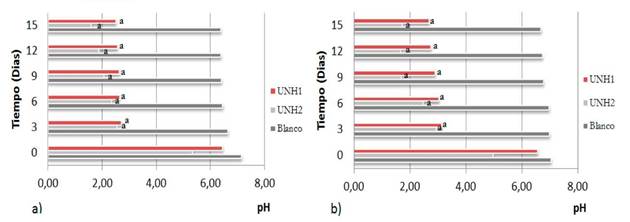
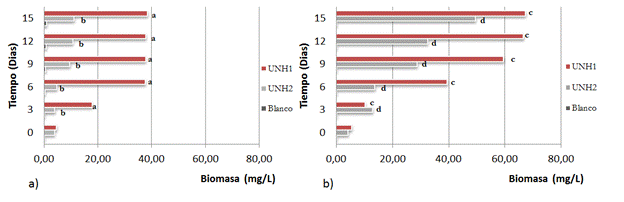
Cuantificación de P, pH y producción de biomasa. En las Figura 2, 3 y 4 se presentan el porcentaje de fósforo solubilizado por Penicillium sp y Mycelia sterilia. Al comparar los dos métodos se encontraron diferencias estadísticas significativas al igual que en el porcentaje de solubilización y producción de biomasa. Con relación al pH no se encontraron diferencias significativas.
Fuente: Elaboración propia
Figura 2 Porcentaje de P solubilizado: a. Método A; b. Método B. Medias con la misma letra no difieren estadísticamente, p<0,05.
Fuente: Elaboración propia
Figura 3 Valores de pH: a. Método A; b. Método B. Medias con la misma letra no difieren estadísticamente, p<0,05.
Fuente: Elaboración propia
Figura 4 Valores de Biomasa Fúngica: a. Método A; b. Método B. Medias con la misma letra no difieren estadisticamente, p<0,05.
La eficiencia solubilizadora de fósforo (ESF) con el Método A presentó un porcentaje mayor con un 73,8% para UNHI y 49%, para UNH2, mientras que con el Método B se obtuvo 62% y 44% respectivamente.
En la producción de biomasa en el medio con agitación (Método A) se obtuvieron valores de 11,20 mg/l para UNHI y 49,54 mg/L para UNH2 mientras que con el Método B se registraron valores de 38,53 mg/l y 67,30 mg/l respectivamente. Para el método con agitación (A) se observaron formaciones de colonias pequeñas muy agrupadas, a diferencia del método con aireación (B) donde el hongo esporuló uniéndose a las paredes del contenedor y en toda el área superficial de la solución.
4. Discusión
Al existir poca información sobre el género de los hongos filamentosos rizosféricos solubilizadores de fósforo, estos resultados de porcentajes de solubilización in vitro (Figura 2) demuestran que se deben realizar más estudios y no centralizar el tema solo en hongos micorrizas arbusculares y bacterias (Corrales, Arévalo y Moreno, 2014; Pérez, et al. 2012).
Los resultados obtenidos son muy promisorios, debido a que ambos hongos solubilizaron un alto porcentaje de fósforo, Mycelia sterilia presentó mayor solubilización del fosfato de aluminio con un promedio de 74% comparado con Penicillium sp con un promedio de 49 % de Eficiencia Relativa; debido posiblemente a la biosíntesis de ácidos orgánicos (AO),que influyen en la acidificación del medio, quelación, precipitación y reacciones de óxido-reducción, para formar complejos con los metales, en este caso el Aluminio (Cerón y Aristizabal, 2012; Malviya, Sing, y Joshi, 2011; Paredes y Espinosa, 2010). La acidificación del PVK con púrpura de bromocresol se evidenció físicamente por el viraje del color del indicador de púrpura a amarillo (Sosa, 2010), lo que confirma la presencia de ácidos en el medio. Los microorganismos asimilan iones amonio (NH4 +), excretando protones lo cual forma complejos entre cationes que precipitan el fósforo de manera inorgánica y aniones orgánicos como oxalatos y fumaratos: desorción de iones de fósforo inorgánico y absorción por aniones orgánicos (Lara, Esquivel y Negrete, 2011; Osorio, 2008).
La eficiencia solubilizadora de fósforo (ESF) con el Método A, presentó un porcentaje mayor. La agitación constante garantizó la homogeneidad del medio, permitiendo a las colonias permanecer más tiempo sumergidas y activas en el medio líquido (FAO, 2015). Con relación al método B, la aireación jugo un papel muy importante, debido a que estos hongos son aerobios (Lugo, Plaza, Cisneros, y Caicedo, 2015) lo que influyó de manera significativa en el desarrollo de biomasa. El parámetro de aireación en un bio-reactor es fundamental, debido que se puede realizar una rápida transferencia de oxígeno y esto genera un incremento en la biomasa del microorganismo, esta técnica es muy usada en la industria biotecnológica para la producción de proteína unicelular (Cruz, 2007).
Con ambos métodos se presentó la acidificación de los medios de cultivo pasando de un valor neutro a valores por debajo de 1,75 (Yauyo, 2015), este comportamiento se esperaba, debido a que estos microorganismos habitan en suelos ácidos (Cisneros y Sánchez de P, 2015) y al producir más ácidos orgánicos de bajo peso molecular, la tendencia de acidificación es creciente. En otros estudios se ha demostrado un comportamiento similar (Behera, Singdevsachan, Mishra, Dutta y Thatoi, 2014).
La biomasa microbiana se ve directamente afectada por la aireación de los medios de cultivo, debido a que estos hongos son aerobios y tienden a permanecer en la superficie del líquido o en las paredes del recipiente. El hongo Penicillium sp, al ser facultativo presentó mayor producción de biomasa, el porcentaje de P soluble fue bajo; lo que indica que el fósforo solubilizado en gran medida paso a formar parte de la estructura del hongo (Giraldo y Villa, 2016). Además las condiciones de crecimiento se vieron favorecidas por la acidificación del medio, siendo ideal para su desarrollo (Beltrán, 2014; Paiva, Pereira y Yano, 2012).
5. Conclusiones
El estudio resultó muy promisorio debido a que las dos cepas de hongos UNH1 y UNH2 presentaron alto porcentaje de solubilización de P, pero al comparar el comportamiento de ambos, se encuentra que el hongo que presentó mayor ESF fue UNH1 con un 73,8% comparado con el hongo UNH2 que solubilizó el fósforo en un 49,6%.
Se determinó que los dos métodos permiten la solubilización del fosfato de aluminio, sin embargo el método A (agitación) es más efectivo que el método B (aireación). Esta última metodología es más fácil de implementar en el campo.
Las condiciones de pH fueron propicias para el crecimiento de los hongos y la producción de biomasa. Los diferentes métodos de cultivo permitieron demostrar que una simple variable puede modificar el rendimiento de la cuantificación del P libre.
La eficiencia de los microorganismos solubilizadores de fosfato se ha estudiado mucho en los últimos años y a partir de un Andisol se pueden obtener microorganismos nativos capaces de transformar los nutrientes presentes en los suelos logrando transformar macronutrientes a su estado de biodisponibilidad evitando el uso de químicos, para así implementar una agricultura sostenible.














