Introducción
En el ser humano, la formación dental resulta de la interacción biológica de dos agrupamientos celulares provenientes del ectodermo y el ectomesénquima. Cada diente es el resultado de movimientos morfogenéticos celulares y la cooperación entre células epiteliales y mesenquimatosas (Rothová et al. 2011; Thesleff, 2003). Este proceso inicia a partir de la formación del germen dental, que se divide en una estructura de origen epitelial: el órgano del esmalte y, en dos estructuras ectomesenquimatosas: la papila primitiva y el folículo fibroso. La papila primitiva dará origen a los odontoblastos, la dentina y la pulpa dental, mientras que el folículo fibroso originara el cemento, hueso alveolar y ligamento periodontal (Liyanage, 2013).
Las células del órgano del esmalte generan la producción del esmalte dental a través de los ameloblastos, células responsable de la secreción de la matriz orgánica, gracias al proceso de la amelogénesis o diferenciación celular que implica el paso por varios estados sucesivos finalizando con la formación del esmalte dental (Zheng et al. 2014). Los ameloblastos crean y mantienen un microambiente extra-celular que propicia la formación del esmalte y secretan las proteínas matriciales que controlan los depósitos de minerales. Estas células presentan varios cambios fenotípicos a lo largo de la amelogénesis, desarrollados en tres etapas: la citodiferenciación, secreción de la matriz amelar y la maduración del esmalte (Berkovitz, Holland y Moxham, 2009).
Durante la citodiferenciación, los ameloblastos denominado pre-ameloblastos, se diferencian y convierten en funcionales; es una fase donde el diente adquiere su forma y los ameloblastos se preparan para ingresar en una fase de secreción. Esta etapa incluye la salida del ciclo celular, alargamiento y polarización de los ameloblastos (Berkovitz, Holland y Moxham, 2009). Durante la secreción de la matriz del esmalte, los ameloblastos fabrican diversas proteínas matriciales. Primero, ocurre la secreción lateral alrededor de las prolongaciones de Tomes, dando lugar a una red de esmalte prismático seguido de los espacios ocupados por las prolongaciones de Tomes que son ocupados por un esmalte interprismático. En la maduración del esmalte, ocurre un crecimiento en el espesor y dimensión de los cristales gracias a la degradación de la matriz orgánica y la llegada masiva de iones de calcio y fosfato (Zheng et al 2013; Boskey, 2003).
Al final de las etapas mencionadas, una estructura acelular, avascular y sin inervación que recubre la totalidad de la corona dental y cuya principal característica es la ausencia de renovación conocida como esmalte dental, es creada (Zheng et al. 2013), cualquiera alteración que afecte su proceso de formación, puede generar anomalías en su estructura. Alteraciones genéticas y funcionales, así como modificaciones en la incorporación de iones como el estroncio, magnesio, carbonatos (CO3 2), plomo o incluso el flúor son reportados por su capacidad en generar alteraciones en la formación del esmalte dental y sus propiedades fisicoquímicas (Boskey, 2003).
El estudio de los diferentes procesos y eventos fisiológicos que dan origen al esmalte dental ha sido posible por medio de modelos animales, uno de estos modelos son los incisivos de los roedores; ellos tienen la capacidad de crecer continuamente y renovar el epitelio dental que produce la matriz del esmalte gracias a células madres. Sin embargo, resulta conveniente continuar dilucidando los procesos sobre la actividad biológica que llevan a cabo los ameloblastos durante su diferenciación. Para ello, se han propuestos modelos celulares como las células epiteliales dentales originadas del asa cervical de incisivos de rata.
Las células epiteliales dentales de incisivos de rata, también denominadas células ameloblásticas de rata, han sido útiles en el estudio de transporte de iones epiteliales durante la amelogénesis (Bori et al. 2016). De acuerdo a estudios inmunohistoquímicos realizados recientemente, las células epiteliales presentan características de los ameloblastos, incluyendo la expresión de la amelogenina, ameloblastina, calicreína-4 y la amelotina. Estas dos últimas, marcadores de los ameloblastos en la etapa de maduración (Kawano et al. 2002). Estas células también han sido usadas con el propósito de conocer el papel de la autofagia en la fluorosis dental y sus mecanismos de acción (Lei et al. 2015). Sin embargo, se requieren más estudios para determinar si las células epiteliales de rata pueden servir como un modelo óptimo que permita conocer los roles fisiopatológicos de los ameloblastos a lo largo de su proceso de diferenciación y el papel de factores que modifiquen una adecuada formación del esmalte dental.
Sistemáticamente, la implementación de modelos celulares implica la utilización de suplementos con Suero Fetal Bovino (SFB). El SFB es una composición que contiene factores biológicos como proteínas, vitaminas, hormonas, glucosa y factores de crecimientos necesarios para el crecimiento, proliferación y mantenimiento de las células (Lee et al 2003; Mucci et al. 2006). El uso del SFB en los cultivos celulares continua siendo debatible dada la probable introducción de elementos que pueden inducir efectos inhibitorios en el desarrollo y diferenciación celular, además de la posibilidad de generar contaminación biológica (Van der Valk et al. 2010). Sin embargo, su uso es casi rutinario por el aporte de factores de crecimiento necesarios para la supervivencia celular.
El uso de medios de cultivos sin suero fetal bovino ni moléculas de origen animal fue fuertemente sugerido por parte de los organismos regulatorios como la FDA (Food and Drug Administration) dado los riegos biológicos potenciales. Desafortunadamente, la eliminación de este componente para muchas líneas celulares representa la disminución en el crecimiento, viabilidad y mantenimiento celular. De allí que se hace necesario profundizar en los conocimientos de base sobre el crecimiento, metabolismo y muerte de líneas celulares cultivados en ausencia de suero fetal bovino.
Con el propósito de comprender los mecanismos implicados en el proceso de la formación del esmalte dental, el desarrollo de un modelo in vitro a partir de células epiteliales dentales se hace necesario. En consecuencia, la comprensión de los aspectos fisiológicos de estas células requiere prioritariamente la caracterización de los elementos necesario para su cultivo, entre ellos, el SFB. El propósito de este trabajo es evaluar el efecto concentración-dependiente de la suplementación de SFB en el medio de cultivo y el comportamiento, crecimiento, proliferación y supervivencia de células epiteliales dentales.
1. Metodología
1.1. Cultivo celular
Células epiteliales dentales originadas del asa cervical de incisivos de rata descritas previamente por Kawano et al. (2002) fueron cultivadas en dos medios de cultivo diferentes: Medio de cultivo 1 (DMEM/F12 + SFB 10%), compuesto de Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) Gibco™, 10% de Suero Fetal Bovino-SFB (Gibco™), 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™). Medio de cultivo 2 (DMEM/F12 + SFB 0%), constituido de DMEM/F12 DMEM Gibco™, 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™). Cada pasaje celular correspondía alrededor de una semana de cultivo. La caja de Petri con las células y el medio de cultivo fueron incubados a 37°C en una atmosfera húmeda que contenía 5% de CO2. El medio de cultivo fue reemplazado dos veces por semana hasta la obtención de células a una confluencia de 70-80%.
1.2. Análisis morfológico
La morfología celular fue observada a lo largo de la proliferación y una vez alcanzada la confluencia por medio de la microscopia de contraste de fases (Zeiss) gracias a cámara fotográfica. En paralelo, una contra-coloración nuclear con el marcador de ácido nucleico Hoechst 33342 (Thermo Fisher Scientific) en las dos condiciones de cultivo fue llevado a cabo con el fin de constatar la supervivencia de las células epiteliales.
1.3. Inmunohistoquímica
A una confluencia de aproximadamente 90%, las células epiteliales dentales fueron fijadas mediante una solución de PBSIX (Gibco™) que contenía 4% de paraformaldehído (Sigma-Aldrich®) - 5% sacarosa (Sigma-Aldrich®) durante 15 minutos. Seguidamente, las células fueron permeabilizadas utilizando 0.5% de Triton X-100 (Sigma-Aldrich®). Evitando una eventual coloración no especifica, las células fueron incubadas 20 minutos en PBSIX que contenía 1% de BSA (Sigma-Aldrich®) / 1% de glicina (Sigma-Aldrich®) a temperatura ambiente. Posteriormente, las células estuvieron en contacto con los anticuerpos primarios a 4°C durante toda la noche. Para la doble inmunofluorescencia, los anticuerpos primarios se incubaron tal como se indicó precedentemente. Finalmente, las células estuvieron en contacto con los anticuerpos secundarios apropiados durante 2h a temperatura ambiente. Los núcleos celulares fueron coloreados con DAPI (Life Technologies Corporation), seguido por el montaje de las células mediante la solución Immu-MountTM (Thermo Scientific).
Los anticuerpos primarios utilizados para la coloración inmunológica fueron: anti-Fibronectin sc-71113 (Santa Cruz Biotechnology INC) (1/200), anti-Vimentin (Sigma-Aldrich®) 1/200. Los anticuerpos secundarios fueron Alexa Fluor 488 donkey anti-ratón (Life Technologies Corporation) -1/400 y Alexa Fluor 594 donkey anti-ratón (Life Technologies Corporation) -1/400, respectivamente. La coloración mediante la faloidina fue realizada después de la incubación del segundo anticuerpo, mediante Alexa FluorTM 594 Phalloidin (Thermo Fisher Scientific) durante 15 minutos y siguiendo las recomendaciones del fabricante. Todas las coloraciones fueron observadas utilizando el microscopio Fluorescente Zeiss AxioSkop.
2. Resultados
La variación en la concentración de SFB en el cultivo de células epiteliales dentales, como un elemento vital que participa en la supervivencia, crecimiento y proliferación de las células cultivadas in vitro fue estandarizada en este estudio. Microscópicamente, las células mostraron un aspecto circular u ovoide junto a un núcleo redondos y voluminoso durante el tiempo de cultivo, haciendo constatar la supervivencia y viabilidad de estas células durante el tiempo de cultivo (Figura 1).
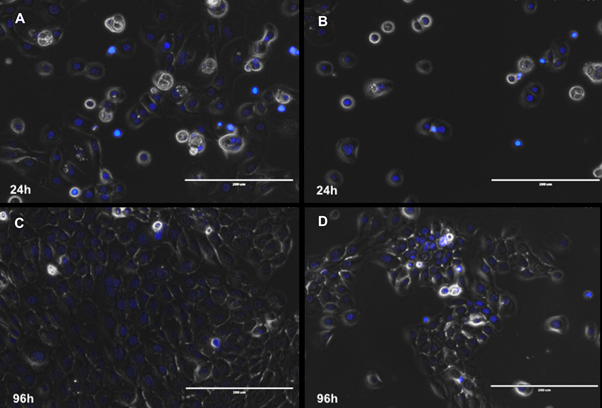
Fuente: Simancas-Escoraa, Díaz-Caballero
Figura 1 Marcaje de los núcleos en azul (Hoechst) de las células epiteliales dentales después de ser cultivadas con SFB 10% (A,C) y SFB 0% (B,D,) a 24 y 96 horas. Barra blanca: 200 μm.
Las células epiteliales dentales cultivadas en ambos grupos experimentales mostraron una supervivencia a lo largo 7 días (Figura 2). Sin embargo, en función de la concentración del SFB, una variación en la confluencia de las células epiteliales dentales fue observada (Figura 2, A-H). En la condición de cultivo 1 (DMEM/F12 + SFB 10%), las células epiteliales alcanzaron una confluencia de aproximadamente 20% luego de 24 horas de cultivo (Figura 2,A). Estos resultados fueron muy similares a los resultados hallados en las células epiteliales cultivadas en ausencia de SFB en el mismo periodo de tiempo (Figura 2,B). Las células epiteliales en contacto con el SFB a 10% continuaron proliferando hasta obtener una confluencia de aproximadamente 100% a las 96 horas (Figura 2. C,E,G). Sin embargo, una cantidad no cuantificable de células flotantes fueron evidentes con el paso del tiempo en las células epiteliales cultivas en ausencia de SFB y la confluencia a 100% no fue observada en los periodos de tiempo estudiados (Figura 2. D,F,H).

Fuente: Simancas-Escorcia, Díaz-Caballero
Figura 2 Proliferación de las células epiteliales dentales cultivadas con SFB 10% (A,C,E,G) y SFB 0% (B,D,F,H) a 24,48,72 y 96 horas. DMEM/F12: Dulbecco’s Modified Eagle Medium: Nutrient Mixture F-12. SFB: Suero Fetal Bovino. Barra blanca: 1000 μm.
2.2. Matriz extracelular y citoesqueleto
La expresión de la actina, elemento fundamental en la arquitectura del citoesqueleto y el movimiento celular fue inmunodetectado por medio de la faloidina. Una detención positiva de la actina presente en las células epiteliales fue observada en las dos condiciones de cultivo celular llevadas a cabo en el presente estudio (Figura 3, A-F). Sin embargo, en el medio de cultivo 1 (DMEM/F12 + SFB 10%), probablemente debido a la presencia de una mayor cantidad de células, el marcaje de la actina mostró una relación estrecha entre las células epiteliales dentales (Figura 3, A-C), contraria a la observación de las células epiteliales cultivadas en el medio de cultivo 2 (DMEM/FI2 + SFB 0%)(Figura 3, D-F).
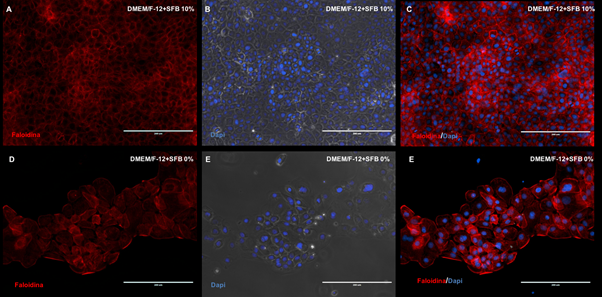
Fuente: Simancas-Escorcia, Díaz-Caballero
Figura 3 Microfotografías del citoesqueleto mediante inmunofluorescencia de los filamentos de actina (faloidina) de células epiteliales dentales a 10% y 0% de SFB. Núcleos coloreados con DAPI (azul). DMEM/FI2: Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12. SFB: Suero Fetal Bovino. Barra blanca: 200 μm.
Haciendo uso de la técnica de doble inmunofluorescencia, la monocapa de células epiteliales dentales cultivadas a diferentes concentraciones de SFB pusieron de manifiesto la expresión de las proteínas vimentina y fibronectina (Figura 4, A-F). Las células epiteliales dentales en contacto con el medio de cultivo 1 (DMEM/F12 + SFB 10%) registraron una mayor red entre los componentes de la MEC y las células. Estos datos se confirman de acuerdo a lo identificado con la fibronectina y una proteína fibrosa que forma los filamentos intermedios del citoesqueleto tal como la vimentina (Figura 4, A-C). En el medio de cultivo 2 (DMEM/F12 + SFB 0%) aunque fue vista la expresión de la fibronectina y la vimenti-na, se constató una red menos compacta de los componentes de la MEC y las células epiteliales dentales comparadas con las células en contacto con el medio de cultivo 1 (Figura 4, D-F). Se identifica que el marcaje emitido en las células epiteliales cultivadas con 10% de SFB se destaca por ser nítido y ubicado de manera uniforme en la zona externa de las células en cultivo. Estos mismo marcaje se encuentra ausente en las células epiteliales tratadas con la ausencia de SFB (Figura 4, B,E).
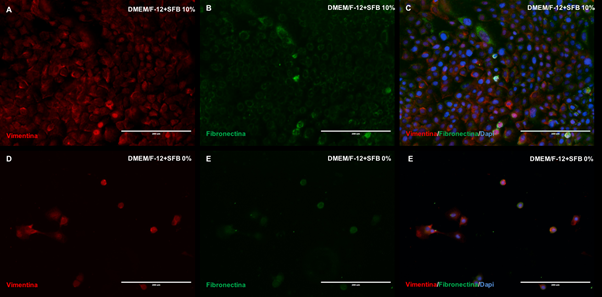
Fuente: Simancas-Escorcia, Díaz-Caballero
Figura 4 Microfotografías del citoesqueleto y matriz extracelular: Expresión de la vimentina y fibronectina en células epiteliales dentales a 10% y 0% de SFB. Núcleos coloreados con DAPI (azul). DMEM/F12: Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12. SFB: Suero Fetal Bovino. Barra blanca. 200 μm.
3. Discusión
El mantenimiento, crecimiento y diferenciación de células humanas y animales in vitro requiere de condiciones adecuadas de cultivo. Una de ellas corresponde al medio de cultivo, elemento encargado de suministrar los componentes esenciales para la proliferación y diferenciación celular. Frecuentemente, los medios basales son complementados con suero de origen humano o animal. El suero es una composición que contiene elementos como hormonas, proteínas de transporte, factores de crecimiento, etc. El suero más utilizado en los medios de cultivo celular es el suero fetal bovino, esencial en promover de manera fisiológica el crecimiento y proliferación celular (Gstraunthaler, Seppi y Pfaller, 1999).
El presente trabajo fue realizado gracias a la utilización del medio de cultivo DMEM/F12 y la suplementación de SFB dada su disponibilidad, frecuente utilización en la literatura científica y diminuta presencia de gamma-globulina, quien garantiza un bajo contenido de anticuerpos y en consecuencia un menor impacto en la inhibición y proliferación celular. Con el cultivo de las células epiteliales dentales del asa cervical de incisivos de rata fueron estudiados los efectos de la concentración del SFB en su comportamiento, crecimiento, proliferación y supervivencia. En el marco de lo anterior, de manera global nos propusimos conocer y comprender cuales eran los efectos de la ausencia de factores hormonales que estimulan el crecimiento y proliferación de las células epiteliales dentales. Así como, diversos factores que afectan la diferenciación y proporcionan proteínas de transporte, minerales, oligoelementos, factores de unión, de estabilización y detoxificación presentes en el SFB.
Actualmente, el uso del SFB en cultivos celulares ha sido objeto de discusión por el impacto que puede tener en estudios experimentales in vitroe interpretación de los resultados. Uno de los cuestionamiento en la utilización del SFB se basa en la posibilidad de introducir a través de este producto, elementos que puedan ocasionar efectos inhibitorios en el desarrollo y diferenciación celular pero también por la contaminación que puede inducir el uso de SFB dado el origen biológico y producción (Van der Valk et al. 2010). Estos cuestionamientos surgen de inquietudes al momento de la extracción de la sangre fetal. Los fetos bovinos de los cuales i se extrae la sangre y que va dirigida a la producción de SFB, se obtiene de vacas preñadas enviadas al sacrificio. Una vez presente en la línea de sacrificio, el feto es separado de la vaca y la sangre fetal se recoge en condiciones asépticas mediante la perforación del corazón del feto, implicando la manipulación del feto tal como lo indica Jochems et al. (2002). Si por diversos motivos esta manipulación presenta alteraciones, la composición del SFB se verá afectada y el riesgo de contaminación de los cultivo será mayor. Sin nombrar la falta de garantía que en términos de bienestar de los animales tendrá lugar producto de la producción del SFB.
En consecuencia, es de anotar que por composiciones indebidas de SFB, riesgo de contaminación, bienestar animal y costos, las autoridades regulatorias, aunque no han desestimado su uso, si se encuentran promoviendo la utilización de elementos alternativos en el cultivo de células tanto en la industria como en la comunidad investigativa en general (Van der Valk et al. 2010). Por ello, con el fin de evitar la proliferación de muchas células en un medio de cultivo suplementado con SFB por las razones evocadas, los equipos de investigación ha volcado su mirada hacia sustitutos de origen humano autógenos que permitan evitar el contacto de células con productos de origen animal, principalmente si se trata de líneas celulares humanas. Estos sustitutos son en su mayoría representados por la familia de derivados plaquetarios que contienen diferentes concentraciones de factores de crecimiento. Entre ellos encontramos diversos derivados plaquetarios utilizados como suplemento de medios de cultivo in vitro: lisa plaquetario, plasma rico en plaquetas, los concentrados plaquetarios y el suero humano (Burnouf et al.2016).
Sin embargo, a pesar de los riesgos biológicos y bioéticos que pueda representar la utilización de SFB en el cultivo celular, la utilización de este suplemento es aun importante. De hecho, la utilización de SFB en nuestro trabajo es aceptable dado que principalmente se buscaba establecer las condiciones óptimas de cultivo en un modelo celular in vitro que será útil en el estudio de los aspectos fisiopatológicos de las células que participan en la formación del esmalte dental. Contrariamente, las recomendaciones encaminadas a desestimar el uso de SFB está focalizado primordialmente en el cultivo de células que pretenden ser utilizadas con fines regenerativos y de tratamiento en muchas patologías humanas.
Se ha establecido que la provisión de factores de crecimiento es esencial en la supervivencia de las células cultivadas. El medio de cultivo DMEM/F12 hace posible el crecimiento de una amplia gama de tipos celulares, además de permitir estudiar sus características biológicas (Roozafzoon et al. 2015; Nishikawa et al. 2018). El presente trabajo ha demostrado que la utilización del medio de cultivo DMEM/F12 en ausencia de SFB disminuyen la proliferación celular de las células epiteliales dentales del asa cervical de incisivos de rata. Cuando estas células fueron cultivadas utilizando el medio de cultivo DMEM/F12 junto a una concentración de 10% de SFB, estas células lograron un nivel de confluencia mucho más elevado en comparación con las células con DMEM/F12 sin la presencia de SFB. Estos resultados que se encuentran en correlación con los presentados por Fujii et al. (2018) y Gürdal et al (2018) quienes haciendo usos de diferentes tipos celulares han permitido constatar que los medios de cultivo suplementados con diferentes concentraciones de SFB influye en el rendimiento de los cultivos celulares.
La disminución aparente en la proliferación de las células epiteliales dentales hallados es el resultado de la ausencia de SFB en el medio de cultivo. La ausencia de este elemento pudo ser el responsable de la inducción de la apoptosis o interrupción del ciclo celular de las células epiteliales dentales. Esta hipótesis puede ser corroborada gracias a la presencia de un número no cuantificable de células epiteliales flotantes en el medio de cultivo o sin adherencia a la caja de Petri en la condición de cultivo donde hubo ausencia de SFB. Muy probablemente, la células epiteliales cultivadas en estas condiciones de cultivo impidió la interacción de receptores membranales y moléculas de adhesión como las integrinas y en efecto, indujo cambios en la MEC, reservorio de diversos factores de crecimiento y moléculas bioactivas determinantes en funciones como la adhesión, migración, diferenciación y apoptosis celular (Yue, 2014).
Dado que las moléculas de la MEC interactúan mediante proteínas, entre ellas las integrinas, es probable que la disminución en la adhesión de las células epiteliales cultivadas sin SFB sea la consecuencia de una deficiente comunicación entre la MEC y el citoesqueleto. Eventualmente, la ausencia de SFB en la condición de cultivo 2 afecto la activación de las integrinas y su cambio conformacional, evitando la exposición de sus dominios citoplasmáticos. En consecuencia, la ausencia de la activación de las integrinas impidió la generar de cascadas de fosforilación y el inicio de los eventos de señalización necesarios para la proliferación, diferenciación y contractibilidad de las células epiteliales dentales. Es de anotar que las integrinas además de aportar en la organización del citoesqueleto y la migración celular, también actúan en la transmisión de señales y la conexión entre los compartimientos intracelular y extracelular (Wolfenson, Lavelin y Geiger, 2013).
La actina y vimentina, proteínas fundamentales del citoesqueleto celular, fueron visualizadas en las células epiteliales dentales en el presente trabajo. Aunque sus marcajes fueron más notorios en las células epiteliales cultivadas con una concentración de 10% de SFB, dada la mayor cantidad de células presentes, sus expresiones también fueron observadas en las células cultivas en ausencia de SFB. Nuestros resultados también constataron la presencia de la fibronectina en las células epiteliales dentales. Sin embargo, contrario a lo observado con la actina y vimentina, donde el marcaje celular fue muy similar independientemente de la concentración de SFB, el inmunomarcaje observado en las células cultivadas en ausencia de SFB difiere de un marcaje nítido y uniforme que bordea la parte externa de las células epiteliales cultivadas con 10% de SFB.
Es reconocido que la fibronectina suele ser fundamental en la unión y migración de las células, funcionando como una especie de 'pegamento biológico' por medio de enlaces de disulfuro al colágeno, heparina y receptores de la superficie celular. Tal parece la alteración en el marcaje de las células epiteliales cultivadas con ausencia de SFB comparada con las células que estuvieron en contacto con 10% de SFB, indica la presencia de cambios importantes en la arquitectura intersticial de estas células. Probablemente, las células epiteliales dentales perdieron la organización polarizada característica, producto de la falta de interacción célula - célula y célula - MEC llevada a cabo por proteínas de adhesión e incluso dominios específicos de la membrana plasmática, por la falta de los elementos encontrados en el SFB. Precisamente, uno de los elementos que facilita la comunicación entre las células y células-MEC a parte de las integrinas es la fibronectina. De allí que deducimos que ante una modificación fisiológica de la fibronectina, la comunicación intercelular se vería severamente afectada e incluso conduciendo a cambios en la MEC dependientes de la ausencia de interacción entre células (Zollinger y Smith, 2017). Sin embargo, es necesario continuar explorando el impacto de la concentración del SFB mediante análisis de la expresión génica de proteínas involucradas en la adhesión, migración, diferenciación y apoptosis de las células epiteliales de rata.
3. Conclusión
La ausencia de suero fetal bovino en el cultivo de las células epiteliales de rata afecta de manera importante la supervivencia, proliferación y altera la expresión de la fibronectina en estas células. Futuros estudios son necesarios para mejorar el conocimiento de la expresión génica de la fibronectina e integrinas que participan en la unión, migración y cambios en la arquitectura de las células epiteliales de rata.















