Introducción
El cultivo de duraznero (Prunus persica L. Batsch) es muy representativo del trópico alto en Colombia (Castro y Puentes, 2012). Las áreas destinadas para la producción de duraznero se concentran principalmente en el departamento de Boyacá, con una participación del 60,5% de las zonas productoras del país. De acuerdo con la Sociedad Colombiana de Ciencias Hortícolas (SCCH) en Colombia, el durazno es la especie de frutal de zona templada más sobresaliente, en virtud que pueden programarse sus cosechas a lo largo del año, siendo uno de los cultivos más productivos y competitivos de la región (SCCH, 2012 citado por Ávila, 2013). Actualmente existen 833 hectáreas sembradas con un rendimiento cercano a las 12 ton.ha-1, distribuidas en los municipios de Sotaquirá, Paipa, Tinjacá, Nuevo Colón y Tuta (MADR, 2015).
En Boyacá los cultivos de caducifolios se encuentran ubicados en altitudes de 2.108 y 2.891 m, con una temperatura que oscila entre 6 y 20°C, humedad relativa del 68%, precipitaciones anuales entre los 960 y 1.100 mm y brillo solar anual de 1.700 y 1.774 h.lux-1 (Miranda y Carranza, 2013a). El departamento tiene ventajas comerciales y productivas en el duraznero y ciruelo (Puentes y otros, 2008).
De acuerdo con su volumen y generación de ingresos, este cultivo es significativo en su participación en el mercado nacional e internacional. En el departamento de Boyacá, las variedades de duraznero más cultivadas son: Dorado, Diamante, Rubidoux y Rey negro (Miranda y Carranza, 2013b).
No obstante, los frutos de durazno presentan susceptibilidad a distintos patógenos principalmente hongos que ocasionan grandes pérdidas (Agrios, 2005; Hernández, 2009). La podredumbre parda o momificación de los frutos es una enfermedad producida por hongos del género Monilia. Este patógeno reduce la calidad y rendimiento en los frutales afectados (Prunus spp.), y en especies de rosáceas (Ogawa, 1995) afecta los cultivos en etapas de floración, fructificación y hasta pos-cosecha (Mendoza, 2010).
La podredumbre parda se atribuye a diferentes especies de Monilia. A nivel mundial se han identificado tres especies que producen la enfermedad: M. laxa, M. fructigena y M. fructicola (Scatoni, 2010). Esta enfermedad sobresale en el cultivo de caducifolios porque produce tizón de flores, muerte de ramas y pudrición en los frutales, hasta su momificación y destrucción (Mondino, 2014). Hay registros donde se menciona que sin un adecuado manejo y condiciones climáticas favorables al patógeno causa pérdidas que superan el 80% por daños en rendimiento y calidad de las cosechas (Mondino, 2002; Coca, 2011). Los ambientes que favorecen su desarrollo son temperaturas entre los 12 a 25°C y humedad relativas entre el 70 y 85%, presentándose un estado de latencia sobre frutos momificados, siendo estos fuente de inóculo en cada ciclo productivo (Agrios, 2004).
En EE.UU. y toda América del Sur M. fructicola causa la pudrición parda del fruto del duraznero, reduce la productividad y su rentabilidad, (Agrios, 2004; Giayetto y otros, 2007). En Japón, M. fructigena, afecta durazno y membrillo (Agrios, 2005). Se han reportado en zonas tropicales y subtropicales M. laxa y M. polystroma que ocasionan la pudrición de frutos de duraznero (Mendoza, 2010), M. laxa que afecta principalmente flores, mientras que M. fructicola tiene mayor severidad en los frutos de duraznero (Mitidieri y otros, 2005; Côté, 2004).
En Colombia, la podredumbre parda ocasiona grandes pérdidas en etapas de pre-cosecha y pos-cosecha afectando el rendimiento y calidad de los frutos, por ello se estableció como objetivo de este trabajo identificar mediante caracteres morfológicos y moleculares, las especies de Monilia spp., que causan la pudrición en frutales de duraznero en cuatro variedades sembradas en el departamento de Boyacá.
1. Materiales y métodos
1.1. Muestreo y recolección de muestras
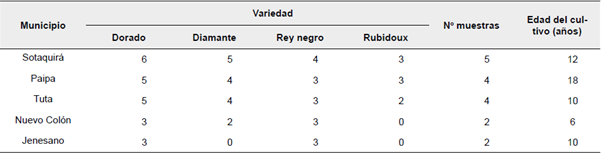
El trabajo inició con una colecta en huertos comerciales de duraznero ubicados en los municipios de: Paipa, Sotaquirá, Tuta, Jenesano y Nuevo Colón, en el departamento de Boyacá (Colombia) (Tabla 1). Las colectas se realizaron en los meses de noviembre a enero de 2016. El muestreo fue aleatorio, en forma de zigzag cada 5 metros de distancia, identificando los focos de infección en donde se colectó frutos, flores y ramas afectadas por pudrición, en las cuatro variedades: Dorado, Diamante, Rubidoux y Rey negro (Petróczy y Palkovics, 2009) (Figura 1).
Tabla 1 Sitios de colecta de muestras de duraznero (Prunus pérsica L. Batsch) en el departamento de Boyacá
Fuente: Autores

Fuente: Autores
Figura 1 Signos y síntomas de campo en frutos de cuatro variedades de duraznero afectados por la podredumbre parda (Monilia spp). A y B Dorado; C y D Diamante; E y F Rey Negro; G y H Rubidoux.
La segunda fase del trabajo se realizó en el Laboratorio de Control Biológico (Grupo Manejo Biológico de Cultivos) adscrito a la Facultad de Ciencias Agropecuarias de la Universidad Pedagógica y Tecnológica de Colombia en Tunja (Boyacá). En cada muestra colectada se empleó una nomenclatura que corresponde a un código formando por la inicial de la provincia de procedencia, inicial de la variedad y seguida de un número ordinal de colección.
Purificación e identificación morfológica de aislamientos
Las muestras colectadas con síntomas asociados a la pudrición parda, se ubicaron en cámara húmeda durante ocho días en total oscuridad, para promover el crecimiento de los microrganismos allí presentes. Se realizó el proceso de aislamiento de los hongos según el protocolo de Salgado (2011). Se cortó un trozo de tejido sano y afectado (0,5 cm), se desinfectó en una solución de hipoclorito de sodio al 0,5% por 30 segundos y posteriormente con alcohol al 70% por un minuto. Finalmente, fueron lavados por triplicado con agua destilada estéril (ADE). Los cortes desinfectados se sembraron en medio de cultivo Papa Dextrosa Agar (DIFCO) suplementado con cloranfenicol y se dejaron en incubación a una temperatura de 25°C.
Posterior, al aislamiento de los hongos, se realizaron cultivos puros, tomando pequeñas porciones del micelio, que se inocularon en cajas Petri con medio PDA y cloranfenicol. Se dejaron en incubación durante 8 días a 25 °C.
Una vez purificados los hongos, se realizó la técnica para obtención de cultivos monospóricos siguiendo el protocolo diseñado por Cañedo & Ames (2004).
En los cultivos monospóricos se procedió a la caracterización morfológica macroscópica de los aislamientos, determinando características de la colonia como coloración, crecimiento y formación de pigmentos difusibles. Igualmente se realizó la descripción microscópica determinando el tamaño, color y forma de los conídios (Lane, 2002).
Caracterización molecular
Esta caracterización se realizó a partir de los cultivos monospóricos de cada aislamiento empleándolos para la extracción de ADN fúngico. Se utilizó el kit de aislamiento de ácidos nucleicos E.Z.N.A. ®Fungal DNA kit (Power Soil DNA Isolation).
Extracción del ADN
Se emplearon los aislamientos crecidos en PDA durante 8 días a temperatura ambiente. Se realizó raspado del cultivo y se suspendió en el buffer respectivo para la extracción de ADN fúngico Buffer 2x CTAB (CTAB 10% 8 mL, Tris HCl IM pH 8.0 4 mL, EDTA 0.5M pH 8.0 160 μl, NaCl 5M 5.6 mL, agua 22.24 mL con volumen final 40 mL) precalentado a 65°C. Se siguió el método de Garcés y Orozco (2003) con algunas modificaciones.
Se adicionó una solución de lisis (I00 mM Tris HCl, pH 8.0; 8.2 g NaCl; 0.5 M EDTA 4 mL; 0,5% SDS) a 65 °C por 30 minutos. El precipitado de ADN se centrifugó I0.000 rpm por 5 minutos a -20 °C, adicionando isopropanol frío. Se descartó el sobrenadante y se colectó el ADN, y se resuspendió en 50 Ml de buffer TE (5 ml Tris, 0.5 M EDTA 4 ml, pH 8) y se centrifugó por I5 minutos, se descartó el sobrenadante y se dejó secar el precipitado.
Para comprobar la pureza del ADN, las muestras fueron corridas en un gel de agarosa 1.5%, con 0,3 mg.mL-1 de bromuro de etidio.
El ADN extraído fue cuantificado mediante fluorometría (DyNA Quant 200) siguiendo el protocolo de instrucciones dadas en el mismo equipo.
• Amplificación y secuenciación
La amplificación se realizó por PCR con los iniciadores ITS4 e ITS5 de la región del ADN ribosomal fúngico.
Se preparó un buffer 1x, nucleótidos 0,2 mM; MgCl2 2,5 mM; primers 0,1 mM de cada uno; BSA 0,5 mg/ml, Taq polimerasa 0,5 U (GIBCO-BRLâ).
La amplificación se realizó de la siguiente manera: desnaturalización inicial de 5 min a 94 °C, 35 ciclos amplificación a 94°C, desnaturalización por 60 segundos, alineamiento a 55°C por 60 segundos y extensión de 60 minutos durante 35 ciclos a 72 °C; por último, extensión final de 5 minutos a 72 °C. Los productos de amplificación, se separaron por electroforesis en geles de agarosa 1.5% (p/v) en Tris-Acetato-EDTA, 3 μl a 100 V por una hora.
La purificación del producto de PCR se realizó mediante precipitación alcohólica, con secuenciación y visualización por electroforesis en gel de agarosa al 1.5% (p/v).
La secuenciación se llevó a cabo utilizando la región ITS, con los oligonucleótidos ITS4 (5'-TCCTCCGCTTATTGATAT-GC-3') e ITS5 (5'- GGAAGTAAAAGTCGTAACAAGG-3') (White y otros, 1990).
2. Resultados
2.1. Muestreo y recolección de muestras
En las fincas visitadas en la zona de estudio, la enfermedad se observó en los durazneros, principalmente localizada en el tercio medio y bajo del árbol.
En los frutos se observó una pudrición café a gris (masas de micelio) que causaba la momificación de estos. Las flores presentaban atizonamiento y las ramas necrosis principalmente en los brotes más jóvenes (Figura 2).

Fuente: Autores
Figura 2 Síntomas de Monilia en duraznero. A, flores con atizonamiento; B a H, ramas con necrosis sobre los brotes más jóvenes; E y H frutos con micelio gris a café.
Los síntomas observados en las muestras colectadas en los huertos coinciden con las descripciones realizadas en otros caducifolios afectados por este patógeno (Michailides y Spotts, 1990; Cárdenas, 2013). En algunos países se reportan el estado sexual (Monilinia), pero en Colombia todavía no hay reportes sobre su presencia (Buriticá, 1999).
Purificación y aislamiento.
Los síntomas de pudrición de fruto se expresan como manchas de diversas tonalidades café. Estas manchas resultan de una infección que inicia con el inóculo del patógeno (esporas y micelio) cuando entra en contacto con el huésped y su posterior propagación afecta los tejidos terminando un una pudrición parda.
Según Arias y Piñeros (2008), los factores de temperatura y pH son importantes para aislar los microorganismos, ya que provocan su crecimiento o inhibición. En el presente estudio las condiciones para el crecimiento de los hongos encontrados en las muestras de durazno fueron de 25 °C y pH de 3.5.
De las muestras colectadas se obtuvieron 54 aislamientos de hongos, los cuales fueron identificados como Alternaría spp. (22 aislamientos; 40,74 %) y Monilia spp. (32 aislamientos; 59,25%), estos últimos afectando los frutos de duraznero de las variedades muestreadas: Dorado, Diamante, Rey negro y Rubidoux.
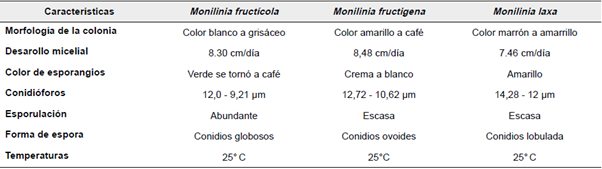
Las características morfológicas para identificación mediante observación, son utilizadas tradicionalmente en estudios con hongos (Suaad, 2013). Todos los aislamientos correspondientes a Monilia se caracterizaron morfológicamente en el laboratorio. Los caracteres morfológicos empleados en la caracterización fueron el tipo de micelio, coloración, tamaño de los conidios, estructura de conidióforos y forma de los conidios (Beales, 2012). La coloración del micelio y características de los conidios y conidióforos coincidieron con las claves taxonómicas para el género Monilia (Barnett y Hunter, 2010; Agrios, 2005).
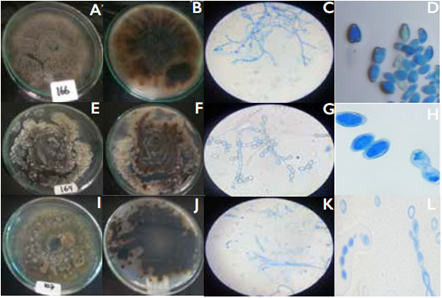
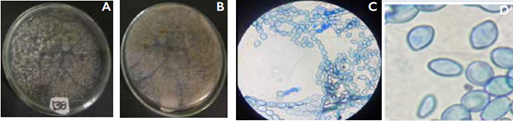
En las Figuras 3, 4 y 5 se muestran ejemplos de las tres especies de Monilia encontradas en el presente estudio.
Fuente: Autores
Figura 3 Características morfológicas de Monilia fructicola en medio PDA.Aislamientos NUREY-1 64 (línea superior), JEDO-107 (línea media) yJEREY-1 66 (línea inferior).Vista frontal (A, E, I), vista posterior (B, F y J), ramoconidias y conidióforos (C, G y K), conidios con forma elíptica o de limón (D, H y L).
Fuente: Autores
Figura 4 Características morfológicas de Monilia fructigena en medio PDA. Aislamiento SORU-164 (A) desarrollo micelial circular de color amarillo a café; (B) micelio posterior mostrando una coloración gris; (C) conidióforos; (D) conidios con forma elíptica y de limón.
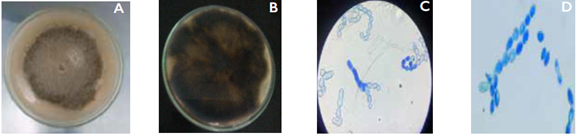
Fuente: Autores
Figura 5 Características morfológicas de Monilia laxa en medio PDA. Aislamiento NUDI-104 A) desarrollo micelial circular de color marrón a amarillo y micelio abundante; (B) micelio posterior mostrando una coloración café; (C) conidióforos; (D) conidios con forma lobulada y de limón.
Monilia fructicola: Se identificaron 20 aislamientos de Monilia como M. fructicola, correspondiente al 62,5% de los aislamientos. Wiley & Sons (2009) reportaron la misma forma y estructura de conidióforos y conidias. Las colonias de los aislamientos JEREY-166, NUREY-164 y JEDO-107, con micelio polvoso de color café a grisáceo. Los conidióforos, presentan hifas primarias con una o varias ramificaciones antes del primer septo, formadas en cadenas, oscilan entre 12,0-9,21 μm. Los conidios son elipsoides, ovoides o alimonados. Presentan abundante esporulación de color crema.
Monilia fructigena: Se identificaron 8 aislamientos de Monilia como M. fructigena, lo que corresponde al 25%, de los aislamientos. Van Leewen y otros (2002) reporto semejanzas en las estructuras de conidióforos y conidias observadas. El aislamiento SORU-138, mostró colonias de color amarillo a café. El micelio hialino al envejecer forma una costra oscura. Los macroconidios son elipsoides, ovoides y su tamaño oscilo entre 12,72-10, 62 μ., se encuentran cadenas ramificadas, agrupadas de color blanco crema a pardo.
Monilia laxa: Se identificaron 4 aislamientos de Monilia como M. laxa, correspondiente al 12,5% de los aislamientos. Neri y otros (2007) reporto semejanzas en las estructuras de las cepas observadas como el aislamiento NUDI-104 de color de marrón grisáceo. El micelio hialino al envejecer forma costra oscura. Los macroconidios son elipsoides, ovoides o alimonados, su tamaño oscilo entre 14,28-6,12 μm.
En las Tablas 2 y 3 se resumen algunas características macro y microscópicas generales observadas y las específicas de cada uno de los aislamientos de Monilia obtenidos.
Tabla 3 Características morfológicas de aislamientos de Monilia spp obtenidos de frutos de durazno en Boyacá.
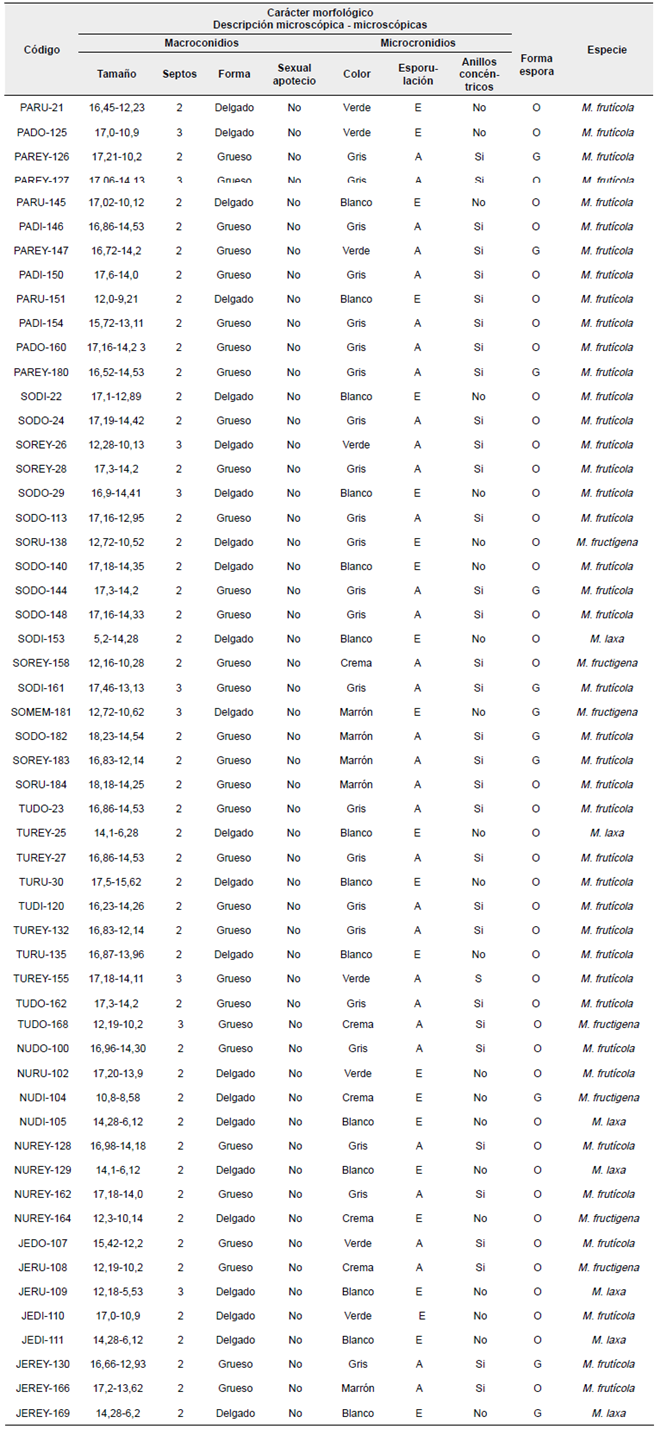
Fuente: Autores
Nota: Convenciones: Forma de macroconidios: D=Delgado, G= grueso; Esporulación microconidos: E= Escasa, A= Abundante; Forma de espora: O= Ovalada, G= Globosa
Menciona Douglas (2003), que el clima es un factor muy influyente en la aparición de la pudrición, principalmente periodos de alta humedad, temperatura y abundantes lluvias. Los resultados de la investigación indican que las condiciones climáticas en los municipios muestreados tienden a ser favorables para la aparición de este fitopatógeno en el cultivo de duraznero, esto en virtud de la presencia de las tres especies de Monilia encontradas.
Caracterización molecular
Se realizó la amplificación con los oligonucleótidos de la región ITS4 e ITS5 (Baldwin y Sanderson, 1995) de cada especie, utilizando una PCR múltiple, usando primers específicos en la región del DNA ribosomal fúngico.
Los números de acceso para M. fructicola y M. fructigena en el genbank NCBI fueron KM652455; KM652469 y KM652466; KM652459, respectivamente.
M. fructicola amplificó 532 a 552 pb en 8 de 54 prototipos analizados. M. fructigena provocó amplicones de 571 a 603 pb en 2 muestras de las 8 analizadas. M. laxa no amplificó en ningún aislamiento.
Las cepas que se caracterizaron como M. fructicola procedían de los municipios de Paipa, Nuevo Colón y Jenesano; en el caso de M. fructigena se obtuvieron en Nuevo Colón y Sotaquirá. Respecto a estas dos especies halladas en el estudio, los datos morfológicos y moleculares fueron consistentes con la descripción previa de la especie (Ioos y Frey, 2000).
En el presente trabajo la comparación en la base de datos mostró que los aislamientos identificados como Monilia fructicola correspondieron a los códigos: PAREY-147 59-1, JEREY-166 59-3, JEDO-107 59-4, PARU-145 59-5, NU-REY-164 59-7 y SOMEM-I8I59-9. Por otro lado, SORU-138 59-6 se identificó como M. fructigena y NUDI-104 59-2 como M. laxa.
Todos estos aislamientos analizados tuvieron una identidad y cobertura del 99% (Figura 6).
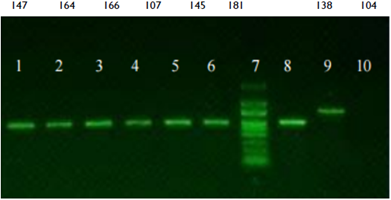
Fuente: Autores
Figura 6 Visualización de los productos de PCR en electroforesis en gel de agarosa al 1.5% (p/v) en tampón Tris-Acetato-EDTA. Se obseva la concentración y calidad de ADN genómico extraído. Monilia frutícola: carril 1 - PAREY 147; carril 2 - NUREY-164; carril 3 - JEREY-166; carril 4 - JEDO-107; carril 5 - PARU-145 y carril 6 -SOMEM-I8I. Monilia fructigena: carril 8-SORU-I38. Monilia laxa: carril 9 - NUDI- 104
Estudios registrados por Meng-Jun y otros (20II) demostraron la presencia M. fructigena y M. fructicola en frutos de durazno en China; las características morfológicas, el tamaño de la espora, color de la colonia y la esporulación fueron similares a las obtenidas en el presente trabajo, apoyando la evidencia que estas dos especies de Moniliason las causantes de la pudrición parda de duraznero en Boyacá.
La literatura reporta que las especies M. laxa y M. fructigena son de origen europeo y M. fructicola de origen americano y frecuente en América (Malvárez y otros, 2004), Japón y China (Zhu, 2005) y Australia y por primera vez en Europa en Francia (OEPP, 2003). En Hungría, Italia y España fue reportada por Petróczy y Palkovics (2009).
En el caso de América, en Uruguay se ha reportado en los cultivos de duraznero como agente causal principal de la podredumbre parda a M. fructicola (Malvárez y otros, 2004) e igualmente se han hecho estudios con resultados similares en Ecuador (Salgado, 2011).
Aunque las características morfológicas y moleculares, pueden presentar diferencias cualitativas y cuantitativas (Lane, 2002), de acuerdo con los resultados obtenidos, se corroboraría la presencia de M. fructicola y M. fructigena como agentes causales de la podredumbre en duraznero en Boyacá.
Malvárez et al. (2004) mencionan que algunas especies de pueden pasar desapercibidas, si se encuentran en porcentajes cercanos al 1%. No se descarta entonces que M. laxa con un 12,5% de presencia, también esté afectando estos frutales en Colombia, a pesar de encontrarse en porcentaje menor respecto de las otras especies encontradas.
De acuerdo con los análisis realizados, en este estudio se determinó que existen tres especies de Monilia en Boyacá, similar a lo reportado por Meng-Jun y otros (2011) y Hrustié y otros (2015), quienes utilizando solo caracterización morfológica, identificaron igualmente las tres especies de Monilia: M. laxa, M. fructigena y M. fructicola como los agentes causales de la pudrición en fruta de hueso en Serbia.
3. Conclusión
El muestreo en el cultivo de duraznero variedades Dorado, Diamante, Rey negro y Rubidoux del departamento de Boyacá presentan incidencia de pudrición parda atribuible a hongos del género Monilia.
La caracterización morfológica y molecular permitió identificar tres especies de Monilia afectando los cultivos: M. fructicola (62,5%), M. fructigena (25%) y M. laxa (12,5%).