1. Introducción
Los fibroblastos son células constitutivas del tejido conjuntivo presentes en todos los vertebrados. Estas células mesenquimatosas presentan una heterogeneidad morfológica y funcional de acuerdo a su localización. Participan en numerosas funciones, entre ellas, la embriogénesis, la homeostasis y reparación tisular (Parsonage et al, 2005; Lv, Tuan, Cheung y Leung, 2014; Rux y Wellik, 2017). Los fibroblastos no son células vasculares ni epiteliales. En todos los tejidos, los fibroblastos son generalmente adherentes a las fibras que ellos sintetizan y pueden formar redes en 3D, incrustándose en la matriz fibrilar (Elcin, Inane y Elcin, 2016). Las primeras descripciones sobre los fibroblastos fueron llevadas a cabo por Schwann, Virchow y Duvall desde finales del siglo XIX (Carrel, 1926). Posteriormente, los fibroblastos fueron cultivados a partir de biopsias de tejidos permitiendo obtener líneas fibroblásticas que han hecho posible mejorar la comprensión de sus funciones en cada tejido. Sin embargo, la definición de los fibroblastos, como de cualquier otra célula, es un proceso complejo dado que sus características estructurales y funcionales son dependientes de condiciones medioambientales particulares in vivo o in vitro. Por ello, es necesario que la descripción de los fibroblastos sea acorde a las dinámicas celulares y no, una definición estática que sería incompleta y aleatoria.
Los fibroblastos gingivales (FGs) son las células que mayoritariamente constituyen el tejido conjuntivo gingival, representando cerca del 65% de células por cm3 (Schroeder, Münzel-Pedrazzoli y Page, 1973). Los FGs son células mononucleares, no polarizadas y responsables de la síntesis, remodelaje, homeostasis y cicatrización del tejido gingival (Simancas-Escorcia y Diaz-Caballero, 2019). Los FGs constituyen células quiescentes en su estado fisiológico. Estas células en ciertos casos no proliferan pero metabólicamente son muy activas. En estas condiciones, una interacción bidireccional se establece entre los fibroblastos y elementos de la matriz extracelular (MEC) con otras células circundantes, cuyo propósito es favorecer la homeostasis tisular (Kim, Wen, Prowse, Hamilton, 2015).
La perturbación del proceso homeostático en el tejido gingival, a lo largo del estado de quiescencia de los FGs durante la morfogénesis o en el desarrollo de procesos de cicatrización, puede conducir a diversas alteraciones. Una de ellas es Agrandamiento Gingival (AG), también conocida como hipertrofia gingival. El AG es el crecimiento excesivo de la encía de manera localizada o generalizada. Esta patología ha sido relacionada con diversas enfermedades sistémicas como el síndrome esmalte renal y, el síndrome de Raine (Díaz Rojas; Simancas-Escorcia, 2019). Asimismo, reportes indican la manifestación de AG por factores idiopáticos, desequilibrios hormonales durante el embarazo o la pubertad y principalmente, como consecuencia de la ingesta prolongada de medicamentos bloqueadores de calcio, inmunosupresores y antiepilépticos (Vidal, De Souza, Ferreira, Fischer, Gonçalves, 2018; Rahul, Gauba, Gorwade, Kumar, 2019). Otros estudios también revelan la presencia del AG en pacientes portadores de tratamiento ortodóntico (Zanatta, Ardenghi, Antoniazzi, Pinto, Rósing, 2014a; Pinto, Alves, Zenkner, Zanatta, Maltz, 2017). En este último grupo de pacientes, investigaciones señalan una prevalencia de 55% en pacientes sometidos a tratamiento de ortodoncia (Rodríguez Vásquez, Fernández García, Valladares Trochez, 2018). Este cambio en la encía puede afectar negativamente la fonación, masticación y percepción estética de los pacientes (Manzur-Villalobos, Díaz-Rengifo, Manzur-Villalobos y Díaz-Caballero, 2018; Guzman-Rivera, Lopez-Alvarez y Ricardo, 2018).
El movimiento dental realizados durante el tratamiento de ortodoncia y las fuerzas de tensión liberadas, podrían generar un impacto en el tejido gingival de los pacientes. Este fenómeno amerita ser estudiado. Diversos estudios han reportado cambios tisulares en el AG, con probables modificaciones en los elementos constituyentes de la MEC, principalmente en pacientes con ingesta crónica de medicamentos. Sin embargo, se requieren trabajos investigativos que permitan dilucidar esos cambios de acuerdo a los factores etiológicos del AG, puntualmente en pacientes con tratamiento ortodóntico. Por lo anterior, el propósito de este trabajo fue identificar y describir los aspectos morfológicos in vivo e in vitro de los tejidos y fibroblastos gingivales en pacientes con agrandamiento gingival portadores de ortodoncia e individuos sanos.
2. Metodología
Pacientes
Estudio prospectivo con la participación de nueve pacientes evaluados e intervenidos quirúrgicamente en el Centro de Referencia de Hipertrofia Gingival de la Facultad de Odontología de la Universidad de Cartagena. Fueron admitidos cuatro pacientes con diagnóstico de agrandamiento gingival por tratamiento ortodóntico y, cinco individuos sanos.
Luego de explicar detalladamente los objetivos del trabajo y haber firmado el consentimiento informado, un examen clínico extra e intraoral fue realizado a cada uno de ellos. Se tuvieron en cuenta pacientes mayores de 18 años de edad con buen estado de salud sistémica y un índice de placa O'Leary ≤ 15%. Los pacientes seleccionados con AG debían tener aparatología ortodóntica ≥1 año. Se excluyeron aquellos pacientes que reportaron haber estado bajo tratamiento farmacológico con bloqueadores de calcio, anticonvulsivantes e inmunosupresores. No se admitieron pacientes que reportaron haber usado antibióticos o antiinflamatorios en los últimos tres meses, pacientes con periodontitis y los que se sometieron a cirugías periodontales en el último año.
Los tejidos gingivales fueron obtenidos mediante gingivectomía para los pacientes con AG por ortodoncia I y alargamiento coronario para los individuos sanos.
Ambas intervenciones quirúrgicas fueron realizadas por un periodoncista utilizando anestesia infiltrativa con Lidocaína 2% y epinefrina 1:80000 en el área quirúrgica. Fue realizado un abordaje incisional a bisel externo e intrasulcular con bisturí Bard Parker número 15. Una evaluación post-quirúrgica a los 7 días, permitió constatar una adecuada cicatrización tisular en todos los pacientes, sin complicaciones. Las muestras obtenidos de cada paciente fueron divididos en dos fracciones, una para ensayos histológicos y otra, destinada al cultivo celular de fibroblastos gingivales.
Análisis histológicos
Los tejidos obtenidos fueron depositados en tubos Eppendorf, lavados tres veces en solución salina tamponada con fosfato (PBS IX, Gibco™) que contenía 1% de penicilina/estreptomicina (10,000 U/mL) (Gibco™). Luego, las muestras fueron segmentadas entre 3-4 mm3 e inmediatamente fijados en paraformaldehído (PFA) tamponado a 4% durante 48 horas. Después, las muestras se incluyeron en concentraciones crecientes de alcohol (50%,70%, 95%,100%) y posteriormente en parafina. Los bloques obtenidos fueron cortados con un espesor entre 5-6mm en un micrótomo Leica RM2125 RST. Esta experimentación fue realizada en el laboratorio de Ciencias Básicas de la Universidad de Cartagena, Colombia.
Coloración de Masson-Goldner
Los tejidos fueron sumergidos en xileno y alcoholes en concentraciones descendentes. Luego, los tejido estuvieron en contacto durante 20 minutos en hematoxilina de Mayer y a continuación una diferenciación acido-alcohol fue realizada. Después, los cortes fueron incluidos en soluciones consecutivas así: primero en solución de azofloxina (10 minutos), después en una solución de ácido fosfovolfrámico-anaranjado G (I minuto) y por último, en una solución verde luz (2 minutos). Finalmente, se procedió al montaje de los tejidos con DPX (Sigma-Aldrich).
Coloración Orceína
Luego de haber desparafinado e hidratado los tejidos tal como se procedió durante la coloración de Masson-Goldner, los tejidos gingivales fueron coloreados en una solución de Orceína (Merck Millipore) durante 30 minutos, lavados con agua destilada y puestos en contacto con una solución de hematoxilina en solución modificada según Gill II (EMD Millipore Corporation) durante 30 segundos. Finalmente, los cortes fueron deshidratados, lavados en xileno y montados en DPX.
Cultivo celular
Las biopsias de tejido gingival obtenidas durante el procedimiento quirúrgico, luego de ser lavadas tres veces en PBS IX, fueron sumergidos en DMEM (Dulbecco's modication of Eagle medium - GibcoTM). Bajo una cabina de flujo laminar, los tejidos fueron fragmentados y cultivados por el método de explante, de acuerdo al protocolo descrito por Simancas-Escorcia, Vergara-Hernández y Díaz-Caballero, 2018. Una vez los FGs obtuvieron una confluencia estimada de entre 80-90%, las células fueron tripsinisadas y cultivadas en cajas de Petri estériles. Fue utilizado un medio de cultivo DMEM + GlutaMAX con 10% de Suero Fetal Bovino-SFB (GibcoTM), I% de penicilina-estreptomicina (GibcoTM), I% de aminoácidos esenciales, 0,5 de Anfotericina B (GibcoTM) y 50 Lirn/mL de ácido ascórbico (GibcoTM). Los fibroblastos de todos los pacientes fueron incubados a 37°C, 5% de CO2 mientras que los medios de cultivos fueron reemplazados tres veces por semana.
Inmunofluorescencia
Durante la proliferación de los fibroblastos gingivales, la morfología celular fue estudiada mediante la observación en un microscopio invertido Axio Vert.AI (Zeiss). Los núcleos fueron visualizados gracias al 4',6-diamidino-2-fenilindol o DAPI (1:3000, Life Technologies Corporation), previa fijación de las células 4% de paraformaldehído (Sigma-Aldrich®) / 5% sacarosa (Sigma-Aldrich®), permeabilización con 0.5% de Triton X-100 (Sigma-Aldrich®) y la incubación en 1% de BSA (Sigma-Aldrich®) / 1% de glicina (Sigma-Aldrich®) a temperatura ambiente. Como anticuerpos primario se empleó anti-Vimentin (1:400, Sigma-Aldrich®). El anticuerpo secundario fue Alexa Fluor 488 donkey antiratón (1:600, Life Technologies Corporation) y Alexa Fluor 594 Phalloidin (1:1000, Thermo Fisher) para visualizar los filamentos de actina. El montaje final de las células se realizó mediante Immu-MountTM (Thermo Scientific).
3. Resultados
El presente trabajo tuvo como propósito la identificación y descripción de los aspectos morfológicos, in vivo e in vitro, de los tejidos y fibroblastos gingivales de pacientes con agrandamiento gingival por ortodoncia e individuos sanos. De los 9 pacientes, el 55,5% (5) corresponden al sexo femenino y el 44,4% (4) al masculino. El promedio de edad fue de 20,2 años en los pacientes con AG y de 22,8 años en el grupo control. La evaluación histológica mediante la coloración de Masson-Goldner reveló la presencia de un tejido epitelial organizado sin signos evidentes de inflamación ni queratinización en todos los individuos sanos. Los núcleos del tejido epitelial eran redondos u ovales dentro de un citoplasma sin alteraciones aparentes. Las prolongaciones epiteliales eran delgadas, algunas únicas o fusionadas, integradas por numerosas células bien organizadas extendiéndose hacia el tejido conjuntivo (Figura 1A). En los pacientes con agrandamiento gingival por ortodoncia se observó un tejido epitelial queratinizado, la presencia de acantosis y células epiteliales que mostraban núcleos pequeños. Se evidenció la presencia de tejidos epiteliales densos y con prolongaciones epiteliales fusionadas de gran tamaño en comparación a los individuos sanos, rodeada de abundantes células con núcleos hipercromáticos (Figura 1B).
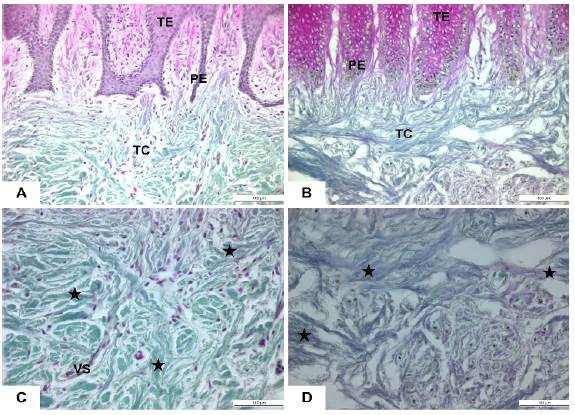
Fuente: Simancas-Escorcia, Vergara-Hernández, Díaz-Caballero
Figura 1 Aspecto histológico del tejido gingival. (A,C) Tejido epitelial y conjuntivo de individuo sano evidenciando la integridad y organización celular epitelio-mesénquima. (B,D) Queratinización, aumento del tejido epitelial y organización aleatoria del tejido conjuntivo en pacientes con agrandamiento gingival por ortodoncia. Coloración de Masson-Goldner. TE: Tejido epitelial; PE: prolongación epitelial; TC: Tejido conjuntivo; VS: vasos sanguíneos. Estrella negra: fibras de colágeno. Barra blanca: 100 µm.
La observación del tejido conjuntivo en los individuos sanos analizados permitió identificar una red de fibras de colágeno bien organizada, distribuidas de manera homogénea, algunas de ellas horizontales y transversales. Entre las fibras de colágeno se pudo evidenciar la presencia de células fibroblásticas con núcleos alargados y redondos. Aquellos fibroblastos gingivales alargados parecían adoptar una configuración anatómica en la misma dirección de las fibras de colágeno, por lo que se estimó como un fibroblasto activo. Se registraron escasas células linfocitarias y la presencia de células sanguíneas (Figura 1C).
Por su parte, el tejido conjuntivo de pacientes con agrandamiento gingival por ortodoncia, registraron fibras de colágeno orientadas aleatoriamente. Una densa red de haces de colágeno subyacente a las prolongaciones epiteliales fue identificadas en todos los pacientes con AG por ortodoncia. Se evidencia marcados espacios entre las fibras de colágeno con diámetros aparentemente menores diámetros en los pacientes con AG, comparados con las fibras de los individuos sanos. En ciertas zonas, las fibras de colágeno de pacientes con AG carecían de organización y mostraban pliegues, bucles y formas variables. Se pudo constatar la escasa presencia de fibroblastos gingivales. Aquellos observados presentaron principalmente núcleos ovalados y redondos. Se identificaron células linfocíticas entre las fibras de colágeno y vasos sanguíneos (Figura 1D).
Con el fin de detallar la identificación y aspectos morfológicos in vivo del tejido gingival fue también realizada la coloración Orceína. En los pacientes con AG por ortodoncia se confirmó la presencia de una MEC caracterizada por fibras de colágeno con poca organización. Se constató disposición 'caótica' de las fibras de colágeno en paquetes gruesos y paralelos. Las fibras elásticas tuvieron una disposición difusa y aleatoria en el tejido conjuntivo en comparación con los tejidos de individuos sanos. Se identificaron escasos fibroblastos entre las fibras de colágeno mientras que en algunos pacientes fue evidente la presencia de fibrocitos (Figura 2 A, B, C, D).
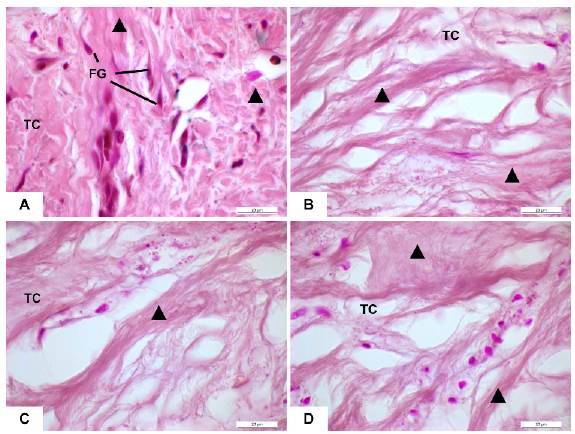
Fuente: Simancas-Escorcia, Vergara-Hernández, Díaz-Caballero.
Figura 2 Tejido conjuntivo de encía de pacientes sanos y con Agrandamiento Gingival por ortodoncia. (A) Tejido conjuntivo (TC) de individuo sano muestra abundante presencia de fibroblastos gingivales (FG) rodeados de fibras compactas. (B,C,D) Escasa presencia de fibroblastos gingivales en tejido conjuntivo de pacientes con agrandamiento gingival por ortodoncia. Coloración Orceína. Triangulo negro: haces de fibras en el TC gingival. Barra blanca: 20 µm.
Los fibroblastos gingivales aislados de las encías de individuos sanos y pacientes con AG por ortodoncia presentaron una proliferación sostenida en el tiempo. La morfología de cada cultivo de individuos sanos y pacientes con agrandamiento gingival por ortodoncia eran muy similares. Los fibroblastos gingivales cultivados, contrariamente a aquellos observados in vivo, se hallaban en contacto con otros fibroblastos. Estas células presentaron un cuerpo celular fusiforme o en forma de estrellas con largas prolongaciones citopiasmáticas, núcleos ovales y alargados (Figura 3A. B. E. F). El citoesqueieto en ambas poblaciones de fibroblastos estaba formado por microfilamentos de actina y vimentina (Figura 3C, D, G, H).
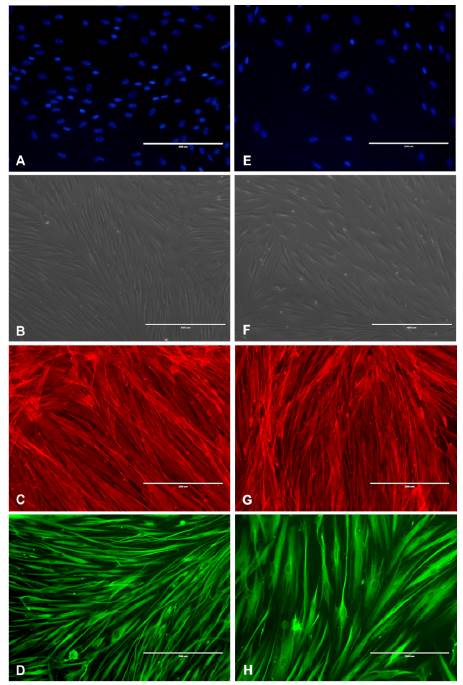
Fuente: Simancas-Escorcia, Vergara-Hernández, Díaz-Caballero.
Figura 3 Fenotipo de fibroblastos gingivales. (A, B, C, D) Núcleos (DAPI), aspecto morfológico, filamentos de actina (rojo) y vimentina (verde) de fibroblastos gingivales de individuos sanos y de pacientes con agrandamiento gingival por ortodoncia (E,F,G,H). Barra blanca: 200 µm.
4. Discusión
Esta investigación proporciona de manera preliminar la identificación y descripción morfológica de los tejidos y fibroblastos gingivales in vivo e in vitro en el AG por tratamiento ortodóntico. Los resultados presentados aquí ponen en evidencia que el AG inducido por el tratamiento con aparatología fija ortodóntica genera cambios importantes en las células y elementos de la MEC en comparación con los tejidos gingivales de individuos sanos. Estos resultados encontrados en una población importante de pacientes atendidos en el Centro de Referencia de Hipertrofia Gingival de la Facultad de Odontología de la Universidad de Cartagena, son consistentes con hallazgos previamente reportados donde se evidencia el incremento de tejido gingival en sujetos bajo tratamiento ortodóntico (Zanatta et al, 2014).
En el presente estudio, se observó un tejido epitelial hiperqueratinizado y cambios en la lámina propia de los pacientes con AG. Estos resultados coinciden con un estudio precedente que revela además, la expresión aumentada de MMP-9 y colágeno tipo IV debido a la tensión mecánica que induce los dispositivos de ortodoncia (gurlin et al. 2012). Estos autores estimaron que la sobrecarga mecánica influye sobre el colágeno, incrementando su remodelación. Sin embargo, los resultados que se muestran aquí no permiten confirmar si la causa de los cambios histológicos de los tejidos gingivales de pacientes por ortodoncia son debido únicamente a la fuerzas mecánicas, aunque un aparente acumulo de haces de colágeno fueron observados en todos los pacientes evaluados con AG. El aumento en la dimensión de las crestas epiteliales también fue un aspecto morfológico observado en todos los pacientes con AG por ortodoncia. Algunos tejidos epiteliales se observaron como un bloque denso de epitelio sin presencia de crestas independientes tal como se ha reportado en otros estudios (Mártha, Mezei y Jánosi, 2013).
Los resultados demostraron unas fibras de colágeno desorganizadas en los pacientes con AG por ortodoncia contrario a lo observado en individuos sanos, donde el tejido conjuntivo presentó haces de fibras de colágeno organizadas de manera paralela y transversales (Pego et al, 2016). En los pacientes con AG por ortodoncia fue notoria la presencia de escasos fibroblastos gingivales comparada con las encías de individuos sanos. Sin embargo, este postulado deberá ser evaluado y confirmado en próximos estudios donde se incluyan un número mayor de pacientes. A pesar de esta limitante en el presente trabajo investigativo, otros estudios han puesto en evidencia el incremento de las fibras de colágeno con un aumento de los fibroblastos gingivales en cultivo (Meng et al, 2008; Martelli-J unior, De Lemos, Silva, Graner, Coletta, 2005). Además, se ha señalado que este crecimiento del número de fibroblastos puede ser proporcional a la producción de fibras de colágeno en pacientes con AG por ortodoncia como ha sido previamente descrito (Lee, Jang, Pallos, Kather, Hart, 2006). Un proceso fisiopatológico diferente puede estar al origen de la producción de colágeno en pacientes con un crecimiento excesivo de encía por ortodoncia. Es probable que exista una desequilibrio entre la producción y degradación de las fibras de colágeno que amerita ser i estudiada a profundidad en trabajos futuros.
El tejido conjuntivo de los pacientes con AG por ortodoncia expusieron la presencia de células linfocítica. Resultados similares han sido reportados en pacientes con AG por medicamentos (Quenel, Keribin, Giran, Tessier, Lesclous, 2019; Bulut, Alaaddinoglu, Bilezikc, Demirhan, Moray, 2002). Puntualmente, el aumento de población linfocitaria en los tejidos gingivales ha sido relacionada con el crecimiento excesivo de encía en pacientes consumidores de nifedipina y pacientes con gingivitis (Pernu y Knuuttila, 2001). Sin embargo, en pacientes con gingivitis, habitualmente, el área de respuesta inmunológica como consecuencia de la placa dental ocurre en el tejido conjuntivo debajo del epitelio sulcular. Nuestros resultados exponen la presencia de células linfocíticas con distribución aleatoria en todo el tejido conjuntivo, no imperativamente subyacente al epitelio sulcular. Pero es probable que el AG en pacientes portadores de ortodoncia pueda deberse a la acumulación de biofilm bacteriano y a su incapacidad de ser retirado dada la presencia de aditamentos utilizados en este tratamiento como ha sido señalado por Zanatta et al, 2014.
Simultáneamente, es probable que un proceso inflamatorio impacte directamente la actividad de los FGs. De hecho, se ha reportado que las lesiones inflamatorias incrementan la actividad mitótica de los fibroblastos gingivales (Stabellini et al, 2004). Un factor limitante de nuestro estudio es la falta de identificación precisa de los perfiles de población de linfocitos en el tejido gingival de los pacientes con AG por ortodoncia y su distribución. Conocer esta población celular, hará posible dilucidar el rol que pueda desempeñar las células inflamatorias sobre los fibroblastos gingivales y un probable aumento en la producción de colágeno.
Las observaciones celulares no revelaron diferencias entre los aspectos morfológicos de los FGs de pacientes con tratamiento ortodóntico e individuos sanos. El marcaje de la actina y vimentina confirma que se trata de fibroblastos gingivales, tal como ha sido descrito en otros estudios (Jin et al, 2015; Simancas-Escorcia, Vergara Hernández y Díaz-Caballero, 2018). Sin embargo, sería interesante indagar sobre la presencia de marcadores específicos como alfa-SMA (smooth muscle actin) in vitro e in vivo y determinar si existe una diferenciación de los fibroblastos de pacientes con AG por ortodoncia y los fibroblastos gingivales de individuos sanos. Sin embargo, se sugiere realizar trabajos investigativos que incluyan un número mayor de pacientes. Además de complementar estos hallazgos mediante análisis inmunohistoquímicos, niveles de expresión génica con marcadores de proliferación celular y análisis bioestadísticos. Esta información será útil en la comprensión del proceso fisiopatológico del AG en pacientes portadores de tratamiento ortodóntico.
5. Conclusión
En los pacientes con agradamiento gingival portadores de tratamiento ortodóntico fue evidente la presencia de un tejido epitelial hiperqueratinizado y acantósico. En estos pacientes, se observó una red compacta de fibras de colágeno. Los fibroblastos gingivales in vitro de pacientes con AG por ortodoncia e individuos sanos fueron morfológicamente similares. Eventualmente, el uso prolongado del tratamiento ortodóntico podría inducir cambios morfológicas en la encia que ameritan continuar ser explorados.














