1. Introducción
La Paratuberculosis bovina (PTB), también conocida como Enfermedad de Johne, es una infección del tracto gastrointestinal causada por Mycobacterium avium, subespecie paratuberculosis (Map), un bacilo grampositivo de crecimiento lento de la familia Mycobacteriaceae que posee pared celular rica en lípidos (Bannantine et al., 2017; Palacios et al., 2019). Esta enfermedad se caracteriza por causar enteritis granulomatosa crónica y linfadenitis en rumiantes domésticos y salvajes (Harris y Barletta, 2001; Sweeney, 2011; Arsenault et al., 2014).
La preocupación más relevante en relación con la importancia de la PTB como enfermedad del ganado lechero, es su posible vínculo con la EC en humanos (McAloon et al., 2019). Sin embargo, esta asociación aún está bajo investigación (Pierce, 2018), ya que la evidencia epidemiológica de un mayor riesgo de EC con una mayor exposición a través de posibles vías de transmisión es débil, y la prueba definitiva de la causalidad no está disponible (Waddell, Rajic, Stark y McEwen, 2016).
Existe poca evidencia de campo en medidas de control específicas, aunque se ha demostrado una disminución de la prevalencia asociada con la implementación de un programa combinado de manejo, prueba y descarte (McAloon et al., 2019). Actualmente, no existe una cura efectiva para la enfermedad y la vacunación posiblemente puede interferir con el diagnóstico de otras enfermedades bovinas (Juste, 2012; Coad, Vordermeier, Whelan y Clifford, 2013). Sin embargo, en la actualidad se están desarrollando estudios basados en genómica para el desarrollo de vacunas contra Map que no presenten estos problemas (Barkema et al., 2018).
Los estudios realizados en Colombia son insuficientes para reflejar con exactitud la situación epidemiológica y el impacto económico y en salud pública de la enfermedad. Aunque se ha confirmado su existencia durante casi un siglo, el pequeño número de estudios limita las pruebas sobre la magnitud de la circulación del Mapen los animales, los humanos, el medio ambiente y los alimentos en Colombia (Correa, García y Fernández, 2018). Boyacá es un departamento que se caracteriza por poseer una cantidad considerable de cabezas de ganado bovino, en donde la mayoría de las explotaciones se dedican a la producción de leche. A pesar de esto, no hay evidencia de la prevalencia de la enfermedad en el departamento. Por lo anterior, el objetivo de la presente investigación fue determinar la seroprevalencia y los principales factores de riesgo asociados con la presentación de PTB en el municipio de Sogamoso, Boyacá; lo que permitiría realizar un primer acercamiento epidemiológico local de la enfermedad y ofrecería las bases para el desarrollo de investigaciones que establezcan la dinámica del patógeno en el departamento.
2. Marco teórico
Map es el agente causante de la enfermedad de Johne, una enteritis crónica inflamatoria que afecta a rumiantes domésticos y salvajes como ovinos, caprinos, bovinos, antílopes, camellos y llamas, entre otros, observándose con mayor frecuencia en ganado especializado para la producción de leche (Windsor, 2015; Garcia y Shalloo, 2015; Benavides, Arteaga y Montezuma, 2015; DeKuiper y Coussens, 2019).
La enfermedad infecta el íleon e induce inflamación severa y alteración del revestimiento intestinal, lo que conlleva a reducir la capacidad de los animales clínicamente infectados para absorber de manera adecuada los nutrientes, causando diarrea crónica persistente e incurable que se acompaña de la excreción de grandes cantidades de Map, pérdida de peso significativa y emaciación intratable que resulta en la muerte (APHIS, 2007; Garcia y Shalloo, 2015; McAloon et al., 2016; Kirkeby, Graesboll, Nielsen, Toft y Halasa, 2017). Los terneros de hasta seis meses de edad son particularmente susceptibles a la infección por Map. La transmisión se produce por la ruta fecal-oral a través de heces o leche contaminadas (Doré et al., 2012). Las consecuencias de la infección neonatal se desarrollan de manera lenta y progresiva y, generalmente, toma hasta dos o más años para que aparezcan los síntomas clínicos (Irenge et al.. 2009).
Sin embargo, la mayoría de los animales infectados permanecen subclínicos durante toda su vida productiva, sin mostrar signos de la enfermedad y representan derramamientos latentes del patógeno. Sumado a esto, a menudo demuestran una amplia gama de respuestas inmunes a Map, dentro del mismo animal a lo largo del tiempo y en diferentes animales dentro de un rebaño (Nielsen y Toft, 2008; Frie, Sporer, Kirkpatrick y Coussens, 2017; Verdugo, Valdes y Salgado, 2020). Esto conlleva a que se presente un largo periodo de incubación, que, junto con las prácticas de manejo del rebaño, la larga supervivencia del patógeno en el medio ambiente y el bajo rendimiento de las pruebas de diagnóstico disponibles, ha facilitado la propagación de la infección (Verdugo et al., 2020).
El diagnóstico de laboratorio de la enfermedad de Johne se logra comúnmente mediante la detección del agente causal en muestras fecales o de tejido, o indirectamente al demostrar la presencia de anticuerpos específicos de patógenos en muestras de suero o leche (Tiwari, Vanleeuwen, Mckenna, Keefe y Barkema, 2006; Collins, 2011). Sumado a esto, existen pruebas de tipo molecular que se implementan para diagnosticarla, sin embargo, debido a las peculiaridades del patógeno, la detección de Map en las heces sigue siendo difícil (Schwalm, Obiegala, Pfeffer y Sting, 2018). Los procedimientos de diagnóstico basados en la detección directa de Map son desafiantes debido a la eliminación del patógeno en bajas concentraciones, la alta estabilidad de la pared celular del patógeno, los inhibidores de PCR en las heces y la microbiota intestinal acompañante. Estos obstáculos importantes requieren procedimientos sofisticados para la preparación de muestras fecales (Acharya, Dhand, Whittington y Plain, 2017).
La extracción de ADN y la PCR en tiempo real para la detección de Map en heces bovinas (PCR directa) se han refinado, también se han desarrollado procedimientos factibles para la detección rápida, sensible y automatizable del agente patógeno (Schwalm et al., 2018). La PCR en tiempo real es una herramienta cuantitativa rápida para la detección de Map en muestras fecales de ganado de alto desprendimiento, los fabricantes ofrecen cada vez más kits completos que incluyen una combinación de reactivos de extracción de ADN y ensayos de PCR en tiempo real (Schwalm et al., 2018).
Esta enfermedad tiene un impacto económico negativo a nivel mundial, el cual es perjudicial en el ganado y otras industrias ganaderas de rumiantes, debido a la pérdida de producción, el sacrificio temprano de los animales infectados, el valor reducido de los mismos, la mortalidad, los posibles efectos adversos sobre la fertilidad y los costos de las pruebas de diagnóstico (Windsor, 2015; Garcia y Shalloo, 2015; McAloon et al., 2016; Kirkeby et al, 2017; DeKuiper y Coussens, 2019). En el ganado bovino, la vacunación contra Mappuede limitar la presentación de síntomas clínicos, pero no previene la infección o la eliminación de bacterias infecciosas en las heces (Stabel, Barnhill, Bannantine, Chang y Osman 2012). Sin embargo, se están desarrollando estudios basados en genómica para el desarrollo de vacunas contra Map que no presenten estos problemas de interferencia con otros agentes etiológicos (Barkema et al.. 2018).
3. Materiales y métodos
Lugar de estudio: el estudio se realizó en el municipio de Sogamoso, ubicado en el centro-oriente del departamento de Boyacá (Colombia) en la región del Alto Chicamocha. Es la capital de la Provincia de Sugamuxi, se encuentra 228,5 km al noreste de Bogotá, la capital del país, y a 75,8 km de Tunja, la capital del departamento. Posee una altitud de 2.569 msnm y tiene temperaturas promedio de 18 °C (Alcaldía Municipal de Sogamoso, 2019).
Tamaño de la muestra: según el Censo Pecuario Nacional, el municipio de Sogamoso registró una población de hembras bovinas de 13.491 animales (ICA, 2019). Teniendo en cuenta esta información, se determinó una muestra de 604 individuos a través del programa estadístico OpenEpi, Versión 3, con un intervalo de confianza del 95%.
Variables: se tuvieron en cuenta la edad, raza y presencia de diarrea como variables en los animales. Para las fincas, se incluyeron la fuente de agua (acueducto, aljibe y quebrada) y fuente de alimentación (silo, heno y concentrado) como variables que pudieran guardar una posible relación con la presencia de PTB.
Toma de muestras: la muestra de sangre se obtuvo a partir de venopunción coccígea de los bovinos, implementando el sistema de tubos al vacío (tipo Vacutainer). El tubo que contenía la sangre sin anticoagulante se centrifugó a 1500 r.p.m. durante 10 minutos para separar las células del suero, el cual fue transferido a tubos de almacenamiento tipo Eppendorf para su congelación a -20°C.
Diagnóstico serológico: las muestras se procesaron bajo la técnica de ELISA indirecta en el Laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia (UPTC), utilizando el kit comercial PARACHEK® 2 KIT (Prionics, Suiza) para la detección de anticuerpos específicos frente a M. paratuberculosis en muestras de suero, siguiendo el protocolo del fabricante. Este kit comercial refiere una sensibilidad del 80% y especificidad del 99%.
Análisis estadístico: el estudio epidemiológico fue Observacional Descriptivo de corte (Transversal), se realizó un muestreo aleatorio simple. La asociación entre las variables de la encuesta epidemiológica y la seroprevalencia fue evaluada mediante la prueba de Chi cuadrado. Las variables que presentaron asociación significativa fueron analizadas mediante regresión logística. El procesamiento de la información se realizó con el software estadístico SPSS versión 20.0.
Consideraciones éticas: el estudio se realizó bajo las condiciones de la Ley 576 del 2000 y la Ley 84 de 1989 de la República de Colombia. Se obtuvo consentimiento informado por parte de los propietarios de los bovinos antes de la recolección de las muestras.
4. Resultados
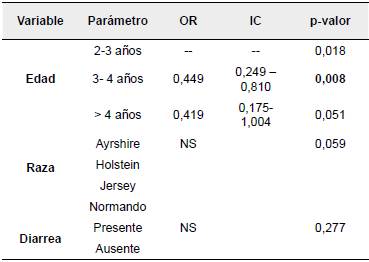
La seroprevalencia de PTB en la población de estudio fue de 10,9% (66/604) (95% IC= 8.4 - 13.4). En relación con los grupos etarios, los individuos de 2 a 3 años presentaron el porcentaje más alto con 18,7% (20/107), seguido de los bovinos de 3 a 4 años con 9,4% (38/406) y los mayores de 4 años con 8,8% (8/91). Asimismo, los individuos de la raza Jersey tuvieron la seroprevalencia más alta 16% (26/162), seguidos de la raza Holstein 10,6% (23/218), Ayrshire 8,8% (12/137) y Normando 5,7% (5/87).
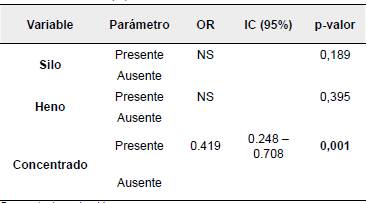
Se encontró asociación estadística significativa entre la edad de los individuos evaluados y la presentación de la enfermedad (p<0,05). No se encontró asociación entre las variables raza y presencia de diarrea con la seropositividad a PTB (Tabla 1).
Tabla 1 Factores de riesgo asociados a la infección por PTB. Los resultados se presentan como Odds Ratio (OR) e intervalo de confianza (IC) del 95%.
Fuente: La investigación
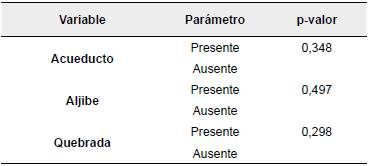
No se encontró asociación estadística significativa (p>0,05) entre la presentación de anticuerpos contra Map con las fuentes de agua analizadas como posibles factores de riesgo (Tabla 2). En relación con las fuentes de alimentación evaluadas, solo el consumo de concentrado presentó asociación estadística significativa con la seropositividad a la enfermedad (p<0,05) (Tabla 3).
Tabla 2 Fuentes de agua como posibles factores de riesgo asociados a las infecciones
Fuente: La investigación
5. Discusión de resultados
En el estudio realizado, el 10,9% (66/604) de las hembras evaluadas fueron seropositivas a la presentación de la enfermedad. A nivel nacional, los estudios más recientes revelan que en Nariño la prevalencia es del 8% (Benavides et al., 2015), en Antioquia se han encontrado prevalencias del 33,8% (Vélez, Rendón, Valencia, Ramírez y Fernández, 2016), 2% (Correa, Ramírez, Olivera y Fernández, 2016), 10% (Fernández, Ramírez y Correa, 2017) y 4,1% (Correa, Ramírez, Arango, Fecteau y Fernández, 2019), y 21,1% en Sucre (Caraballo, Castellar y Pardo, 2018). Es importante destacar que Boyacá forma parte de las zonas del trópico alto en Colombia donde más leche se produce (FEDEGAN, 2014) , sin embargo, no se evidencian reportes de la presencia de la enfermedad en este departamento. Los registros de prevalencia de infección por Map en Colombia son limitados, debido a que no se realizan pruebas periódicas de la enfermedad en las lecherías, o sólo se realiza en vacas sospechosas de estar clínicamente afectadas (Correa et al., 2019).
Por otro lado, se han establecido prevalencias de 3,53% en Venezuela (Santeliz, Giménez, Bastidas y Cova, 2013) y 0,92% ± 7,37 en la Provincia de Cañete, Perú (Valderrama y Peñaranda, 2014). Una revisión sistemática de literatura, reportó que la prevalencia global no ajustada de la enfermedad para América Latina y el Caribe a nivel de rebaño está en 75,8% (Fernández, Correa y Ramírez, 2014), mientras que en Brasil se reportaron prevalencias de 34,5% a nivel de rebaño y del 10,7% a nivel de animal (Vilar et al., 2015) . Finalmente, en Chile la prevalencia se estima en 6,3% (Verdugo et al., 2020).
Se debe tener en cuenta que la alta heterogeneidad detectada en las estimaciones de prevalencia en cada una de las investigaciones podría atribuirse a la gran diversidad en el diseño del estudio o la prueba utilizada (Fernández et al., 2014). Asimismo, la prevalencia de PTB puede verse afectada debido a que ésta tiene un período de incubación relativamente largo y a que los niveles de anticuerpos contra el Mapsolo se detectan mediante la prueba ELISA al final del período de incubación, haciendo que esta prueba sea ineficaz para detectar a los animales infectados en el periodo de infección temprana (Vilar et al., 2015).
En relación con los grupos etarios, los individuos entre 2 y 3 años presentaron la seroprevalencia más alta a la enfermedad, resultados que concuerdan con lo reportado en Egipto por Selim, Ali y Ramadan (2019), donde la mayor prevalencia de la enfermedad se notificó principalmente en el mismo grupo etario. De la misma forma, se logró establecer que el rango de edad de 3 a 4 años puede considerarse como un factor de protección contra la enfermedad, lo cual puede deberse a que la susceptibilidad a la PTB depende de la edad, y ésta forma parte de la base de los programas de control en granja, por lo que se ha aceptado que la resistencia a la infección por Mapaumenta con la edad (Larsen, Merkal y Cutlip, 1975; Windsor y Whittington, 2010; McAloon et al., 2019).
De cualquier modo, se debe tener en cuenta que la susceptibilidad de los animales jóvenes está condicionada en primer lugar por la madre, la cual puede experimentar una bacteriemia varios meses antes de que se desencadene la conversión del sistema inmunológico a una producción de anticuerpos detectables en varios casos. En segundo lugar, a que pueden producirse bajos niveles de excreción al medio ambiente antes de que se presente una producción detectable de anticuerpos y estos niveles son suficientes para infectar al recién nacido. En tercer lugar, el parto puede ser un factor estresante que dé lugar a la conversión a la inmunidad humoral,mientras que el Map ya se ha transmitido (Saxmose, Frello Hansen, Kvist y Kostoulas, 2016).
En cuanto a la raza, la Jersey presentó la seroprevalencia más alta. Esto se debe a que la susceptibilidad a la infección con PTB puede verse influenciada genéticamente, ya que se ha sugerido que ciertas razas de ganado (Guernsey y Jersey) y ciertas líneas familiares pueden tener una predisposición genética a infectarse con el patógeno (Roussel et al., 2005; Elzo et al., 2006; Osterstock, Fosgate, Cohen, Derr y Roussel, 2008; Fecteau, 2018). Además, se ha estimado que la heredabilidad de la PTB en el ganado lechero es, aproximadamente, del 9% al 12% (Kirkpatrick y Shook, 2011).
A pesar de lo mencionado anteriormente, no se encontró diferencia estadística significativa entre la presencia de la enfermedad y las razas evaluadas en el estudio, resultados que difieren con lo reportado por Vélez et al. (2016), quienes encontraron asociación estadística significativa entre la raza y los resultados de ELISA, indicando que la seropositividad a la enfermedad depende de la raza de los bovinos. Es importante resaltar que la raza juega un papel importante en la epidemiología de la enfermedad, pues ha sido descrita como factor asociado a la presentación de seropositividad en ganado lechero, encontrando efectos y diferencias en diversas poblaciones bovinas que juegan un papel fundamental en la genética de la resistencia a las enfermedades y pueden ser usados como una herramienta para el control de la PTB (Jaramillo, Montoya, Uribe, Ramírez y Fernández, 2017a).
No se encontró asociación estadística significativa entre la enfermedad y la presencia de diarrea en las hembras evaluadas, lo cual se podría deber a que el estudio de la expresión clínica de la infección por Map ha demostrado ser difícil, debido a que la PTB se caracteriza por un periodo de incubación prolongado, donde solo una parte de los animales infectados progresará hacia las etapas clínicas de la enfermedad. Por lo tanto, se espera una baja incidencia clínica, lo que conlleva a un aumento en el tamaño de muestra requerido que permita realizar un estudio epidemiológico sólido (Verdugo et al., 2020).
Las diferentes fuentes de agua utilizadas para el consumo animal no presentaron diferencias estadísticas,sin embargo,se encontró un número significativo de animales seropositivos que consumían agua de aljibe (12,7%) y agua de acueducto (11,7%). Esto cobra importancia debido a que algunos estudios sugieren la posible circulación de cepas de Map desde y hacia el medio ambiente, así como también entre diferentes animales del hato (Fernández, Abdulmawjood, Akineden y Bülte, 2011). Además, es importante resaltar que los animales que son infectados a una edad temprana permanecerán en el rebaño, eliminando el patógeno a través de las heces y generando así contaminación del agua y de los alimentos (Vilar et al., 2015).
Por último, se encontró asociación estadística significativa entre el suministro de concentrado y la presentación de la enfermedad. Se ha demostrado que las muestras de polvo ambiental contienen patógenos viables, por lo que el inadecuado almacenamiento de los alimentos puede conllevar a una contaminación de los mismos (Eisenberg et al, 2010).
6. Conclusiones
La seroprevalencia encontrada sugiere la presencia de una transmisión activa de la enfermedad entre la población de bovinos lecheros del municipio de Sogamoso, donde las medidas de control disponibles no se llevan a cabo de forma adecuada o no son lo suficientemente efectivas para mejorar las condiciones sanitarias de las producciones. Es importante considerar el desarrollo de estudios de incidencia que permitan realizar un seguimiento del comportamiento epidemiológico de la PTB en la región, de tal forma que se puedan identificar los principales factores de riesgo relacionados con la presentación y distribución geográfica de la enfermedad.